美人蕉属(Canna) 植物具有叶片粗犷、花色娇艳、花期长、易于栽培等优点, 被广泛应用于园林绿化, 是热带及亚热带常见的观花植物; 其中美人蕉(Canna indica L.) 的根茎具有清热利湿、舒筋活络功效, 主治黄疸肝炎、风湿麻木、外伤出血等[1]。美人蕉品种大多可归类为美人蕉、柔瓣美人蕉、粉美人蕉、大花美人蕉及兰花美人蕉等5个种系和杂交种系[2]。目前, 美人蕉属植物的研究主要集中在吸附重金属、污水土壤修复及其化感作用上, 其化学成分及生物活性研究主要集中在美人蕉这一品种上[3-7], 其他品种研究较少。大花美人蕉(C. generalis) 为美人蕉属植物在园林上应用的一个主要品种, 根茎的化学成分有脂肪醇、甾醇、酚类、黄酮类及糖苷类等[8, 9], 其根提取物能改善硫酸葡聚糖钠盐诱导的结肠炎, 具有一定抗炎活性[9]。为了深入开发大花美人蕉的药用价值, 对其化学成分进行了进一步研究。除了之前报道的8个已知化合物[8], 还从大花美人蕉根的乙醇提取物中分离得到2个二萜类化合物, 经多种波谱技术鉴定为(5R, 8S, 9S, 10R, 13R)-2-酮-对映-贝壳杉-15-烯-17-酸(1) 和(4R, 5S, 8S, 9S, 10S, 13R)-19-羟基-对映-贝壳杉-15-烯-17-酸(2), 结构见图 1。化合物1为新化合物, 化合物2为首次从大花美人蕉根中分离得到。

|
Figure 1 Chemical structures of compounds 1 and 2 |
化合物1为白色粉末,
| Table 1 The 1H (600 MHz) and 13C NMR (150 MHz) data of compound 1 in CDCl3 |
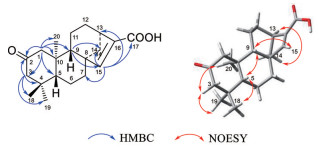
|
Figure 2 Key HMBC and NOESY correlations of compound 1 |

|
Figure 3 Experimental and calculated ECD spectra of compounds 1 (A, Shift = 11 nm) and 2 (B, Shift = -8 nm) |
根据波谱分析, 并与已有文献[13, 14]数据进行比对, 化合物2与土槿丁酸区别在于羟基连接在C-19的甲基上。发现计算ECD谱与实验ECD谱(图 3) 变化趋势一致, 从而确定了化合物2的绝对构型。因此, 化合物2的结构鉴定为(4R, 5S, 8S, 9S, 10S, 13R)-19-羟基-对映-贝壳杉-15-烯-17-酸, 与文献[15]报道的化合物9 (19α-羟基-对映-贝壳杉烷-15-烯-17-酸) 结构相同, 但与其13位羟基构型(13S) 不同。
预实验中对化合物1和2进行了细胞毒活性测试, 遗憾的是, 在100 μmol·L-1浓度下对人肺癌细胞(A549)、人乳腺癌细胞(MCF-7) 的生长均未表现明显的抑制作用。据文献[15]报道, 化合物2在100 μmol·L-1浓度下对人膀胱癌细胞T-24有抑制作用(抑制率为20.34%), 对人卵巢癌细胞(SK-OV-3)、人宫颈癌细胞(HeLa)、人乳腺癌细胞(MCF-7) 及人胃癌细胞(BGC-823) 均未表现明显的抑制作用。
实验部分UltiMate 3000液相色谱仪(美国Thermo Fisher公司), 配置VWD-3100紫外检测器, AcclaimTM 120 C18色谱柱(150 mm × 4.6 mm, 5 μm); Agilent 600 MHz DD2核磁共振波谱仪(美国Agilent公司), 以TMS为内标; Anton Paar MCP 500旋光仪(奥地利Anton Paar公司); Shimadzu UV-2600紫外光谱仪(日本Shimadzu公司); Agilent 6230 TOF LC-MS质谱仪(美国Agilent公司); Chirascan CD光谱仪(英国应用光物理公司)。柱色谱硅胶(青岛海洋化工有限公司); 薄层色谱(TLC) HSGF254硅胶板(烟台江友硅胶开发公司); 柱色谱反相硅胶Chromatorex C18 (MB100-40, 粒径40~75 μm, 日本富士化学公司); 分析纯甲醇、乙醇、石油醚、乙酸乙酯购买自天津市富宇精细化工有限公司; 色谱纯甲醇购买自国药集团化学试剂有限公司。
实验材料于2015年5月购于湖北省武汉市汉口北的四季美花木市场, 产地为武汉市蔡甸区, 由中国科学院华南植物园童毅华副研究员鉴定为大花美人蕉(Canna generalis)。标本(No.CG-201505) 存放于武汉科技大学化学与化工学院。
1 提取分离去除美人蕉茎叶及须根, 处理后的美人蕉根切片晾干, 粉碎后得到粉末2.5 kg; 用5 L 95%乙醇溶液浸泡提取(2天× 3次), 接着用5 L 80%乙醇溶液浸泡提取(2天× 3次), 合并提取液后减压浓缩得无乙醇溶液2 L, 依次用石油醚、乙酸乙酯萃取, 减压浓缩后得到石油醚萃取物(24.2 g) 及乙酸乙酯萃取物(15.7 g)。石油醚萃取物经正相硅胶柱色谱分离, 以石油醚-乙酸乙酯(1∶0→1∶1) 梯度洗脱, TLC检查后合并得到10个组分(P1~P10)。P8 (0.9 g) 经反相硅胶柱色谱分离, 以甲醇-水(70∶30→90∶10) 梯度洗脱, TLC检查后合并得到6个亚组分(P8-1~P8-6)。P8-1经正相硅胶柱色谱分离, 以石油醚-乙酸乙酯(92∶8) 洗脱, 再经高效液相色谱制备, 甲醇-水(70∶30) 为流动相, 流速1 mL·min-1, 得到化合物2 (1.8 mg, tR = 15.5 min) 和1 (3.2 mg, tR = 19.4 min)。
2 计算ECD法MMFF分子力场和DFT/TDDFT计算分别使用Spartan 14软件和Gaussian16程序。采用Spartan 14软件在MMFF力场下进行构象搜索。用Gaussian16程序B3LYP/6-31G (d) 水平下进行优化和震动计算。对低能量构象使用M06-2X/6-31G (d) 进行TDDFT计算。ECD谱由SpecDis程序生成。在298.15 K下, 根据每个构象的相对自由能进行玻尔兹曼分布, 根据甲醇溶液中每个构象的玻尔兹曼分布权重, 从低能量构象生成计算光谱。
3 结构鉴定化合物1 白色粉末, 易溶于氯仿,
化合物2 白色粉末, 易溶于氯仿,
作者贡献: 周文婷负责分离纯化、谱图解析及文章的整理; 龚志伟通讯作者, 负责实验设计及稿件修改。
利益冲突: 作者声明不存在利益冲突。
| [1] |
Wu DL. Musaceae Zingiberaceae Cannaceae, Flora Reipublicae Popularis Sinicae (中国植物志)[M]. Beijing: Science Press, 1981: 155-157.
|
| [2] |
Huang GT, Ouyang DM, Xiang QB, et al. Studies on classification for cultivars of Canna L.[J]. J Nanjing Forest Univ Nat Sci (南京林业大学学报·自然科学版), 2005, 29: 20-24. |
| [3] |
Tang XY, Liu J, Zhang ZH, et al. Studies on the chemical constituents of Canna indica[J]. Chin Tradit Herb Drugs (中草药), 1995, 26: 107. |
| [4] |
Srivastava J, Vankar P. Methylated anthocyanidin glycolsides from flowers of Canna indica[J]. Carbohydr Res, 2010, 345: 2023-2029. DOI:10.1016/j.carres.2010.07.015 |
| [5] |
Anh L, Hieu N, Trang D, et al. Cannadicas A and B: two new oligosaccharide esters from the roots of Canna indica L.[J]. Nat Prod Res, 2021. DOI:10.1080/14786419.2020.1869232 |
| [6] |
Anh L, Hieu N, Trang D, et al. Two new acylated sucroses from the roots of Canna indica L. and their antioxidant activity[J]. Nat Prod Commun, 2021, 16: 1-5. DOI:10.1177/1934578X21991720 |
| [7] |
Chen HJ, Chen CN, Sung ML, et al. Canna indica L. attenuates high-glucose- and lipopolysaccharide-induced inflammatory mediators in monocyte/macrophage[J]. J Ethnopharmaco, 2013, 148: 317-321. DOI:10.1016/j.jep.2013.04.037 |
| [8] |
Zhou WT, Ye L, Gong ZW. Chemical constituents from roots of Canna generalis[J]. J Trop Subtrop Bot (热带亚热带植物学报), 2018, 26: 556-560. |
| [9] |
Mahmoud T, EI-Maadawy W, Kandil Z, et al. Canna x generalis L.H. Bailey rhizome extract ameliorates dextran sulfate sodium-induced colitis via modulating intestinal mucosal dysfunction, oxidative stress, inflammation, and TLR4/NF-κB and NLRP3 inflammasome pathways[J]. J Ethnopharmacol, 2021, 269: 113670. DOI:10.1016/j.jep.2020.113670 |
| [10] |
Li ZL, Chen K, Pan DJ, et al. Studies on the novel diterpenoic constituents of TU-JIN-PI IV. Isolation and identification of pseudolaric acid D and pseudolaric acid E[J]. Acta Chim Sin (化学学报), 1989, 47: 258-261. |
| [11] |
Cai TZ, Qi W, Yang LM, et al. Chemical constituents of Pseudolarix kaempferi Gord[J]. J Chin Pharm Sci, 2012, 21: 428-435. DOI:10.5246/jcps.2012.05.057 |
| [12] |
Garcez F, Garcez W, da Silva A, et al. Terpenoid constituents from leaves of Guarea kunthiana[J]. J Braz Chem Soc, 2004, 15: 767-772. DOI:10.1590/S0103-50532004000500025 |
| [13] |
Grande M, Mancheoño B, Sanchez M. Elasclepiol and elasclepic acid, beyerane diterpenoids from Elaeoselinum asclepium[J]. Phytochemistry, 1989, 28: 1955-1958. DOI:10.1016/S0031-9422(00)97893-2 |
| [14] |
Tanaka N, Ooba N, Duan HQ, et al. Kaurane and abietane diterpenoids from Tripterygium doianum (Celastraceae)[J]. Phytochemistry, 2004, 65: 2071-2076. DOI:10.1016/j.phytochem.2004.04.032 |
| [15] |
Wang WM, Zhao M, Zhang SJ, et al. Diterpenoid compounds in ethyl acetate extract of corn stigma, extraction method and application: China, CN 112110819 A[P]. 2020-12-22.
|
 2022, Vol. 57
2022, Vol. 57


