2. 重庆市第八中学校, 重庆 400030
2. Chongqing No.8 Secondary School, Chongqing 400030, China
细菌产生耐药性是其正常的进化过程。但由于抗菌药物在人类和动物中的交叉使用和/或滥用, 加快了细菌耐药的进程。世卫组织全球抗菌素耐药性和使用监测系统(GLASS) 报告证实, 2020年全球抗菌素耐药性正在上升, 特别是在低收入和中等收入国家, 死亡率和发病率都在增加[1]。多重耐药性病原真菌的出现并在全球范围内传播, 严重威胁着人类健康[2]。2012年以来, 真菌对人类生命健康的影响呈螺旋式上升, 真菌疾病的全球死亡率已超过疟疾和乳腺癌, 与结核病和艾滋病的死亡率相当[3]。因此, 开发新型抗菌药物以解决耐药性问题迫在眉睫。
辛弗林是一种天然小分子生物碱, 存在于柑橘的果皮和果肉中, 是中药枳实的主要成分之一; 辛弗林具有血管收缩[4]、减肥[5]、延缓细胞衰老[6]、抗哮喘[7]、抗抑郁[8]、防脱发[9]、抗炎[10]、治疗胃病[11]、抗菌[12]等生物活性, 目前已收载于北欧三国药典和德国药典, 在欧美国家用于医药、食品饮料等行业, 应用最广的是作为减肥保健品及饮品。虽然如此, 由于辛弗林结构与肾上腺素和麻黄碱相似, 其用药安全性曾遭受质疑。大约30项研究表明, 在正常剂量下辛弗林不会对心血管产生不良影响, 也没有兴奋剂的作用, 证明了辛弗林的安全性[13], 从而刺激了人们对辛弗林及其衍生物的研究热情。然而国内外对辛弗林的衍生物研究很少, 报道的都是具有抗肿瘤[14, 15]或减肥[16]活性的羟基衍生物, 仲胺衍生物鲜少报道。
唑类化合物具有广泛生物活性, 不少唑类化合物是一线抗真菌药物。四氮唑衍生物可用于农药、医药、光感材料等物质的合成, 例如picarbutrazox[17]、四唑吡氨酯[18]是已经上市的杀真菌药物。1-甲基-5-巯基-1H-四氮唑(5-MMT) 是头孢孟多、头孢甲肟盐酸盐、头孢美唑、头孢替坦等抗菌药物的结构片段, 不仅能提高头孢菌素抗菌活性并且扩大了抗菌谱[19]。一些研究表明, 5-MMT作为重要药效片段, 可以提高分子抗菌活性[20, 21]。磺胺药物(如磺胺嘧啶sulfadiazine)[22]是较早出现并使用至今的抗菌药物; 含磺酰胺基的药物也很多, 诸如格列美脲(glimepiride, 降糖)、呋塞米(furosemide, 利尿)、西地那非(sildenafil, 解决勃起功能障碍)[23-25]。本实验室发现, 某些含磺酰胺基的化合物具有抗结核(H37Rv)、降血脂(PCSK9) 及抗肿瘤(IDO1、EZH2、Set8、hNNMT等) 等活性[26-28]。
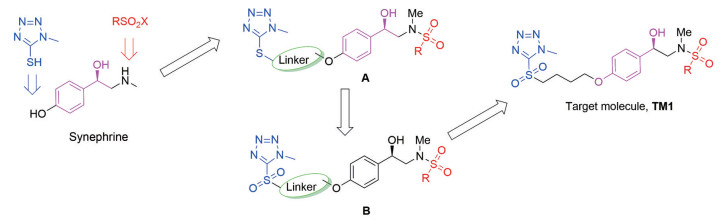
多靶点药物设计策略, 是复杂疾病尤其是多靶点疾病新药开发的新思路。药效团连接法, 可将多种作用靶点的药物引入单一分子之中, 是多靶点药物设计的思路之一[29]。辛弗林分子不仅可作为多靶点药物之一, 而且可作为母核结构提供1个或多个连接位点; 在辛弗林母核的羟基和胺基上引入药效团5-MMT及磺酰基, 有可能获得显示多靶点活性的抗真菌和/或抗菌的先导分子。本研究设计了图 1所示的分子模式A; 考虑到分子的稳定性和生物活性, 将分子模式A的硫醚键氧化为砜基, 可得到分子模式B; 为使设计分子的相对分子质量尽可能低且具有多靶点性以及在体内代谢具有一定的稳定性, 选取柔性的烷基链作为连接链, 进而确定了目标分子的结构模式TM1 (图 1)。
|
Figure 1 Design of synephrine derivatives TM1 |
通过合成路线设计及反应条件探索, 经多步反应合成了20个尚未报道的新分子; 抗人致病菌和抗真菌活性测试, 发现了高活性分子。本研究为辛弗林衍生物的后续研究奠定了基础。
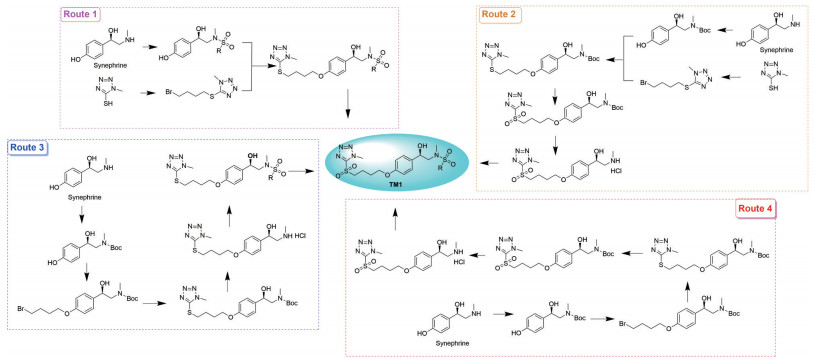
结果与讨论 1 化学实验从辛弗林合成目标分子, 有4条较为可行的合成路线, 如图 2所示。
|
Figure 2 Synthetic routes of target molecule TM1 |
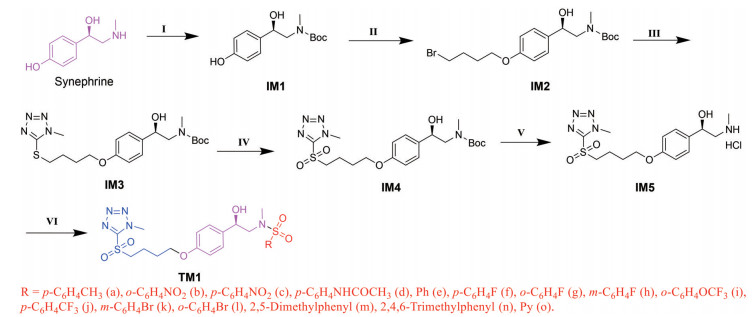
合成路线1最短, 但是辛弗林与RSO2Cl反应时反应位点控制存在一定难度; 二溴代烷与唑反应时位阻小, 但很难控制只生成单取代物; 合成实验个数多(1+3X, X为磺酰基个数)。合成路线2也存在唑与二溴代烷反应时控制生成单取代物的难题, 同时多了辛弗林仲胺的Boc保护与脱保护步骤, 但采用先氧化后脱保护策略, 增加了共同中间体, 进而减少了实验个数(5+X)。合成路线3和4都是线性的逐步合成路线, 合成路线3先脱Boc再引入磺酰基最后氧化, 合成实验个数4+2X; 合成路线4是先氧化再脱Boc最后引入磺酰基, 合成实验个数5+X。从实验的简洁性看, 合成路线2和4有更多的共同中间体, 节约总合成时间, 缺点是能得到的化合物数量少。作为一种尝试, 本研究选择合成路线4作为目标分子的合成路线(图 3)。
|
Figure 3 Synthesis of target molecule TM1 Regents and conditions: (Ⅰ) Boc2O, EtOH, r, t., 1 h; (Ⅱ) 1, 4-Dibromobutane, K2CO3, DMF, 45 ℃, 4 h; (Ⅲ) 5-Mercapto-1-methyltetrazole, K2CO3, DMF, 45 ℃, 5 h; (Ⅳ) mCPBA, DCM, 30 ℃, 4 h; (Ⅴ) HCl-EA, ice bath, 4.5 h; (Ⅵ) RSO2Cl, K2CO3, DMF, ice bath |
辛弗林的氨基保护方法很多, 本研究选用Boc2O/EtOH法[30], 反应速度快、选择性好、IM1收率极高(> 99%), 且后处理简便。中间体IM2的合成, 关键是二溴代烃不要产生双取代产物且不残留二溴丁烷; 在K2CO3为碱、DMF为溶剂、45 ℃反应的优化反应条件下合成[31], 得到的是油状产物, 尝试加入石油醚、快速搅拌, 能够析出白色固体, 将其柱色谱分离后可以得到彻底除掉1, 4-二溴丁烷的纯净IM2。本来预计IM3的合成不会很简单, 但采用高纯度IM2在优化条件下合成, 加水即可除掉杂质, 95%以上收率得到高纯度IM3。中间体IM4合成是最关键的一步, 作者进行了广泛的条件探索, 在间氯过氧苯甲酸(mCPBA) 2.5当量、二氯甲烷(DCM) 作溶剂、反应温度为30 ℃的优化条件下, 反应4 h左右可以完成, 以中等收率实现了关键中间体IM4的合成。IM4脱Boc制备中间体IM5, 虽然成熟方法很多, 但只有采用HCl-EA脱Boc, 才能得到固体产品, 收率90%左右。
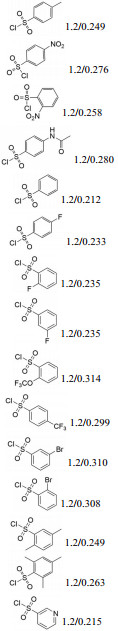
1.2 目标分子TM1a~TM1o的合成虽然仲胺与磺酰氯反应形成磺酰胺的过程比较常见, 但为了实现IM5分子中醇羟基和仲胺的选择性反应, 作者以TsCl为模型, 对TsCl和K2CO3的用量、反应温度、溶剂进行了探索, 发现辛弗林仲胺磺酰化的最好条件为: K2CO3为碱, DMF为溶剂, 温度0~5 ℃, 投料摩尔比为IM5-TsCl-K2CO3 = 1:1.2:2。按此最优条件合成目标分子TM1a~TM1o, 结果如表 1所示。该反应收率中等(41%~67%), 收率与磺酰氯苯环取代基之间存在一定规律, 一般是对位者 > 间位者 > 邻位者。
| Table 1 Synthetic results of TM1a-TM1o |
细菌感染所引发的疾病, 影响着人类健康。抗菌药物的开发挽救了无数生命。以克林沙星(CLX)、诺氟沙星(NOR)、环丙沙星(CIP)、沙拉沙星(SAR)、恩诺沙星(ENO)、巴洛沙星(BAL)、洛美沙星(LOM)、加替沙星(GAT) 为阳性对照, 选取3株G-菌株、4株G+菌株, 用于测试中间体及TM1a~TM1o的抑菌能力, 相关结果见表 2。
| Table 2 Inhibitory activity of the synthesized molecules against human pathogenic bacteria. CLX: Clinafloxacin; NOR: Norfloxacin; CIP: Ciprofloxacin; SAR: Sarafloxacin; ENO: Enrofloxacin; BAL: Balofloxacin; LOM: Lomeflolacin; GAT: Gatifloxacin |
总体来说, 该系列分子对于G-菌的抑制活性强于G+菌。对于沙门氏菌, 目标分子TM1o和2个中间体IM1和IM2的MIC值为128 μg·mL-1, 强于母核辛弗林(MIC > 256 μg·mL-1)。对于鲍曼不动杆菌, 这15个磺酰化目标分子TM1的MIC值(0.216~0.251 μmol·mL-1) 小于上市药物NOR、ENO、LOM和GAT (0.341~0.401 μmol·mL-1), 表明其活性强于这些上市药物。对于大肠杆菌, 中间体IM5的MIC值为4 μg·mL-1, IM3和IM4的MIC值(2 μg·mL-1) 与8种阳性对照药物的MIC值相等, 远强于母核辛弗林(256 μg·mL-1), 说明在辛弗林酚羟基进行衍生可以得到抗大肠杆菌活性提高的分子。
对于大肠杆菌而言, MIC值N-磺酰基衍生物(多数TM1) > N-Ac衍生物(LP TM3-12) > N-Boc衍生物(IM4), 表明NMe连接磺酰基并未提高抗大肠杆菌活性, 但连接脂肪酰基值得后续关注; 将IM3氧化成砜得到IM4, 虽然二者的MIC值相同, 但IM4相对分子质量更大, 说明活性IM4 > IM3, 亦即硫醚键变成砜基具有提高辛弗林衍生物抗菌活性的趋势。
2.2 抗真菌活性真菌感染包括常见的浅表或黏膜感染和严重的全身侵袭性真菌感染(invasive fugal infection, IFI), 威胁着全世界数百万人生命。IFIs主要由念珠菌、烟曲霉(A. fumigatus) 和新生隐球菌(C. neoformans) 等机会性真菌病原体引起[31]。白色念珠菌(C. albicans)、热带假丝酵母菌(C. tropical)、近平滑念珠菌(C. parapsilosis) 属于念珠菌属。本文选取了5种人致病真菌用于测试TM1a~TM1o的抑菌能力, 相关结果见表 3。
| Table 3 Inhibitory activity of the synthesized molecules against fungi |
对于耐药热带假丝酵母菌, 绝大部分TM1的MIC值小于母核辛弗林, IM4和IM5的MIC值分别为0.136和0.158 μmol·mL-1, 亦即活性IM4 > IM5, 表明引入酰胺基能提高母核生物活性; 此外, TM1n MIC值为0.063 μmol·mL-1, 活性大于中间体IM4、IM5和阳性对照药物氟康唑(MIC = 0.104 μmol·mL-1), 说明辛弗林仲胺基引入磺酰基有可能增强其对耐药热带假丝酵母菌的抑制作用。
对于近平滑念珠菌ATCC22019, TM1和中间体的MIC值(0.631~0.008 μmol·mL-1) 小于辛弗林(1.531 μmol·mL-1), 显示其活性都强于辛弗林。IM3和IM4的MIC值分别为0.146和0.136 μmol·mL-1, 说明砜型分子的活性强于硫醚型分子, 这是对目标分子设计的肯定。15个目标分子中有10个的MIC值< 0.136 μmol·mL-1, 强于IM3, 表明多数磺酰化产物的活性强于Boc保护产物的活性。TM1a/1c/1f/1j这4个分子的MIC值低于0.015 μmol·mL-1, 活性是LP TM3-12的3倍; TM1f活性最好(MIC = 0.008 μmol·mL-1), 和阳性对照药物氟康唑(MIC = 0.007 μmol·mL-1) 相当。分析构效关系发现, 磺酰胺环上取代基与活性之间存在如下关系: 吸电子者 > 供电子者, 且供电子越多, 抑菌活性越低; 同一个取代基, 对位者≥邻位者≥间位者。
对于耐药白色念珠菌, 9个目标分子、含唑中间体IM3~IM5的MIC值都小于辛弗林, 说明对辛弗林的胺基、羟基衍生都可以得到高活性分子; TM1f和TM1o与氟康唑的MIC值(0.014 μmol·mL-1) 相等, TM1n的MIC值(0.007 μmol·mL-1) 是氟康唑的1/2, 进一步说明分子结构影响其生物活性, 对辛弗林的合理修饰有可能发现高活性抗真菌分子。
对于白色念珠菌ATCC90023, 8个目标分子的MIC值小于辛弗林, 即活性强于母核。中间体活性IM5 < IM4 < IM3 (MIC分别为0.158、0.272和0.584 μmol·mL-1), 说明硫醚键氧化成砜且脱掉Boc基能够增强抑制白色念珠菌的能力。TM1d和TM1f活性和氟康唑相当(MIC分别为0.007、0.008和0.007 μmol·mL-1), 具有进一步研究的潜力。
3 结论本研究设计了辛弗林酚羟基和甲胺基的含唑和磺酰基衍生物TM1, 通过6步反应合成得到了预计的目标分子; 1H NMR、13C NMR和HR-MS确证了目标分子的结构。虽然目标分子对测试的G+和G-菌抑制活性不强, 但中间体IM4和IM5对大肠杆菌的抑制活性与8种氟喹诺酮药物相当。抗真菌活性测试发现, TM1f对近平滑念珠菌ATCC22019、耐药白色念珠菌和白色念珠菌ATCC90023抑制活性和氟康唑相当, TM1n对热带假丝酵母菌和耐药白色念珠菌抑制活性都强于氟康唑, 从而发现了较母核活性更好、对人致病真菌具有高抑制活性的未见报道的新分子, 为辛弗林衍生物研究提供了新的思路。
实验部分核磁共振仪(Bruker公司, ADVANCE ⅢTM 600 MHz, TMS为内标); 高分辨质谱仪(QTOF-MS, Bruker Impact Ⅱ, Germany); 自动旋光仪(WZZ-2S, 上海精密科学仪器有限公司); 熔点测定仪(X-6, 北京福凯仪器有限公司)。
辛弗林(绵阳迪澳药业有限公司); 1, 4-二溴丁烷、Boc2O (AR)、1-甲基-5-巯基-1H-四氮唑(AR)、间氯过氧苯甲酸(AR) (上海达瑞精细化工有限公司); 碳酸钾(重庆市钛新化工有限公司, AR, 使用前用研钵研细、烘箱干燥), 其余试剂均为市售化学纯或分析纯产品, 反应溶剂经过干燥处理, 其余未经纯化直接使用。
1 化合物的合成 1.1 中间体IM1合成向100 mL圆底烧瓶中依次加入原料辛弗林(8.451 g, 50 mmol)、EtOH (10 mL), 室温(20 ℃) 快速搅拌, 5 min后, 缓慢滴加Boc2O (12.803 g, 55 mmol)。滴毕, 继续室温快速搅拌, TLC监测反应进程。反应结束后, 旋除EtOH, 加入适量石油醚(PE), 超声至有白色固体析出。再加入适量PE, 搅拌0.5 h, 抽滤, 干燥, 称重, 得白色固体IM1 (纯品), 收率99.2%~99.6%, mp 88.5~90.1 ℃。
1.2 中间体IM2合成向100 mL圆底烧瓶中依次加入原料IM1、DMF、研细的K2CO3粉末, 45 ℃油浴搅拌。0.5 h后, 滴加1, 4-二溴丁烷, 45 ℃油浴快速搅拌, TLC (DCM-MeOH = 10:1) 监测反应进程。反应停止后, 室温搅拌, 加入饱和Na2CO3溶液和DCM, 搅拌0.5 h, 分液, 收集有机相, 饱和NaCl溶液(10 mL×3) 洗涤, 无水Na2SO4干燥, 旋除溶剂, 得到淡黄色液体。加入适量PE, 快速搅拌至有白色固体析出, 抽滤, 收集白色固体, PE洗涤固体至无1, 4-二溴丁烷气味, 干燥, 称重, 得粗品。柱色谱分离PE-EA = 10:1~5:1 (v/v), 得白色固体IM2, 干燥, 称重。收率66.5%~69.9%, mp 92.8~94.2 ℃。
1.3 中间体IM3合成100 mL圆底烧瓶中加入1-甲基-5-巯基-1H-四氮唑(5-MMT)、DMF, 搅拌, 溶解后加入无水K2CO3, 45 ℃水浴快速搅拌0.5 h, 加入IM2, TLC (PE-EA = 5:1, DCM-MeOH = 10:1) 监测反应进程。反应结束后, 冷却至室温, 加入10 mL冰冷饱和Na2CO3, 搅拌10 min, 加入20 mL DCM, 搅拌10 min, 分液, 收集DCM相, 饱和NaCl溶液(10 mL×3) 洗涤, 收集有机相, 无水Na2SO4干燥, 旋除(42.2 ℃) 溶剂, 得到白色固体, TLC验纯, 干燥, 称重。收率95.7%~96.9%, mp 95.5~96.9 ℃。
1.4 中间体IM4合成于100 mL圆底烧瓶依次加入IM3、DCM, 搅拌数分钟后一次性加入mCPBA (含量75%), TLC (PE-EA = 5:1, PE-EA = 1:1) 监测至反应结束, 加入0.5当量Na2SO3粉末和饱和Na2CO3溶液, 调节pH = 9, 搅拌10 min, 加入DCM, 搅拌0.5 h, 分液, 收集有机相, 无水Na2SO4干燥, 旋除溶剂, 得到红棕色黏稠液体, 柱色谱分离PE-EA = 10:1~8:1 (v/v), 得白色固体, TLC验纯, 称重。收率61.3%~62.9%, mp 110.2~112.1 ℃。
1.5 中间体IM5合成于50 mL圆底烧瓶中依次加入IM4, 滴加HCl-EA, 室温快速搅拌, TLC监测反应。反应结束后, 旋除(45 ℃) 溶剂, 加入适量EA搅拌数分钟, 再次旋除溶剂, 再加入适量PE搅拌数分钟, 旋除溶剂, 干燥, 称重。收率89.6%~90.4%, mp 133.7~135.1 ℃。
1.6 TM1a~TM1o合成于100 mL圆底烧瓶中加入IM5 (1 mmol), DMF溶解后, 加入K2CO3, 冰水浴(0~5 ℃) 中快速搅拌30 min, 再加入磺酰氯, TLC监测反应。反应结束, 加入H2O和DCM各10 mL, 搅拌10 min, 分液漏斗中分液, 收集DCM相, 饱和NaCl溶液洗涤, 无水Na2SO4干燥, 柱色谱分离PE-EA = 8:1~1:3 (v/v), 得到TM1, 干燥, 称重。
TM1系列化合物的表征数据如下:
TM1a: 白色固体, mp 110.0~111.1 ℃, [α]
TM1b: 黄色固体, mp 118.9~119.8 ℃, [α]
TM1c: 黄色固体, mp 117.1~118.2 ℃, [α]
TM1d: 白色固体, mp 107.2~108.9 ℃, [α]
TM1e: 黄色油状液体, [α]
TM1f: 黄色油状液体, [α]
TM1g: 黄色油状液体, [α]
TM1h: 黄色油状液体, [α]
TM1i: 白色固体, mp 122.5~123.9 ℃, [α]
TM1j: 白色固体, mp 115.4~116.2 ℃, [α]
TM1k: 白色固体, mp 136.4~137.8 ℃, [α]
TM1l: 白色固体, mp 136.0~137.1 ℃, [α]
TM1m: 白色固体, mp115.4~116.2 ℃, [α]
TM1n: 黄色油状液体, [α]
TM1o: 黄色油状液体, [α]
按照美国国家临床实验室标准化委员会(NCCLS) 推荐的微量稀释法, 采用本实验室常用的测试方法[32-34], 测定了目标分子对金葡菌ATCC25129及ATCC14125、藤黄微球菌、大肠杆菌ATCC25922、鲍曼不动杆菌ATCC19606、沙门氏菌ATCC13076、铜绿假单胞菌ATCC27853的MIC, 测试结果见表 2。
2.2 抗真菌活性采用NCCLS推荐的微量肉汤稀释法, 参照本实验室常用的测试方法[32-34], 测定了中间体及目标分子TM1a~TM1o抑制人致病真菌的MIC值, 测试结果见表 3。
致谢: 西南大学药学院中医药学院徐兴然副教授在人致病菌、化学化工学院周成合教授在真菌活性测试中提供的大力帮助, 绵阳迪澳药业有限公司赠送辛弗林样品, 本学院老师在核磁共振和高分辨质谱测试中提供的支持。
作者贡献: 李文粒负责大多数化合物的合成与部分生物活性测试, 论文的撰写、修改和校对; 范莉负责对外联系及文本修改、校对; 刘寒驰、彭诗琦、李鑫、郑怡、吴景灏负责部分分子合成; 李芬芬参与抗真菌活性测试; 杨大成负责课题规划, 指导实验的设计、化合物的合成, 文本的修改、校对。
利益冲突: 无利益冲突。
| [1] |
World Health Organization. 2020 antibacterial agents in clinical and preclinical development: an overview and analysis [R]. Geneva: WHO, 2021.
|
| [2] |
Perlin DS, Rautemaa-Richardson R, Alastruey-Izquierdo A. The global problem of antifungal resistance: prevalence, mechanisms, and management[J]. Lancet Infect Dis, 2017, 17: e383-e392. DOI:10.1016/S1473-3099(17)30316-X |
| [3] |
Brown GD, Denning DW, Gow N, et al. Hidden killers: human fungal infections[J]. Sci Transl Med, 2012, 4: 165rv13. |
| [4] |
Wang TS, Pan Y, Ma QS. Effects of loganin and synephrine on severe hemorrhagic shock model in rabbits[J]. J Nanjing Univ Tradit Chin Med (南京中医药大学学报), 1999, 6: 345-346. |
| [5] |
Haaz S, Fontaine KR, Cutter G. Citrus aurantium and synephrine alkaloids in the treatment of overweight and obesity: an update[J]. Obes Rev, 2010, 7: 79-88. |
| [6] |
Feng FC, Wang ZC, Li RF, et al. Citrus alkaline extracts prevent fibroblast senescence to ameliorate pulmonary fibrosis via activation of COX-2[J]. Biomed Pharmacother, 2019, 112: 108669. DOI:10.1016/j.biopha.2019.108669 |
| [7] |
Fu MQ, Zou B, An KJ, et al. Anti-asthmatic activity of alkaloid compounds from Pericarpium Citri Reticulatae (Citrus reticulata 'Chachi')[J]. Food Funct, 2019, 10: 903-911. DOI:10.1039/C8FO01753K |
| [8] |
Kim KW, Kim HD, Jung JS, et al. Characterization of antidepressant-like effects of p-synephrine stereoisomers[J]. Naunyn-Schmiedeberg's Arch Pharmacol, 2001, 364: 21-26. DOI:10.1007/s002100100416 |
| [9] |
Mccoy J, Goren OA. Synephrine compositions: US, 10758465 [P]. 2020-09-01.
|
| [10] |
Ko HC, Wang YH, Liou KT. Anti-inflammatory effects and mechanisms of the ethanol extract of evodia rutaecarpa and its bioactive components on neutrophils and microglial cells[J]. Eur J Pharmacol, 2007, 555: 211-217. DOI:10.1016/j.ejphar.2006.10.002 |
| [11] |
Fang YS, Shan DM, Liu JW, et al. Effect of constituents from Fructus Aurantii Immaturus and Radix Paeoniae Alba on gastrointestinal movement[J]. Planta Med, 2009, 75: 24-31. DOI:10.1055/s-0028-1088342 |
| [12] |
Ozçelik B, Kartal M, Orhan I. Cytotoxicity, antiviral and antimicrobial activities of alkaloids, flavonoids, and phenolic acids[J]. Pharm Biol, 2011, 49: 396-402. DOI:10.3109/13880209.2010.519390 |
| [13] |
Stoh SJ. Safety, efficacy, and mechanistic studies regarding Citrus aurantium (bitter orange) extract and p-synephrine[J]. Phytother Res, 2017, 31: 1463-1474. DOI:10.1002/ptr.5879 |
| [14] |
Vanden BW, De BK, Van CS. Synephrine derivatives useful as anti-inflammatory agents: US, 8039501 [P]. 2011-10-18.
|
| [15] |
Peng YH. A kind of preparation method of transdermally absorbable synephrine derivative: CN, ZL10077518.0 [P]. 2013-02-06.
|
| [16] |
De BK, Gerlo S, Haegeman G. Synephrine derivatives for the treatment of cancer: US, 1198308 [P]. 2008-01-23.
|
| [17] |
Ye X. Novel fungicide picarbutrazox[J]. World Pestic (世界农药), 2018, 40: 63-64. |
| [18] |
Luan BH, Jang FX, Wang YZ, et al. Evaluation of field control effect of new fungicide tetrazopyrazine on cucumber downy mildew[J]. Agrochemicals (农药), 2020, 59: 372-374. |
| [19] |
You QD. Medicinal Chemistry (药物化学)[M]. 7th Ed. Beijing: People's Medical Publishing House, 2011: 403.
|
| [20] |
Shan LX. Synthesis and Antibacterial Activity of Alkyl Side Chain Acyl Lactone Derivatives Containing Aryl Tetrazolium (含芳基四氮唑烷基侧链酰内酯衍生物的合成与抗菌活性研究) [D]. Guangzhou: Jinan University, 2013.
|
| [21] |
Huang M. Study on Nitrogen-containing Derivatives of Gatifloxacin (加替沙星含氮衍生物的研究) [D]. Chongqing: Southwest University, 2017.
|
| [22] |
Yang QL, Xu LF, Gui QJ, et al. Study on the in vitro anti-toxoplasma effects of erythromycin, azithromycin, sulfadiazine and allicin[J]. Med Sci J Cent South China (中南医学科学杂志), 2007, 26: 27-30. |
| [23] |
Yen FS, Hsu CC, Su YC, et al. Impacts of early insulin treatment vs glimepiride in diabetic patients with background metformin therapy: a nationwide retrospective cohort study[J]. Medicine, 2021, 100: e25085. DOI:10.1097/MD.0000000000025085 |
| [24] |
Bayer SS, Uprimny C, Kroiss AS, et al. Comparison of early imaging and imaging 60 min post-injection after forced diuresis with furosemide in the assessment of local recurrence in prostate cancer patients with biochemical recurrence referred for 68Ga-PSMA-11 PET/CT[J]. Diagnostics, 2021, 11: 1191-1191. DOI:10.3390/diagnostics11071191 |
| [25] |
Zhang YY, Zhou W, Wu X, et al. Cavernous artery intima-media thickness predicts the response to sildenafil in erectile dysfunction patients as a morphological parameter[J]. Andrologia, 2021, 53: e14149. |
| [26] |
Yang DC, Zhang SH, Fan L, et al. Thioether, sulfoxide and sulfone derivatives of dihydroartemisinin and their applications: CN, 110642869A [P]. 2020-01-03.
|
| [27] |
Yang Y, Yan JF, Fan L, et al. Synthesis of novel phenylacetic acid derivatives containing benzene-sulfonamide structural unit and their PPAR agonistic activity[J]. Acta Pharm Sin (药学学报), 2012, 47: 1630-1639. |
| [28] |
Yang DC, Yan JF, Xu J, et al. Synthesis and antidiabetic activity of 4-(1-aryl-3-oxo-5-phenyl-pentan -amino) benzenesulfonamide[J]. Acta Pharm Sin (药学学报), 2010, 45: 66-71. |
| [29] |
Proschak E, Stark H, Merk D. Polypharmacology by design: a medicinal chemist's perspective on multitargeting compounds[J]. J Med Chem, 2018, 62: 420-444. |
| [30] |
Vilaivan T. A rate enhancement of tert-butoxycarbonylation of aromatic amines with Boc2O in alcoholic solvents[J]. Tetrahedron Lett, 2006, 47: 6739-6742. DOI:10.1016/j.tetlet.2006.07.097 |
| [31] |
Luo P. Design, Synthesis and Biological Activity of Novel Compounds with Synephrine as Nucleus (以辛弗林为母核的多把点新型化合物设计、合成及生物活性研究) [D]. Chongqing: Southwest University, 2020.
|
| [32] |
Fan L, Yang DC, Pan JF, et al. p-Aminosalicylic acid dihydroartemisinin derivatives and preparation method and application thereof: CN, 2020110275326 [P]. 2020-09-25.
|
| [33] |
Yang DC, Li WL, Luo P, et al. Synephrine fluoroquinolone derivatives and preparation method and application thereo: CN, 2020110275504 [P]. 2020-09-25.
|
| [34] |
Yang DC, Luo P, Li WL, et al. Synephrinazole derivatives and preparation method and application thereof: CN, 2020110275650 [P]. 2020-09-25.
|
 2022, Vol. 57
2022, Vol. 57