2. 山西大学化学生物学与分子工程教育部重点实验室, 山西 太原 030006;
3. 地产中药功效物质研究与利用山西省重点实验室, 山西 太原 030006;
4. 中国医学科学院、北京协和医学院药物研究所, 北京 100050
2. The Key Laboratory of Chemical Biology and Molecular Engineering of Ministry of Education, Shanxi University, Taiyuan 030006, China;
3. The Key Laboratory of Effective Substances Research and Utilization in TCM of Shanxi Province, Taiyuan 030006, China;
4. Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
抑郁症是世界上最常见的精神类疾病之一[1, 2], 以显著而持久的负面情绪状态为特征, 具有较高的发病率、复发率和致残率[3-5]。根据世界卫生组织的最新数据, 到2030年抑郁症将升至全球疾病负担的首位[6, 7]。目前市场上治疗抑郁症的药物以化学药为主, 但停药后存在复发、毒副作用等诸多问题, 极大地影响了临床疗效和患者依从性[8]。近年来中医药在治疗抑郁症上应用广泛, 因其具有良好的治疗效果、不良反应小以及能改善抑郁症伴发症状等优势越来越受到人们的关注[9, 10]。因此, 从中药复方和天然化合物中挖掘和研制理想的抗抑郁药物, 对抑郁症的预防和治疗具有重要的意义[11]。柴归颗粒是本课题组在挖掘抗抑郁经典名方逍遥散科学内涵的基础上研发的抗抑郁新药, 其处方由柴胡、当归、白芍、麸炒白术、炙甘草、薄荷6味中药组成, 按照中药新药6.1类注册技术要求, 完成了化学与工艺、质控与标准、药理与毒理、制剂与稳定性、中试工艺验证等临床前研究[12, 13], 已经获得国家药品监督管理局新药审批中心批准(受理号: CXZL1700051; 批件号: 2018L03149), 并正在开展药物临床试验研究[13, 14]。中药复方成分多样, 作用机制复杂, 为当前研究的难点[15]。因此, 阐明柴归颗粒抗抑郁作用机制对促进该新药研制及后期临床应用具有重要意义。
代谢组学(metabolomics) 是指对某一生物或细胞在一定时期内产生的所有低分子量代谢物进行定性或定量分析的一门学科, 是系统生物学(system biology) 重要组成部分[16, 17]。同基因组学、转录组学和蛋白质组学等其他组学相比, 代谢组学可反映生物或细胞的代谢过程和代谢水平的特征, 更好地体现物质在体内发生的代谢变化[18, 19]。但另一方面, 生物机体的代谢网络庞大复杂, 靠单一的组学技术无法系统揭示疾病的发病机制, 需要整合生物信息学的手段。生物网络分析工具等新手段是生物信息学的重要组成部分, 可以揭示生物分子的复杂性和相互关系, 为系统识别复杂疾病的生物标志物和药物靶点提供新的思路[20-22]。Xu等[20]利用人类代谢网络、蛋白质-蛋白质相互作用和药物-靶标网络探索来自阿尔茨海默病小鼠模型和患者大脑的单细胞数据, 发现脂肪酸和氨基酸可引发疾病相关的小胶质细胞和星形胶质细胞间的分子网络改变。中药复方常被视作一个复杂体系, 其具有治疗作用的活性成分与人体生物学网络间存在着复杂调控网络[23]。因此, 从新的层面通过整合代谢组学和生物网络分析手段开展中医药复杂体系的整体调控作用机制研究具有重要意义。本研究成功建立慢性不可预见性轻度应激(chronic unpredictable mild stress, CUMS) 抑郁大鼠模型, 利用血浆代谢组学技术结合多变量数据处理方法筛选柴归颗粒发挥抗抑郁作用的关键生物标志物和代谢通路, 最后结合生物信息学手段对筛选得到的关键代谢物进行分析, 构建相关生物网络来探讨柴归颗粒的抗抑郁作用机制。
材料与方法动物 健康雄性SPF级SD大鼠(180~200 g) 购于北京维通利华实验动物技术有限公司, 许可证号: SCXK (京) 2016-0006。实验开始前适应性饲养7天, 饲养环境温度为(25 ± 2) ℃, 湿度为(55 ± 5) %, 12 h明暗交替光照, 实验期间动物自由摄食和饮用水。动物实验遵循山西大学动物伦理委员会的规定并通过动物实验伦理审查(批号: SXULL2020028)。
药物 柴归颗粒(批号20181009) 委托山西省中医药研究院制剂中心制备, 由柴胡16.38 kg、当归16.38 kg、白芍16.38 kg、麸炒白术16.38 kg、炙甘草8.19 kg、薄荷5.46 kg组成。以上药材均采购于山西省华阳药业有限公司, 经山西大学中医药现代研究中心秦雪梅教授鉴定柴胡Bupleurum chinense DC.、当归Angelica sinensis (Oliv.) Diels.、白芍Paeonia lactiflora Pall.、白术Atractylodes macrocephala Koidz.、甘草Glycyrrhiza uralensis Fisch.和薄荷Mentha haplocalyx Briq.均为正品, 且符合2020年版中国药典标准。
仪器及试剂 超高效液相色谱-质谱联用仪(Thermo-Fisher Dionex UltiMate 3000 UHPLC-Q Exactive Orbitrap-MS) 和色谱柱: ACQUITY UPLC HSS T3 (2.1 mm × 100 mm, 1.8 μm) (美国Waters公司); Neofuge 13R高速台式冷冻离心机(上海力申科学仪器有限公司); 真空冷冻干燥机(上海知信仪器技术有限公司); 蔗糖(天津市风船化学试剂科技有限公司); 乙腈(色谱级)、甲酸(色谱级)、甲醇(色谱级) (美国Thermo Fisher Scientific公司); CP214电子天平[奥豪斯仪器(常州) 有限公司]。
分组与给药 适应7天后, 对所有大鼠称量体重, 进行旷场实验和糖水偏爱实验行为学测试, 剔除个别异常鼠, 将32只大鼠随机分为4组, 分别为正常组(C, control), 模型组(M, CUMS model), 柴归颗粒中、高剂量(CGGM, 8.3 g·kg-1、CGGH, 16.6 g·kg-1)。各给药组按照10 mL·kg-1灌胃给药, 正常对照组和模型组给予相应体积的蒸馏水。
CUMS抑郁大鼠模型的构建 参照课题组前期方法[24-26], 建立CUMS大鼠抑郁模型。除对照组, 其他组大鼠相同条件下单独饲养, 并每天随机给予一种应激, 如热刺激(50 ℃, 10 min)、4 ℃冰水中游泳(5 min)、超声刺激(60 Hz, 3 h)、夹尾(2 min)、昼夜颠倒、足底电击(每次10 s, 共10次)、禁水(24 h)、束缚(3 h) 和禁食(24 h) 等。同1种应激累计使用不得大于4次, 持续4周。
LC-MS代谢组学数据收集
大鼠血浆样本的采集 在最后一次给药24 h后, 大鼠腹腔注射10%水合氯醛以0.003 mL·g-1麻醉, 腹主动脉采血, 置于肝素钠管中, 3 000 r·min-1离心10 min, 取血浆于-80 ℃冰箱保存, 用于后续代谢组学分析。
血浆代谢组学样本的制备 将大鼠血浆样本从-80 ℃冰箱取出, 于4 ℃下解冻30 min, 吸取100 μL血浆样品、225 μL甲醇和75 μL乙腈, 混合, 涡旋3 min, 4 ℃、12 000 r·min-1下离心20 min, 上清液用真空冷冻干燥机冻干, 提取物150 μL甲醇-乙腈(3:1) 复溶, 涡旋5 min, 4 ℃、12 000 r·min-1离心20 min, 取100 μL上清液进样分析。取上述每个测试样品上清液各10 μL并充分混合, 作为质量控制(quality control, QC) 样本, 进样时每5个样本插入一个QC样本, 用来检查仪器是否稳定。
液相条件 流动相A% (0.1%甲酸水)、流动相B% (0.1%甲酸乙腈), 按以下梯度洗脱: 0~2 min, 2% B; 2~3 min, 2%~35% B; 3~16 min, 35%~60% B; 16~18 min, 60%~73% B; 18~28 min, 73%~98% B; 28~30 min, 98% B; 30~33 min, 98%~2% B; 33~35 min, 2% B。采用Waters ACQUITYUPLC HSS T3 (2.1 mm × 100 mm, 1.7 μm) 色谱柱, 进样量5 μL、流速0.3 mL·min-1和柱温35 ℃下进行分析。
质谱条件 采用加热电喷雾电离(HESI) 方法, 正负离子切换采集模式Full Scan/dd-MS2扫描模式; 喷雾电压正负极分别为3.5 kV、2.5 kV; 毛细管温度, 350 ℃; 鞘气流速: 30 arb, 辅助气流速: 10 arb; 质谱检测采集范围为m/z 50~1 000。
LC-MS数据处理 将代谢组学原始数据导入Compound Discoverer 3.1软件(Thermo公司, 美国), 处理得每个样本匹配和对齐的峰值相关数据。将从Compound Discoverer 3.1软件导出的数据导入Excel 2016, 进行总峰面积归一化。将归一化峰表数据导入SIMCA-P 14.1软件(Umetrics公司, 瑞典) 进行主成分分析(principal component analysis, PCA), 偏最小二乘法判别分析(partial least squares discrimination analysis, PLS-DA) 和正交偏最小二乘法判别分析(partial least squares discriminant analysis, OPLS-DA)。结合OPLS-DA分析中的VIP (variable importance in the projection) > 1及T检验(P < 0.05) 筛选正常对照组与CUMS抑郁模型组之间显著改变的差异变量。结合二级碎片离子和在线数据库HMDB、Metlin和Pubchem等对筛选出的差异代谢物进行指认鉴定。
关键代谢物生物网络的构建与分析 将柴归颗粒调节的关键代谢物导入Cytoscape软件的插件Metscape, 建立关键代谢物-基因网络, 获得代谢物相关基因。通过GeneCards数据库(https://genecards.weizmann.ac.il/v3/) 输入关键词“depression (抑郁症)”搜索疾病基因, 通过韦恩图(Venn diagram) 求关键代谢物相关基因和疾病基因的交集。采用Cytoscape软件插件Cluego对筛选出的共有基因进行KEGG富集分析。将韦恩图所得共有基因导入STRING (https://string-db.org/) 在线数据库分析, 得到蛋白质-蛋白质相互作用网络(Protein-protein interaction, PPI), 网络导入Cytoscape软件, 利用其CytoHubba插件以最大集团中心度(maximal clique centrality, MCC) 进行网络节点排名, 排名前十的蛋白为柴归颗粒治疗抑郁症的潜在靶点, 利用MetaboAnalyst5.0网站的Joint-Pathways Analyst板块, 对得到的10个潜在靶点进行联合通路分析, 分析靶点和通路的关系。
统计学分析 GraphPad Prism 8.1软件作图。数据以平均值± SEM表示, 采用SPSS 26.0软件进行统计分析, 通过t检验比较两组之间的统计学差异, 通过单因素方差分析(one-way ANOVA) 比较多组之间的统计学差异, P < 0.05被认为数据之间存在显著性差异。
结果与讨论 1 代谢组学分析 1.1 仪器系统稳定性监测大鼠血浆样本的离子流色谱图通过UPLC-MS/MS的正、负离子模式获得。采用无监督的PCA模式对QC样本进行聚类分析来考察仪器系统的稳定性。结果图 1A所示, 无监督模式PCA评分图中正常组和模型明显分离, QC样品聚类良好, 表明所建立的代谢组学分析方法稳定可靠, 符合大批量进样的分析条件。
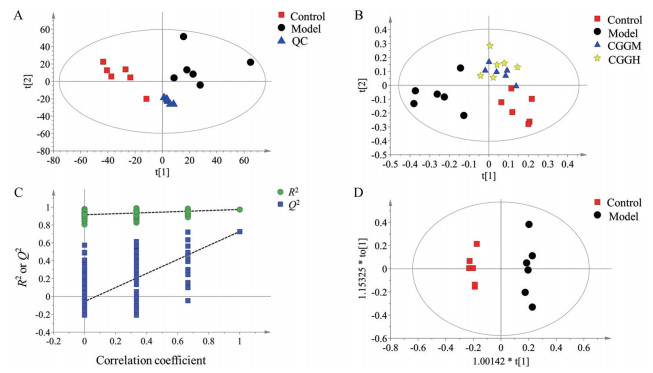
|
Figure 1 Metabolomics profiling analysis of plasma. A: PCA score plots of QC samples; B: PLS-DA score plot; C: PLS-DA validation plot; D: OPLS-DA score plots. CGGM: Medium dose group of Chaigui granules, CGGH: High dose group of Chaigui granules |
首先应用PLS-DA对各组样本进行代谢轮廓分析。图 1B为所有组样本的PLS-DA图, 空白组与模型组显著分开, 表明CUMS造模4周后引起大鼠血浆代谢轮廓发生明显变化, CUMS模型复制成功, 柴归颗粒中、高剂量给药组均与模型组显著分开, 而且更加靠近正常组, 表明柴归颗粒能改善抑郁大鼠血浆代谢异常。所有组进行PLS-DA代谢轮廓分析后, 对空白组和CUMS模型组进行模型验证。如图 1C所示, 发现模型拟合性好, 预测具有可靠性(R2 = 0.917, Q2 = -0.035)。此外, 用OPLS-DA分析评估对照组和模型组之间的代谢物的差异, 在血浆中, 对照组和模型组之间有明显的分离(图 1D)。上述结果表明, 柴归颗粒治疗后, CUMS造模诱发的代谢紊乱得到改善。
1.3 差异代谢物分析根据血浆代谢物的质荷比、分子式、二级碎片离子、保留时间, 并结合在线数据库对正常空白组与模型组之间显著变化的代谢物进行鉴定, 共指认出20个差异代谢物(表 1)。与对照组相比, CUMS模型组有13个差异代谢物(3-羟基丁酸、鹅去氧胆酸、胆酸、脱氧胆酸、乙醇酸、亚油基肉碱、N-乙酰缬氨酸、棕榈酰肉碱、硬脂酰肉碱、三氟乙酸、缬氨酸、L-蛋氨酸、花生四烯酸) 增加, 7个差异代谢物(二十二碳三烯酸、LysoPC(18:1(9Z))、4-羟基苯甲醛、L-谷氨酰胺、L-酪氨酸、LysoPC(18:3(9Z, 12Z, 15Z))、N-月桂酰甘氨酸) 减少, 其中如图 2所示, 12种代谢物在柴归颗粒治疗后显著回调(P < 0.05)。结果表明, 给予柴归颗粒治疗后, 模型组大鼠的代谢物可以被明显调节, 代谢紊乱情况得到改善。
| Table 1 Differential metabolites in plasma which were associated with depression detected by UPLC-MS/MS. "↓" or "↑" means the changes of metabolites in model group compared with control group; *P < 0.05, **P < 0.01, model group vs control group; VIP: Variable importance value |

|
Figure 2 Relative peak areas of the potential biomarkers in plasma regulated by Chaigui granules. n = 6, |
将差异代谢物导入Metaboanalyst 5.0数据库中进行代谢通路分析。代谢通路影响值(impact value) > 0.1的通路被视为贡献值最大的代谢通路。共筛选得到5条与抑郁显著相关的代谢通路(图 3), 主要包括苯丙氨酸、酪氨酸和色氨酸的生物合成; 花生四烯酸代谢; 酪氨酸代谢; 丙氨酸、天冬氨酸和谷氨酸代谢; 半胱氨酸和蛋氨酸代谢。在CUMS模型影响的5条代谢通路中, 柴归颗粒能调节其中的4条, 主要包括苯丙氨酸、酪氨酸和色氨酸的生物合成; 花生四烯酸代谢; 酪氨酸代谢; 丙氨酸、天冬氨酸和谷氨酸代谢。
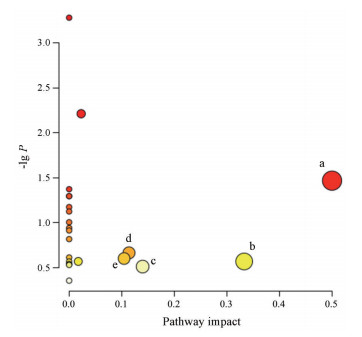
|
Figure 3 Metabolic pathways related to depression. a: Phenylalanine, tyrosine and tryptophan biosynthesis; b: Arachidonic acid metabolism; c: Tyrosine metabolism; d: Alanine, aspartate and glutamate metabolism; e: Cysteine and methionine metabolism |
选择柴归颗粒调节的关键代谢物进行生物网络分析, 进一步聚焦柴归颗粒发挥抗抑郁作用的核心代谢通路, 挖掘其潜在的抗抑郁靶点。运用Cytoscape插件Metscape构建代谢物-通路相关基因网络, 见图 4。通过Gene‐Cards网站输入关键词“depression (抑郁症)”搜索疾病基因靶点, 共得到13 266种。通过韦恩图求通路基因和疾病基因的交集发现两者的共有靶点为71个。应用Cytoscape软件插件Cluego对筛选出71个共有靶点进行KEGG富集分析, 结果见图 5。KEGG富集分析结果显示柴归颗粒调节的主要通路包括花生四烯酸代谢、脂肪酸降解、酪氨酸代谢、丙氨酸、天冬氨酸和谷氨酸代谢等。其中花生四烯酸代谢在所有通路中占比最大, 表明花生四烯酸代谢可能是柴归颗粒发挥抗抑郁作用的重要通路。花生四烯酸是一种ω-6多不饱和脂肪酸, 广泛存在于动物的体内, 它和其代谢产物(如前列腺素、白三烯) 是机体重要的生物活性物质, 可以调节大脑中的神经传递、兴奋性毒性和神经炎症等过程[27, 28]。花生四烯酸在炎症反应中扮演着重要角色, 可以代谢生成前列腺素和白三烯b4。已有研究表明, 在阿尔茨海默症和重度抑郁症等精神类疾病中花生四烯酸及其代谢物的水平升高[29, 30]。本研究发现CUMS抑郁模型大鼠中花生四烯酸的含量升高, 代谢通路分析结果也表明CUMS造模可引起大鼠体内花生四烯酸代谢通路紊乱。花生四烯酸含量的升高和花生四烯酸代谢通路的紊乱都可被柴归颗粒所逆转, 提示柴归颗粒可以通过降低花生四烯酸水平来调控花生四烯酸代谢发挥抗抑郁作用。

|
Figure 4 The compound-gene networks of the key metabolites and targets for the antidepressant effect of Chaigui granules. The red hexagons represent the potential biomarkers regulated by Chaigui granules. The pink hexagons represent compounds associated with the potential biomarkers. The purple circles represent genes associated with the potential biomarkers |
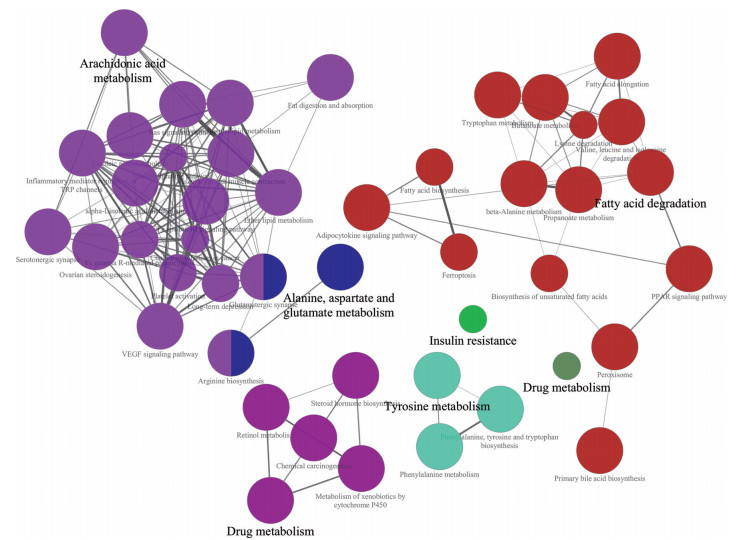
|
Figure 5 The network of analysis of KEGG for the antidepressant effect of Chaigui granules. The top five pathways are arachidonic acid metabolism, fatty acid degradation, drug metabolism, alanine, aspartate and glutamatemetabolism, and tyrosine metabolism |
将韦恩图所得71个共有靶点导入STRING (https://string-db.org/) 在线数据库分析, 得到PPI网络, 见图 6。将此PPI网络导入Cytoscape软件, 利用其CytoHubba插件对网络中的节点进行排名, 以最大集团中心度(maximal clique centrality, MCC) 得分最高的蛋白倾向于关键蛋白, 获得排名前十的蛋白靶点分别为CYP2B6、CYP2E1、CYP2C9、CYP2C8、PLA2G6、PTGS2、ALOX15B、PTGS1、ALOX12和ALOX5, 在网络图中起主要作用, 其主要分布于花生四烯酸途径。前列腺素内过氧化物合酶(PTGS) 可以催化花生四烯酸生成前列腺素。作为前列腺素生物合成的关键限速酶, PTGS有两种同工酶: 组成型PTGS1和诱导型PTGS2, 由特定的刺激事件调节, 与炎症相关的前列腺素生物合成有关[31]。本课题组前期研究表明, 柴胡白芍药对可协同降低花生四烯酸水平, 抑制PTGS1和PTGS2活性, 从而调控花生四烯酸代谢而发挥抗抑郁作用[32]。此外, 初步临床证据表明, 一些非甾体抗炎药物, 如PTGS2抑制剂塞来昔布, 可增强抗抑郁治疗的疗效[33]。

|
Figure 6 Protein-protein interaction network of the shared targets. CYP2B6: Cytochrome P450 family 2 subfamily B member 6; CYP2E1: Cytochrome P450 family 2 subfamily E member 1; CYP2C9: Cytochrome P450 family 2 subfamily C member 9; CYP2C8: Cytochrome P450 family 2 subfamily C member 8; PLA2G6: Phospholipase A2 group VI; PTGS2: Prostaglandin-endoperoxide synthase 2; ALOX15B: Arachidonate 15-lipoxygenase type B; PTGS1: Prostaglandin-endoperoxide synthase 1; ALOX12: Arachidonate 12-lipoxygenase, 12S type; ALOX5: Arachidonate 5-lipoxygenase |
柴归颗粒是在挖掘抗抑郁经典名方逍遥散科学内涵的基础上研发的抗抑郁新药, 深度阐明柴归颗粒抗抑郁作用机制对促进该新药研发及后期临床应用具有重要意义。CUMS抑郁大鼠模型是国际上目前较为公认的抑郁症动物模型, 它能够稳定地模拟人类抑郁症患者的核心症状快感缺失现象, 且具有高度的相似性, 也是基础研究中最常见的抑郁症动物模型[34-36]。因此, 使用CUMS模型研究抑郁症的病因和抗抑郁药的作用机制具有重要的科学意义。本研究采用CUMS联合孤养的抑郁模型, 利用代谢组学技术对大鼠血浆样本进行分析, 发现与对照组比较, CUMS模型组大鼠中20个生物标志物含量有显著差异(P < 0.05), 柴归颗粒治疗后能显著回调二十二碳三烯酸、3-羟基丁酸、4-羟基苯甲醛、鹅去氧胆酸、胆酸、L-谷氨酰胺、乙醇酸、亚油基肉碱、L-酪氨酸、N-乙酰缬氨酸、棕榈酰肉碱和花生四烯酸等12个内源性代谢物。通过生物网络分析工具对柴归颗粒调节的关键代谢物进行网络分析表明血浆的花生四烯酸代谢途径可能是柴归颗粒发挥抗抑郁作用的重要通路, 花生四烯酸代谢途径上的CYP2B6、CYP2E1、CYP2C9、CYP2C8、PLA2G6、PTGS2、ALOX15B、PTGS1、ALOX12和ALOX5等10个蛋白为柴归颗粒发挥抗抑郁作用的潜在靶点。
作者贡献: 周玉枝、秦雪梅、杜冠华负责研究思路的提出; 黄德华、王力文、宫文霞进行实验并处理数据; 周玉枝、田俊生、高晓霞提供撰写思路及修改论文; 黄德华查阅部分文献, 撰写草稿。所有作者阅读并认可的终稿。
利益冲突: 所有作者均无相关利益冲突。
| [1] |
Bridges L, Sharma M. The efficacy of yoga as a form of treatment for depression[J]. J Evid Based Complement Altern Med, 2017, 22: 1017-1028. DOI:10.1177/2156587217715927 |
| [2] |
Mitina M, Young S, Zhavoronkov A. Psychological aging, depression, and well-being[J]. Aging (Albany NY), 2020, 12: 18765-18777. |
| [3] |
Chen JJ, Qin XM, Du GH, et al. Advances in the pathogenesis of depression based on purinergic system and purine metabolism[J]. Acta Pharm Sin (药学学报), 2021, 56: 2464-2471. |
| [4] |
Smith K. Mental health: a world of depression[J]. Nature, 2014, 515: 181. |
| [5] |
Jiao H, Yan Z, Ma Q, et al. Influence of Xiaoyaosan on depressive-like behaviors in chronic stress-depressed rats through regulating tryptophan metabolism in hippocampus[J]. Neuropsychiatr Dis Treat, 2019, 15: 21-31. |
| [6] |
Oh DR, Yoo JS, Kim Y, et al. Vaccinium bracteatum leaf extract reverses chronic restraint stress-induced depression-like behavior in mice: regulation of hypothalamic-pituitary-adrenal axis, serotonin turnover systems, and ERK/Akt phosphorylation[J]. Front Pharmacol, 2018, 9: 604. DOI:10.3389/fphar.2018.00604 |
| [7] |
Opoku AK, Terhorst Y, Vega J, et al. Predicting depression from smartphone behavioral markers using machine learning methods, hyperparameter optimization, and feature importance analysis: exploratory study[J]. JMIR Mhealth Uhealth, 2021, 9: e26540. DOI:10.2196/26540 |
| [8] |
Ma WN, Zhou MM, Gou XJ, et al. Urinary metabolomic study of chlorogenic acid in a rat model of chronic sleep deprivation using gas chromatography-mass spectrometry[J]. Int J Genomics, 2018, 2018: 1361402. |
| [9] |
Chu HB, Tan YD, Li YJ, et al. Anxiolytic and anti-depressant effects of hydroalcoholic extract from Erythrina variegata and its possible mechanism of action[J]. Afr Health Sci, 2019, 19: 2526-2536. DOI:10.4314/ahs.v19i3.28 |
| [10] |
Wang FR, Qiao MQ, Xue L, et al. Possible involvement of μ opioid receptor in the antidepressant-like effect of shuyu formula in restraint stress-induced depression-like rats[J]. Evid Based Complement Alternat Med, 2015, 2015: 452412. |
| [11] |
Shi ZP, Wu XY, Dong Q, et al. Mechanism and research progress of anti-depression Chinese medicine compound prescription[J]. Asia-Pac Tradit Med (亚太传统医药), 2017, 13: 68-70. |
| [12] |
Chen L, Zheng XF, Gao XX, et al. Anti-depressant effect and mechanism of supercritical CO2 extract from compound Chaigui Fang[J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 2744-2750. |
| [13] |
Gao X, Li Y, Meng M, et al. Exploration of chemical composition and absorption characteristics of Chaigui granules based on UHPLC-Q-orbitrap-MS/MS[J]. J Pharm Biomed Anal, 2020, 187: 113293. DOI:10.1016/j.jpba.2020.113293 |
| [14] |
Zhao YX, Xu T, Tian JS, et al. Effect of Chaigui granule on gut microbiota in chronic unpredicted mild stress induced depression rats model[J]. Chin Tradit Herb Drugs (中草药), 2021, 52: 736-743. |
| [15] |
Wang Z, Chen YY, Zhang YY, et al. Problems and solutions in study of multi- component and multi-target mechanism of action of Ttraditional Chinese Medicine[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2018, 24: 1-6. |
| [16] |
Hu H, Fang Z, Mu T, et al. Application of metabolomics in diagnosis of cow mastitis: a review[J]. Front Vet Sci, 2021, 8: 747519. DOI:10.3389/fvets.2021.747519 |
| [17] |
Su G, Wang H, Gao Y, et al. 1H-NMR-based metabonomics of the protective effect of Coptis chinensis and berberine on cinnabar-induced hepatotoxicity and nephrotoxicity in rats[J]. Molecules, 2017, 22: 1855. DOI:10.3390/molecules22111855 |
| [18] |
Fiehn O. Metabolomics-the link between genotypes and phenotypes[J]. Plant Mol Biol, 2002, 48: 155-171. DOI:10.1023/A:1013713905833 |
| [19] |
Yao C, Tang N, Xie G, et al. Management of hepatic encephalopathy by traditional Chinese medicine[J]. Evid Based Complement Alternat Med, 2012, 2012: 835686. |
| [20] |
Xu J, Zhang P, Huang Y, et al. Multimodal single-cell/nucleus RNA sequencing data analysis uncovers molecular networks between disease-associated microglia and astrocytes with implications for drug repurposing in Alzheimer's disease[J]. Genome Res, 2021, 31: 1900-1912. DOI:10.1101/gr.272484.120 |
| [21] |
Lee MY, Hu T. Computational methods for the discovery of metabolic markers of complex traits[J]. Metabolites, 2019, 9: 66. DOI:10.3390/metabo9040066 |
| [22] |
Guo L, Li L, Xu Z, et al. Metabolic network-based identification of plasma markers for non-small cell lung cancer[J]. Anal Bioanal Chem, 2021, 413: 7421-7430. DOI:10.1007/s00216-021-03699-5 |
| [23] |
Tian G, Hu YZ, Li C, et al. The mechanism of action of Pudilan Xiaoyan oral liquid against LPS-induced acute respiratory infection in mice based on biological network analysis and metabolomics[J]. Acta Pharm Sin (药学学报), 2021, 56: 816-822. |
| [24] |
Liu X, Wei F, Liu H, et al. Integrating hippocampal metabolomics and network pharmacology deciphers the antidepressant mechanisms of Xiaoyaosan[J]. J Ethnopharmacol, 2021, 268: 113549. DOI:10.1016/j.jep.2020.113549 |
| [25] |
Gong W, Zhu S, Chen C, et al. The anti-depression effect of Angelicae Sinensis Radix is related to the pharmacological activity of modulating the hematological anomalies[J]. Front Pharmacol, 2019, 10: 192. DOI:10.3389/fphar.2019.00192 |
| [26] |
Chen CC, Yin QC, Tian JS, et al. The mechanism of the anti-depression effect of the Radix Bupleuri-Radix Paeoniae Alba herb pair determined by liver metabolomics[J]. Acta Pharm Sin (药学学报), 2020, 55: 941-949. |
| [27] |
Zhang H, Lu D, Li X, et al. Heavy ion mutagenesis combined with triclosan screening provides a new strategy for improving the arachidonic acid yield in Mortierella alpina[J]. BMC Biotechnol, 2018, 18: 23. DOI:10.1186/s12896-018-0437-y |
| [28] |
Larrieu T, Laye S. Food for mood: relevance of nutritional omega-3 fatty acids for depression and anxiety[J]. Front Physiol, 2018, 9: 1047. DOI:10.3389/fphys.2018.01047 |
| [29] |
Green P, Gispan-Herman I, Yadid G. Increased arachidonic acid concentration in the brain of flinders sensitive line rats, an animal model of depression[J]. J Lipid Res, 2005, 46: 1093-1096. DOI:10.1194/jlr.C500003-JLR200 |
| [30] |
Bazinet RP, Laye S. Polyunsaturated fatty acids and their metabolites in brain function and disease[J]. Nat Rev Neurosci, 2014, 15: 771-785. |
| [31] |
Le HD, Meisel JA, de Meijer VE, et al. The essentiality of arachidonic acid and docosahexaenoic acid[J]. Prostaglandins Leukot Essent Fatty Acids, 2009, 81: 165-170. DOI:10.1016/j.plefa.2009.05.020 |
| [32] |
Li X, Qin XM, Tian JS, et al. Integrated network pharmacology and metabolomics to dissect the combination mechanisms of Bupleurum chinense DC-Paeonia lactiflora Pall herb pair for treating depression[J]. J Ethnopharmacol, 2021, 264: 113281. DOI:10.1016/j.jep.2020.113281 |
| [33] |
Leonard BE. Inflammation and depression: a causal or coincidental link to the pathophysiology?[J]. Acta Neuropsychiatr, 2018, 30: 1-16. |
| [34] |
Yan L, Xu X, He Z, et al. Antidepressant-like effects and cognitive enhancement of coadministration of Chaihu Shugan San and fluoxetine: dependent on the BDNF-ERK-CREB signaling pathway in the hippocampus and frontal cortex[J]. Biomed Res Int, 2020, 2020: 2794263. |
| [35] |
Xie H, Jin D, Kang Y, et al. The effect of Piper laetispicum extract (EAE-P) during chronic unpredictable mild stress based on interrelationship of inflammatory cytokines, apoptosis cytokines and neurotrophin in the hippocampus[J]. BMC Complement Altern Med, 2015, 15: 240. |
| [36] |
Zhao J, Niu C, Wang J, et al. The depressive-like behaviors of chronic unpredictable mild stress-treated mice, ameliorated by Tibetan medicine Zuotai: involvement in the hypothalamic-pituitary-adrenal (HPA) axis pathway[J]. Neuropsychiatr Dis Treat, 2018, 14: 129-141. DOI:10.2147/NDT.S151107 |
 2022, Vol. 57
2022, Vol. 57


