2. 中山大学药学院 (深圳), 广东 广州 510006
2. School of Pharmaceutical Sciences (Shenzhen), Sun Yat-sen University, Guangzhou 510006, China
益生菌被广泛定义为“当给予足够剂量时对宿主有益的活微生物”。大量研究表明, 益生菌能够对机体产生多种有益作用, 如调整肠道微生态平衡、提高消化酶活性、促进动物器官生理机能成熟和增强机体免疫等[1-3]。随着近年来对益生菌研究的不断深入, 益生菌在治疗方面也产生显著的疗效, 例如可以抑制肠道病原体[4], 缓解便秘[5]和腹泻[6], 抑制癌细胞和肿瘤生长等[7, 8]。尽管大量证据表明益生菌的优势作用, 但只有少数研究涉及益生菌在胃肠道中的迁移和定植, 其具体的定植存活率研究尚在起步阶段[9]。究其原因, 很大程度上是由于标记策略的局限性。目前, 关于细菌的迁移和定植的具体信息, 研究较为前沿的是Wang等[9, 10], 详细解释了体内细菌的生长分裂模式以及整体菌群移植特性, 但其尚未关注常见益生菌定植到体内后的具体定植活性。
目前, 益生菌定植活性的研究方法主要分为体外模拟实验和体内定植活性研究。体外模拟实验主要是通过细菌对肠上皮细胞的黏附实验和胃肠道模拟实验来评估细菌的定植潜力[11], 但忽略了机体先天免疫反应和肠道复杂的微生物群环境[12]。体内定植活性研究主要有平板计数法、聚合酶链式反应(PCR)、荧光标记法等[12, 13]。平板计数法是传统的细菌生存能力衡量的标准方法, 但是肠道细菌能培养者尚在少数, 且不能实时获取实验结果, 往往实验周期较长。荧光定量PCR可以对细菌进行定量分析, 结果较为准确, 但PCR需要设计特异性引物, 只能反映某种特定菌株基因存在多少的情况, 其结果并不能区分细菌的死活情况。
近年来, 荧光标记技术的发展对益生菌体内追踪提供了很好的技术支持。目前益生菌的在体分析中, 广泛应用的荧光标记策略, 主要可以分为基于基因工程细菌或标记在细菌表面的化学探针标记[14]。基因工程中使用的报告基因包括荧光蛋白基因[15]和生物发光基因(荧光素酶)[16], 但荧光素酶和大多数荧光蛋白需要在有氧条件下才能产生荧光信号或促进生色团的成熟, 而肠道中的低氧环境会严重影响它们在体内对细菌成像的用途[17]。化学标记策略上, 有研究运用生物正交点击化学技术对细菌自身合成细菌壁所需的糖进行叠氮基修饰, 使菌体新合成的细菌壁连接上叠氮基, 通过铜催化反应实现与荧光基团的偶联, 进而达到荧光标记的目的[9, 18]。但传统点击化学反应一般需要在铜催化下进行与荧光基团的连接反应, 不仅过程繁琐且会对细菌产生毒害作用, 不利于下一步研究。细胞增殖示踪荧光探针(CFDA-SE) 也是一种简单的化学标记策略[19], 且其优势是只对活细胞进行荧光标记, 且荧光均匀稳定, 但这种探针无法区分细菌与细胞, 不能直接用于生物体内的细菌活性检测。
荧光D-氨基酸(fluorescent D-amino-acids, FDAAs) 是一种根据细菌细胞壁的主要成分肽聚糖(peptidoglycan, PG) 在合成过程中需要D-氨基酸, 设计出的能在细菌自身生长过程中被利用从而实现菌体成像的探针[20]。D-氨基酸具有非常高的生物相容性, 动物体内基本不利用D-氨基酸, 其只在细菌、植物体等细胞壁合成过程中被利用[21], 故其与荧光基团结合后, 可在体内定位。因此作者推测能否利用这种探针直接对益生菌在肠道原位定植活性进行检测。同时由于各种益生菌的菌体大小不一, 至今关于益生菌定植活性的研究中较少考虑是否会与菌体大小有关[22], 故本研究中选取的3种益生菌均代表了大部分益生菌的菌体大小。嗜酸乳杆菌(Lactobacillus acidophilus, LA) 作为经典的几种益生菌之一, 菌体约1~6 μm代表了大部分杆菌的大小; 韦荣球菌(Veillonella atypica, VA) 作为新兴明星菌代表了较小的一类球菌; 干酪乳杆菌(Lactobacillus casei, LC) 菌体较大, 约10~20 μm代表了细菌中菌体较大的一类, 以3种尺寸为代表性的益生菌来评估该法研究益生菌在肠道定植活性的可行性。
本研究成功建立了一种基于FDAAs标记的考察口服益生菌在肠道原位定植活性的方法。即先用红色探针(TAMRA-D-lysine, TDL) 体外标记益生菌口服灌胃给小鼠后, 再灌胃绿色探针(fluorescein-D-lysine, FDL), 则灌胃后存活下来的益生菌会被标记上绿色。本文利用该法考察了口服益生菌的肠道原位定植活性。
材料与方法仪器 400 MHz核磁共振波谱仪(瑞士Bruker公司); 荧光分光光度计(日本Hitachi公司); CO2培养箱(新加坡ESCO科技有限公司); 多功能酶标仪(美国Bio-rad公司); BX53荧光显微镜(日本Olympus株式会社); 冰冻切片机(美国Thermo Fisher科技公司); 激光共聚焦显微镜(德国Zeiss公司); 流式细胞仪(美国Agilent科技有限公司)。
试剂 异硫氰酸荧光素(FITC) 和二异丙基乙胺(DIPEA), 上海凛恩科技发展有限公司; 5(6)-羧基四甲基罗丹明琥珀酰亚胺酯[5(6)-TAMRA-SE], 上海毕得医药科技股份有限公司; N(α)-Boc-D-赖氨酸(Boc-D-Lys-OH) 及N, N-二甲基甲酰胺(DMF), 上海阿拉丁生化科技股份有限公司; 乙酸乙酯及二氯甲烷, 天津致远化学试剂有限公司; 三氟乙酸, 上海麦克林生化科技有限公司; 二甲基亚砜, 美国Mpbio公司; MRS培养基及BHI培养基, 青岛海博生物技术有限公司; 琼脂糖, 美国Sigma公司。
菌种 LA (CICC6096)、LC (CICC6117) 购自中国工业微生物菌种保藏管理中心, VA (ATCC17744) 购自美国菌种保藏中心。
动物 雄性SPF级C57BL/6小鼠, 体重18~22 g, 由珠海百试通生物科技有限公司提供, 许可证号SCXK (粤) 2020-0051; 实验期间饲养于广州中医药大学动物中心, 环境级别为SPF级, 实验单位使用许可证号为SYXK (粤) 2018-0085。本实验获得广州中医药大学动物伦理委员会批准(批准号: 20200918002)。
FDAAs的合成与纯化表征 取13.2 mg Boc-D-Lys-OH (0.054 mmol) 和20.7 mg 5(6)-TAMRA-SE (0.038 mmol) 于含有0.8 mL DMF及10 μL DIPEA的圆底烧瓶中, 用磁力搅拌器在无氧条件下室温反应过夜(18 h); 产物与10 mL 1:1的TFA: DCM溶液继续反应30 min; 即得TDL粗产物[23]。
取30.1 mg FITC (0.078 mmol) 和23.7 mg Boc-D-Lys-OH (0.094 mmol) 于含有1.5 mL DMF的圆底烧瓶中, 用磁力搅拌器在无氧条件下室温反应4 h; 产物与10 mL 1:1的TFA: DCM溶液继续反应30 min; 即得FDL粗产物[23]。
使用制备液相在C18柱(250 mm × 10 mm) 上对各粗产物进行纯化, 流动相A为含0.05% TFA的乙腈, 流动相B为含0.05% TFA的水, 流速为5 mL·min-1; 其中TDL流动相比例为A: B = 50:50, 检测波长为555 nm, FDL流动相比例为A: B = 30:70, 检测波长为440 nm。
采用核磁共振法进行化合物结构表征, 荧光分光光度计法扫描产物的荧光吸收, 对TDL和FDL的荧光光谱进行表征。
益生菌的培养与体外标记 在饱和湿度的CO2培养箱中对各益生菌进行培养(37 ℃, 5% CO2), 其中LA和LC培养基为MRS肉汤, 而VA培养基为含乳酸的BHI肉汤, 且需在厌氧袋中进行培养。
将FDAAs溶解在DMSO中配制成适宜浓度的母液, 在0.99 mL处于对数生长期的菌液中加入10 μL的FDAAs母液, 使其终浓度为0.3 mmol·L-1并充分混匀, 继续培养3 h后取出菌液, 离心(5 000 r·min-1, 5 min), 弃上清液, 沉淀加入1 mL 70%的乙醇重悬后在冰上固定10 min, 离心(5 000 r·min-1, 5 min), 弃上清液, 用2×1 mL的无菌PBS洗涤, 沉淀重悬在1 mL的无菌PBS里作为待测菌液, 进行下一步镜检或者流式测定。如进行体内定植研究, 则无需固定, 将菌液分装为1×108 CFU·mL-1即可。
FDAAs的细菌毒性 为了考察FDAAs对细菌生长的影响, 用终浓度为0.125、0.3、0.5、1、2和3 mmol·L-1的FDAAs与不同菌共同孵育12 h后取出菌液, 离心(5 000 r·min-1, 5 min), 弃上清液, 用2×1 mL的无菌PBS洗涤后, 沉淀重悬在1 mL的无菌PBS里作为待测菌液, 各吸取0.2 mL于96孔板中利用酶标仪测量OD600值, 实验重复3次, 取平均值。
肠道菌群标记 给予C57BL/6小鼠灌胃0.2 mL浓度为3 mmol·L-1的FDAAs溶液, 4 h后即完成标记, 颈椎脱臼处死小鼠, 根据参考文献[24]选取盲肠及其内容物放入1 mL无菌PBS中剪碎; 用100 μm细胞筛过滤除去大部分非细菌碎片; 收集滤液, 离心(15 000 r·min-1, 2 min), 弃上清液, 沉淀加入1 mL 70%的乙醇重悬后在冰上固定10 min, 离心(15 000 r·min-1, 2 min), 弃上清液, 再用2×1 mL的无菌PBS洗涤, 沉淀重悬在1 mL的无菌PBS里作为待测菌液。
益生菌在体定植活性研究 将含有1×108 CFU·mL-1的TDL标记菌液离心(5 000 r·min-1, 5 min), 弃上清液, 再用0.2 mL的无菌PBS重悬, 给小鼠进行灌胃; 等待2 h后, 每只小鼠再次给予浓度为3 mmol·L-1的FDL溶液0.2 mL, 经过4 h的标记后颈椎脱臼处死, 提取菌液待测。
荧光显微镜观察标记菌 称取0.1 g琼脂糖于含有10 mL无菌PBS (pH 7.0) 的烧杯中, 加热至琼脂糖完全融化; 吸取0.2 mL滴在显微镜载玻片中间, 迅速将盖玻片放在此液滴的顶部向下按压以形成琼脂糖垫层; 观察前取下盖玻片, 在琼脂糖垫上滴加10 μL的菌液, 重新盖盖玻片后使用BX53荧光显微镜进行观察。
荧光标记强度与标记率 使用ACEA Quanteon流式细胞仪选取对应荧光通道对标记菌进行检测, 每个样本收集20 000个事件, 使用Flowjo软件(V10.0.8rl) 进行数据分析以得到标记率。
统计学分析 应用IBM SPSS 21.0统计软件进行数据分析。计量资料均符合正态分布, 以均值±标准差(
对纯化后各产物进行了NMR数据采集, TDL, 1H NMR (400 MHz, MeOD-d4): δ = 8.76 (d, J = 1.7 Hz, 1H), 8.26 (dd, J = 7.9, 1.8 Hz, 1H), 7.54 (d, J = 7.9 Hz, 1H), 7.15 (d, J = 9.5 Hz, 2H), 7.07 (dd, J = 9.5, 2.4 Hz, 2H), 7.01 (d, J = 2.4 Hz, 2H), 3.91 (t, J = 6.4 Hz, 1H), 3.51 (t, J = 7.2 Hz, 1H), 2.05~1.89 (m, 2H), 1.77 (dt, J = 14.8, 7.4 Hz, 2H), 1.65~1.49 (m, 2H), 1.24~1.12 (m, 2H)。13C NMR (100 MHz, MeOD-d4): δ = 172.3, 160.8, 159.1, 158.9, 137.6, 131.9, 131.1, 115.5, 114.7, 97.5, 54.2, 40.9, 40.6, 32.2, 30.2, 23.2。
FDL, 1H NMR (400 MHz, MeOD-d4) δ = 7.92 (d, J = 8.4 Hz, 1H), 7.84 (d, J = 7.4 Hz, 1H), 7.42 (s, 1H), 6.69 (d, J = 2.4 Hz, 2H), 6.66 (s, 2H), 6.56 (dd, J = 8.7, 2.4 Hz, 2H), 3.84 (t, J = 6.1 Hz, 1H), 3.59 (s, 2H), 2.03~1.91 (m, 1H), 1.91~1.78 (m, 1H), 1.73~1.59 (m, 2H), 1.59~1.41 (m, 2H)。13C NMR (100 MHz, MeOD-d4) δ = 155.3, 131.1, 130.9, 129.6, 126.3, 122.0, 114.9, 112.7, 103.5, 53.9, 45.0, 31.3, 30.7, 29.5, 23.4。
通过分析对比与查阅的文献[23]相符合, 证明成功合成了TDL与FDL。
1.2 FDAA的荧光光谱用荧光分光光度计对各产物的PBS溶液进行荧光光谱扫描, TDL的最大Ex/Em = 550/582 nm, FDL的最大Ex/Em = 460/526 nm。
1.3 镜下观察FDAA标记菌使用BX53荧光显微镜对各FDAAs分别标记的LA、LC和VA进行观察, 如图 1所示, 可清楚看到细菌形态及其PG合成的活跃位点。LA呈较短杆状, 末端呈圆形, PG合成活跃在中部横膈, 可见一端呈现明亮荧光的菌体, 推断其分裂方式为常见二分裂; LC菌体较大, 呈链状, 易断裂, 连接处PG合成横隔或呈交叉状; VA为极小的球菌, 分裂时PG在球体中部大量合成, 逐渐变化为葫芦状相连接的两个菌体。

|
Figure 1 Lactobacillus acidophilus (LA), Lactobacillus casei (LC) and Veillonella atypica (VA) marked by fluorescent D-amino-acids (FDAAs). The arrow points to the peptidoglycan (PG) active site and the white box is the extended region. TDL: TAMRA-D-lysine; FDL: Fluorescein-D-lysine |
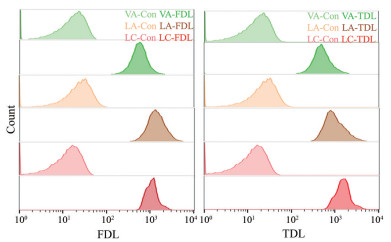
使用流式细胞仪对FDAAs对菌的标记率进行了检测, 从图 2的流式图中可以看到, TDL与FDL在体外标记的3种益生菌, 均能与未经标记的菌完全分开, 达到100%的标记率。
|
Figure 2 FDAAs labeling rate of LA, LC and VA. Con: Control group |
考察了一系列浓度下FDAAs对益生菌生长的毒性, 对各菌标记12 h后测量OD600值, 结果各浓度组与正常组相比, 细菌生长速率差异无统计学意义(P > 0.05), 证明了FDAAs的安全性。
2 益生菌肠道原位标记方法建立FDAAs只对存在代谢能力的活菌进行标记, 故可以利用此原理用两步标记法对益生菌活性进行检测。第一步为在体外用红色的TDL对益生菌进行标记; 第二步为益生菌口服灌胃后, 再灌胃绿色的FDL对存活下来的益生菌进行标记, 从而实现其活力检测。由于TDL自身较高的激发波长, 不仅可以在体内长时间地稳定存在, 对细胞的光损伤也可以达到最少, 因此在中放在首位, FDL则放在后位。
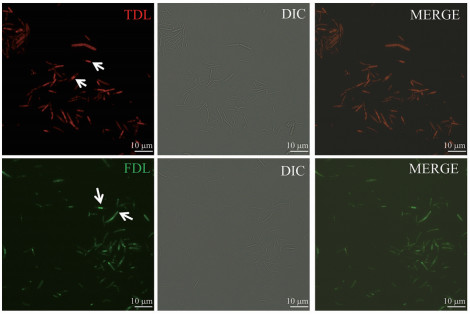
2.1 肠道菌群单色标记镜下观察首先对肠道菌群进行单色标记, 确保探针在小鼠体内能普遍标记上细菌。对分别经FDL和TDL标记的肠道菌群镜下观察可以看到, TDL、FDL均可清楚展现肠道细菌形态及其PG合成和活跃位点(荧光较亮处), 与明场下的细菌图层叠加可以看出较高的标记率, 如图 3。
|
Figure 3 Intestinal flora labeled by FDAAs. The arrow points to the PG active site. DIC: Differential interference contrast |
为了确保两步标记法可以在菌体上实现双重标记, 在体外培养的益生菌上进行了双色标记的实验, 即先进行TDL的标记后再进行FDL的标记。图 4可以看到, 3种菌均呈现出良好的标记效果, 菌体红色部位为先一步合成的PG, 而绿色部位代表后来新合成的PG。流式图对未标记、TDL标记、FDL标记以及TDL&FDL先后标记的3种益生菌进行检测, 可以实现明显的分群, 表明可以利用此方法进行益生菌活性检测。

|
Figure 4 Two-color labeling of probiotics. A: Sequential labeled bacteria by TDL and FDL. The arrow points to the PG active site and the white box is the extended region. B: Flow cytometry of labeled bacteria |
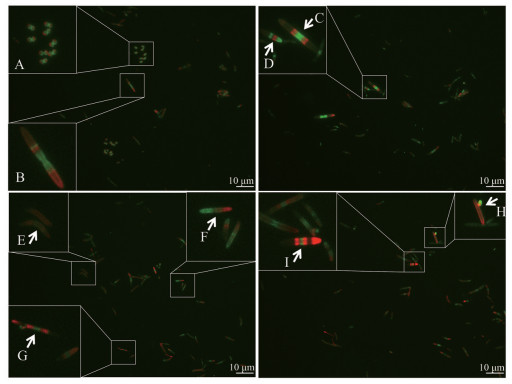
对小鼠体内菌群进行双色标记实验, 即首先灌胃TDL标记肠菌后再灌胃FDL进行第二次标记, 提取肠道菌群镜下观察, 图 5展示了肠道中大小形状不一的多种细菌, 如球菌(图 5A)、杆菌(图 5B)、弧菌(图 5E) 等; 菌体颜色表示了PG合成的先后顺序, 即红色为先前合成的PG, 绿色为之后合成的, 因此可以推断出不同细菌的生长分裂方式, 如典型的在菌体中部合成隔膜进行分裂(图 5A、C) 和形成茎/芽进行分裂的(图 5H)。还观察到一些菌的PG合成顺序和方式, 如图 5C、D完全相反的PG合成顺序; 图 5B在菌体中部与其中一端的中部同时进行新PG合成; 图 5E的整体扩散合成; 图 5F则仅从端点进行合成; 图 5G、I则相间进行合成呈现出分段效果[10]。此镜下观察肠道细菌的双色标记得到了与体外益生菌双色标记类似的结果, 说明该法可用于短时间内对普通细菌的活性检测。
|
Figure 5 Sequential labeled intestinal flora. The arrow points to the PG active site and the white box is the extended region. A: Coccus; B: Bacillus; A and C: Diaphragm division; C and D: Opposite sequence of PG synthesis; E: Vibrio; F: Synthesis of PG from the end point; G and I: Synthesize PG in segments; H: Budding |
为使FDL灌胃小鼠可达到最优的标记率, 故探究其最佳标记浓度和标记时间。使用浓度分别为0.25、0.5、1、2和3 mmol·L-1的FDL对小鼠肠道菌群进行标记4 h, 对菌群的荧光强度进行流式检测发现, 浓度由低到高的标记率分别为: 56.53% ± 0.68%、68.73% ± 3.17%、84.63% ± 1.00%、85.33% ± 2.03%和91.27% ± 0.07% (n = 3,
使用浓度为3 mmol·L-1的FDL对小鼠标记1、2、4、6和8 h后取盲肠菌群进行流式分析, 标记率依次为: 4.30% ± 0.50%、67.73% ± 1.14%、92.50% ± 0.10%、92.57% ± 0.31%和94.33% ± 0.15% (n = 3,
图 6展示了经两步法标记后显示的肠道存活下来的LA、LC、VA, 其中菌体只标记为红色的说明3种益生菌灌胃后在第2次绿色的探针标记之前, 菌体已经死亡。有研究表明细菌体外标记FDAAs后在富含营养的培养基中培养6~8 h, 则菌体的标记基本被代谢清除; 而直接灌胃探针体内标记则24 h后仍然可以观察到荧光信号[18]。由图 6可以看出3种菌在体内的生长方式与体外相同, 但生长速率与体外相比大大降低, 故可能是由于体外培养时所用培养基营养丰富且无其他细菌竞争生存位点, 而体内由于其他菌群与之竞争生存位点, 同时还有机体先天免疫的干扰[12]等, 导致细菌的生长代谢较为缓慢。

|
Figure 6 LA, LC, and VA survived after gavage. The white box is the extended region |
如图 7B所示, 对3种益生菌在盲肠菌群的占比进行比较发现, VA占比最高, 达到9.21% ± 1.23%, LC为1.37% ± 0.31%, LA为3.60% ± 0.35%。如图 7C所示, 对益生菌灌胃后在肠道内的存活率进行比较发现, LA的存活率可达92.30% ± 1.67%, 而LC和VA分别只有84.13 % ± 4.06%、82.27% ± 2.43%。由于VA是球菌, 菌体不到1 μm, 故在肠道中更容易镶嵌于绒毛中留存下来, 因而占比较高; LC菌体10~20 μm左右, 菌体较大, 易断裂, 导致菌体活力下降, 黏附力不足, 故易排出体外且存活率较低; LA菌体中等, 符合大部分细菌菌体的大小, 且其本身可产生酸性物质, 具有较强的黏附性, 故能快速适应消化道的环境, 从而更好地存活下来[22]。由上述结果可知, 菌体大小的差异可能对益生菌在体内定植占比有一定的影响, 而其活性情况则更可能与益生菌在体内的适应程度有关。

|
Figure 7 Colonization survival rate of LC, LA and VA in cecum. A: Gating strategies used for sorting double-labeled bacterial populations; B: Ratio of LA, LC and VA in cecum flora; C: Ratio of survived LA, LC and VA. n = 3, |
PG是原核生物特有细胞壁成分, 一般由4或5个D-氨基酸短肽与聚糖链交联形成的大分子复合物[25]。在细菌的生长分裂过程中, 糖基化酶和肽酶把PG结构中的聚糖链和肽交联结构裂解, 利用游离的糖、氨基酸等合成新的结构以实现扩增[26]。故可以利用游离的D-氨基酸直接与荧光基团结合获得FDAAs, 当细菌生长分裂时则会利用这些FDAAs结合到PG中。早前已有研究证明细菌可以特异性利用荧光标记的D-氨基酸而荧光标记的L-氨基酸则没有被利用[27], 说明FDAAs可以在细菌合成中特异性被L, D-转肽酶识别。同时D-氨基酸具有高度的生物相容性, 动物体内基本不吸收D-氨基酸, 除了胃肠道的细菌利用以外可以快速排出体外, 故可以利用FDAAs直接标记肠菌用于定位活性检测。
本研究在利用FDAAs过程中发现单色标记益生菌只能得出灌胃进去的益生菌在肠道中的定位情况, 其益生菌的具体定植活性情况仍未可知。而当利用双色标记时, 例如在体外先用TDL标记益生菌, 待灌胃益生菌后一段时间再灌胃FDL, 在胃肠道内仍存活的益生菌就会利用FDL这个探针, 故这类菌会带有双色标记, 因此可以得到益生菌在胃肠道中的具体活性情况。
有效补充益生菌可有益肠道健康, 这是全球共识。细菌的黏附和定植是一个动态过程, 即便补充了益生菌, 还会随着时间推移由于胃肠道的蠕动和胆汁酸的分泌等而逐渐下降; 而益生菌只有在定植位点达到一定的数量, 才能成为局部优势菌发挥其作用[2]。现如今常有的一些体外研究益生菌黏附性实验, 大部分是直接利用益生菌测其对各种细胞的黏附性, 其黏附率有30%~90%左右不等[28, 29], 虽然结果很可观, 但它忽略了真实复杂肠道环境的诸多干扰因素[30, 31]。而在同属荧光标记的方法中, 如需体内跟踪观察某一特定菌种, 大部分是基因工程菌, 需要单独特异性的设计及培养, 其不够方便快捷[24]。
本研究成功建立了一种快速、直观、方便且无毒的可检测活菌的方法, 揭示了时下常见的3种益生菌补充进入肠道后的具体定植存活情况, 3种益生菌口服灌胃后占盲肠细菌总数的1%~9%, 这个占比对比于其他益生菌的体外实验结果而言不高, 说明体外实验结果还是过于乐观的; 而对比于一些体内驻留菌占整个肠道细菌总数的1%~4%而言[32]还是较为接近的, 说明该法用于考察益生菌在肠道原位定植活性的可靠性。除此以外, 大部分研究表明益生菌活菌的效果优于相应的死菌, 故补充益生菌时, 还应考虑其存活率问题。而通过两步标记法我们可知, 3种益生菌口服进入肠道后并非100%的存活, 可能由于益生菌种类的不同, 其对肠道的黏附力度、适应性等的不一致, 故其存活率还是有所差异的。
由此可知当正常人体补充益生菌时, 一过性补充难以从一个完整的平衡体系中竞争到一个生存位点, 使口服的益生菌成为优势菌发挥其应有作用。故益生菌的补充应最好具有周期性, 争取定时、定量, 有选择性的补充具有黏附力强、效果好、容易存活的益生菌, 例如本文研究的LA。
遗憾的是, 双荧光探针分子虽然可以实现快速标记益生菌, 但是其FDAAs探针本身对细菌并不具备特异性, 是一个广谱的细菌探针。虽然可以先在体外标记目标单菌, 再结合体内另一种颜色的探针, 从而能分析某几种单菌在体内活性; 但当细菌脱离标记环境后, 其生长分裂会重新利用新的PG, 从而逐渐把原有标记的PG替换, 故而无法分析益生菌在体内的长期定植存活情况[18]。
双荧光探针分子两步标记益生菌在肠道原位活性的分析研究, 为益生菌在肠道原位定植活性提供理论支撑, 有望进一步用于探讨其他细菌在体内定植活性的具体机制。其可以和荧光原位杂交[10]联合应用来弥补FDAAs不具备特异性的缺陷, 二者结合应能研究益生菌在体内长时间的定植存活情况; 也能与组织透明化三维成像[33]等结合, 从而进一步实现细菌在肠道的可视化发展, 以期补充肠道“暗物质”的更多信息。
作者贡献: 李琳和陈荧负责进行实验实施、数据收集和结果分析; 陈国平和李佩参与实验实施; 陈荧负责撰写、修改文章; 廖琼峰和谢智勇负责指导整个实验实施以及指导文章的撰写和修改。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Kanmani P, Satish KR, Yuvaraj N, et al. Probiotics and its functionally valuable products-a review[J]. Crit Rev Food Sci Nutr, 2013, 53: 641-658. DOI:10.1080/10408398.2011.553752 |
| [2] |
Flint HJ, Scott KP, Louis P, et al. The role of the gut microbiota in nutrition and health[J]. Nat Rev Gastroenterol Hepatol, 2012, 9: 577-589. DOI:10.1038/nrgastro.2012.156 |
| [3] |
Quigley EMM. Prebiotics and probiotics in digestive health[J]. Clin Gastroenterol Hepatol, 2019, 17: 333-344. DOI:10.1016/j.cgh.2018.09.028 |
| [4] |
Lee DK, Park JE, Kim MJ, et al. Probiotic bacteria, B. longum and L. acidophilus inhibit infection by rotavirus in vitro and decrease the duration of diarrhea in pediatric patients[J]. Clin Res Hepatol Gastroenterol, 2015, 39: 237-244. DOI:10.1016/j.clinre.2014.09.006 |
| [5] |
Kang S, Park MY, Brooks I, et al. Spore-forming Bacillus coagulans SNZ 1969 improved intestinal motility and constipation perception mediated by microbial alterations in healthy adults with mild intermittent constipation: a randomized controlled trial[J]. Food Res Int, 2021, 146: 110428. DOI:10.1016/j.foodres.2021.110428 |
| [6] |
Schnadower D, O'Connell KJ, VanBuren JM, et al. Association between diarrhea duration and severity and probiotic efficacy in children with acute gastroenteritis[J]. Am J Gastroenterol, 2021, 116: 1523-1532. DOI:10.14309/ajg.0000000000001295 |
| [7] |
Tripathy A, Dash J, Kancharla S, et al. Probiotics: a promising candidate for management of colorectal cancer[J]. Cancers (Basel), 2021, 13: 3178. DOI:10.3390/cancers13133178 |
| [8] |
Riaz RMS, Shi J, Zhu J, et al. Capacity of lactic acid bacteria in immunity enhancement and cancer prevention[J]. Appl Microbiol Biotechnol, 2017, 101: 35-45. DOI:10.1007/s00253-016-8005-7 |
| [9] |
Wang W, Zhu Y, Chen X. Selective imaging of gram-negative and gram-positive microbiotas in the mouse gut[J]. Biochemistry, 2017, 56: 3889-3893. DOI:10.1021/acs.biochem.7b00539 |
| [10] |
Lin L, Wu Q, Song J, et al. Revealing the in vivo growth and division patterns of mouse gut bacteria[J]. Sci Adv, 2020, 6: eabb2531. DOI:10.1126/sciadv.abb2531 |
| [11] |
Ding SJ, Wang WW, Li AK, et al. Advance on adhesion of probiotic in intestinal tract[J]. Feed Ind Mag (饲料工业), 2016, 37: 55-61. |
| [12] |
Qin WF, Song X, Xia YJ, et al. Influencing factors of lactic acid bacteria in the intestinal colonization and research methods[J]. Food Sci (食品科学), 2021, 42: 275-283. |
| [13] |
Wu ZC, Gao YS, Wang S, et al. Advances in the adhesion ability evaluation model of probiotics[J]. J Microbiol (微生物学杂志), 2019, 39: 114-119. |
| [14] |
Wang W, Yang Q, Du Y, et al. Metabolic labeling of peptidoglycan with NIR-Ⅱ dye enables in vivo imaging of gut microbiota[J]. Angew Chem Int Ed Engl, 2020, 59: 2628-2633. DOI:10.1002/anie.201910555 |
| [15] |
Lim B, Zimmermann M, Barry NA, et al. Engineered regulatory systems modulate gene expression of human commensals in the gut[J]. Cell, 2017, 169: 547-558. DOI:10.1016/j.cell.2017.03.045 |
| [16] |
Foucault ML, Thomas L, Goussard S, et al. In vivo bioluminescence imaging for the study of intestinal colonization by Escherichia coli in mice[J]. Appl Environ Microbiol, 2010, 76: 264-274. DOI:10.1128/AEM.01686-09 |
| [17] |
Landete JM, Medina M, Arqués JL. Fluorescent reporter systems for tracking probiotic lactic acid bacteria and bifidobacteria[J]. World J Microbiol Biotechnol, 2016, 32: 119. DOI:10.1007/s11274-016-2077-5 |
| [18] |
Hudak JE, Alvarez D, Skelly A, et al. Illuminating vital surface molecules of symbionts in health and disease[J]. Nat Microbiol, 2017, 2: 17099. DOI:10.1038/nmicrobiol.2017.99 |
| [19] |
Chen C, Zhou FF, Wu ZZ, et al. A fluorescence labeling method for the study on antagonistic activities of Lactobacillus plantarum ST-Ⅲ against enteric pathogens and its related mechanism[J]. Chin J Microecol (中国微生态学杂志), 2010, 22: 773-777, 780. |
| [20] |
Magnet S, Arbeloa A, Mainardi JL, et al. Specificity of L, D-transpeptidases from gram-positive bacteria producing different peptidoglycan chemotypes[J]. J Biol Chem, 2007, 282: 13151-13159. DOI:10.1074/jbc.M610911200 |
| [21] |
Lam H, Oh DC, Cava F, et al. D-Amino acids govern stationary phase cell wall remodeling in bacteria[J]. Science, 2009, 325: 1552-1555. DOI:10.1126/science.1178123 |
| [22] |
Justice SS, Harrison A, Becknell B, et al. Bacterial differentiation, development, and disease: mechanisms for survival[J]. FEMS Microbiol Lett, 2014, 360: 1-8. DOI:10.1111/1574-6968.12602 |
| [23] |
Kuru E, Tekkam S, Hall E, et al. Synthesis of fluorescent D-amino acids and their use for probing peptidoglycan synthesis and bacterial growth in situ[J]. Nat Protoc, 2015, 10: 33-52. DOI:10.1038/nprot.2014.197 |
| [24] |
Van Zyl WF, Deane SM, Dicks LMT. In vivo bioluminescence imaging of the spatial and temporal colonization of lactobacillus plantarum 423 and enterococcus mundtii ST4SA in the intestinal tract of mice[J]. BMC Microbiol, 2018, 18: 171. DOI:10.1186/s12866-018-1315-4 |
| [25] |
Egan AJ, Vollmer W. The physiology of bacterial cell division[J]. Ann N Y Acad Sci, 2013, 1277: 8-28. DOI:10.1111/j.1749-6632.2012.06818.x |
| [26] |
Vollmer W, Joris B, Charlier P, et al. Bacterial peptidoglycan (murein) hydrolases[J]. FEMS Microbiol Rev, 2008, 32: 259-286. DOI:10.1111/j.1574-6976.2007.00099.x |
| [27] |
Kuru E, Hughes HV, Brown PJ, et al. In situ probing of newly synthesized peptidoglycan in live bacteria with fluorescent D-amino acids[J]. Angew Chem Int Ed Engl, 2012, 51: 12519-12523. DOI:10.1002/anie.201206749 |
| [28] |
Todorov SD, Botes M, Guigas C, et al. Boza, a natural source of probiotic lactic acid bacteria[J]. J Appl Microbiol, 2010, 104: 465-477. |
| [29] |
Kumar R, Bansal P, Singh J, et al. Aggregation, adhesion and efficacy studies of probiotic candidate Pediococcus acidilactici NCDC 252: a strain of dairy origin[J]. World J Microbiol Biotechnol, 2020, 36: 1-15. DOI:10.1007/s11274-019-2775-x |
| [30] |
Calatayud M, Dezutter O, Hernandez-Sanabria E, et al. Development of a host-microbiome model of the small intestine[J]. FASEB J, 2019, 33: 3985-3996. DOI:10.1096/fj.201801414R |
| [31] |
Santarmaki V, Kourkoutas Y, Zoumpopoulou G, et al. Survival, intestinal mucosa adhesion, and immunomodulatory potential of Lactobacillus plantarum strains[J]. Curr Microbiol, 2017, 74: 1061-1067. DOI:10.1007/s00284-017-1285-z |
| [32] |
Peng D, Hu ZW, Zhang XW. Therapeutic perspectives of intestinal probiotics A. muciniphila in metabolic disorders[J]. Acta Pharm Sin (药学学报), 2019, 54: 768-777. |
| [33] |
Wang W, Zhang N, Du YH, et al. Three-dimensional quantitative imaging of native microbiota distribution in the gut[J]. Angew Chem Int Ed Engl, 2021, 60: 3055-3061. DOI:10.1002/anie.202010921 |
 2022, Vol. 57
2022, Vol. 57


