乙型肝炎病毒(hepatitis B virus, HBV) 长时间感染会引起慢性乙型肝炎, 其感染过程中持续存在的肝脏炎症反应会引起肝纤维化和肝硬化, 最终发展为肝细胞癌, 严重威胁患者生命。目前针对HBV感染的治疗药物主要包括干扰素和核苷酸类似物, 这些药物在抗病毒治疗中具有明显的疗效, 但也存在诸多不良反应。干扰素治疗的应答率低且不良反应大[1], 核苷类似物长期服用易产生耐药性和毒副作用[2, 3]。中药在调节机体免疫功能方面具有独特优势, 在临床上已被应用于HBV感染的治疗。
中药丹参(Salvia miltiorrhiza) 是一种唇形科属草本植物, 具有抗炎[4]、抗氧化[5]、抗肝细胞损伤[6]及抗病毒[7]等药理活性, 已广泛用于冠心病[8]、脑血管疾病[9]、肝病[10]、癌症[11]等的临床治疗。如丹参注射液常用于HBV病毒感染引起的慢性乙型肝炎患者治疗, 对患者的临床症状有明显改善, 对其肝功能的恢复也有显著促进作用[12, 13]。因为丹参成分较复杂, 目前对于其抗HBV的活性成分的研究仅有零星文献报道[14-16], 缺乏全面、系统的抗HBV活性的药效物质基础及其多成分、多靶点、多途径的网络调控机制的研究, 限制了进一步的药物筛选、研发及临床应用。
网络药理学基于“多成分-多靶点-多途径”理念, 通过整合系统生物学和系统药理学研究的成果, 以网络方法研究机体与药物间的相互作用, 预测中药的药效物质基础与作用机制, 受到中医药学界高度重视[17, 18]。针对目前肆虐的新型冠状病毒肺炎, 许多研究利用网络药理学方法对部分中药复方中可能具有治疗作用的活性成分也进行了有益探讨, 大大节省了药物筛选时间和成本[19, 20]。
本文应用网络药理学方法预测了丹参抗HBV活性成分和作用机制, 利用HBV复制模型小鼠验证了丹参代表性活性成分紫草酸的抗HBV药效及对PI3K/AKT和mTOR信号通路关键蛋白表达的影响, 为进一步挖掘丹参抗HBV有效成分与作用机制提供参考。
材料与方法丹参化学成分筛选 使用中药系统药理学分析网络平台(TCMSP)[21] (http://lsp.nwu.edu.cn/tcmsp.php) 收集丹参的化学成分, 以类药性(DL) ≥ 0.18, 口服吸收利用度(OB) ≥ 30%[22]为条件筛选潜在活性成分, 并根据化合物的Pubchem Cid从PubChem数据库[23] (https://pubchem.ncbi.nlm.nih.gov/) 中获取对应的化学结构, 以SDF的格式形式保存备用。除此之外, 本研究还利用Pubmed数据库通过文献调研丹参中的其他抗HBV活性成分, 并以上述方式获取对应的化学结构。
丹参活性成分-治疗靶点预测 将上述SDF格式结构文件导入SwissTargetPrediction数据库[24] (http://www.swisstargetprediction.ch/), 并选择种属“Homo sapiens”预测活性化合物所对应的的作用靶点。以“hepatitis B virus”和“chronic hepatitis B”为关键词, 通过GeneCards数据库(http://www.genecards.org/) 检索HBV相关的作用靶点, 导出所有靶点的Excel文件备用[25, 26]。最后将每个活性成分所对应的前15位靶基因[25, 27]与HBV相关的疾病基因进行映射, 筛选得到的靶点即为丹参活性成分治疗HBV感染的作用靶点。
丹参治疗HBV感染的蛋白互作网络(PPI) 构建 将丹参治疗HBV感染的相关靶点输入String数据库[28] (https://string-db.org/), 物种选择“Homo sapiens”, 建立蛋白质-蛋白质互作网络, 将minimum required interaction score设置为highest confidence (0.9), 下载TSV格式文件并导入Cytoscape3.6.1软件进行拓扑学性质分析, 由拓扑学参数度值(degree) 作为筛选标准筛选出核心靶点。
丹参“成分-靶点”网络构建 将获得的靶点对应到各活性成分, 并导入Cytoscape3.6.1软件建立成分-靶点网络, 借助内置Networkanalysis分析拓扑学性质, 采用拓扑学参数度值、节点介度(betweenness)、节点紧密度(closeness) 和邻域连通性(neighborhood connectivity) 筛选丹参治疗HBV感染的核心活性成分。
GO和KEGG通路富集分析 利用DAVID 6.8数据库(https://david.ncifcrf.gov/) 对丹参治疗HBV感染的靶基因进行GO功能富集分析和KEGG通路富集分析, 阈值设置为P < 0.05, 物种选择“Homo sapiens”。GO富集分析内容选择生物过程、分子功能和细胞组分, 最后根据P值分别对3个部分的前10个条目绘制柱状图。KEGG通路富集分析可视化后得到气泡图。
分子对接 采用分子对接软件AutoDock Vina将丹参核心活性成分与靶蛋白进行半柔性分子对接, 化合物的PDB格式结构文件由ChemOffice软件转换SDF格式得到, 所需受体从PDB (http://www.rcsb.org/Pdb/home/home.do) 数据库中获取。以结合能的大小来判断化合物与靶蛋白的结合活性, 结合能小于0 kJ·mol-1表明受体配体能够自发结合, 小于-5 kJ·mol-1表明蛋白质与化合物具有较好的结合能力[29]。利用Pymol将活性成分与靶蛋白的对接结果进行可视化分析。
实验动物 SPF级C57BL/6雄性小鼠(6~8周龄, 体重16~18 g) 购于三峡大学动物实验中心[许可证号SCXK (鄂) 2017-0012]。实验前小鼠适应性喂养1周, 室温20~25 ℃, 自由饮食饮水。本实验经湖北大学动物伦理与福利委员会批准。
药品、试剂与仪器 紫草酸(lithospermic acid, LA) (纯度≥ 98%, 成都德思特生物科技有限公司, 批号: DST200529-028); 阿德福韦酯(adefovir dipivoxil tablets, ADV; 福建广生堂药业股份有限公司, 国药准字: H20070198); 生理盐水(石家庄四药有限公司, 批号: 2009191904); 无内毒素质粒中量小提试剂盒和组织基因组DNA提取试剂盒(北京天根生化科技有限公司, 批号: U9218、U9228); 病毒DNA提取试剂盒(北京康为世纪生物有限公司, 批号: 30320); QuantiNova SYBR试剂盒(德国QIAGEN公司, 批号: 163045634); 小鼠乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg) 和乙型肝炎e抗原(hepatitis B e antigen, HBeAg) ELISA试剂盒(厦门慧嘉生物公司); RIPA裂解液(上海碧云天生物技术有限公司, 货号: P0013B); BCA蛋白测定试剂盒(美国ThermoFisher公司, 批号: SK258368); AKT、p-AKT和mTOR抗体(沈阳万类生物科技有限公司, 货号: WL003b、WLP001a、WL02477); β-actin和p-mTOR (Ser2448) 抗体(货号: 4970S、5536T)、过氧化酶标记的山羊抗兔IgG二抗(货号: 7074S) (美国Cell Signaling Technology公司)。
CFX-96型实时荧光定量PCR仪、电转仪和电泳槽(美国BIO-RAD公司); Envision多探测器酶标仪(美国Perkin Elmer公司); 蛋白凝胶成像仪(美国General Electric公司); QB-208型多用途旋转摇床(江苏其林贝尔仪器制造有限公司)。
动物造模、分组及给药 取C57BL/6小鼠34只, 随机选取6只作为正常对照组, 剩余通过尾静脉高压水动力法在5~8 s内注射含6 µg pAAV-HBV1.2质粒(该质粒由国立台湾大学医学院临床医学研究生研究所陈培哲教授馈赠) 的生理盐水, 注射体积为小鼠体重的10%。注射后第3天通过眼眶静脉丛采血、收集血清, 用绝对荧光定量法检测血清中HBV DNA拷贝量, 根据临床患者阳性标准HBV DNA ≥ 103 copies·mL-1[30], 筛选出HBV DNA阳性复制小鼠即成功造模的小鼠。
继而选择HBV DNA阳性复制小鼠, 在注射pAAV-HBV1.2一周时进行随机分组给药[31]。小鼠总共分为5组, 即正常对照组、模型组、紫草酸低、高剂量组和阳性对照组。正常对照组为6只未进行pAAV-HBV1.2注射小鼠, 其余各组均为7只HBV复制阳性小鼠。正常对照组和模型组均注射生理盐水, 紫草酸低、高剂量组分别注射20和40 mg·kg-1紫草酸[剂量是参考文献[32]并经亚急性毒性实验(结果未显示) 确定的无毒剂量], 阳性对照组灌胃10 mg·kg-1 ADV (剂量是参考文献确定[33, 34]), 给药体积均为0.1 mL/10 g, 每日给药1次, 连续给药3周。小鼠每周采血1次, 3 500 r·min-1离心20 min收集血清。用绝对荧光定量法检测血清中HBV DNA拷贝量, ELISA检测血清中HBsAg和HBeAg的表达量。给药第21天处死小鼠, 灌流取肝组织并保存于液氮中。
绝对荧光定量PCR法检测血清和肝组织中HBV DNA的拷贝数 根据病毒DNA提取试剂盒和组织基因组DNA提取试剂盒说明书分别提取血清和肝组织基因组DNA, HBV DNA引物序列: 上游: 5'-CTGCATCCTGCTGCTATG-3', 下游: 5'-CACTGAACAAATGGCAC-3'。反应体系: DNA 2 μL, 上下游引物各1.4 μL, SYBR Green Supermix 10 μL, 水5.2 μL。反应条件为: 95 ℃预变性2 min、95 ℃变性5 s、60 ℃退火10 s、72 ℃延伸45 s, 共40个循环。扩增结束后, 以拷贝数的对数值为横坐标, Cq值为纵坐标, 拟定标准曲线, 计算HBV DNA的拷贝数。
Western blot法进行靶点表达验证 使用RIPA裂解液提取小鼠肝组织总蛋白, 用BCA法测定蛋白浓度并进行定量。分别用10%和6%的SDS-PAGE胶分离蛋白样品, 并用湿转法将蛋白转移至PVDF膜上, 用5%的脱脂牛奶将膜在室温下封闭2 h, 然后与对应目的蛋白一抗β-actin (1:1 000)、p-mTOR (1:1 000)、mTOR (1:500)、AKT (1:1 000) 和p-AKT (1:1 000) 于摇床4 ℃孵育过夜, 之后与过氧化酶标记的山羊抗兔IgG (1:10 000) 于摇床室温孵育1 h, 用TBST洗膜, 最后用ECL发光液对蛋白进行显影曝光, 利用Image J对蛋白进行定量分析。
统计学分析 应用GraphPad Prism 6.01软件进行统计分析, 数据用平均值±标准差(
在TCMSP数据库中共检测得到202个丹参的化学成分, 根据OB和DL参数筛选出65个化学成分。考虑到可能存在漏选情况, 补充了经文献检索获得的3个已报道抗HBV活性的成分(原儿茶醛[14]、原儿茶酸[15]和紫草酸[16])。通过PubChem数据库查询, 确定上述68个化合物中有明确结构的化合物38个(表 1)。
| Table 1 Information of active compounds of Salvia miltiorrhiza (S. miltiorrhiza). OB: Oral bioavailability; DL: Drug-likeness |
用SwissTargetPrediction和GeneCards数据库预测, 去除重复靶点后共获得化合物对应靶点212个, HBV相关靶点9 917个。将活性成分的作用靶点与疾病靶点进行映射, 最终获得丹参活性成分干预HBV感染的潜在靶点共178个。
3 丹参“成分-靶点”网络将178个丹参干预HBV感染的潜在靶点与所属活性成分对应, 通过Cytoscape3.6.1软件丹参构建“成分-靶点”网络(图 1), 并以节点度值、节点介度、节点紧密度和邻域连通性的中位数为考核指标进行拓扑学分析(数值见表 2)。具体的筛选方法是: 首先在网络中选出度值较大的化合物, 同时兼顾考虑这些化合物的节点介度、节点紧密度和邻域连通性的中位数大小, 并辅助参考文献报道进行筛选确定。最终筛选出核心活性成分有: 丹参醌酚Ⅱ (D25)、丹参新酮(D26)、原儿茶酸(D36)、紫草酸(D37) 和原儿茶醛(D38), 提示这些化合物可能在丹参抗HBV感染中发挥潜在的作用。

|
Figure 1 Compound-target network of S. miltiorrhiza against hepatitis B virus (HBV) |
| Table 2 Topological parameter values of compound-target network of S. miltiorrhiza against HBV |
由STRING数据库构建蛋白质交互作用网络PPI, 该网络(图 2) 共包含节点178个、边395条, 平均节点度值为4.44, 平均介数为0.494。由节点度值作为拓扑学筛选标准, 每个节点的大小代表度值, 值越大, 节点越大, 表明此靶点在治疗HBV感染中越重要。经过筛选得到的排名前9位靶蛋白分别为磷脂酰肌醇3激酶(phosphatidylinositol-4, 5-pisphosphate 3-kinase catalytic subunit alpha, PIK3CA)、β淀粉样前体蛋白(amyloid beta precursor protein, APP)、信号传导与活化转录因子3 (signal transducer and activator of transcription 3, STAT3)、LCK蛋白(LCK proto-oncogene, Src family tyrosine kinase, LCK)、白介素2 (interleukin 2, IL2)、丝裂原激活蛋白激酶8 (mitogen-activated protein kinase 8, MAPK8)、丝裂原激活蛋白激酶14 (mitogen-activated protein kinase 14, MAPK14)、FYN蛋白(FYN proto-oncogene, Src family tyrosine kinase, FYN)、丝氨酸/苏氨酸蛋白激酶1 (AKT serine/threonine kinase 1, AKT1)。各靶点对应的度值如图 3所示。
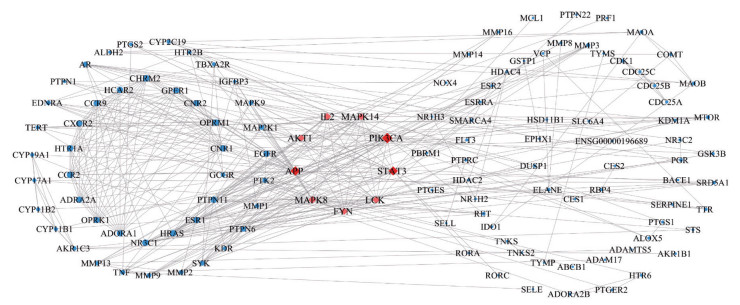
|
Figure 2 Protein-protein interaction network of antiviral targets in S. miltiorrhiza |

|
Figure 3 Degree values of targets in protein-protein interaction network |
通过DAVID数据库对178个丹参干预HBV感染的潜在靶点进行GO富集分析(P < 0.05), 共得到405个相关条目, 包括278个生物过程, 46种细胞组分, 81种分子功能。根据P值筛选出每部分的前10个条目见图 4, 显示丹参干预HBV感染涉及多个生物学过程, 影响多种细胞组分和分子功能, 如药物反应、氧化还原过程、炎症反应、RNA聚合酶Ⅱ转录因子活性、配体激活的序列特异性DNA结合等。
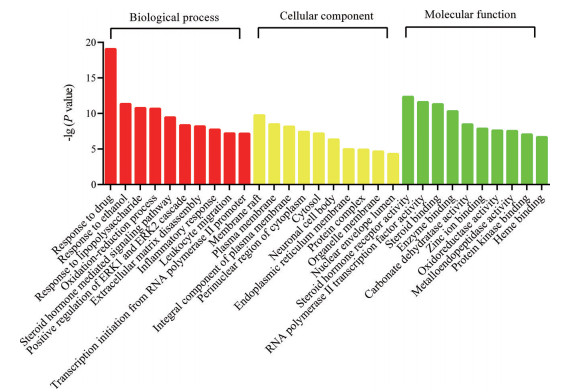
|
Figure 4 GO enrichment analysis of related protein targets |
在KEGG信号通路分析(P < 0.05) 中共获得68条相关信号通路。根据P值的大小及文献调研结果制作的相关信号通路气泡图显示, 丹参干预HBV感染涉及疾病信号通路(insulin resistance、proteoglycans in cancer)、免疫信号通路(T cell receptor signaling pathway、Fc epsilon RI signaling pathway、B cell receptor signaling pathway、Toll-like receptor signaling pathway)、炎症信号通路(TNF signaling pathway)、代谢信号通路(nitrogen metabolism、steroid hormone biosynthesis、arachidonic acid metabolism) 及信号转导信号通路(cAMP signaling pathway、mTOR signaling pathway、PI3K/AKT signaling pathway) 等(图 5)。

|
Figure 5 Diagram of KEGG pathway enrichment analysis of related protein targets |
将筛选出的核心活性成分丹参醌酚Ⅱ (D25)、丹参新酮(D26)、原儿茶酸(D36)、紫草酸(D37) 和原儿茶醛(D38) 分别与PPI网络分析中的前3位靶蛋白PIK3CA (PDB ID: 3HHM)、APP (PDB ID: 3MXC)、STAT3 (PDB ID: 5AX3) 以及KEGG富集分析结果中的信号通路蛋白AKT (PDB ID: 3O96)、mTOR (PDB ID: 5WBJ) 进行分子对接。分子对接结果显示, 在25对分子对接关系中, 活性成分与关键靶点的结合能均小于-5 kJ·mol-1, 表明这5个丹参活性成分与上述靶蛋白均具有较高的亲和力(图 6)。继而利用分子对接软件AutoDock Vina研究了紫草酸与上述靶蛋白的结合情况。结果如图 7所示, 紫草酸与各靶点中的多个位点的氨基酸残基(如谷氨酰胺、苯丙氨酸、亮氨酸等) 具有结合能力, 结合力主要有氢键和苯环π共轭效应等。同时, 在相同空间距离下, 紫草酸能够更多地与靶点mTOR的氨基酸残基结合, 与分子对接热图中紫草酸与mTOR的高结合活性结果一致。

|
Figure 6 Heat map for binding energy of key compounds and targets of S. miltiorrhiza against HBV |
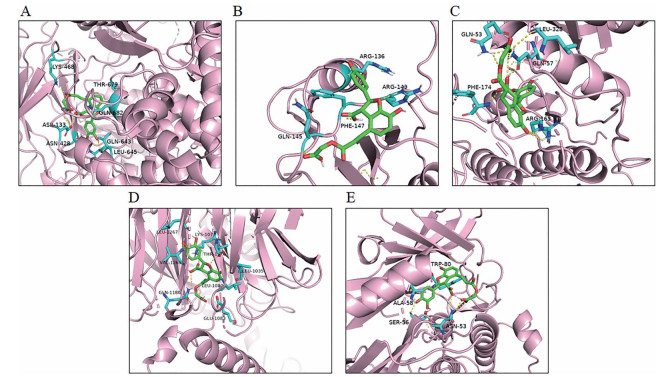
|
Figure 7 Molecular docking bonding pattern diagram of lithospermic acid bound to PIK3CA (A), APP (B), STAT3 (C), mTOR (D), and AKT1 (E) |
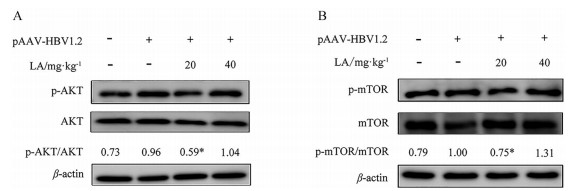
为了验证网络药理学预测的丹参成分干预HBV感染相关分子作用机制的可靠性, 本文以紫草酸为例进行了实验验证。如图 8和表 3所示, 与模型组相比, 紫草酸给药1~3周均能明显抑制血清HBV DNA的复制, 且给药后第3周能明显降低肝组织HBV DNA、血清HBsAg和HBeAg的水平, 表明紫草酸在体内具有较明显的抗HBV作用。根据KEGG信号通路富集分析结果, 也初步考察了紫草酸对模型小鼠PI3K/AKT和mTOR信号通路的影响。结果显示, 给药后第21天, 相对于模型组, 20 mg·kg-1紫草酸给药组AKT和mTOR的磷酸化水平明显下调(图 9)。综合上述网络药理学研究结果及实验验证, 表明紫草酸抗HBV作用可能与调控PI3K/AKT和mTOR信号通路相关。
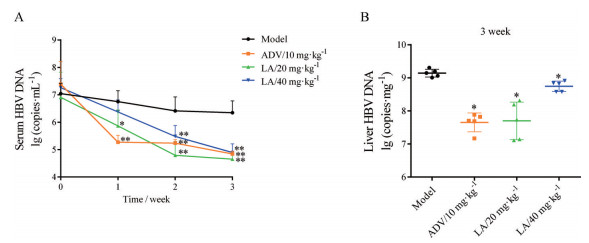
|
Figure 8 Lithospermic acid significantly inhibited the replication of HBV DNA in an HBV replicating mouse model. A: Serum HBV DNA (n = 7); B: Intrahepatic HBV DNA (n = 5). |
|
Table 3 Inhibitory effects of LA on serum HBsAg and HBeAg levels in an HBV replicating mouse model. n = 7, |
|
Figure 9 Influence of LA on the protein expression of p-AKT, AKT (A) and p-mTOR, mTOR (B) in liver tissues of mice. n = 4, |
丹参的活性成分主要分为水溶性和脂溶性两大类, 具有广泛的药理活性[35]。文献报道丹参的水溶性成分原儿茶醛[14]、原儿茶酸[15]和紫草酸[16]均能抑制HBV的复制, 但是针对其他成分抗HBV的作用未见报道。本文通过成分-靶点网络预测, 同时结合文献报道, 筛选出丹参干预HBV感染的关键成分丹参醌酚Ⅱ (D25)、丹参新酮(D26)、原儿茶酸(D36)、紫草酸(D37) 和原儿茶醛(D38)。研究表明, 丹参醌酚Ⅱ具有防凝血、改善血液循环的作用[36]; 丹参新酮能抑制血小板聚集及抗炎、镇静等功效[36, 37]; 丹参注射液在治疗慢性乙型肝炎时通过多种作用机制发挥药效, 包括降低血黏度、改善肝脏微循环、扩张毛细血管、清除肝内氧自由基等[13]。多酚类化合物在体内外具有较好的抗HBV活性, 如表没食子儿茶素-3-没食子酸酯在HepG2.2.15细胞中能通过ERK1/2介导的HNF4α下调抑制HBV复制[38]; 绿原酸、奎宁酸和咖啡酸在体外和鸭乙肝模型上均能明显抑制HBV DNA的复制和HBsAg的分泌[39]。多酚类化合物紫草酸能抑制HBV[16]和HIV[40]的复制。上述文献表明, 本文预测的这5个丹参有效成分可能具有抗HBV活性。本文通过在HBV复制小鼠模型上进行药效学评价, 验证了紫草酸具有明显的抗HBV活性。
根据蛋白互作PPI网络预测的丹参关键活性成分干预HBV感染的关键靶点包括PIK3CA、STAT3、APP、IL-2和AKT1等。PIK3CA是一种磷脂酰肌醇激酶, 能靶向调控癌症的发生发展。由PIK3CA基因编码的产物P110α是PI3K的一种催化亚基, 介导PI3K/AKT/mTOR信号通路的激活, 促使癌症的恶性转化[41]。通过对与临床和遗传特征相关的肝癌亚群(G1~G6) 的转录组分析发现, G2亚群中存在高拷贝的HBV感染和PIK3CA突变[42]。同时, PIK3CA也参与调节乙型肝炎后期肝硬化阶段肝细胞的增殖分化[43]。STAT3是一种转录因子, 参与调控细胞的增殖、凋亡和癌变过程, 在病毒感染中也起着关键作用。HBV可激活STAT3促进自身的复制, 同时阻止受病毒感染的肝细胞发生凋亡[44]。APP是一种跨膜蛋白, 会与铜离子和锌离子结合, 影响机体的氧化损伤反应。Wang等[45]在研究其水解产物β-淀粉样蛋白(amyloid β-protein, Aβ) 的清除过程中发现, HBV感染的肝硬化患者Aβ的表达水平显著高于非携带者, 且血浆中Aβ的表达水平与肝功能受损程度正相关, 说明HBV感染可能参与调控APP的水解过程。此外, 细胞免疫中的Th1亚类细胞会分泌IL-2, 激活细胞毒性T淋巴细胞的抗病毒免疫反应[46]。AKT1属蛋白激酶, 参与细胞凋亡及葡萄糖代谢等细胞过程, 其激活依赖于PI3K信号转导途径, 是该途径的关键节点蛋白。乙型肝炎病毒基因组X区所编码的蛋白(hepatitis B virus X protein, HBx) 可激活AKT抑制肝细胞凋亡, 促进持续的、非细胞病理的HBV复制[47]。microRNA-520a可抑制AKT的激活, 降低HepG2.2.15细胞中的HBV转录和复制水平[48]。上述文献表明, PIK3CA、STAT3、APP、IL-2和AKT1与HBV的感染密切相关, 分子对接分析也表明所选的5种活性成分与上述靶蛋白间均有较好的结合活性, 提示这些靶蛋白可能是丹参关键活性成分干预HBV感染的关键靶点。
中药可通过抑制病毒复制或增强机体免疫, 发挥直接或间接的抗HBV作用。KEGG富集分析结果表明mTOR信号通路、PI3K/AKT信号通路、T细胞受体信号通路和Toll样受体信号通路等与HBV感染高度相关。HBV感染会刺激机体产生一系列的免疫反应。研究表明, 在HBV慢性感染后, 感染者体内的HBV特异性CD8+ T细胞会高度表达程序性死亡受体-1, 可使感染者出现T细胞免疫功能衰竭, T细胞增殖、细胞因子分泌及细胞毒功能等受到影响, 在阻断程序性死亡受体-1信号通路后可增强病毒特异性免疫[49]。Toll样受体在先天免疫中起着关键作用, Toll样受体信号会抑制HBV复制, 是治疗慢性HBV感染的重要治疗策略[50]。在某些生理和病理条件下, PI3K/AKT/mTOR信号转导通路可调节HBV复制。Wan等[51]研究发现3, 4, 5-三氧咖啡因喹啉酸甲酯会激活AKT/mTOR信号通路促进HepG2.2.15细胞中HBV的复制。文献报道, HBV感染会激活AKT, 且使用PI3K抑制剂Ly294002可阻断HBsAg分泌, 进而降低肝细胞上清液中HBsAg的水平[52]。此外, PI3K/AKT/mTOR信号通路可通过负向调节自噬相关(ATG) 蛋白的磷酸化激活自噬[53], 而HBV会诱导肝细胞发生自噬而促进自身的复制[54], 且HBx能以PI3K/AKT/mTOR信号通路非依赖方式诱导自噬小体的形成[55]。蛋白互作PPI网络预测结果显示PIK3CA和AKT1具有较高度值, 两者在PI3K/AKT信号通路中扮演重要角色, 同时分子对接也显示紫草酸与PIK3CA、AKT1和mTOR蛋白具有较强亲和力。本文动物实验结果表明, 紫草酸能明显下调HBV复制小鼠模型肝组织中通路靶蛋白AKT和mTOR的磷酸化水平, 提示紫草酸可能通过调控PI3K/AKT和mTOR信号通路来发挥抗HBV作用, 更为深入的机制有待进一步研究。值得注意的是, 针对网络药理学预测结果中鲜有报道的丹参醌酚Ⅱ和丹参新酮的抗HBV作用, 以及免疫相关信号通路如T细胞受体信号通路和Toll样受体信号通路等与HBV复制的相关性, 还需相关药理实验结果证明。
作者贡献: 温海梅设计了文章的研究方法、完成了实验工作、分析并整理实验数据及进行论文的撰写; 王思源收集了化学成分和靶点, 并进行了分子对接工作; 王亚茹和邢凤丽共同完成了文献搜索与整理; 陈勇提供了论文的修改; 蔡文涛提供了文章主题中心思想、基金支持、负责实验进度把关, 并完成了论文撰写的指导和修改。
利益冲突: 所有作者均声明没有利益冲突。
| [1] |
Van ZM, Flink HJ, Verhey E, et al. The safety of pegylated interferon alpha 2b in the treament of chronic hepatitis B: predictive factors for dose reduction and treament discontinuation[J]. Aliment Pharmacol Ther, 2005, 21: 1163-1171. DOI:10.1111/j.1365-2036.2005.02453.x |
| [2] |
Yao GB, Zhu M, Cui ZY, et al. A 7-year study of lamivudine therapy for hepatitis B virus E antigen-positive chronic hepatitis B patients in China[J]. J Dig Dis, 2009, 10: 131-137. DOI:10.1111/j.1751-2980.2009.00375.x |
| [3] |
Liaw YF, Kao JH, Piratvisuth T, et al. Asian-pacifific consensus statement on the management of chronic hepatitis B: a 2012 update[J]. Hepatol Int, 2012, 6: 531-561. DOI:10.1007/s12072-012-9365-4 |
| [4] |
Moon S, Shin S, Kim S, et al. Role of Salvia miltiorrhiza for modulation of Th2-derived cytokines in the resolution of inflammation[J]. Immune Netwk, 2011, 11: 288-298. DOI:10.4110/in.2011.11.5.288 |
| [5] |
Matkowski A, Zielińska S, Oszmiański J, et al. Antioxidant activity of extracts from leaves and roots of Salvia miltiorrhiza Bunge., S. przewalskii Maxim., and S. verticillata L.[J]. Biores Technol, 2008, 99: 7892-7896. DOI:10.1016/j.biortech.2008.02.013 |
| [6] |
Jin Q, Jiang S, Wu YJ, et al. Hepatoprotective effect of cryptotanshinone from Salvia miltiorrhiza in D-galactosamine/lipopolysaccharide-induced fulminant hepatic failure[J]. Phytomedicine, 2014, 21: 141-147. DOI:10.1016/j.phymed.2013.07.016 |
| [7] |
Yin ZK, Feng ZM, Jiang JS, et al. Two new tanshinone derivatives from the rhizomes of Salvia miltiorrhiza and their antiviral activities[J]. J Asian Nat Prod Res, 2020, 22: 24-29. DOI:10.1080/10286020.2019.1645132 |
| [8] |
Lam FFY, Yeung JHK, Cheung JHY, et al. Pharmacological evidence for calcium channel inhibition by Danshen (Salvia miltiorrhiza) on rat isolated femoral artery[J]. J Cardiovasc Pharmacol, 2006, 47: 139-145. DOI:10.1097/01.fjc.0000197540.12685.ce |
| [9] |
Zhou Y, Li W, Xu L, et al. In Salvia miltiorrhiza, phenolic acids possess protective properties against amyloid β-induced cytotoxi-city, and tanshinones act as acetylcholinesterase inhibitors[J]. Environ Toxicol Pharmacol, 2011, 31: 443-452. DOI:10.1016/j.etap.2011.02.006 |
| [10] |
Yuan Y, Wu Q, Shi JS, et al. Advance in studies on hepatoprotective effect of Salvia miltiorrhiza and its main components[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 588-593. |
| [11] |
Chen X, Guo JJ, Bao JL, et al. The anticancer properties of Salvia miltiorrhiza Bunge (Danshen): a systematic review[J]. Med Res Rev, 2014, 34: 768-794. DOI:10.1002/med.21304 |
| [12] |
Zhang J. Curative effect on the treatment of chronic hepatitis B with Danshen[J]. Acta Med Sin (华夏医学), 2005, 18: 21-22. |
| [13] |
Xu F. Clinical study on the treatment of chronic hepatitis B with Danshen injection[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2013, 24: 2442-2443. |
| [14] |
Zhou Z, Zhang Y, Ding XR, et al. Protocatechuic aldehyde inhibits hepatitis B virus replication both in vitro and in vivo[J]. Antiviral Res, 2007, 74: 59-64. DOI:10.1016/j.antiviral.2006.12.005 |
| [15] |
Dai XQ, Cai WT, Wu X, et al. Protocatechuic acid inhibits hepatitis B virus replication by activating ERK1/2 pathway and down-regulating HNF4α and HNF1α in vitro[J]. Life Sci, 2017, 180: 68-74. DOI:10.1016/j.lfs.2017.05.015 |
| [16] |
Cai WT, Zhu SQ, Han FM, et al. The application of lithospermic acid in the preparation of anti-HBV drugs: CN, 201910169847.5[P]. 2019-05-21.
|
| [17] |
Xie J, Gao S, Lin L, et al. Research progress and application strategy on network pharmacology in Chinese materia medica[J]. Chin Herb Med (中草药), 2019, 50: 2257-2264. |
| [18] |
Li S. Network pharmacology evaluation method guidance-draft[J]. World J Tradit Chin Med (世界中医药杂志), 2021, 7: 146-154. |
| [19] |
Liu Q, He Z, Yang H, et al. Exploration on active compounds of Feiduqing for treatment of COVID-19 based on network pharmacology and molecular docking[J]. Chin Herb Med (中草药), 2020, 51: 1713-1722. |
| [20] |
Wu H, Wang J, Yang Y, et al. Preliminary exploration of the mechanism of Qingfei Paidu decoction against novel corona-virus pneumonia based on network pharmacology and molecular docking technology[J]. Acta Pharm Sin (药学学报), 2020, 55: 374-383. |
| [21] |
Ru J, Li P, Wang J, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. J Chem-inform, 2014, 6: 13. |
| [22] |
Veber DF, Johnson SR, Cheng HY, et al. Molecular properties that influence the oral bioavailability of drug candidates[J]. J Med Chem, 2002, 45: 2615-2623. DOI:10.1021/jm020017n |
| [23] |
Kim S, Chen J, Cheng T, et al. PubChem 2019 update: improved access to chemical data[J]. Nucleic Acids Res, 2019, 47: D1102-D1109. DOI:10.1093/nar/gky1033 |
| [24] |
Daina A, Michielin O, Zoete V. SwissTargetPrediction: updated data and new features for efficient prediction of protein targets of small molecules[J]. Nucleic Acids Res, 2019, 47: W357-W364. DOI:10.1093/nar/gkz382 |
| [25] |
Yuan W, Wei Y, Chen Y, et al. Mechanisms of eleutheroside for treatment of diabetes mellitus type 2 based on network pharmacology[J]. Acta Pharm Sin (药学学报), 2019, 54: 1982-1989. |
| [26] |
Chen H, Hu J, Zhang L, et al. Exploration on mechanisms of Salvia miltiorrhiza in treating cirrhosis based on network pharmacology[J]. Chin Herb Med (中草药), 2020, 51: 3968-3977. |
| [27] |
Sung Y, Li B, Guan Y, et al. Potential molecular mechanism for Chaiyin Granules against coronavirus infection based on network pharmacology and molecular docking[J]. Chin Herb Med (中草药), 2020, 51: 4999-5009. |
| [28] |
Szklarczyk D, Gable AL, Lyon D, et al. STRING v11: protein-protein association networks with increased coverage, supporting functional discovery in genome-wide experimental datasets[J]. Nucleic Acids Res, 2019, 47: D607-D613. DOI:10.1093/nar/gky1131 |
| [29] |
Song H, Ma X, Wang D, et al. Potential mechanism of Huangqin decoction for the treatment of ulcerative colitis based on network pharmacology[J]. Acta Pharm Sin (药学学报), 2020, 55: 247-255. |
| [30] |
Ju Y, Hou N, Zhang X, et al. Blockade of Tim-3 pathway ameliorates interferon-γ production from hepatic CD8+ T cells in a mouse model of hepatitis B virus infection[J]. Cell Mol Immunol, 2009, 6: 35-43. DOI:10.1038/cmi.2009.5 |
| [31] |
Sang X, Wang R, Han Y, et al. T cell-associated immunoregulation and antiviral effect of oxymatrine in hydrodynamic injection HBV mouse model[J]. Acta Pharm Sin B, 2017, 7: 311-318. DOI:10.1016/j.apsb.2017.02.005 |
| [32] |
Li W, Qiang Z, Li X, et al. Pharmacokinetics and metabolism of lithospermic acid by LC/MS/MS in rats[J]. Int J Pharm, 2008, 350: 240-246. DOI:10.1016/j.ijpharm.2007.09.001 |
| [33] |
Julander JG, Sidwell RW, Morrey JD. Characterizing antiviral activity of adefovir dipivoxil in transgenic mice expressing hepatitis B virus[J]. Antiviral Res, 2002, 55: 27-40. DOI:10.1016/S0166-3542(01)00223-6 |
| [34] |
Morrey JD, Motter NE, Taro B, et al. Efficacy of cationic lipid-DNA complexes (CLDC) on hepatitis B virus in transgenic mice[J]. Antiviral Res, 2008, 79: 71-79. DOI:10.1016/j.antiviral.2008.01.157 |
| [35] |
Liu H, Jiang C, Feng J, et al. Research progress of Tanshinone[J]. Chin Pharmacol Bull (中国药理学通报), 2016, 32: 1643-1647. |
| [36] |
Liu AL, Li MY, Wang YT, et al. Research status of pharmaco-logical active substance basis of Salvia miltiorrhiza[J]. Chin Pharm J (中国药学杂志), 2007, 42: 641-646. |
| [37] |
Wang H, Gu J, Hou X, et al. Anti-inflammatory effect of milti-rone on inflammatory bowel disease via TLR4/NF-κB/IQGAP2 signaling pathway[J]. Biomed Pharmacother, 2017, 85: 531-540. DOI:10.1016/j.biopha.2016.11.061 |
| [38] |
Wang ZY, Li YQ, Guo ZW, et al. ERK1/2-HNF4α axis is involved in epigallocatechin-3-gallate inhibition of HBV replication[J]. Acta Pharmacol Sin, 2020, 41: 278-285. DOI:10.1038/s41401-019-0302-0 |
| [39] |
Wang GF, Shi LP, Ren YD, et al. Anti-hepatitis B virus activity of chlorogenic acid, quinic acid and caffeic acid in vivo and in vitro[J]. Antiviral Res, 2009, 83: 186-190. DOI:10.1016/j.antiviral.2009.05.002 |
| [40] |
Abd-Elazem IS, Chen HS, Bates RB, et al. Isolation of two highly potent and non-toxic inhibitors of human immunodeficiency virus type 1 (HIV-1) integrase from Salvia miltiorrhiza[J]. Antiviral Res, 2002, 55: 91-106. DOI:10.1016/S0166-3542(02)00011-6 |
| [41] |
Janku F, Tsimberidou AM, Garrido-Laguna I, et al. PIK3CA mutations in patients with advanced cancers treated with PI3K/AKT/mTOR axis inhibitors[J]. Mol Cancer Ther, 2011, 10: 558-565. DOI:10.1158/1535-7163.MCT-10-0994 |
| [42] |
Boyault S, Rickman DS, de Reyniès A, et al. Transcriptome classification of HCC is related to gene alterations and to new therapeutic targets[J]. Hepatology, 2007, 45: 42-52. DOI:10.1002/hep.21467 |
| [43] |
Zheng P, Li Y, Li X, et al. Expression of P21ras and PIK3CA in human tissues of hepatocellular carcinoma and hepatic cirrhosis[J]. Int J Surg (国际外科学杂志), 2010, 37: 511-514. |
| [44] |
Hösel M, Quasdorff M, Ringelhan M, et al. Hepatitis B virus activates signal transducer and activator of transcription 3 supporting hepatocyte survival and virus replication[J]. Cell Mol Gastroenterol Hepatol, 2017, 4: 339-363. DOI:10.1016/j.jcmgh.2017.07.003 |
| [45] |
Wang YR, Wang QH, Zhang T, et al. Associations between hepatic functions and plasma amyloid-beta levels-implications for the capacity of liver in peripheral amyloid-beta clearance[J]. Mol Neurobiol, 2017, 54: 2338-2344. DOI:10.1007/s12035-016-9826-1 |
| [46] |
Luisa B, Siham S, Darrell L, et al. Altered T cell costimulation during chronic hepatitis B infection[J]. Cell Immunol, 2009, 257: 61-68. DOI:10.1016/j.cellimm.2009.02.008 |
| [47] |
Rawat S, Bouchard MJ. The hepatitis B virus (HBV) HBx protein activates AKT to simultaneously regulate HBV replication and hepatocyte survival[J]. J Virol, 2015, 89: 999-1012. DOI:10.1128/JVI.02440-14 |
| [48] |
Sun W, Zhang JQ, Chen JL. microRNA-520a suppresses HBV replication in HepG2.2. 15 cells by inactivating AKT[J]. J Int Med Res, 2018, 46: 4693-4704. DOI:10.1177/0300060518792780 |
| [49] |
Zhang LL, Fang F. PD-1 negative immunomodulation signal pathway in HBV infection[J]. Chin J Immunol (中国免疫学杂志), 2019, 35: 2419-2422, 2429. |
| [50] |
Zhang XY, Kraft A, Broering R, et al. Preclinical development of TLR ligands as drugs for the treatment of chronic viral infections[J]. Expert Opin Drug Discov, 2012, 7: 597-611. DOI:10.1517/17460441.2012.689281 |
| [51] |
Wan HQ, Ge LL, Xiao LY, et al. 3, 4, 5-Tri-O-caffeoylquinic acid methyl ester isolated from Lonicera japonica Thunb. flower buds facilitates hepatitis B virus replication in HepG2.2. 15 cells[J]. Food Chem Toxicol, 2020, 138: 111250. DOI:10.1016/j.fct.2020.111250 |
| [52] |
Xiang KL, Wang B. Role of the PI3K-AKT-mTOR pathway in hepatitis B virus infection and replication[J]. Mol Med Rep, 2018, 17: 4713-4719. |
| [53] |
Gallagher LE, Williamson LE, Chan EYW. Advances in autophagy regulatory mechanisms[J]. Cells, 2016, 5: 24. DOI:10.3390/cells5020024 |
| [54] |
Sir D, Tian Y, Chen WL, et al. The early autophagic pathway is activated by hepatitis B virus and required for viral DNA replication[J]. Proc Natl Acad Sci U S A, 2010, 107: 4383-4388. DOI:10.1073/pnas.0911373107 |
| [55] |
Zhong LM, Shu WQ, Dai WB, et al. Reactive oxygen species-mediated c-Jun NH-terminal kinase activation contributes to hepa-titis B virus X protein-induced autophagy via regulation of the Beclin-1/Bcl-2 interaction[J]. J Virol, 2017, 91: e00001-17. |
 2022, Vol. 57
2022, Vol. 57


