体温调节是人体内分泌系统自主神经和行为调节共同作用的结果, 调节中枢位于下丘脑视前区(preoptic area, POA), 温度信号经由初级感觉神经元传至脊髓或三叉神经背角(dorsal horn, DH) 后继续传导至外侧臂旁核(lateral parabrachial nucleus, LPB), 刺激LPB区中分别调节冷热信号的神经元后投射到体温调节中枢POA, 经由下丘脑背内侧核(dorsomedial hypothalamus, DMH), 传至中缝苍白球(rostral Raphe Pallidus, rRPa), 作用于棕色脂肪组织(brown adipose tissue, BAT), 通过促进或抑制BAT产热, 进而调节体温[1-3]。腺苷作为内源性的神经递质, 在调节机体生理状态的过程中扮演了重要的角色。整体水平给予小鼠腺苷可以导致一系列的生理反应, 包括自主活动的减少、镇静及体温的降低。有文献表明, 激活小鼠下丘脑区域的腺苷A1受体(adenosine A1 receptor, A1R) 可导致体温降低[4, 5]。本实验室前期针对腺苷母核进行了一系列设计和优化, 得到了化合物YZG-330 (化学结构见图 1), 在整体动物药效学研究过程中, 发现YZG-330可以显著降低动物的体温, 且实验证明这种降温作用是通过激活中枢A1R实现的[6], 但其具体作用机制尚未完全明确。

|
Figure 1 Chemical structure of YZG-330 [(2R, 3S, 4R, 5R)-2-(hydroxymethyl)-5-(6-(((R)-1-phenylpropyl) amino)-9H-purin-9-yl) tetrahydrofuran-3, 4-diol]. Molecular weight: 385.42 |
A1R可介导丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK) 信号通路激活[7], MAPK是一组能被不同的细胞外刺激激活的丝氨酸-苏氨酸蛋白激酶, 是调节正常和病理状态下多种细胞过程(如增殖、分化、凋亡和应激反应) 的关键信号通路。MAPK可分为4个亚族: 细胞外调节蛋白激酶(extracellular regulated protein kinase, ERK)、P38蛋白(protein 38, P38)、c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK) 和ERK5[8], 其中P38以及ERK信号通路均可介导瞬时受体电位M8 (transient receptor potential M8, TRPM8) 及瞬时受体电位A1 (transient receptor potential A1, TRPA1) 激活[9]。TRP通道是瞬时感受器电位离子通道家族中的成员, 主要位于细胞膜上, 其主要功能是感受温度和其他物理及化学伤害性刺激, 可参与机体温度感觉及体温调节等重要生命活动[10]。TRP通道共有28个亚基, 分为7个亚家族: TRPA、TRPC、TRPM、TRPML、TRPN、TRPP和TRPV[11]。这些亚型的离子通道有着不同的温度敏感性, 且TRP每一种亚型只针对特定范围的温度变化有反应: TRPV 1/2/3/4和TRPM 2/4/5是热激活通道, 而冷刺激主要激活TRPA1和TRMP8亚型[12]。TRP离子通道是一种非选择性阳离子通道, 可介导阳离子尤其是Ca2+的转运[13]。细胞膜内外尤其是胞内Ca2+浓度的改变可引发许多生理及病理性改变。Ca2+是一种重要的体温负调节介质, 有实验表明小鼠中枢神经系统胞内Ca2+含量上升可刺激下丘脑体温调定点导致体温下降[14]。
本文将基于A1R下游信号通路对YZG-330的作用机制进行进一步探索。
材料与方法实验动物 雄性ICR小鼠SPF级, 体重24~26 g; 购自北京维通利华实验动物技术有限公司[许可证编号: SCXK (京) 2016-0006]。动物饲养环境保持12 h昼夜节律, 室温保持在(24 ± 1) ℃, 相对湿度为(60 ± 5) %。标准小鼠饲养盒内喂养动物, 自由进食和进水。动物实验均获得中国医学科学院药物研究所伦理委员会批准。
药品与试剂 化合物YZG-330, 由中国医学科学院药物研究所石建功教授实验室合成, HPLC检测纯度大于99%。1, 3-二丙-8-环戊黄嘌呤(8-cyclopentyl-1, 3-dipropylxanthine, DPCPX) (9A/70155, Tocris公司); TRPM8拮抗剂2 (HY-112430)、SB-203580 (HY-10256)、磷酸酶抑制剂(HY-K0022)、蛋白酶抑制剂(HY-K0010) (MCE公司); N6-环戊基腺苷(N6-cyclopentyladenosine, CPA) (ab120398)、抗TRPA1兔多抗(19124-1-AP)、抗TRPM8兔单抗(ab109308) (Abcam公司); 抗phospho-P38 (4511S)、抗P38兔单抗(8690S) (Cell Signaling Technology公司); 抗β-tubulin抗体(ab1017t, 北京博奥锐京公司); 山羊抗兔IgG (ZB-2301, 中山金桥公司); 山羊抗鼠IgG (SA00001-1, Proteintech公司); RIPA裂解液(强) (P0013B)、DMSO (ST038) (上海碧云天生物技术研究所); BCA蛋白浓度检测试剂盒(CW0014S, 康为世纪生物技术有限公司); D-Hanks液(H-1045, 北京Solarbio公司); Fluo-3AM ester (50013, 北京博知源公司); Pluronic F-127增溶剂(P300MP, 赛默飞公司)。
仪器 动物智能数字测温计(TH212, 恒进达海创高科); DYY-7C型电泳仪(北京六一厂); 酶标仪(MQX200, 美国Bio-Tek公司); ECL (Image Quant LAS4000, 美国GE公司); 脑立体定位仪(深圳瑞沃德生命科技有限公司)。
动物体温测定 雄性ICR小鼠随机分为4组, 每组6只, 分别为溶剂对照组、YZG-330 (0.25、1和4 mg·kg-1, i.p.) 组。实验时, 首先抓取小鼠测量两次肛温, 取平均值作为基础体温, 后腹腔注射给予YZG-330, 每10 min抓取小鼠记录其肛温。
雄性ICR小鼠随机分为8组, 每组6只, 分别为溶剂对照组、P38磷酸化拮抗剂SB-203580组(20 mg·kg-1, i.p.)、YZG-330组(2 mg·kg-1, i.p.)、阳性对照CPA组(1 mg·kg-1, i.p.)、SB-203580 (5和20 mg·kg-1, i.p.) + YZG-330 (2 mg·kg-1, i.p.) 组、SB-203580 (5和20 mg·kg-1, i.p.) + CPA (1 mg·kg-1, i.p.) 组。实验时, 首先抓取小鼠测量两次肛温, 取平均值作为基础体温, 后按组别腹腔给予不同剂量拮抗剂, 20 min后按组别给予YZG-330、CPA和溶剂, 每10 min抓取小鼠记录其肛温。
雄性ICR小鼠随机分为6组, 每组6只, 分别为溶剂对照组、TRPM8拮抗剂2 (每只小鼠0.1 μg, i.c.v.)、YZG-330组(1 mg·kg-1, i.p.)、YZG-330组(0.25 mg·kg-1, i.p.)、TRPM8拮抗剂2 (每只0.1 μg, i.c.v.) + YZG-330 (1 mg·kg-1, i.p.) 组、TRPM8拮抗剂2 (每只0.1 μg, i.c.v.) + YZG-330 (0.25 mg·kg-1, i.p.) 组。实验时, 首先抓取小鼠测量两次肛温, 取平均值作为基础体温, 后按组别侧脑室注射给予拮抗剂或溶剂, 5 min后按组别给予YZG-330或溶剂, 每10 min抓取小鼠记录其肛温。
下丘脑蛋白匀浆制备 ICR小鼠随机分组, 按组别给予相应化合物, 15 min或1 h后脱颈处死取脑, 置于冰上分离下丘脑, 称重。RIPA裂解液中加入1×蛋白酶抑制剂、1×磷酸酶抑制剂混合物混合置于冰上备用, 样品称重后按1∶10 (w/v) 比例向组织中加入相应体积的RIPA裂解液, 在冰浴条件下超声破碎, 功率250 W, 每次3 s, 间隔10 s, 反复2~3次, 之后置于冰上10 min使蛋白充分裂解, 在4 ℃条件下12 000 ×g离心20 min, 离心后取蛋白上清液。
蛋白质免疫印迹(Western blot) Western blot使用BCA法测定待检测蛋白浓度, 加入SDS-PAGE蛋白上样缓冲液后37 ℃水浴15 min, 采用等量上样进行聚丙烯酰胺凝胶电泳分离、转膜, 用5%脱脂牛奶在室温下封闭膜70 min后, TBST洗涤3次, 每次5 min; 将膜放于TBST稀释的一抗中, 4 ℃孵育过夜; 回收一抗, TBST洗涤3次, 每次5 min; 将膜放于TBST稀释的二抗中(二抗按1∶8 000稀释), 室温震荡孵育1 h, TBST洗3次, 每次5 min; 在PVDF膜中滴加配好的ECL发光液, 利用化学发光成像系统采集化学发光图像。用Image J软件处理目的蛋白条带。
下丘脑细胞Ca2+含量测定 将取出的新鲜下丘脑组织迅速置于4 ℃ D-Hanks液中, 研磨成匀浆, 过200目网筛滤至培养皿中, 滤液在4 ℃下1 000 r·min-1离心10 min, 弃上清, 在沉淀物中加入Krebs-Ringer-HEPES-glucose buffer (KRH-glc) 400 μL, 吹打均匀后, 取20 μL细胞悬液加入20 μL 0.04%台盼蓝, 混匀后进行细胞计数检测活细胞浓度。
将细胞稀释至每毫升2×106个, 分为空白组、对照组、YZG-330组(0.1、0.3、1、3、6.5和10 μmol·L-1) 和CaCl2阳性对照组(2 mol·L-1)。除空白组外每100 μL细胞液中加入25 μL Fluo-3AM稀释液及25 μL CaCl2 (1.2 mol·L-1), 使探针终浓度为5 μmol·L-1, CaCl2终浓度为0.2 mol·L-1; 空白组每100 μL细胞液中加入25 μL Fluo-3AM稀释液及25 μL KRH-glc, 使探针终浓度为5 μmol·L-1。避光震荡孵育20 min, 按组别分别加入50 μL KRH-glc、各浓度YZG-330及CaCl2溶液。采用荧光分光光度计测定, 激发波长为488 nm, 发射波长为526 nm。根据公式可计算[Ca2+]。[Ca2+] = Kd [(F-Fmin)/(Fmax-F)]。Kd值为450 nmol·L-1, Fmin为空白组荧光强度, Fmax为加入2 mol·L-1 CaCl2后测得的荧光强度。
细胞提取步骤同上, 将细胞稀释至每毫升2×106个, 共分为对照组、YZG-330组(6.5 μmol·L-1)、DPCPX组(1 μmol·L-1) 和DPCPX (0.5和1 μmol·L-1) +YZG-330 (6.5 μmol·L-1) 联合给药组。每100 μL细胞液中加入25 μL Fluo-3AM稀释液及25 μL各浓度DPCPX或KRH-glc, 使探针终浓度为5 μmol·L-1。避光震荡孵育20 min, 分别加入YZG-330或KRH-glc。采用荧光分光光度计测定, 激发波长为488 nm, 发射波长为526 nm。计算DPCPX抑制率Ri。Ri = [FYZG-330-FYZG-330+DPCPX]/[FYZG-330-FCon]。F为各组荧光强度值。
细胞提取步骤同上, 将细胞稀释至每毫升2×106个, 共分为对照组、YZG-330组(6.5 μmol·L-1)、TRPM8拮抗剂2组(0.1 μmol·L-1)、TRPM8拮抗剂2组(1 μmol·L-1) 和TRPM8拮抗剂2 (0.1和1 μmol·L-1) + YZG-330 (6.5 μmol·L-1) 联合给药组。每100 μL细胞液中加入25 μL Fluo-3AM稀释液及25 μL不同浓度的TRPM8拮抗剂2或KRH-glc, 使探针终浓度为5 μmol·L-1。避光震荡孵育20 min, 分别加入YZG-330或KRH-glc。采用荧光分光光度计测定, 激发波长为488 nm, 发射波长为526 nm。计算TRPM8拮抗剂2抑制率Ri。Ri = [FYZG-330-FYZG-330+TRPM8 antagonist 2]/(FYZG-330-FCon)。F为各组荧光强度值。
统计与分析 动物行为学实验数据以均数±标准误表示, 其余实验结果数据以均数±标准差表示, 应用GraphPad Prism 5.0软件进行统计学分析。使用软件中Student's t-test方法进行统计处理, 显著性结果分别以P < 0.05、P < 0.01或P < 0.001表示有差异、显著性差异和极显著性差异。
结果 1 YZG-330可剂量依赖性地降低小鼠体温腹腔注射给予小鼠YZG-330 (0.25、1和4 mg·kg-1), 与对照组相比, YZG-330可以显著降低小鼠体温(图 2)。YZG-330在0.25 mg·kg-1剂量下, 20 min后小鼠体温表现出显著性降低, 降温幅度最大达1.8 ± 1.1 ℃ (P < 0.01), 40 min后小鼠体温与对照组无差异。YZG-330在1 mg·kg-1剂量下, 小鼠体温在整个检测过程中与对照组小鼠相比均具有显著性差异, 给药50 min后小鼠体温降至最低点, 降温幅度达3.4 ± 1.9 ℃ (P < 0.001)。YZG-330在4 mg·kg-1剂量下, 10 min后小鼠体温显著降低, 在整个检测过程中体温持续降低, 90 min后, 降温速率减缓, 体温趋于稳定。YZG-330 (1和4 mg·kg-1) 各剂量组间具有显著性差异(图 2)。以上结果提示, YZG-330可剂量依赖性地降低小鼠体温。

|
Figure 2 The effect of YZG-330 (i.p.) on body temperature in mice. The mouse basal body temperature was measured before the administration of YZG-330, and then mice were administered YZG-330 (0.25, 1 and 4 mg·kg-1, i.p.), respectively, and the body temperature was measured every 10 minutes. n = 6, |
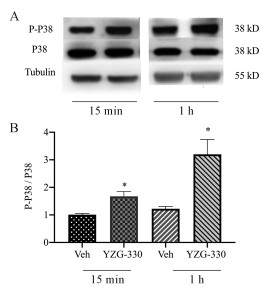
如图 3所示, 给予小鼠YZG-330 (2 mg·kg-1, i.p.) 15 min和1 h后, Western blot法检测小鼠下丘脑组织匀浆中P38蛋白表达及其磷酸化水平。与对照组相比, 给药15 min和1 h后小鼠下丘脑中总P38表达量均无明显变化, P38磷酸化水平以及P-P38/P38比值显著升高, 相对于给药后15 min, 给药1 h后P38磷酸化水平增幅较大, 且与对照组相比均具有显著性差异。
|
Figure 3 Effect of YZG-330 (2 mg·kg-1, i.p) on the expression of P38 and its phosphorylated level in mouse hypothalamic. A: Expression of P38 and P-P38; B: Quantification of P-P38/P38 expression. n = 3, |
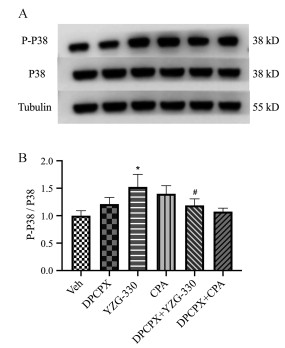
灌胃给予A1R拮抗剂DPCPX (5 mg·kg-1, i.g.), 20 min后给予YZG-330 (2 mg·kg-1, i.p.) 或CPA, Western blot检测小鼠下丘脑匀浆中P38表达及其磷酸化情况。如图 4所示, DPCPX可显著抑制YZG-330促进小鼠下丘脑P38磷酸化的作用, 同时降低了P-P38/P38比值, 与YZG-330组相比具有显著性差异。提示A1R参与了YZG-330调控小鼠下丘脑组织中P38磷酸化的作用, 确定A1R激活后下游信号为P38蛋白的磷酸化。
|
Figure 4 Effect of DPCPX (5 mg·kg-1, i.g) on YZG-330-induced change of expression of P38 and its phosphorylation in mouse hypothalamus. A: Expression of P38 and P-P38; B: Quantification of P-P38/P38 expression. n = 3, |
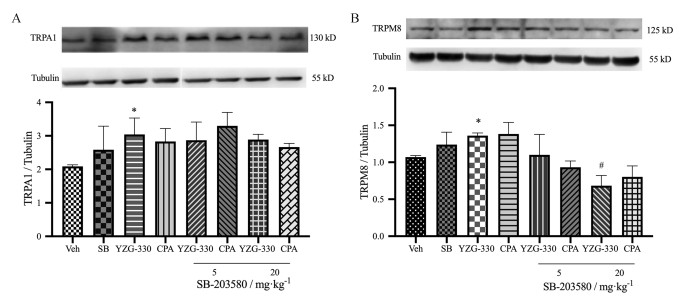
腹腔注射给予小鼠YZG-330 (0.25、2和4 mg·kg-1), 1 h后检测小鼠下丘脑组织中TRPM8和TRPA1的表达量, 如图 5所示, 在0.25、2和4 mg·kg-1三个剂量下YZG-330均上调了TRPA1和TRPM8的表达量, 且与溶剂对照组相比均具有显著性差异。

|
Figure 5 Effect of YZG-330 on the expression of transient receptor potential A1 (TRPA1, A) and transient receptor potential M8 (TRPM8, B) in mouse hypothalamus. n = 3, |
腹腔注射给予选择性P-P38抑制剂SB-203580 (5和20 mg·kg-1), 20 min后腹腔注射给予YZG-330 (2 mg·kg-1)。如图 6所示, 在20 mg·kg-1剂量下SB-203580可有效抑制YZG-330上调TRPM8的表达, 与单独给予YZG-330组相比具有显著性差异; SB-203580 (5 mg·kg-1) 对YZG-330上调TRPM8表达的抑制作用无统计学意义。但是SB-203580 (5和20 mg·kg-1) 对YZG-330上调TRPA1表达无显著抑制作用。结果提示, P38 MAPK信号通路介导了YZG-330上调TRPM8表达的作用, 即P38蛋白磷酸化后可以上调TRPM8离子通道的表达。
|
Figure 6 The effect of SB-203580 (5, 20 mg·kg-1, i.p.) on YZG-330-induced change of expression of TRPA1 (A) and TRPM8 (B) in mouse hypothalamus. n = 3, |
如图 7所示, 小鼠下丘脑细胞与YZG-330共孵育10 min后, 在0.1~10 μmol·L-1剂量区间内, YZG-330组细胞内荧光强度的增加呈剂量依赖性, 与溶剂对照组相比均具有显著性差异。先加入DPCPX (0.5和1 μmol·L-1) 或者TRPM8拮抗剂2 (0.1和1 μmol·L-1), 20 min后再加入YZG-330 (6.5 μmol·L-1), 10 min后检测荧光强度, 如表 1所示, 与YZG-330组相比, DPCPX+YZG-330细胞内荧光强度显著降低, 且具有量效关系; TRPM8拮抗剂2 (1 μmol·L-1) + YZG-330细胞内荧光强度显著降低。

|
Figure 7 The effect of YZG-330 on Ca2+ level in mouse hypothalamic cells. n = 3, |
|
Table 1 The inhibition of DPCPX or TRPM8 antagonist 2 on YZG-330-induced influx of Ca2+ in mouse hypothalamic cells. Incubate A1R inhibitor DPCPX (0.5 and 1 μmol·L-1) or TRPM8 antagonist 2 (0.1 and 1 μmol·L-1) in advance, add YZG-330 (6.5 μmol·L-1) 20 minutes later to detect the fluorescence intensity in mouse hypothalamus cells. n = 3, |
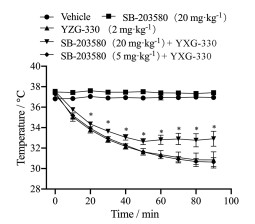
如图 8所示, 给药10 min后, 单独给予SB-203580 (20 mg·kg-1) 对小鼠体温无明显影响, YZG-330 (2 mg·kg-1) 组和SB-203580 (5和20 mg·kg-1, i.p.) + YZG-330组小鼠体温均明显下降。与YZG-330组相比, SB-203580 (20 mg·kg-1) + YZG-330组小鼠在给予YZG-330 30 min后降温速率开始明显减缓, 在50 min时体温降至最低, 降幅达4.90 ± 0.55 ℃, 随后体温回升。SB-203580 (5 mg·kg-1) + YZG-330组小鼠体温与YZG-330组相比无显著性差异。结果提示, YZG-330的降温作用可部分被P38抑制剂拮抗, P38蛋白的磷酸化在YZG-330致小鼠体温降低过程中发挥了重要作用。
|
Figure 8 The effect of SB-203580 on YZG-330-induced increase of mouse body temperature. The mouse basal body temperature was measured in advance, and then the selective P38 inhibitor SB-203580 (5, 20 mg·kg-1, i.p.) was given, followed by YZG-330 (2 mg·kg-1, i.p.) 20 min later, and body temperature was measured every 10 minutes. n = 6, |
如图 9所示, 给药30 min后, 单独给予选择性TRPM8离子通道拮抗剂2 (每只小鼠0.1 μg, i.c.v.) 对小鼠体温无明显影响, 而YZG-330组(0.25和1 mg·kg-1) 小鼠体温均明显下降, 与溶剂对照组相比有显著性差异。TRPM8拮抗剂2 + YZG-330 (0.25或1 mg·kg-1) 组小鼠体温与对应的YZG-330组(0.25或1 mg·kg-1) 均有显著性差异。结果表明, YZG-330的降温作用可部分被TRPM8拮抗剂2拮抗, TRPM8离子通道在YZG-330致小鼠体温降低过程中发挥了重要作用。

|
Figure 9 Effect of YZG-330 and TRPM8 ion channel on the maximum change of mouse body temperature. Antagonist was intracerebroventricularly given to mice for each group 10 min before intraperitoneal administration of YZG-330. n = 6, |
本文首先验证了YZG-330在A1R介导下的降温作用。通过整体药效学评价, 本研究发现YZG-330可剂量依赖性地降低小鼠体温, 且P38受体拮抗剂SB-203580和TRPM8拮抗剂2均可拮抗YZG-330的降温作用。Western blot结果显示, 在给药15 min和1 h后, YZG-330可显著上调小鼠下丘脑中P38磷酸化表达, 并且可以被A1R抑制剂DPCPX拮抗。给药1 h后YZG-330可显著上调小鼠下丘脑组织中TRPM8的表达量, 且上调作用可被DPCPX和SB-203580拮抗, 说明YZG-330对TRPM8表达的调控受A1R和P38 MAPK信号通路的介导。YZG-330同样可在A1R介导下上调TRPA1的表达, 但SB-203580无法拮抗YZG-330对TRPA1的调控, 说明YZG-330对TRPA1的上调作用是通过A1R介导的, 但不受P38 MAPK信号通路的调控。荧光探针检测小鼠下丘脑细胞内Ca2+实验结果显示, YZG-330可剂量依赖性地促进小鼠下丘脑细胞中Ca2+内流, 且DPCPX或TRPM8拮抗剂均可抑制YZG-330引起的胞内Ca2+升高的作用。
实验发现, YZG-330致TRPM8和TRPA1表达上调没有量效关系, 可能是由于TRP离子通道的激活具有“Flip-flop”开关效应, 温度达到激活范围内即可激活, 不存在剂量依赖性。
A1R是一种G蛋白耦联型受体, 后续反应均通过cAMP-PKA或PI3K-AKT信号通路完成[15], 研究表明, A1R介导体温调节时, 是通过PKA-cAMP信号通路发挥作用的[16], 其下游是P38 MAPK通路[17]。基于以上实验结果得出结论: YZG-330激动A1R, 通过PKA-cAMP信号通路上调P38磷酸化水平, 上调TRPM8表达量, 激活离子通道, 促进Ca2+内流, 从而导致小鼠体温降低。最终确定的信号通路如图 10所示。由于A1R抑制剂DPCPX只能部分拮抗YZG-330的降温作用, 故YZG-330可能存在其他的作用靶点, 其具体机制还有待进一步探索。

|
Figure 10 YZG-330 cooling pathway in mouse hypothalmatic cells |
作者贡献: 朱子玉主要负责部分动物行为学以及分子水平实验、文章撰写; 虞远智主要负责部分动物行为学、细胞水平实验以及文章整体修改; 袁月负责部分分子水平实验以及数据分析整理; 张建军主要负责指导整个实验的完成和投稿。
利益冲突: 所有作者均声明无利益冲突。
| [1] |
Swoap SJ, Bingaman MJ, Hult EM, et al. Alternate-day feeding leads to improved glucose regulation on fasting days without significant weight loss in genetically obese mice[J]. Am J Physiol Regul Integr Comp Physiol, 2019, 317: R461-R469. DOI:10.1152/ajpregu.00140.2019 |
| [2] |
Gavrilova O, Leon LR, Marcus-Samuels B, et al. Torpor in mice is induced by both leptin-dependent and -independent mechanisms[J]. Proc Natl Acad Sci U S A, 1999, 96: 14623-14628. DOI:10.1073/pnas.96.25.14623 |
| [3] |
Bolze F, Morath V, Bast A, et al. Long-acting PASylated leptin ameliorates obesity by promoting satiety and preventing hypo-metabolism in leptin-deficient Lep (ob/ob) mice[J]. Endocrinology, 2016, 157: 233-244. DOI:10.1210/en.2015-1519 |
| [4] |
Province HS, Xiao C, Mogul AS, et al. Activation of neuronal adenosine A1 receptors causes hypothermia through central and peripheral mechanisms[J]. PLoS One, 2020, 15: e0243986. DOI:10.1371/journal.pone.0243986 |
| [5] |
Kan HW, Chang CH, Lin CL, et al. Downregulation of adeno-sine and adenosine A1 receptor contributes to neuropathic pain in resiniferatoxin neuropathy[J]. Pain, 2018, 159: 1580-1591. DOI:10.1097/j.pain.0000000000001246 |
| [6] |
Jia SB, Zhang Y, Shi JG, et al. Central-adenosine A1 receptor involved in the thermal regulation effect of YZG-330, a N6-substituted adenosine derivative, in mice[J]. Acta Pharm Sin (药学学报), 2015, 50: 690-696. |
| [7] |
Zong KQ, Ma ZC, Gao Y. Progress in research on effects of adenosine A1 receptors[J]. Chin Pharmacol Bull (中国药理学通报), 2008, 24: 573-576. |
| [8] |
Raman M, Chen W, Cobb MH. Differential regulation and pro-perties of MAPKs[J]. Oncogene, 2007, 26: 3100-3112. DOI:10.1038/sj.onc.1210392 |
| [9] |
Mizushima T, Obata K, Katsura H, et al. Noxious cold stimulation induces mitogen-activated protein kinase activation in transient receptor potential (TRP) channels TRPA1- and TRPM8-containing small sensory neurons[J]. Neuroscience, 2006, 140: 1337-1348. DOI:10.1016/j.neuroscience.2006.03.024 |
| [10] |
Cheng W, Liu J, Sun CS, et al. Research progress of temperature-sensitive TRP channels as drug targets for neuropathic pain[J]. Prog Physiol Sci (生理科学进展), 2012, 43: 125-130. |
| [11] |
Ramsey IS, Delling M, Clapham DE. An introduction to TRP channels[J]. Annu Rev Physiol, 2006, 68: 619-647. DOI:10.1146/annurev.physiol.68.040204.100431 |
| [12] |
Almeida MC, Vizin RCL, Carrettiero DC. Current understanding on the neurophysiology of behavioral thermoregulation[J]. Temperature, 2015, 2: 483-490. DOI:10.1080/23328940.2015.1095270 |
| [13] |
Liu CL, Su HC, Wan HY, et al. Forsythoside A exerts antipyretic effect on yeast-induced pyrexia mice via inhibiting transient receptor potential vanilloid 1 function[J]. Int J Biol Sci, 2017, 13: 65-75. DOI:10.7150/ijbs.18045 |
| [14] |
Xue XL, Xing FY, Wang SQ, et al. The effect of hypothermia on the content of neuropeptides and other active substances in rat plasma and different brain regions[J]. Chin J Pathophysiol (中国病理生理杂志), 2002, 18: 100-103. |
| [15] |
Merighi S, Benini A, Mirandola P, et al. A3 adenosine receptor activation inhibits cell proliferation via phosphatidylinositol 3-kinase/Akt-dependent inhibition of the extracellular signal-regulated kinase 1/2 phosphorylation in A375 human melanoma cells[J]. J Biol Chem, 2005, 280: 19516-19526. DOI:10.1074/jbc.M413772200 |
| [16] |
Haas HL, Selbach O. Functions of neuronal adenosine receptors[J]. Naunyn Schmiedebergs Arch Pharmacol, 2000, 362: 375-381. DOI:10.1007/s002100000314 |
| [17] |
Asada R, Kanemoto S, Matsuhisa K, et al. IRE1α-XBP1 is a novel branch in the transcriptional regulation of UCP1 in brown adipocytes[J]. Sci Rep, 2015, 5: 16580. DOI:10.1038/srep16580 |
 2022, Vol. 57
2022, Vol. 57


