在过去几十年里, 植物天然产物一直是药物研发的灵感来源之一。天然产物的结构、分子差异、高安全性、可用性、可获得性和低成本为推动药物发现提供了显著优势。随着研究的深入, 许多天然产物被证明具有广泛药理作用和良好疗效, 为医药产业的发展开辟了新天地[1]。
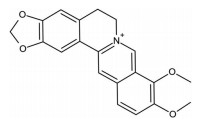
小檗碱(berberine) 又名黄连素, 是一种苄基异喹啉类生物碱, 化学结构式如图 1所示, 主要存在于毛茛科、小檗科、罂粟科、芸香科、防己科、鼠李科等植物中, 在黄连和黄柏中的含量最高, 一般从毛茛科植物黄连等根状茎中提取获得, 临床应用主要为其盐酸盐和硫酸盐, 我国现用合成法大量生产[2]。现代药理学研究最早发现小檗碱对多种革兰阳性菌和革兰阴性菌有抑制作用, 对肠道感染和细菌性痢疾有效, 所以最初小檗碱主要用于临床治疗消化道疾病如肠胃炎和细菌性痢疾[3]。随着研究的深入, 小檗碱被发现具有其他广泛的药理活性, 如止泻、抗糖尿病、降血脂、抗肿瘤活性等[2], 这些新发现赋予其新的意义和价值。尽管在过去10年中小檗碱的药理作用已在临床患者和动物模型中得到证实, 但其使用尚未被一般医学界接受, 纯小檗碱配方没有被批准用于任何特定疾病, 原因主要有两个: 对人体的具体靶点和作用机制尚不明确, 以及其极低的口服生物利用度。本文综述了小檗碱的药理活性及机制、代谢过程和药代动力学特征, 重点介绍了通过提高溶解度和渗透性、抑制P-gp (P-glycoprotein) 外排、结构修饰4种途径来提高其口服生物利用度的策略。
|
Figure 1 Chemical structure of berberine |
小檗碱在许多药理实验中被用作标准的止泻药, Di Pierro等[4]研究发现, 即使经过30天, 以小檗碱为基础的营养补充剂也能显著减少50%~70%的腹泻事件。90天后, 这种减少改善到70%~80%, 每周排泄次数减少了60%以上, 超过50%的治疗对象表现正常。小檗碱的止泻作用可能与以下机制有关: 逆转霍乱毒素和大肠杆菌相关毒素的分泌; 通过减少肠道平滑肌收缩和延缓肠道转运时间来调节肠道运动[5]; 提高Na+/H+交换器3和水通道蛋白4的表达水平和恢复疾病状态下的肠屏障功能[6]。虽然小檗碱是一种治疗各种细菌相关性腹泻的非处方药, 然而小檗碱在临床上也会引起轻度腹泻。
1.2 抗菌小檗碱已被证明对胸膜肺炎放线杆菌、痢疾志贺菌、表皮葡萄球菌和大肠杆菌等多种细菌有抗菌活性[7]。Zhang等[8]的研究中, 以小檗碱为基础治疗的幽门螺旋杆菌根除率(80.4%) 高于克拉霉素、阿莫西林和奥美拉唑的标准三联疗法(67.0%), 小檗碱似乎可考虑作为根除幽门螺旋杆菌方案的替代药物。小檗碱的抗菌作用可能是由于其对细菌的内毒素(如脂多糖) 和细菌表面蛋白排序酶活性的抑制作用[9]。此外, 小檗碱已被证明是一种高亲和力的脂多糖拮抗剂, 可减少脂多糖与宿主免疫细胞上特定受体的相互作用。研究表明[10], 小檗碱是一种DNA配体, 能在体外结合单链和双链DNA, 与细菌中的DNA结合会导致DNA损伤。小檗碱与一些常见的抗生素有协同作用, 最近的一项研究表明[11], 小檗碱与阿奇霉素联用表现出更好的抗菌效能。
1.3 降血糖小檗碱是治疗2型糖尿病(type 2 diabetes mellitus, T2DM) 的有力候选药物, Zhou等[12]研究表明, 中药提取物小檗碱对糖尿病大鼠具有多靶点的抗糖尿病和肾脏保护作用, 可作为治疗T2DM和预防糖尿病肾病的有效替代药物。已经提出了小檗碱抗糖尿病活性的几种机制, 包括增加胰岛素敏感性、调节肠道微生物群、激活AMP依赖的蛋白激酶(AMP-activated protein kinase, AMPK) 通路、促进肠道胰高血糖素样蛋白分泌、刺激外周组织的糖酵解细胞、抑制肝脏糖异生和增加葡萄糖转运蛋白, 并上调肝脏低密度脂蛋白受体mRNA表达[13]。Di等[14]使用网络药理学和T2DM小鼠模型, 表明小檗碱可通过重要靶点和多个信号通路有效预防T2DM症状。
1.4 降血脂小檗碱已被证明是一种安全有效的降胆固醇药物, Kong等[15]研究发现, 32名高胆固醇血症患者口服小檗碱3个月后, 血清总胆固醇(total cholesterol, TC)、血清甘油三酯(triglyceride, TG)、血浆低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C) 水平分别降低了29%、35%、25%。在人肝癌细胞中, 低密度脂蛋白受体(low density lipoprotein receptor, LDLR) mRNA和蛋白质水平分别增加了3.5倍和2.6倍, 表明小檗碱通过调节LDLR的表达来调节LDL-C水平。小檗碱可能对LDLR代谢有双重作用: 稳定其mRNA的转录来上调LDLR表达, 通过泛素化和肝细胞核因子1α的降解抑制前蛋白转化酶的表达[16]。小檗碱也可通过抑制胆固醇吸收和促进排泄来降低TC水平。他汀类药物是高胆固醇血症患者的首选药物, 10%~15%的患者对他汀类药物不耐受[17]。小檗碱的作用机制不同于他汀类药物, 小檗碱与辛伐他汀的组合降低LDL-C和TG水平比辛伐他汀或小檗碱单一疗法更有效[18]。
1.5 抗癌小檗碱对结直肠癌、乳腺癌、卵巢癌、肝癌、胆管癌、白血病等多种肿瘤有抗癌活性[19], 在癌症发展的增殖、生长和转移阶段都能发挥抗癌作用。已经提出了几种小檗碱的抗增殖作用机制, 包括下调细胞周期素B1, 通过mTOR信号通路诱导自噬细胞死亡以及与寡核苷酸结合抑制DNA合成[20]。在一项研究中[21], 小檗碱(10~40 μmol·L-1) 以剂量依赖方式显著抑制人肝癌细胞系HepG2的增殖, 在小鼠结肠肿瘤细胞中也有类似结果[22]。Samadi等[23]发现小檗碱可通过靶向多条通路引起结肠癌细胞的细胞周期阻滞、抑制炎症和诱导凋亡, 小檗碱诱导前列腺癌细胞产生活性氧并激活线粒体依赖性的凋亡[24], 还通过抑制花生四烯酸途径显示出化学预防作用。小檗碱仅在浓度大于10 μmol·L-1时才观察到显著的体外生物学效应, 这比人类口服摄入小檗碱后可达到的浓度(4.0 nmol·L-1) 高数千倍, 小檗碱作为抗癌药进入临床应用还要先解决口服吸收差的问题[25]。
小檗碱作为治疗剂的多功能性是由于其对酶、受体和细胞信号通路的不同影响, 通过特异性和一般性的抗氧化和抗炎机制建立了其多元药理活性, 但小檗碱在动物模型中的生物利用度很低。越来越多的证据表明, 肠道微生物群是小檗碱多功能作用的靶标。研究表明, 在病理条件下, 小檗碱可逆转肠道微生物区系的结构和数量变化, 肠道微生物区系是小檗碱生物利用度和药理学之间的新兴联系。Liao等[26]的研究表明小檗碱不仅可改善大鼠结肠损伤, 也能改善肠道微生物区系, 从而改善相关功能, 肠道微生物群有作为新治疗靶点和生物诊断标志物的潜力。Xu等[27]研究发现, 葛根芩连汤中的小檗碱主要通过调节肠道微生物群来减轻肠道炎症和降低葡萄糖。在Shi等[28]的研究中, 评估了小檗碱对肠道微生物区系组成的影响, 与疾病模型组相比, 小檗碱处理组的细菌总数明显增加, 而变形杆菌的数量受到抑制, 小檗碱降低高脂饮食诱导动脉粥样硬化和炎症反应与小檗碱对微生物区系的调节作用类似。Pan等[29]的研究也揭示了小檗碱对大鼠血清葡萄糖水平和溃疡性结肠炎的影响与肠道微生物群的结构调节有关。Cui等[30]从肠道微生物群角度出发, 综述了小檗碱的研究进展及其在动脉粥样硬化和代谢性疾病治疗中的作用机制, 以揭示肠道微生物群对小檗碱多功能生物学效应的潜在贡献, 证明了小檗碱的多重药理作用在一定程度上是由于其对肠道微生物区系的调节作用。
2 小檗碱的药代动力学 2.1 吸收药物口服生物利用度受很多因素影响, 如药物理化性质(在胃肠道中的溶解度、渗透性和稳定性)、剂型(药物分散度和溶出度) 及生理因素(肠壁和肝脏的外排及代谢)。小檗碱口服生物利用度极低, 在两项对大鼠的研究中, 分别为0.36%[31]和0.68%[32]。
虽然目前还不清楚小檗碱低口服生物利用度的确切机制, 但一些研究已提出了其可能原因。小檗碱的溶解度差, 在生物药剂学分类系统中属于Ⅳ类药物, 在生理条件下, 其主要以电离形式存在, 易在胃肠道酸性环境中自我聚集, 降低其溶解度, 在pH 1.2 (HCl) 下的溶解度是在pH 7.0溶解度的1/20, 大约56%的小檗碱因聚集而未被胃肠道吸收[25]。由于小檗碱的疏脂性, 穿过肠细胞受到阻碍, 其在大鼠肠黏膜的有效渗透系数为0.178×10-4 cm·s-1, 证实了其低渗透性[33]。P-gp表达在肠壁上皮层的顶膜, 可主动地将某些化合物转运到血液到管腔的方向, 并限制其在吸收方向的转运。小檗碱已被证实是P-gp的底物, P-gp外排作用对小檗碱的转运有很大影响。另外, 由于肝肠循环过程的存在, 小檗碱的胆汁再排泄也可能降低其口服吸收。
2.2 分布小檗碱在体内组织中的摄取和分布对其生物活性非常重要, 但目前对这一问题的研究还很少。虽然小檗碱的生物利用度和血浆浓度很低, 不能解释其药理作用, 但体内研究表明, 口服后小檗碱及其活性代谢物的组织分布高于血液中的浓度。给大鼠口服小檗碱(200 mg·kg-1) 后发现[34], 其在肝、肾、肌肉、肺、脑、心脏、胰腺和脂肪中的含量由大到小依次递减, 且在所研究的大部分组织中, 其含量在给药后4 h也高于血浆中的含量。小檗碱的主要代谢物[小檗红碱(berberrubine, M1)、唐松草分定(thalifendine, M2) 和药根碱(jatrorrhizine, M4)] 的器官分布也高于血液中的浓度。小檗碱及其代谢物在组织中保持相对稳定, 这些结果可解释为什么即使其血液浓度很低, 在体内仍具有活性, 目前还没有关于小檗碱在人体内分布的研究。
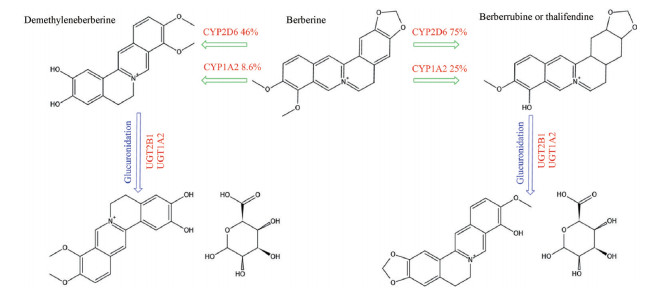
2.3 代谢肝脏是小檗碱在大鼠和人类体内代谢的主要场所, 氧化去甲基化和葡萄糖醛酸化是小檗碱在大鼠体内的主要代谢途径。小檗碱的主要循环代谢物为M1、M2、去亚甲基小檗碱(demethyleneberberine, M3)。几种细胞色素P450同工酶(cytochrome P450 proteins, CYP) 参与了M1和M2的形成, CYP2D6是产生小檗碱代谢物的主要人体CYP, 其次是CYP1A2、CYP3A4、CYP2E1和CYP2C19。Chen等[35]研究表明, CYP2D6和CYP1A2参与M1或M2过程占比分别为75.253% ± 9%和25.323% ± 6%, 参与M3过程占比分别为46.893% ± 8%和8.679% ± 5% (图 2), 提示CYP2D6在小檗碱代谢中具有重要作用, 在小檗碱给药过程中应考虑CYP2D6的药物遗传学和药物相互作用。小檗碱的M1和M2代谢物经Ⅰ相脱甲基化后, 与葡萄糖醛酸或硫酸偶联, 生成Ⅱ相代谢物, 其中M2-葡醛酸苷含量约为M1-葡醛酸苷含量的24倍。尿苷二磷酸葡萄糖醛酸基转移酶(UDP-glucuronosyltransferase, UGT) 是人体内重要的催化Ⅱ相结合反应的酶, 广泛分布于人体的肝、肾、胃肠道及各种腺体组织, UGT2B1和UGT1A1负责M1 (M2) 和M3的葡萄糖醛酸化, 这些硫酸盐或葡萄糖醛酸代谢物是极性的, 很容易排泄出来。
|
Figure 2 Metabolism pathways and the relative role of enzymes responsible in biotransformation of berberine in human |
Ma等[36]的研究评价了给药200 mg·kg-1后小檗碱及其代谢物的排泄情况。结果表明, 小檗碱总回收率为22.83%, 主要排泄途径为粪便[胆汁中9.2×10-6% (24 h), 尿液中0.093 9% (48 h), 粪便中22.74% (48 h)]。小檗碱的主要代谢物(M1和M2) 通过胆汁和尿液排出, 目前还没有关于小檗碱排泄的人体研究。
3 提高口服生物利用度策略虽然小檗碱能通过调节肠道菌群代谢和组织分布发挥一定的药理活性, 但极低的口服生物利用度还是限制了其在临床上的应用。通过提高口服生物利用度可提高药理活性, 降低达到相同疗效的给药剂量, 进而减少不良反应。如前所述, 小檗碱的口服生物利用度低, 主要是由于在酸性条件下自聚集导致的溶解度差、渗透性低、P-gp介导的大分子外排和肠道首过效应。近年来, 研究者针对限制生物利用度的不同因素已尝试了不同策略来提高小檗碱的口服生物利用度, 主要通过提高小檗碱溶解度和渗透性、抑制P-gp介导的外排和结构修饰等策略。
3.1 提高溶解度溶解度是影响药物口服生物利用度的一个关键因素, 如前所述, 小檗碱具有pH依赖性溶解度, 在酸性条件下易自聚集而导致溶解度差, 控制小檗碱在肠道释放有利于提高其在胃肠道中的有效浓度。Wang等[37]研制了小檗碱Eudragit S100固体分散体, 该药物在酸性介质中释放量最小, 在肠道介质中释放量较高, 采用MTT法对小檗碱固体分散体制剂进行体外细胞毒性研究。实验结果表明, 所选配方对结肠癌和直肠癌细胞生长的抑制活性显著增加, 且呈剂量和时间依赖性。Gao等[38]成功研制了新型pH响应型复合水凝胶微球, 结果表明, 在pH 7.4时, 复合水凝胶微球的溶胀率和盐酸小檗碱累积释放最高, 显著提高胃肠道中盐酸小檗碱的有效浓度。
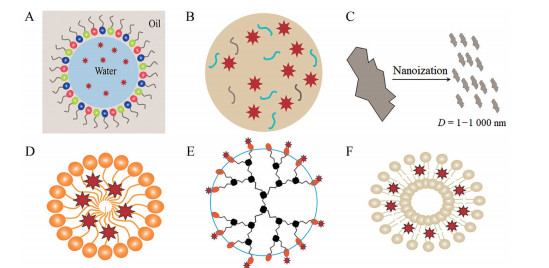
微乳液、纳米乳液和自乳化体系(图 3A) 是由表面活性剂、助表面活性剂、油相和水相组成的热力学稳定体系, 由于其表面张力低, 可增加药物溶解度, 并改善药物在人体肠道内壁的吸收。Marino等[39]开发了一种新型纳米乳给药系统, 体外细胞模型评价表明, 在不同温度下制备的小檗碱制剂吸收率提高4.5~6倍。在Zhu等[40]的研究中, 口服小檗碱微乳制剂的大鼠(25 mg·kg-1) 的血浆药峰浓度Cmax (236.6 ± 7.9 ng·mL-1) 和药时曲线下面积(area under curve, AUC, 709.6 ± 42.3 min·ng·mL-1) 值分别为口服小檗碱商业片剂的163.4%和154.2%, 相对生物利用度为242%。Pund等[41]开发了液体和固体形式的小檗碱微/纳米乳液和自纳米乳化给药系统, 该系统具有改善的溶解度、溶出度和体内治疗效果。小檗碱吸收率和治疗效果提高可归因于微乳液、纳米乳液和自乳化体系更有效的递送方式。
|
Figure 3 Berberine nano delivery system: (A) nanoemulsion, (B) solid dispersion, (C) nanocrystal, (D) polymer micelle, (E) dendrimer, (F) liposome |
固体分散体(solid dispersion, SD, 图 3B) 作为一种药物制剂的中间体, 可增加难溶性药物的溶出度和提高生物利用度、延缓药物释放、增加药物稳定性。Meng等[42]报道了以柠檬酸钠为吸收增强剂的小檗碱无定形固体分散体, 用于提高小檗碱的溶出度和口服生物利用度。在固体分散体中, 观察到大部分小檗碱以无定形形式存在, 其溶解度和溶解速率显著提高。与纯小檗碱相比, 固体分散体生物利用度增加了5倍。Mishra等[43]使用不同比例的亲水性载体甘油酯44/14和甘油酯50/13制备盐酸小檗碱固体分散体, 与游离盐酸小檗碱相比, 溶解度由0.718 ± 0.02 mg·mL-1提高到2.841 ± 0.15 mg·mL-1, 2 h药物释放量从24.39%提高到98.59%, 口服生物利用度提高了2.32倍。该研究证实了固体分散体制剂对于难溶性药物溶解度和溶出度的提高, 并进一步提高药物的口服生物利用度。
药物纳米晶(nanocrystal, 图 3C) 是一种纳米级无载体胶体体系, 理论载药量为100%。根据Noyes-Whitney方程和Ostwald-Freundlich方程, 当药物粒径达到纳米级, 其溶解度和溶出速度与粒径成反比, 降低粒径有利于提高难溶性药物的溶解度和溶出度。Sahibzada等[44, 45]采用纳米悬浮液蒸发沉淀法(EPN) 和注射泵抗溶剂沉淀法(APSP) 制备了直径90~110 nm (APSP) 和直径65~75 nm (EPN) 的半晶纳米粒(NPs), 对制备的纳米粒和未加工的小檗碱在家兔体内进行药动学参数、组织病理学和血液生化分析。与未加工的小檗碱相比, 用小檗碱纳米粒治疗的动物的肝功能检测、酶水平和肝脏组织病理学得到了显著改善, 而用两种不同方法制备的小檗碱纳米晶的药动学参数比未加工小檗碱高约3.97和3.88倍。Wang等[46]使用高压均质法制备了平均粒径为73.1 ± 3.7 nm的小檗碱纳米混悬剂, 与小檗碱原料药相比, 纳米制剂的溶解度和有效性增强, 纳米粒在糖尿病小鼠模型中显示出显著抗糖尿病活性, 且其不良反应更少。以上研究证实了纳米化对于小檗碱口服生物利用度和药理活性的提高, 主要归因于纳米化对小檗碱溶解度和溶出度的提高。
聚合物胶束(polymer micelle, 图 3D) 是由两亲性嵌段共聚物在水中自组装形成的一种热力学稳定的胶体溶液, 广泛应用于难溶性药物递送。Shen等[47]制备了含有维生素E聚乙二醇琥珀酸酯(TPGS) 的聚合物胶束, 改进小檗碱对肿瘤的递送, 制备的胶束稳定, 小檗碱的溶解度提高了300%, 小檗碱聚合物胶束在健康犬模型中的AUC (69.308 h·mg·L-1) 相比游离小檗碱(1.979 h·mg·L-1) 提高了37倍。Kwon等[48]采用薄膜水合法制备了小檗碱-P85-Tween-80配比为1∶5∶0.5 (w/w/w) 的胶束制剂, 该配方使小檗碱溶解度提高了800%, AUC提高了14.58倍(由2 067 ± 1 731提高至32 214 ± 18 966 min·ng·mL-1)。以上研究表明聚合物胶体能显著提高小檗碱的溶解度, 进而提高小檗碱口服生物利用度, 是一种提高小檗碱疗效的潜力制剂。树枝状大分子(dendrimer, 图 3E) 又称高支化聚合物, 因其增溶性能而成为被关注的结构。Gupta等[49]将小檗碱共价偶联到端胺G4 PAMAM树状大分子并与游离小檗碱性能比较, 小檗碱共轭二聚体的粒径更小, 小檗碱负载量更多, 溶解性更好, 半衰期延长, 小檗碱共轭二聚体的AUC (2 471.17 h·µg·mL-1) 相比游离小檗碱(1 424.42 h·µg·mL-1) 提高了73%。Wang等[50]制备了BBR-MgAl单层水滑石给药系统, 小檗碱的溶解度和溶出速度增加, 在大鼠体内的AUC(0-∞)由885.442提高至3 472.912 h·ng·mL-1, Cmax由802.817提高至189.783 ng·mL-1。此外, 新制剂在降低空腹血糖、改善糖耐量和胰岛素抵抗方面比等剂量小檗碱有更强作用。总之, 树枝状大分子可以通过提高小檗碱溶解度来提高其口服生物利用度, 并提高其药理活性。
3.2 提高通透性影响小檗碱口服生物利用度的另一因素是低渗透性, 使用肠道吸收促进剂是一种提高低通透性药物口服生物利用度的方法, 香料、肽基促进剂、表面活性剂和聚合物已被研究证明可改变肠道通透性。在Liu等[51]的研究中, 添加癸酸钠(sodium decanoate) 的小檗碱口服制剂与不添加组相比, 小檗碱的AUC增加了28%。血糖曲线下面积减少22.5%, 其抗糖尿病作用通过改善小檗碱的摄取而增强。此外, Zhang等[52]还研制出一种用癸酸钠制备的小檗碱无定形固体分散体, 不仅溶解度和溶出度显著提高, 与普通小檗碱片相比, 其体外膜渗透性增加了3倍。在Lv等[53]的研究中, 添加了癸酸钠的小檗碱的AUC令人难以置信地增加了41.1倍, 另一种吸收增强剂脱氧胆酸钠也以同样机制使小檗碱的AUC增加了35.3倍。癸酸钠对小檗碱生物利用度的提高主要是因其可增大肠上皮紧密连接和与小檗碱形成盐增加小檗碱的脂溶性, 从而提高小檗碱在肠道的渗透性。
Chen等[54]研究表明, 当配方中添加0.5%、1.5%和3.0%壳聚糖(chitosan) 时, 大鼠口服小檗碱的AUC值分别增加了1.9、2.2和2.5倍。壳聚糖可与上皮细胞表面糖蛋白的阴离子组分相互作用, 调节紧密连接, 增强药物细胞旁通透性; 其次, 壳聚糖是一种高分子聚合物, 具有黏附性, 增加了药物在黏膜表面的滞留, 进而促进小檗碱的吸收和提高其生物利用度。Godugu等[55]利用双通道喷枪技术制备了小檗碱喷雾干燥黏膜制剂, 体外Caco-2渗透性研究表明, 小檗碱的渗透显著增加。渗透促进剂甘油(glycerin) 和薄荷酮(menthone) 和间接渗透促进剂壳聚糖在改善小檗碱的渗透性方面发挥了重要作用, 与游离小檗碱相比AUC提高了6倍(由819.35提高至5 724.39 h·ng·mL-1), Cmax提高了2.46倍(由146.87提高至509.31 ng·mL-1)。Narade等[56]采用32全因子设计法, 对槲皮素对盐酸小檗碱渗透性的影响进行了合理优化, 结果表明10 mg槲皮素对低渗盐酸小檗碱的累积药物释放百分比(% cumulative drug release, %CDR) 最高可达90.91% ± 1.66%, 表明采用槲皮素作为生物促进剂有利于提高盐酸小檗碱的渗透性和口服生物利用度。以上研究表明, 渗透促进剂有利于提高药物的渗透性, 进而提高口服生物利用度。
一些特殊的纳米制剂也会提高渗透性, 如固体分散体、纳米乳和脂质体(图 3F) 等。Shi等[57]制备了小檗碱与氢化磷脂酰胆碱(HPC) 的无定形固体分散体, 在单次肠灌注实验中, 固体分散体显示了在空肠内更大的吸收速率常数和表观渗透率系数, AUC和Cmax分别提高了2.6和3.3倍。Li等[58]开发了盐酸小檗碱的水包油纳米乳液体系以提高稳定性和口服生物利用率, Caco-2细胞单层评估显示, 盐酸小檗碱的肠道通透性显著增加, 与未包封的盐酸小檗碱相比, 纳米乳液显示出440.40%的相对生物利用度, 并在6个月稳定性研究中保持稳定。Xu等[59]制备了一种新型纳米乳剂, 粒径约30 nm, 稳定性好, 细胞转运和肠道灌注研究表明, P-gp外排减少了50%, 通透性提高了5.5倍, 小檗碱的口服生物利用率提高了112% (由131.23提高至278.23 h·µg·L-1), 糖尿病小鼠血糖水平降为原来的1/3。同样, Li等[60]采用低能乳化法制备了小檗碱乳化剂体系, 该新系统在家兔体内的相对口服生物利用度比小檗碱原料药显著提高3.41倍。此外, Caco-2细胞的单层转运研究表明, 该系统有助于促进渗透和抑制外排, 在白血病小鼠模型中, 小檗碱纳米乳治疗的小鼠的存活时间明显长于小檗碱治疗的小鼠。Yin等[61]制备了粒径为160 nm的硒涂层纳米脂质载体, 口服生物利用度提高了约6.63倍。Jia等[62]研究采用超临界CO2溶液增强分散法制备了小檗碱前体脂质体, 包封率为90.3% ± 4.9%, 口服生物利用度为小檗碱原料药的22.47倍。固体分散体、纳米乳、脂质体对小檗碱渗透性的提高, 可能通过与肠道上皮细胞表面糖蛋白相互作用来调节通透性, 或者通过提高药物在肠道黏膜的滞留时间来实现。
3.3 抑制P-gp外排P-gp介导的分子外排是许多药物的主要吸收屏障, 小檗碱是P-gp蛋白的底物, 是小檗碱生物利用度低的一个主要因素[63], 因此添加P-gp抑制剂是提高小檗碱口服生物利用度常见的策略。常见的P-gp抑制剂包括TPGS、聚氧乙烯蓖麻油(cremophor EL)、泊洛萨姆(Poloxamer)、环糊精(cyclodextrinzz) 和聚乙二醇(polyethylene glycol), 此外一些具有P-gp抑制功能的天然化合物如水飞蓟素(silybum)、粉防己碱(tetrandrine) 和姜黄素(curcumin) 也是提高小檗碱生物利用度的候选化合物[64]。
Zhang等[65]将TPGS与小檗碱的磷脂复合物联合给药, 口服含2.5% TPGS的小檗碱的大鼠体内小檗碱的AUC值分别增加了约1.90和2.90倍, 且未损伤上皮和完整的绒毛结构。Sun等[66]评价了明胶对小檗碱在原位肠道吸收的影响, 结果表明, 明胶对肠道P-gp有潜在抑制作用, 吸收增强, 口服给药后具有更明显的降糖效果。在Shan等[67]的研究中, 通过P-gp抑制剂粉防己碱来提高小檗碱的吸收, 粉防己碱显著抑制Caco-2肠细胞的外排(由74.6%降至46.5%), 小檗碱的Cmax和AUC值分别增加了0.62和0.61倍, 与小檗碱单独作用相比, 显著降低了55.2%的空腹血糖。Narade等[68]研究了不同浓度(2、6和10 mg) 姜黄素对盐酸小檗碱山羊肠道通透性的影响。研究发现, 6 mg姜黄素能将盐酸小檗碱的CDR提高至23.92% ± 0.78%, 揭示了姜黄素(6 mg) 的共同给药对促进盐酸小檗碱膜通透性的有益作用, 这有望提高其生物利用度, 从而提高治疗效果, 这种作用可能归因于姜黄素对P-gp的抑制作用。
Elsheikh等[69]用2.5% w/v聚氧乙烯蓖麻油和12.5% w/w小檗碱制备了乳糜微滴, 与游离小檗碱相比, 乳糜微滴的吸收速率和程度显著增强(大于2倍)。由于外排抑制, 乳糜微滴的平均停留时间和分布容积显著增加, 肠道药物清除率降低。另外, 由于其特有的淋巴靶向性, 可绕过肝肠首过代谢而提高生物利用度。Xiong等[70]研究并开发了一种改良的Brij-S20纳米晶体制剂(BBR-BS20-NCs), 结果表明, BBR-BS20-NCs可通过对P-gp功能的短期可逆调节, 显著提高MDCK-MDR1细胞对小檗碱的摄取, 促进小檗碱在水溶液的溶解速率和释放程度, 相对于游离小檗碱的相对生物利用度为404.1%。Kwon等[48]利用普朗尼克P85 (Pluronic P85) 和Tween-80开发了一种负载小檗碱的混合胶束, 胶束制剂使小檗碱的吸收渗透率提高了364%, 外排比(即外排渗透率与吸收渗透率的比值) 从7.54降至1.05, 表明P-gp介导的小檗碱外排受到抑制, 与游离小檗碱相比, AUC提高了14.6倍。Khan等[71]以盐酸小檗碱为载体, 制备聚乳酸-羟基乙酸共聚物纳米粒。体内外对Caco-2细胞和大鼠肠道灌流实验显示渗透性提高5.5倍, P-gp外排减少50%, 对乳腺癌细胞毒性可提高14倍, 渗透性提高和外排抑制导致生物利用度提高进而提高药理活性。P-gp外排是导致小檗碱生物利用度低的一大因素, 以上研究通过使用P-gp抑制剂或者将小檗碱包裹在具有抑制外排效应的纳米制剂来提高其透过率, 进一步提高生物利用度和药理活性。
3.4 结构修饰小檗碱的化学结构对其生物活性起至关重要的作用, 如异构化已被证明对小檗碱的抗氧化活性有显著影响。许多经修饰的小檗碱衍生物或类似物具有更好生物学效应, 并有可能通过结构修饰来调节药代动力学特征和生物利用度。
Cheng等[72]合成了二氢小檗碱衍生物8, 8-二甲基二氢小檗碱盐酸盐, 提高了在肥胖和糖尿病小鼠模型中的生物利用度, 相同剂量下提高糖耐量、减轻胰岛素抵抗、降低血浆甘油三酯效果优于小檗碱和二氢小檗碱。Chen等[73]为提高小檗碱的生物利用度, 合成了3个新的9-邻糖基小檗碱衍生物, 体内药代动力学实验结果表明, 其中9-O-glycosyl-berberine效果最佳, 相比小檗碱AUC增加10.1倍(由63.42增至268.94 h·µg·L-1), 表明亲水改性可显著提高盐酸小檗碱的生物利用度。同样, Han等[74]合成了一些碳水化合物修饰的小檗碱衍生物, 在细胞毒性实验中, 甘露糖修饰的小檗碱衍生物的效价(IC50值) 是小檗碱的1.5倍。体外葡萄糖消耗实验表明, 甘露糖修饰的小檗碱衍生物也显示出潜在抗糖尿病活性, 经甘露糖修饰后的衍生物溶解度提高, 有利于生物利用度的提高。碳水化合物结构已被证明可提高药物的生物利用度, 增强药物的受体结合亲和力, Wang等[75]利用双糖基对小檗碱进行结构修饰, 结果表明, 以碳水化合物基团修饰小檗碱可得到具有较好抗糖尿病活性的衍生物, 尤其是二葡萄糖修饰的小檗碱衍生物, 即使在很低浓度下, 也能显著提高斑马鱼的摄取。Shan等[76]的研究合成了小檗碱类似物伪小檗碱(IMB-Y53), 证明其对P-gp具有低亲和力。在Caco-2细胞中, IMB-Y53的保留时间明显长于小檗碱, 等剂量给药IMB-Y53的Cmax和AUC值分别为小檗碱的1.61的2.27倍, IMB-Y53在培养细胞中以与小檗碱相似的程度刺激葡萄糖的利用。小檗碱衍生物有与小檗碱相似或更强的药理活性, 并通过结构修饰改造其代谢特征, 提高生物利用度, 是小檗碱特有治疗策略的候选药物, 但在生物利用度和分布方面仍需与小檗碱进行确切的比较。
4 小檗碱毒性研究小檗碱的毒性效应通常用半数致死量(median lethal dose, LD50) 表示, 因给药生物和给药途径而异。在Singh等[77]的研究中, 纯小檗碱通过腹腔给药的LD50为23 mg·kg-1, 而口服给药的LD50为329 mg·kg-1。对于大鼠, 硫酸小檗碱经腹腔注射的LD50是205 mg·kg-1; 对于猫, 硫酸小檗碱口服剂量达到50 mg·kg-1就会出现大肠和小肠出血性炎症, 口服剂量在100 mg·kg-1可在6~8 h内引起猫呕吐, 同样剂量持续8~10天可致命。Mahmoudi等[78]研究了小檗碱对小鼠的免疫毒性作用, 5 mg·kg-1可影响淋巴细胞增殖, 还可观察到延迟型超敏反应, 而10 mg·kg-1可抑制体液和细胞免疫功能。根据一项临床研究[79], 当T2DM患者服用500 mg剂量的小檗碱, 每天3次, 持续13周时, 34.5%的患者报告了便秘、腹泻、腹痛、肠胃气胀等各种胃肠道不良反应。当暴露于UV-A辐射时, 小檗碱(50 μmol·L-1) 会导致人角质形成细胞活力下降80%, 并以单链断裂形式造成DNA损伤, 导致光毒性和遗传毒性。小檗碱可致心脏毒性, 导致功能性心跳过缓。根据临床病例研究[80], 一名53岁男性在开始使用含小檗碱产品治疗高胆固醇血症6天后, 因疲劳、呼吸困难和心动过缓而入院。因此, 本病例研究提示, 对于迷走神经张力高的患者, 应仔细权衡小檗碱的使用, 因为该药具有心脏收缩和抗心律失常的特性, 可能导致心律失常, 使患者暴露于潜在的健康风险。
5 总结与展望目前人们对天然衍生产品的兴趣不断增长, 大量研究从天然产物中发现了具有极高药用价值的化合物。小檗碱是一种多功能药物, 具有止泻、降糖、降血脂、抗癌和抗菌等广泛药理活性, 其极低的口服生物利用度限制了临床应用。小檗碱口服生物利用率低的主要因素为溶解度和渗透性差、P-gp介导的外排和肝肠代谢。为解决这一问题, 研究者已提出了多种策略, 包括各种纳米递送系统提高溶解度和渗透性、渗透促进剂和P-gp抑制剂、结构修饰以改变药代动力学特征, 结果显示各种策略下小檗碱的口服生物利用度和药理活性都有不同程度的提高。因此, 将具有多种治疗潜力的小檗碱及其衍生物转化为一种技术商业化和符合要求的产品是很有潜力的。
小檗碱通过对特定酶、受体和细胞信号通路的不同影响而产生广泛的药理活性, 其产生药理活性的作用机制不同于有些临床药物, 通过与临床上应用的药物联用, 可产生协同作用, 有待进一步研究。小檗碱还可通过调节肠道微生物区系紊乱来改善代谢, 提示其对代谢性疾病有较好治疗效果。小檗碱在人体内的分子机制尚未完全揭示, 对人体的具体靶点和作用机制尚不清楚, 还需更深入的临床研究来支持小檗碱的临床应用。
在临床研究中, 小檗碱的长期安全性是建立在较低的生物利用度的基础上, 为提高小檗碱的摄取而改变整个肠道的上皮运输特性可能会带来不良反应, 如肠道免疫系统从营养物质中识别毒素的能力受损。毒理学研究表明, 小檗碱对胃肠道功能、免疫功能和心脏等都具有一定毒性, 还需更多的长期临床试验来更好地确定小檗碱的人体安全性。美国食品和药物管理局尚未批准纯小檗碱用于处方或非处方药物使用。各种提高小檗碱口服生物利用度的策略只在动物和细胞层面进行了验证, 缺乏有力的临床研究结果。建议开展高质量、精心设计、大规模、多中心的临床试验, 以评价小檗碱的安全性、毒理学特征和临床应用价值, 大规模开发小檗碱制剂, 增强药理作用, 减少小檗碱的口服剂量, 从而最大限度地减少不良反应。
作者贡献: 周剑雄主要负责论文撰写、图形绘制、格式修改及论文投稿; 吴送姑、龚俊波和魏振平主要负责论文的构思、修改和审核。
利益冲突: 本论文中不涉及任何利益冲突。
| [1] |
Chen L, Zhu L, Chen JL, et al. Crystal structure-guided design of berberine-based novel chitinase inhibitors[J]. J Enzyme Inhib Med Chem, 2020, 35: 1937-1943. DOI:10.1080/14756366.2020.1837123 |
| [2] |
Parth P. A bird's eye view on a therapeutically 'wonder molecule': berberine[J]. Phytomedicine Plus, 2021, 1: 100070. DOI:10.1016/j.phyplu.2021.100070 |
| [3] |
Rabbani GH, Butler T, Knight J, et al. Randomized controlled trial of berberine sulfate therapy for diarrhea due to enterotoxigenic Escherichia coli and Vibrio cholerae[J]. J Infect Dis, 1987, 155: 979-984. DOI:10.1093/infdis/155.5.979 |
| [4] |
Di Pierro F, Bertuccioli A, Giuberti R, et al. Role of a berberine-based nutritional supplement in reducing diarrhea in subjects with functional gastrointestinal disorders[J]. Minerva Gastroenterol Dietol, 2020, 66: 29-34. |
| [5] |
Yu M, Jin X, Liang C, et al. Berberine for diarrhea in children and adults: a systematic review and meta-analysis[J]. Ther Adv Gastroenterol, 2020, 13: 1756284820961299. |
| [6] |
Dubreuil JD. Antibacterial and antidiarrheal activities of plant products against enterotoxinogenic Escherichia coli[J]. Toxins, 2013, 5: 2009-2041. DOI:10.3390/toxins5112009 |
| [7] |
Raju M, Kulkarni YA, Wairkar S. Therapeutic potential and recent delivery systems of berberine: a wonder molecule[J]. J Funct Foods, 2019, 61: 103517. DOI:10.1016/j.jff.2019.103517 |
| [8] |
Zhang XM, Yang YS, Gang S, et al. Berberine-, allicin- or clarithromycin-based triple therapy for the first-line treatment of Helicobacter pylori infection: an open-label, randomized trial[J]. Gastroenterology, 2014, 146: S398. |
| [9] |
Lin Y, Si SY, Jiang JD. Antibacterial activity of berberine[J]. Acta Pharm Sin (药学学报), 2018, 53: 163-168. |
| [10] |
Du GF, Le YJ, Sun X, et al. Proteomic investigation into the action mechanism of berberine against Streptococcus pyogenes[J]. J Proteomics, 2020, 215: 103666. DOI:10.1016/j.jprot.2020.103666 |
| [11] |
Gupta S, Gupta R, Gupta J. Evaluation of pharmacodynamic interaction between berberine and antibacterial drug (azithromycin) in albino Wistar rats[J]. Curr Trends Biotechnol Pharm, 2021, 15: 256-267. |
| [12] |
Zhou J, Pan J, Xiang Z, et al. Xiaokeyinshui extract combination, a berberine-containing agent, exerts anti-diabetic and renal protective effects on rats in multi-target mechanisms[J]. J Ethnopharmacol, 2020, 262: 113098. DOI:10.1016/j.jep.2020.113098 |
| [13] |
Feng X, Sureda A, Jafari S, et al. Berberine in cardiovascular and metabolic diseases: from mechanisms to therapeutics[J]. Theranostics, 2019, 9: 1923-1951. DOI:10.7150/thno.30787 |
| [14] |
Di S, Han L, An X, et al. In silico network pharmacology and in vivo analysis of berberine-related mechanisms against type 2 diabetes mellitus and its complications[J]. J Ethnopharmacol, 2021, 276: 114180. DOI:10.1016/j.jep.2021.114180 |
| [15] |
Kong W, Wei J, Abidi P, et al. Berberine is a promising novel cholesterol-lowering drug working through a unique mechanism distinct from statins[J]. Nat Med, 2004, 10: 1344-1351. DOI:10.1038/nm1135 |
| [16] |
Li DD, Yu P, Xiao W, et al. Berberine: a promising natural isoquinoline alkaloid for the development of hypolipidemic drugs[J]. Curr Top Med Chem, 2020, 20: 2634-2647. DOI:10.2174/1568026620666200908165913 |
| [17] |
Gonnelli S, Caffarelli C, Stolakis K, et al. Efficacy and tolerability of a nutraceutical combination (red yeast rice, policosanols, and berberine) in patients with low-moderate risk hypercholesterolemia: a double-blind, placebo-controlled study[J]. Curr Ther Res Clin Exp, 2015, 77: 1-6. DOI:10.1016/j.curtheres.2014.07.003 |
| [18] |
Li G, Zhao M, Qiu F, et al. Pharmacokinetic interactions and tolerability of berberine chloride with simvastatin and fenofibrate: an open-label, randomized, parallel study in healthy Chinese subjects[J]. Drug Des, Dev Ther, 2019, 13: 129-139. |
| [19] |
Natalia BM, Gabriela CS, Juan CRB, et al. Natural compounds as modulators of cell cycle arrest: application for anticancer chemotherapies[J]. Curr Genomics, 2017, 18: 106-131. DOI:10.2174/1389202917666160808125645 |
| [20] |
Habtemariam S. Recent advances in berberine inspired anticancer approaches: from drug combination to novel formulation technology and derivatization[J]. Molecules, 2020, 25: 1426-1456. DOI:10.3390/molecules25061426 |
| [21] |
Liu B, Wang GS, Yang J, et al. Berberine inhibits human hepatoma cell invasion without cytotoxicity in healthy hepatocytes[J]. PLoS One, 2011, 6: e21416. DOI:10.1371/journal.pone.0021416 |
| [22] |
Wang LH, Liu LP, Shi Y, et al. Berberine induces caspase-independent cell death in colon tumor cells through activation of apoptosis-inducing factor[J]. PLoS One, 2012, 7: e36468. DOI:10.1371/journal.pone.0036468 |
| [23] |
Samadi P, Sarvarian P, Gholipour E, et al. Berberine: a novel therapeutic strategy for cancer[J]. IUBMB Life, 2020, 72: 2065-2079. DOI:10.1002/iub.2350 |
| [24] |
Park SH, Sung JH, Kim EJ, et al. Berberine induces apoptosis via ROS generation in PANC-1 and MIA-PaCa2 pancreatic cell lines[J]. Braz J Med Biol Res, 2015, 48: 111-119. DOI:10.1590/1414-431x20144293 |
| [25] |
Spinozzi S, Colliva C, Camborata C, et al. Berberine and its metabolites: relationship between physicochemical properties and plasma levels after administration to human subjects[J]. J Nat Prod, 2014, 77: 766-772. DOI:10.1021/np400607k |
| [26] |
Liao Z, Xie Y, Zhou B, et al. Berberine ameliorates colonic damage accompanied with the modulation of dysfunctional bacteria and functions in ulcerative colitis rats[J]. Appl Microbiol Biotechnol, 2020, 104: 1737-1749. DOI:10.1007/s00253-019-10307-1 |
| [27] |
Xu X, Gao Z, Yang F, et al. Antidiabetic effects of Gegen Qinlian Decoction via the gut microbiota are attributable to its key ingredient berberine[J]. Genomics, Proteomics Bioinf, 2020, 18: 721-736. DOI:10.1016/j.gpb.2019.09.007 |
| [28] |
Shi YF, Hu JX, Geng J, et al. Berberine treatment reduces atherosclerosis by mediating gut microbiota in apoE-/- mice[J]. Biomed Pharmacother, 2018, 107: 1556-1563. DOI:10.1016/j.biopha.2018.08.148 |
| [29] |
Pan HJ, Li ZF, Xie J, et al. Berberine influences blood glucose via modulating the gut microbiome in grass carp[J]. Front Microbiol, 2019, 10: 1066. DOI:10.3389/fmicb.2019.01066 |
| [30] |
Cui HX, Hu YN, Li JW, et al. Hypoglycemic mechanism of the berberine organic acid salt under the synergistic effect of intestinal flora and oxidative stress[J]. Oxid Med Cell Longevity, 2018, 2018: 8930374. |
| [31] |
Yang S, Li D, Yu Z, et al. Multi-pharmacology of berberine in atherosclerosis and metabolic diseases: potential contribution of gut microbiota[J]. Front Pharmacol, 2021, 12: 709629. DOI:10.3389/fphar.2021.709629 |
| [32] |
Liu YT, Hao HP, Xie HG, et al. Extensive intestinal first-pass elimination and predominant hepatic distribution of berberine explain its low plasma levels in rats[J]. Drug Metab Dispos, 2010, 38: 1779-1784. DOI:10.1124/dmd.110.033936 |
| [33] |
Chen W, Miao YQ, Fan DJ, et al. Bioavailability study of berberine and the enhancing effects of TPGS on intestinal absorption in rats[J]. AAPS Pharmscitech, 2011, 12: 705-711. DOI:10.1208/s12249-011-9632-z |
| [34] |
Tan XS, Ma JY, Feng R, et al. Tissue distribution of berberine and its metabolites after oral administration in rats[J]. PLoS One, 2013, 8: e77969. DOI:10.1371/journal.pone.0077969 |
| [35] |
Chen J, Zhang Yl, Dong Y, et al. Enzyme reaction kinetics, metabolic enzyme phenotype, and metabolites of berberine[J]. Chin Tradit Herb Drugs (中草药), 2013, 44: 3334-3340. |
| [36] |
Ma JY, Feng R, Tan XS, et al. Excretion of berberine and its metabolites in oral administration in rats[J]. J Pharm Sci, 2013, 102: 4181-4192. DOI:10.1002/jps.23718 |
| [37] |
Wang GH, Wang JY, Huang J, et al. Solid dispersion of berberine hydrochloride and Eudragit S100: formulation and physicochemical characterization[J]. J Shenyang Pharm Univ (沈阳药科大学学报), 2019, 36: 1-6. |
| [38] |
Gao J, Fan D, Song P, et al. Preparation and application of pH-responsive composite hydrogel beads as potential delivery carrier candidates for controlled release of berberine hydrochloride[J]. R Soc Open Sci, 2020, 7: 200676. DOI:10.1098/rsos.200676 |
| [39] |
Marino M, Gardana C, Scialpi A, et al. An in vitro approach to study the absorption of a new oral formulation of berberine[J]. PharmaNutrition, 2021, 18: 100279. DOI:10.1016/j.phanu.2021.100279 |
| [40] |
Zhu JX, Tang D, Feng L, et al. Development of self-microemulsifying drug delivery system for oral bioavailability enhancement of berberine hydrochloride[J]. Drug Dev Ind Pharm, 2013, 39: 499-506. DOI:10.3109/03639045.2012.683875 |
| [41] |
Pund S, Borade G, Rasve G. Improvement of anti-inflammatory and anti-angiogenic activity of berberine by novel rapid dissolving nanoemulsifying technique[J]. Phytomedicine, 2014, 21: 307-314. DOI:10.1016/j.phymed.2013.09.013 |
| [42] |
Meng ZJ, Zhang M, Wei SN, et al. Amorphous solid dispersion of berberine with absorption enhancer demonstrates a remarkable hypoglycemic effect via improving its bioavailability[J]. Int J Pharm, 2014, 467: 50-59. DOI:10.1016/j.ijpharm.2014.03.017 |
| [43] |
Mishra R, Dhole S. Lipid-based floating multiparticulate delivery system for bioavailability enhancement of berberine hydrochloride[J]. J Appl Pharm Sci, 2019, 9: 36-47. DOI:10.7324/JAPS.2019.91105 |
| [44] |
Sahibzada MUK, Sadiq A, Faidah HS, et al. Berberine nanoparticles with enhanced in vitro bioavailability: characterization and antimicrobial activity[J]. Drug Des Devel Ther, 2018, 12: 303-312. DOI:10.2147/DDDT.S156123 |
| [45] |
Sahibzada MUK, Zahoor M, Sadiq A, et al. Bioavailability and hepatoprotection enhancement of berberine and its nanoparticles prepared by liquid antisolvent method[J]. Saudi J Biol Sci, 2021, 28: 327-332. DOI:10.1016/j.sjbs.2020.10.006 |
| [46] |
Wang ZP, Wu JB, Zhou Q, et al. Berberine nanosuspension enhances hypoglycemic efficacy on streptozotocin induced diabetic C57BL/6 mice[J]. Evid Based Complement Alternat Med, 2015, 2015: 239749. |
| [47] |
Shen R, Kim JJ, Yao M, et al. Development and evaluation of vitamin E D-α-tocopheryl polyethylene glycol 1000 succinate-mixed polymeric phospholipid micelles of berberine as an anticancer nanopharmaceutical[J]. Int J Nanomed, 2016, 11: 1687-1700. |
| [48] |
Kwon M, Lim DY, Lee CH, et al. Enhanced intestinal absorption and pharmacokinetic modulation of berberine and its metabolites through the inhibition of P-glycoprotein and intestinal metabolism in rats using a berberine mixed micelle formulation[J]. Pharmaceutics, 2020, 12: 882. DOI:10.3390/pharmaceutics12090882 |
| [49] |
Gupta L, Sharma AK, Gothwal A, et al. Dendrimer encapsulated and conjugated delivery of berberine: a novel approach mitigating toxicity and improving in vivo pharmacokinetics[J]. Int J Pharm, 2017, 528: 88-99. DOI:10.1016/j.ijpharm.2017.04.073 |
| [50] |
Wang A, Yang W, Yang X, et al. MgAl monolayer hydrotalcite increases the hypoglycemic effect of berberine by enhancing its oral bioavailability[J]. Biomed Pharmacother, 2020, 127: 110140. DOI:10.1016/j.biopha.2020.110140 |
| [51] |
Liu CS, Zheng YR, Zhang YF, et al. Research progress on berberine with a special focus on its oral bioavailability[J]. Fitoterapia, 2016, 109: 274-282. DOI:10.1016/j.fitote.2016.02.001 |
| [52] |
Zhang M, Lv XY, Li J, et al. Sodium caprate augments the hypoglycemic effect of berberine via AMPK in inhibiting hepatic gluconeogenesis[J]. Mol Cell Endocrinol, 2012, 363: 122-130. DOI:10.1016/j.mce.2012.08.006 |
| [53] |
Lv XY, Li J, Zhang M, et al. Enhancement of sodium caprate on intestine absorption and antidiabetic action of berberine[J]. AAPS PharmSciTech, 2010, 11: 372-382. DOI:10.1208/s12249-010-9386-z |
| [54] |
Chen W, Fan DJ, Meng LK, et al. Enhancing effects of chitosan and chitosan hydrochloride on intestinal absorption of berberine in rats[J]. Drug Dev Ind Pharm, 2012, 38: 104-110. DOI:10.3109/03639045.2011.592531 |
| [55] |
Godugu C, Patel AR, Doddapaneni R, et al. Approaches to improve the oral bioavailability and effects of novel anticancer drugs berberine and betulinic acid[J]. PLoS One, 2014, 9: e89919. DOI:10.1371/journal.pone.0089919 |
| [56] |
Narade S, Pore Y. Optimization of ex vivo permeability characteristics of berberine in presence of quercetin using 32 full factorial design[J]. J Appl Pharm Sci, 2019, 9: 73-82. |
| [57] |
Shi CY, Tong Q, Fang JG, et al. Preparation, characterization and in vivo studies of amorphous solid dispersion of berberine with hydrogenated phosphatidylcholine[J]. Eur J Pharm Sci, 2015, 74: 11-17. DOI:10.1016/j.ejps.2015.04.001 |
| [58] |
Li YJ, Hu XB, Lu XL, et al. Nanoemulsion-based delivery system for enhanced oral bioavailability and Caco-2 cell monolayers permeability of berberine hydrochloride[J]. Drug Deliv, 2017, 24: 1868-1873. DOI:10.1080/10717544.2017.1410257 |
| [59] |
Xu HY, Liu CS, Huang CL, et al. Nanoemulsion improves hypoglycemic efficacy of berberine by overcoming its gastrointestinal challenge[J]. Colloids Surf B Biointerfaces, 2019, 181: 927-934. DOI:10.1016/j.colsurfb.2019.06.006 |
| [60] |
Li J, Yang L, Shen R, et al. Self-nanoemulsifying system improves oral absorption and enhances anti-acute myeloid leukemia activity of berberine[J]. J Nanobiotechnol, 2018, 16: 76-88. DOI:10.1186/s12951-018-0402-x |
| [61] |
Yin JT, Hou YT, Yin YY, et al. Selenium-coated nanostructured lipid carriers used for oral delivery of berberine to accomplish a synergic hypoglycemic effect[J]. Int J Nanomed, 2017, 12: 8671-8680. DOI:10.2147/IJN.S144615 |
| [62] |
Jia JF, Zhang KR, Zhou X, et al. Berberine-loaded solid proliposomes prepared using solution enhanced dispersion by supercritical CO2: sustained release and bioavailability enhancement[J]. J Drug Delivery Sci Technol, 2019, 51: 356-363. DOI:10.1016/j.jddst.2019.03.021 |
| [63] |
Zhang YT, Yu YQ, Yan XX, et al. Different structures of berberine and five other protoberberine alkaloids that affect P-glycoprotein-mediated efflux capacity[J]. Acta Pharmacol Sin, 2019, 40: 133-142. DOI:10.1038/s41401-018-0183-7 |
| [64] |
Dewanjee S, Dua TK, Bhattacharjee N, et al. Natural products as alternative choices for P-glycoprotein (P-gp) inhibition[J]. Molecules, 2017, 22: 871. DOI:10.3390/molecules22060871 |
| [65] |
Zhang ZH, Chen Y, Deng J, et al. Solid dispersion of berberine-phospholipid complex/TPGS 1000/SiO2: preparation, characterization and in vivo studies[J]. Int J Pharm, 2014, 465: 306-316. DOI:10.1016/j.ijpharm.2014.01.023 |
| [66] |
Sun J, Bao H, Peng Y, et al. Improvement of intestinal transport, absorption and anti-diabetic efficacy of berberine by using Gelucire44/14: in vitro, in situ and in vivo studies[J]. Int J Pharm, 2018, 544: 46-54. DOI:10.1016/j.ijpharm.2018.04.014 |
| [67] |
Shan YQ, Zhu YP, Pang J, et al. Tetrandrine potentiates the hypoglycemic efficacy of berberine by inhibiting P-glycoprotein function[J]. Biol Pharm Bull, 2013, 36: 1562-1569. DOI:10.1248/bpb.b13-00272 |
| [68] |
Narade S, Pore Y. Assessment of permeability berberine chloride across goat intestinal membrane in presence of natural biopotentiator curcumin[J]. Indian Drugs, 2021, 58: 23-27. DOI:10.53879/id.58.04.12162 |
| [69] |
Elsheikh MA, Elnaggar YSR, Hamdy DA, et al. Novel cremochylomicrons for improved oral bioavailability of the antineoplastic phytomedicine berberine chloride: optimization and pharmacokinetics[J]. Int J Pharm, 2018, 535: 316-324. DOI:10.1016/j.ijpharm.2017.11.023 |
| [70] |
Xiong W, Sang W, Linghu KG, et al. Dual-functional Brij-S20-modified nanocrystal formulation enhances the intestinal transport and oral bioavailability of berberine[J]. Int J Nanomed, 2018, 13: 3781-3793. DOI:10.2147/IJN.S163763 |
| [71] |
Khan I, Joshi G, Nakhate KT, et al. Nano-co-delivery of berberine and anticancer drug using PLGA nanoparticles: exploration of better anticancer activity and in vivo kinetics[J]. Pharm Res, 2019, 36: 149-165. DOI:10.1007/s11095-019-2677-5 |
| [72] |
Cheng Z, Chen AF, Wu F, et al. 8, 8-Dimethyldihydroberberine with improved bioavailability and oral efficacy on obese and diabetic mouse models[J]. Bioorg Med Chem, 2010, 18: 5915-5924. DOI:10.1016/j.bmc.2010.06.085 |
| [73] |
Chen Z, Ye XL, Yi J, et al. Synthesis of 9-O-glycosyl-berberine derivatives and bioavailability evaluation[J]. Med Chem Res, 2011, 21: 1641-1646. |
| [74] |
Han LW, Sheng WL, Li XB, et al. Novel carbohydrate modified berberine derivatives: synthesis and in vitro anti-diabetic investigation[J]. MedChemComm, 2019, 10: 598-605. DOI:10.1039/C9MD00036D |
| [75] |
Wang L, Kong H, Jin M, et al. Synthesis of disaccharide modified berberine derivatives and their anti-diabetic investigation in zebrafish using a fluorescence-based technology[J]. Org Biomol Chem, 2020, 18: 3563-3574. DOI:10.1039/D0OB00327A |
| [76] |
Shan YQ, Ren G, Wang YX, et al. Berberine analogue IMB-Y53 improves glucose-lowering efficacy by averting cellular efflux especially P-glycoprotein efflux[J]. Metabolism, 2013, 62: 446-456. DOI:10.1016/j.metabol.2012.09.009 |
| [77] |
Singh N, Sharma B. Toxicological effects of berberine and sanguinarine[J]. Front Mol Biosci, 2018, 5: 21. DOI:10.3389/fmolb.2018.00021 |
| [78] |
Mahmoudi M, Rabe SZT, Balali Mood M, et al. Immunotoxicity induced in mice by subacute exposure to berberine[J]. J Immunotoxicol, 2016, 13: 255-262. DOI:10.3109/1547691X.2015.1058306 |
| [79] |
Rad SZK, Rameshrad M, Hosseinzadeh H. Toxicology effects of Berberis vulgaris (barberry) and its active constituent, berberine: a review[J]. Iran J Basic Med Sci, 2017, 20: 516-529. |
| [80] |
Cannillo M, Frea S, Fornengo C, et al. Berberine behind the thriller of marked symptomatic bradycardia[J]. World J Cardiol, 2013, 5: 261-264. DOI:10.4330/wjc.v5.i7.261 |
 2022, Vol. 57
2022, Vol. 57


