2. 太和康美中医研究院有限公司, 北京 102400;
3. 植然天成生物科技有限公司, 北京 101299;
4. 北京东方淼森生物科技有限公司, 北京 101299
2. Taihe Kangmei Chinese Medicine Research Institute Co., Ltd., Beijing 102400, China;
3. Zhiran Tiancheng Biotechnology Co., Ltd., Beijing 101299, China;
4. Beijing Oriental Miaosen Biotechnology Co., Ltd., Beijing 101299, China
天然来源的小分子化合物一直被认为是创新药物的重要源泉, 尤其是从中药分离发现的小分子化合物, 已引起国内外学者广泛关注。然而, 当前的瓶颈是这些经过充分研究且具有确切生物活性的中药小分子化合物在向临床转化的过程中, 由于溶解度差、稳定性不理想、缺少作用部位靶向性、生物利用度低等原因, 限制了其发挥真正的临床疗效。近年来, 国内外学者专注于以各类载体为基础的药物递送系统来提高天然小分子的溶解度、稳定性、靶向性等, 已有许多含有中药复合物的超分子载药系统成功研制, 用于修复伤口、抗菌、抗肿瘤等[1, 2]。
2021年1月7日, 国家卫健委正式批准透明质酸(hyaluronic acid, HA) 作为新食品原料在普通食品中添加使用, 使HA作为一种口服原料再次得到人们关注, HA口服途径的开发势必将会扩大其使用范围, 增大其使用价值, 推动医药行业的发展。此前, HA由于良好的生物相容性、可降解性、亲水性、肿瘤靶向性、黏性等特性, 在医疗保健、生物材料和化妆品行业发挥着重要作用。在化妆品领域, HA作为天然保湿因子载中药小分子化合物广泛应用于化妆品的增稠、修复、防晒、润滑和抗菌消炎等方面[3]; 在医药领域, 研究者利用HA作为载体为中药小分子化合物更好应用于临床做出了很多探索性工作。本综述针对国内外研究成果, 对HA的来源、特征等进行了初步总结, 并结合实例讨论了HA对改善中药小分子的溶解度、生物利用度、靶向性、改变剂型等功能改进方面的研究, 以期为中药小分子化合物和HA更好地开发和应用于临床带来启发。
1 HA概述 1.1 HA的来源HA又称玻璃酸、玻尿酸, 是由D-葡萄糖醛酸和N-乙酰氨基葡萄糖之间通过β-(1, 4) 和β-(1, 3) 糖苷键交替构成的高分子质量长链酸性黏多糖(图 1), 于1934年由Meyer等[4]从牛眼玻璃体中分离得到。HA是细胞外基质的主要成分, 由HA合成酶在细胞质膜上合成后再被排到细胞外基质中, 广泛存在于脊椎动物的上皮细胞和结缔组织如皮肤、关节液、玻璃体等, 维持着细胞和组织的机械完整性、稳定性和黏弹性, 并对其起着润滑作用[5, 6]。HA的工业合成主要包括动物组织萃取法、微生物发酵法和化学合成法, 其中, 医药注射级HA主要采用微生物发酵法。作为一种内源性的高分子多糖, HA不仅易降解、无不良反应、生物相容性好、安全性高, 还具有黏性、流变性、水合作用, 广泛应用于药物递送系统。
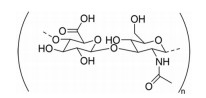
|
Figure 1 Chemical structural units of hyaluronic acid (HA) |
HA易溶于水, 具有良好的水合作用, 水溶液具有较大黏性, 可通过化学修饰或物理交联制备水凝胶用于药物载体。在HA分子结构中, D-葡萄糖醛酸上羧酸的羰基为吸电子基团, 羟基为供电子基团, N-乙酰氨基葡萄糖上乙酰氨基的羰基为吸电子基团, 氨基为供电子基团, 由于吸电子基团和供电子集团间的静电引力, HA分子之间相互交联, 在微观结构上可形成具有孔径的结构单元(图 2A、B), 从而使HA双分子链间相互交联形成网状结构(图 2C), 该结构有利于小分子药物的黏附和包载[7]。
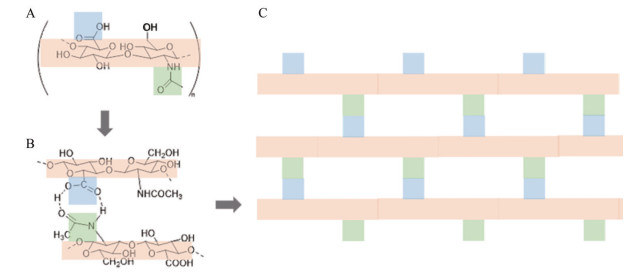
|
Figure 2 A: Structural formula of HA. B: Hydrogen bond between carboxyl group and acetyl group. C: Schematic diagram of HA network |
由于自身的羧基和其他基团, HA带负电荷, 属于阴离子聚糖, 常与细胞外的Na+、Ca2+、Mg2+、K+等阳离子结合, 这使得HA作为一种药物载体具有巨大优势。在体外, 表面高电位有利于纳米粒在溶液中悬浮, 避免产生聚集或沉淀; 在体内, 表面负电荷会导致HA修饰的药物与带负电荷的血清蛋白之间产生排斥力, 从而延长纳米载体的血浆半衰期。研究发现, 阳离子药物载体在全身给药后往往会非特异性地与不同细胞结合, 而采用阴离子载体可减少非特异性的不良反应[8]。因此, HA可避免正电荷与生物体内细胞引起非特异性结合, 从而延长了药物在体内的循环时间。此外, 由于HA自身带负电荷, 可与壳聚糖(阳离子聚糖) 相互作用形成网状结构用于包载药物[9]。
1.2.3 具有多种分子质量HA具有不同的分子质量, 高分子质量(200~2 000 kDa) 主要是在初始形成时产生[10], 在HA酶、机械力和氧化应激作用力下逐渐被分解变短, 生成低分子质量HA (<120 kDa) 和多种HA低聚物, 不同分子质量的HA往往具有不同的功能和作用。
高分子质量HA具有大分子效应, 其水黏性使其可吸附自身重量1 000倍的水, HA水合基质在体内可促进细胞运动和增殖, 进一步促进细胞再生、迁移以及伤口愈合的组织重塑, 高分子质量HA还可与细胞表面受体结合从而促进一系列细胞反应进程。
有报道称低分子质量HA可激活树突细胞并促进其成熟, 促进多种炎症因子如IL-1β、TNF-α、IL-6和IL-12[11], 促进趋化因子表达和细胞分化[10]。低分子质量HA还可促进巨噬细胞及其他细胞一氧化氮的合成, 短链的低分子质量HA可促进软骨细胞、纤维原细胞和内皮细胞的增殖和扩散。
1.2.4 靶向性HA具有靶向性, 可与癌细胞表面过表达的蛋白受体CD44、RHAMM和Neurocan特异性结合, 其中CD44是近年来科学界最关注的干细胞样细胞受体(跨膜糖蛋白) 之一。CD44受体作为多种肿瘤细胞类型检测的主要生物标志物如肝细胞癌、乳腺癌、卵巢癌等[12], 与癌症产生、转移、淋巴结浸润和恶性肿瘤的发展息息相关。HA和CD44的相互作用通过刺激一系列信号通路, 导致癌细胞的黏附、转移和生长, 同时也被证明在改善抗癌药物的耐药性方面发挥关键作用[13]。HA可使抗肿瘤药物靶向异常基因和癌细胞, 同时其固有特性包括非免疫原性、亲水性和生物安全性, 可减少药物脱靶所导致的不良反应, 在开发抗肿瘤药物方面得到了广泛的研究[7, 14, 15]。
2 基于HA超分子特性对中药小分子的功能改进中医药经过几千年的临床实践, 其疗效已得到广泛认可, 随着提取分离技术的发展, 越来越多的小分子化合物被发现和应用, 其中一些中药小分子化合物由于具有显著药效学活性得到了广泛关注和研究。但这些小分子化合物常具有溶解性差、生物利用度低等缺陷难以完全发挥其药效。近年来, 研究者致力于通过多种方法改善其性质, 例如通过多种载体制备不同剂型从而扩大中药小分子化合物的疗效及应用范围, 其中, 利用HA作为载体显著地改善中药小分子化合物的溶解度、生物利用度、靶向性等, 广泛应用于多种疾病如癌症、关节炎、皮肤伤口炎症等, 不仅如此, HA本身的药效学活性具有协调增效作用, 这为中药小分子化合物更好地应用于临床提供了基础。
2.1 增加中药小分子的溶解度从中药中提取分离得到的中药小分子化合物具有生物安全性和显著的药效学活性, 但由于其较差的溶解性, 目前仍未在临床得到充分使用。利用HA可显著提高被载药物的亲水性, 从而增加小分子化合物的溶解性。
姜黄素是一种二酮类化合物, 常从姜科、天南星科中的一些植物如郁金(Curcuma aromatica Salisb.)、姜黄(C. longa L.)、莪术[C. zedoaria (Berg.) Rosc.]、菖蒲(Acorus calamus L.) 等的根茎中提取, 具有抗炎、抗菌、抗氧化和抗肿瘤等多种药理活性, 有研究表明姜黄素可抑制癌细胞分化、生长、血管生成和新陈代谢, 但其较差的溶解性制约了治疗潜力的进一步发展; Lai等[16]将亲水性的HA和亲脂性的姜黄素通过自组装的方法结合在一起制备生成聚合纳米粒, 制备出的纳米粒显著改善了姜黄素的溶解性, 通过CD44受体介导的细胞内吞作用从而被乳腺癌细胞(MCF-7) 和4TI有效内化达到抗肿瘤疗效, 由于其pH敏感性, 在酸性溶酶体环境中成功释放姜黄素用于癌症治疗。体内抗肿瘤实验表明, 与单独使用姜黄素相比, 加入HA的姜黄素络合物可有效增加药物在肿瘤位点的聚集, 从而有效抑制肿瘤生长。人参为五加科植物人参(Panax ginseng C.A.Mey.) 的干燥根, 含有多种人参皂苷、蛋白质和多糖, 其中齐墩果酸、熊果酸、人参皂苷Rg3已被证明具有确切的抗肿瘤活性, 但其水溶性差使其临床使用价值受到限制。孙爽等[17, 18]用HA包裹齐墩果酸、熊果酸、人参皂苷Rg3生成纳米脂质体, 增加药物的溶解度, 延长药物在体内的循环时间, 同时改善药物在体内的分布情况, 从而在提高药物疗效的同时降低不良反应。小檗碱是由多种中药如黄连(Coptidis rhizoma)、黄柏(Cortex phellodendri) 分离得到的异喹啉类生物碱, 小檗碱对各种癌细胞具有抑制作用, 主要通过诱导细胞凋亡和细胞周期阻滞, 并通过多种途径调控抑制细胞迁移和侵袭。虽然小檗碱具有良好的抗肿瘤性能, 但由于其水溶性较差, 有效浓度较低, 在肿瘤部位吸收受限, 因此其作为抗癌化合物的应用受到限制。此外, 肌肉注射和静脉注射小檗碱引起的过敏性休克和药物皮疹的发生率进一步限制了其使用, Bhatnagar等[19]为促进小檗碱对CD44阳性肿瘤细胞的特异性靶向和清除, 制备了HA接枝聚乳酸-羟基乙酸共聚物纳米粒。通过体外研究表明, 纳米粒负载的小檗碱与小檗碱单独治疗相比, 纳米粒中的小檗碱在MCF-7细胞中的释放速度更快, 对肿瘤细胞毒性增加, 具有显著的抗癌活性(图 3)。
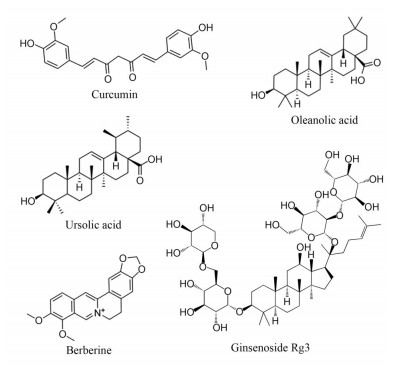
|
Figure 3 Structural formulae of small molecule compounds of traditional Chinese medicine (TCM) |
中药小分子进入人体后极易发生降解失去药效, HA作为一种黏性多糖, 可延长药物在体内的保留时间, 另一方面, 由于HA属于阴离子聚糖, 相较于表面带阳离子的药物载体具有更久的半衰期, 从而提高中药小分子化合物的生物利用度。
青藤碱是从防己科植物青风藤(Sinomenium acutum) 中提取分离得到的生物碱, 具有抗炎[20]、免疫抑制[21]、预防肝炎[22]等药理作用, 关节腔注射青藤碱是骨关节炎治疗的有效方式; 然而青藤碱在体内易被快速清除, 但过大剂量又会引起肾损伤和轻微的心肌充血, 这极大限制了其进一步应用于临床。如何在青藤碱显著的药效活性基础上提高生物利用度以及降低不良反应是目前研究的难题。HA由于其黏性可延长在特定区域的保留时间从而提高生物利用, 且作为膝关节软骨和润滑液的重要组成成分具有良好的生物相容性和安全性[23], Liu等[24]通过合成方法成功制备出青藤碱和HA及脱镁叶绿酸共轭的水凝胶, 并评价了青藤碱在关节腔内的药代动力学谱。与青藤碱注射液相比, 与HA的共轭的青藤碱水凝胶注射后在关节腔内的药物浓度明显增加, 生物利用度增加为单独注射青藤碱的2.9倍, 平均停留时间为单独注射青藤碱的1.88倍, 极大提高了青藤碱的生物利用度。咖啡酸是一种酚酸类化合物, 广泛存在于茵陈(Swertia mussotii Franch.)、金银花(Lonicera japonica Thunb.) 等中药中, 由于具有多个酚羟基极易被氧化, 是一种强抗氧化剂; Sguizzato等[25]将咖啡酸负载于HA和泊洛沙姆的固体脂质纳米粒中, 从而更好地控制咖啡酸的释放, 显著提高了其生物利用度, 与咖啡酸水溶液相比, 从纳米凝胶中扩散咖啡酸的速度是其1/8。
2.3 促进中药小分子化合物靶向抗肿瘤癌症治疗仍是现代医学面临的重大挑战, 药物输送到肿瘤组织不可避免地会遇到许多问题, 如肿瘤靶向能力差、癌细胞内药物释放缓慢、肝脏大量积聚产生不良反应等, 由于HA与CD44和RHAMM等靶点具有特异性识别的功能, 中药小分子通过与HA混合制备新的剂型提高抗肿瘤药物的靶向性, 增加活性药物在肿瘤细胞的浓度, 减少给药量降低不良反应, 从而增强抗肿瘤活性。
紫杉醇是从红豆杉(Ramulus Taxi Cuspidatae) 树皮中分离得到的微量单体成分, Luo等[26]通过自组装甲氧基聚乙二醇-聚丙交酯嵌段共聚物和HA-紫杉醇络合物制备了有效治疗癌症的复合纳米粒。制备所得的纳米粒在体外通过CD44受体增强细胞内化, 并对肺癌细胞A549具有选择性的细胞毒性。更重要的是, 与其他紫杉醇制剂相比, 该纳米粒在体内具有减少肝积聚、良好的肿瘤靶向能力和优越的抗肿瘤疗效。表没食子儿茶素没食子酸酯是绿茶中的主要活性成分, 具有抗氧化、抗炎和抗肿瘤作用, Liang等[27]用HA和表没食子儿茶素-3-没食子酸酯自组装后结合聚乙烯亚胺和颗粒酶, 制备生成纳米凝胶, 用于靶向递送蛋白质到癌细胞。HA与CD44的特异性结合特征为络合物提供了靶向结合位点, 并证明了表没食子儿茶素没食子酸酯大分子衍生物与抗癌蛋白的自组装可形成稳定的胶束纳米复合物, 在体内和体外都比自由蛋白具有更强的靶向抗癌作用。槲皮素是从槐米中分离里得到的多酚类黄酮化合物, 具有抗炎、抗氧化、抗肿瘤等作用, 但其溶解度低、靶向性差, HA由于其本身可天然与CD44结合的优势, 有望改善槲皮素的抗肿瘤缺陷, 熊奇[28]通过研磨法将槲皮素和HA混合制备生成纳米混悬液, 通过体外细胞实验和动物体内肿瘤生长实验证明利用HA制备的新型槲皮素纳米制剂具有良好的抗肿瘤活性。
2.4 协同促进中药小分子化合物的疗效HA本身作为细胞外基质的重要组成成分具有良好的药效学活性如润滑关节和组织、抗炎和促进伤口愈合等, 这使得HA在作为药用辅料改善被载药物溶解度、提高其生物利用度的同时, 也具有协同增强被载药物药效学活性的功能。
白藜芦醇是一种非黄酮类的多酚化合物, 主要存在于桑树(Morus alba L.)、朝鲜槐(Maackia amurensis Rupr. et Maxim.) 等多种植物中, 由于具有调节伤口愈合、微循环、神经末梢功能等被得到广泛应用[29], 但其稳定性较差阻碍了临床的进一步应用。由于HA是细胞外基质的重要组成成分, 在改善白藜芦醇的稳定性基础上, 进一步促进皮肤伤口的愈合, 保护局部环境的微妙平衡, Gokce等[30]将HA和二棕榈酰磷脂酰胆碱制备成微粒并成功负载白藜芦醇, 在增加溶解度的同时, 观察到体外协同作用对糖尿病创面愈合的影响, 并对糖尿病大鼠氧化应激和体内伤口愈合性能的影响进行了体外表征和评估, 结果表明这种方法具有良好的应用前景。穿心莲内酯是穿心莲[Andrographis paniculata (Burm.f.) Nees] 的主要有效成分, 具有祛热解毒, 消炎止痛的功效, Sanad等[31]利用壳聚糖和HA制备纳米载体包载穿心莲内酯用于促进外部伤口愈合和减少氧化应激反应, HA本身也具有一定的抗炎活性, 制备的化合物通过穿心莲内酯和HA的联合抗炎和抗氧化作用促进创面愈合减少疤痕形成和改善组织功能。另外, 与单独的穿心莲内酯比较, 制备得到的纳米载体包载的穿心莲内酯具有良好的孔隙率、肿胀率和控释率。淫羊藿苷是中药淫羊藿(Epimedium brevicornu Maxim.) 的主要有效成分, 能促进骨细胞增殖与分化、提高软骨细胞活性、促进细胞增殖, 淫羊藿苷和HA均可用于骨科治疗, 张君涛等[32]将HA和淫羊藿苷制备生成结合物, 并通过体内实验证明该结合物可提高膝关节软骨缺损兔软骨组织Ⅱ型胶原的表达并发挥软骨保护作用。
2.5 改善药物剂型HA作为一种大分子生物材料, 具有水化、再生性能和容积效应, 可生成如水凝胶、微针、胶束等剂型以适应不同给药方式, 如水凝胶可应用于注射给药、皮肤给药和口服给药, 微针可应用于皮肤给药等。基于HA的这些特性, 也可使中药小分子化合物具有更广泛的用药途径。
大黄酸是大黄中的主要成分之一, 广泛应用于抗炎研究, 但其水溶性差极大限制了其临床应用。Zheng等[2]通过自组装的方法生成了大黄酸水凝胶, 具有显著的抗炎活性, 但该水凝胶不稳定, 不利于皮肤范围的给药, 限制了其在外用伤口抗炎的治疗, HA通过氧化反应交联β-环糊精和二茂铁生成主客体结构, 与具有自组装特性的大黄酸相互作用生成性能更稳定、结构更完整的超分子水凝胶, 对于脂多糖诱导的体外炎症模型具有良好的治疗效果, 对糖尿病大鼠皮肤伤口愈合有促进作用, 使伤口从炎症期成功进入细胞增殖愈合过程。芦丁是中药槐米中的主要有效成分之一, 其抗氧化活性得到了广泛研究和应用, Fonseca等[33]将芦丁与HA结合起来开发创新型微针贴剂应用于皮肤化妆品, 与面霜和凝胶相比, 微针增加药物疗效减少损失。制备的HA微针结合纳米纤维素作为背部层, 获得的宽200 μm、高450 μm的微针具有足够的机械力来承受皮肤插入力, 在人类志愿者身上进行的初步体内研究证实了芦丁纳米微针的安全性和皮肤相容性, 没有角质层水化或发红, 并具有良好的抗氧化活性。
如表 1[2, 16, 18, 19, 24-28, 30-33]所示, 基于HA优良的超分子性能, 多种中药小分子化合物通过与HA的相互作用改善了溶解度, 提高其生物利用度、靶向性及剂型等。因此, HA作为多种中药小分子化合物的超分子载体, 可通过自身优越的物理化学特性和药效学活性, 更好地改善中药小分子化合物应用于临床面临的挑战。
| Table 1 Summary of functional modification of small molecular compounds in TCM based on supramolecular properties of HA |
HA不仅可解决中药小分子本身的问题, 还具有独特的药效学活性、良好的生物相容性和可降解性, 可广泛应用于各种药物制剂, 已获批为新的口服类添加剂。作为一种多功能载体, 这为中药如何克服面向临床的不足如低溶解度、低生物利用度及靶向性差等提供了更多思路和解决方案。但HA在向临床转化过程中伴随着诸多困难, 首先其强亲水性使其不能与疏水性药物偶联, 一般需在二甲基亚砜等有机溶剂中发生化学反应, 有机溶剂的参与会导致工艺复杂化甚至带来潜在的安全性问题并威胁健康, 这也导致了HA作为药物载体的工业化和产业化困难; 其次, 天然来源的HA力学性能不足且在体内代谢快, 一般需化学合成手段来进行化学改性研究, 而化学合成多发生在羧基上, 作为肿瘤药物传递载体, 这种合成会影响HA和CD44的特异性结合从而影响其靶向抗肿瘤活性; HA与中药领域的交叉研究目前处于起步阶段, 未来通过调节不同分子质量的HA比例, 从而不经过结构修饰来改善中药小分子化合物性质的研究需进一步展开; 另外, HA聚合物的分子质量较大, 进入体内后不可避免地会被降解、代谢, 因此降解产物在体内的作用途径需进一步追踪和研究, 以确保其产生更低的不良反应, 这也是HA在临床应用时需重点解决的问题。
中药的发展离不开进一步在临床的广泛应用, 需对越来越多的药物载体进行挖掘从而改善小分子药物理化性质。相信随着研究的深入, 会有更多中药成分在基于HA超分子特性上被挖掘出新的治疗效果和应用, 这将不仅使中药小分子成分更好地应用于临床, 也将使其在大健康、材料、功能化妆品领域取得更大的进展。
作者贡献: 袁枝花负责文章的文献调研和撰写; 皮雯敏、王志家、林晓钰负责参考文献的整理; 刘有停、曲召辉、邱显荣负责文章的修改; 王鹏龙负责对文章的思路整理、审阅和修改。
利益冲突: 所有作者均声明没有利益冲突。
| [1] |
Webber M, Pashuck E. (Macro) molecular self-assembly for hydrogel drug delivery[J]. Adv Drug Deliv Rev, 2021, 172: 275-295. DOI:10.1016/j.addr.2021.01.006 |
| [2] |
Zheng J, Fan R, Wu H, et al. Directed self-assembly of herbal small molecules into sustained release hydrogels for treating neural inflammation[J]. Nat Commun, 2019, 10: 1604. DOI:10.1038/s41467-019-09601-3 |
| [3] |
Juncan A, Moisă D, Santini A, et al. Advantages of hyaluronic acid and its combination with other bioactive ingredients in cosmeceuticals[J]. Molecules (Basel), 2021, 26: 4429. DOI:10.3390/molecules26154429 |
| [4] |
Meyer K, Palmer W. The polysaccharides of vitreous humor and of umbilical cord[J]. Biochem J, 1934, 107: 629-634. |
| [5] |
Li C, Cao Z, Li W, et al. A review on the wide range applications of hyaluronic acid as a promising rejuvenating biomacromolecule in the treatments of bone related diseases[J]. Int J Biol Macromol, 2020, 165: 1264-1275. DOI:10.1016/j.ijbiomac.2020.09.255 |
| [6] |
Wang J. Prepared Hydrogel Dressing Based on Hyaluronic Acid for Combining with Cell Sheet and Anti-bacteria (基于透明质酸构建的水凝胶应用于细胞膜片的复合或抗菌敷料) [D]. Beijing: Beijing University of Chemical Technology, 2020.
|
| [7] |
Wu BH, Yang SY, Sun J, et al. Advances in hyaluronic acid modified anti-tumor drugs[J]. Chem J World (化学世界), 2020, 61: 662-668. |
| [8] |
Liu R, Xiao W, Hu C, et al. Theranostic size-reducible and no donor conjugated gold nanocluster fabricated hyaluronic acid nanoparticle with optimal size for combinational treatment of breast cancer and lung metastasis[J]. J Control Release, 2018, 278: 127-139. DOI:10.1016/j.jconrel.2018.04.005 |
| [9] |
Nath S, Abueva C, Kim B, et al. Chitosan-hyaluronic acid polyelectrolyte complex scaffold crosslinked with genipin for immobilization and controlled release of BMP-2[J]. Carbohydr Polym, 2015, 115: 160-169. DOI:10.1016/j.carbpol.2014.08.077 |
| [10] |
Itano N, Sawai T, Yoshida M, et al. Three isoforms of mammalian hyaluronan synthases have distinct enzymatic properties[J]. J Biol Chem, 1999, 274: 25085-25092. DOI:10.1074/jbc.274.35.25085 |
| [11] |
de la Motte C, Nigro J, Vasanji A, et al. Platelet-derived hyaluronidase 2 cleaves hyaluronan into fragments that trigger monocyte-mediated production of proinflammatory cytokines[J]. Am J Pathol, 2009, 174: 2254-2264. DOI:10.2353/ajpath.2009.080831 |
| [12] |
Todaro M, Gaggianesi M, Catalano V, et al. CD44v6 is a marker of constitutive and reprogrammed cancer stem cells driving colon cancer metastasis[J]. Cell Stem Cell, 2014, 14: 342-356. DOI:10.1016/j.stem.2014.01.009 |
| [13] |
Safdar M, Hussain Z, Abourehab M, et al. New developments and clinical transition of hyaluronic acid-based nanotherapeutics for treatment of cancer: reversing multidrug resistance, tumour-specific targetability and improved anticancer efficacy[J]. Artif Cells Nanomed Biotechnol, 2018, 46: 1967-1980. |
| [14] |
Wang M, Hu Y, Qin X, et al. A hyaluronic acid nanogel for melanoma targeted drug delivery[J]. Acta Pharm Sin (药学学报), 2020, 55: 146-151. |
| [15] |
Qiu L, Long M, Chen D. Hyaluronic acid-based carriers for tumor targeted delivery system[J]. Acta Pharm Sin (药学学报), 2013, 48: 1376-1382. |
| [16] |
Lai H, Ding X, Ye J, et al. pH-responsive hyaluronic acid-based nanoparticles for targeted curcumin delivery and enhanced cancer therapy[J]. Colloids Surf B Biointerfaces, 2021, 198: 111455. DOI:10.1016/j.colsurfb.2020.111455 |
| [17] |
Sun S, Shang RY, Xiao HB, et al. In vivo imaging in tumor-bearing animals and tissue distribution of nanostructured lipid carrier modified by hyaluronic acid loaded with three components in Panax ginseng[J]. Chin Tradit Herb Drugs (中草药), 2019, 50: 4209-4218. |
| [18] |
Sun S, Shang RY, Xiao HB, et al. Preparation and characterization of nanostructured lipid carrier modified by hyaluronic acid loaded with three components in Ginseng Radix[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 3815-3820. |
| [19] |
Bhatnagar P, Kumari M, Pahuja R, et al. Hyaluronic acid-grafted PLGA nanoparticles for the sustained delivery of berberine chloride for an efficient suppression of Ehrlich ascites tumors[J]. Drug Deliv Transl Res, 2018, 8: 565-579. DOI:10.1007/s13346-018-0485-9 |
| [20] |
Vieregge B, Resch K, Kaever V. Synergistic effects of the alkaloid sinomenine in combination with the immunosuppressive drugs tacrolimus and mycophenolic acid[J]. Planta Med, 1999, 65: 80-82. DOI:10.1055/s-2006-960446 |
| [21] |
Liu L, Buchner E, Beitze D, et al. Amelioration of rat experimental arthritides by treatment with the alkaloid sinomenine[J]. Int J Immunopharmacol, 1996, 18: 529-543. |
| [22] |
Kondo Y, Takano F, Yoshida K, et al. Protection by sinomenine against endotoxin-induced fulminant hepatitis in galactosamine-sensitized mice[J]. Biochem Pharmacol, 1994, 48: 1050-1052. DOI:10.1016/0006-2952(94)90378-6 |
| [23] |
Ling PX, Liang H, He YL, et al. The application of sodium hyaluronate in joint diseases[J]. Chin J Repar Reconstr Surg (中国修复重建外科杂志), 2002, 16: 1-4. |
| [24] |
Liu J, Shao H, Fang S, et al. Evaluation of pharmacokinetics and pharmaco-dynamics of sinomenine-hyaluronic acid conjugate after intra-articular administration for osteoarthritis treatment[J]. Drug Des Devel Ther, 2019, 13: 657-665. DOI:10.2147/DDDT.S186558 |
| [25] |
Sguizzato M, Mariani P, Ferrara F, et al. Nanoparticulate gels for cutaneous administration of caffeic acid[J]. Nanomaterials (Basel), 2020, 10: 961. DOI:10.3390/nano10050961 |
| [26] |
Luo K, Yin S, Zhang R, et al. Multifunctional composite nanoparticles based on hyaluronic acid-paclitaxel conjugates for enhanced cancer therapy[J]. Int J Pharm, 2020, 589: 119870. DOI:10.1016/j.ijpharm.2020.119870 |
| [27] |
Liang K, Ng S, Lee F, et al. Targeted intracellular protein delivery based on hyaluronic acid-green tea catechin nanogels[J]. Acta Biomater, 2016, 33: 142-152. DOI:10.1016/j.actbio.2016.01.011 |
| [28] |
Xiong Q. Preparation and Evaluation of Hyaluronic Acid-based Novel Quercetin Nano-formulation (基于透明质酸的新型槲皮素纳米制剂的制备及评价) [D]. Chongqing: Chongqing Medical University, 2020.
|
| [29] |
Bashmakov Y, Assaad-Khalil S. Petyaev I resveratrol may be beneficial in treatment of diabetic foot syndrome[J]. Med Hypotheses, 2011, 77: 364-367. DOI:10.1016/j.mehy.2011.05.016 |
| [30] |
Gokce E, Tuncay Tanrıverdi S, Eroglu I, et al. Wound healing effects of collagen-laminin dermal matrix impregnated with resveratrol loaded hyaluronic acid-DPPC microparticles in diabetic rats[J]. Eur J Pharm Biopharm, 2017, 119: 17-27. DOI:10.1016/j.ejpb.2017.04.027 |
| [31] |
Sanad R, Abdel-Bar H. Chitosan-hyaluronic acid composite sponge scaffold enriched with andrographolide-loaded lipid nanoparticles for enhanced wound healing[J]. Carbohydr Polym, 2017, 173: 441-450. DOI:10.1016/j.carbpol.2017.05.098 |
| [32] |
Zhang JT, Zhang DL, Wu CC, et al. Preparation of icariin and hyaluronic acid conjugate and its protective effect on rabbit cartilage tissue with knee joint cartilage defect[J]. Shandong Med J (山东医药), 2018, 58: 30-33. |
| [33] |
Fonseca D, Vilela C, Pinto R, et al. Bacterial nanocellulose-hyaluronic acid microneedle patches for skin applications: in vitro and in vivo evaluation[J]. Mater Sci Eng C, 2021, 118: 111350. DOI:10.1016/j.msec.2020.111350 |
 2022, Vol. 57
2022, Vol. 57


