2. 军事科学院军事医学研究院毒物药物研究所, 北京 100850;
3. 中国人民解放军73101部队, 江苏 徐州 221000;
4. 郑州大学, 河南 郑州 450000
2. Institute of Pharmacology and Toxicology, Academy of Military Medical Sciences, Academy of Military Sciences, Beijing 100850, China;
3. Unit 73101 of Chinese PLA, Xuzhou 221000, China;
4. Zhengzhou University, Zhengzhou 450000, China
温度敏感型凝胶(简称温敏凝胶) 是一种温度响应型的原位凝胶, 其状态与温度密切相关, 在室温条件下是流动性较好的液体状态, 在人体温度下变成半固体状态, 并具有较好的黏附性。给药后, 在病灶部位迅速发生溶胶-凝胶转变并黏附在给药部位。温敏凝胶稳定地嵌入药物分子并能保持药物活性, 在大多数组织中都有较好相容性, 局部施用药物也可绕过组织中的一些生理屏障, 这些优势使温敏凝胶成为药剂学及生物技术领域研究的热点之一。本文依据近些年的文献报道, 综述了温敏凝胶的特点、常用温敏材料及在鼻腔、眼、阴道、牙周、皮肤、瘤内、关节腔等不同给药部位中研究的进展, 为温敏凝胶更好地用于临床提供参考(图 1)。

|
Figure 1 The characteristics of thermosensitive gel, commonly used thermosensitive materials, application in different parts of the nasal cavity, eye, vagina, periodontal, skin, tumor and joint cavity, and their clinical application |
温敏凝胶是一种可对环境温度变化作出响应并产生相变的制剂, 在室温条件下, 凝胶网络结构收缩, 呈现液体状态; 当温度上升到一定程度时, 凝胶溶胀产生相变呈现半固体状态。发生相变时的温度称为低临界溶解温度(lower critical solution temperature, LCST)[1], 也称为胶凝温度。温敏凝胶这种状态的改变是因为制备温敏凝胶的材料中同时含有亲水性和疏水性基团, 当外界温度发生变化时, 这些基团与其他分子间的相互作用发生改变, 影响凝胶内的网络结构, 进而使之产生相变。
制备温敏凝胶的材料即温度敏感性生物材料(简称“温敏材料”) 是一种极具代表性的新型智能材料, 一般是有机高分子物质利用分子间的氢键、π-π作用、范德华力及疏水作用等作用形成[2]。常用温敏凝胶的材料一般分为人工合成和天然形成两类, 人工合成材料包括泊洛沙姆类[3-6]、聚N-异丙基丙烯酰胺类[7-10]、聚乙二醇-聚酯类[11, 12]等; 天然形成材料有壳聚糖[13-16]、纤维素类[17-19]等。
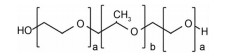
1.1 泊洛沙姆泊洛沙姆是一种聚(环氧乙烷)-聚(环氧丙烷)-聚(环氧乙烷) (PEO-PPO-PEO) 三嵌段共聚物[20], 由中心疏水聚(环氧丙烷) (PPO) 核心组成, 两侧有亲水性聚(环氧乙烷) (PEO) 链[21] (图 2)。升温后, 泊洛沙姆胶束中的疏水性聚环氧丙烷基团脱水发生溶胀, 达到一定温度时, 胶束开始互相接触并形成网络结构, 形成凝胶, 最直接表现是黏度上升。泊洛沙姆家族中作为温敏凝胶材料最常用的是泊洛沙姆407和泊洛沙姆188, 泊洛沙姆407在17.5%~30%浓度范围内具有成胶性, 且随浓度增大胶凝温度逐渐下降, 泊洛沙姆188作为一种温度调节剂, 2%~10%的浓度加入到泊洛沙姆407中可升高胶凝温度, 泊洛沙姆188浓度越大, 胶凝温度越高[22]。
|
Figure 2 Poloxamer structural formula |
快速凝胶化、合适的黏弹性、剪切后快速黏度恢复及特殊的三维网状结构使得以泊洛沙姆构建的温敏凝胶在药物传递、组织工程、预防肿瘤术后复发等方面发挥优势[23]。两亲性和自组装形成胶束的能力使温敏凝胶可作为药物载体并提高药物生物利用度[24]。在组织工程中, 良好的生物相容性、无毒、可控的生物降解性和适当的机械和结构特性为细胞生长、增殖和分化提供一个合适的相互连接的微环境[25]。肿瘤术后切除的手术腔内注射温敏凝胶, 药物包载于凝胶的三维网状结构中, 黏附在残余切除组织的局部稳定持续的释放, 泊洛沙姆高分子材料的两亲性和无毒性使得癌细胞更易受到药物抑制, 有效地预防肿瘤的局部复发[26]。生物黏附性较差、药物释放速度较快是泊洛沙姆高分子温敏材料应用存在的主要问题, 通常会与卡波姆、透明质酸、羟丙基甲基纤维素等生物黏附材料共同构建凝胶递药体系, 卡波姆的羧基与泊洛沙姆的醚键形成氢键而构成三维网状结构, 使凝胶的切变力变大, 黏附性增强, 凝胶强度增大, 延长药物的释放[27]。
1.2 聚N-异丙基丙烯酰胺类聚N-异丙基丙烯酰胺是一种典型的温度敏感性材料, 其结构中既包含亲水性的酰胺基(-CONH2), 又包含疏水性的异丙基[-CH (CH3)2][28] (图 3)。在低温下, 聚(N-异丙基丙烯酰胺) 三维网状结构中存在许多空隙, 这些空隙被水占据, 水分子与酰胺基形成氢键, 在聚合物表面形成水分子层; 温度升高后, 氢键被破坏, 异丙基脱水, 水分减少, 疏水基团的缔合作用加强, 水被排出, 收缩形成凝胶。

|
Figure 3 Poly(N-isopropylacrylamide) structural formula |
聚N-异丙基丙烯酰胺单体形成的温敏凝胶响应速率慢、难以生物降解以及机械性能差, 限制了其应用, 常采用嵌段共聚法、接枝法、共混法、互穿网络结构法等对其进行改性。将N-异丙基丙烯酰胺与N-丙烯酸琥珀酰亚胺酯利用嵌段共聚法形成聚(N-异丙基丙烯酰胺-co-N-丙烯酸琥珀酰亚胺酯), 不仅可保持聚N-异丙基丙烯酰胺的温敏特性, 又结合了琥珀酰亚胺酯运载菠萝蛋白酶的作用, 使得该嵌段共聚物在生物酶的固定化和运载方面提供了新的方法。聚N-异丙基丙烯酰胺与其他聚合物如羧甲基纤维素共混, 既能提高共混后聚合物的胶凝温度, 又能提高黏附性。接枝法是在聚N-异丙基丙烯酰胺的侧链或主链末端引入其他聚合物链段, 化学键的形成可改变聚合物胶凝温度, 并可改善黏度等性能。在聚N-异丙基丙烯酰胺单体中引入聚乙烯吡咯烷酮构建聚(N-异丙基丙烯酰胺)/聚乙烯吡咯烷酮(PNIPAM/PVP) 互穿聚合物网络[29], PVP的引入缩短了凝胶对温度的响应时间, 且提高了模型药物的载药量, 改变了药物的释放方式。
在药物递送应用中, 常构建温度和pH双重响应的聚N-异丙基丙烯酰胺凝胶, 与丙烯酸共聚的水凝胶在人体温度和pH小于5.5条件下形成凝胶, 而在pH 7.4不能形成凝胶, 这种依赖pH形成凝胶并释放药物的特点在促进伤口愈合时发挥了优势, 在伤口处快速形成凝胶释放药物使局部浓度增高, 并随后在pH改变为生理pH时通过降解来消除[30]。苯甲酸衍生物修饰壳聚糖-聚(N-异丙基丙烯酰胺) 可注射温敏凝胶在青光眼神经病变的治疗中应用, 苯甲酸衍生物的甲基和羟基增强了壳聚糖-聚(N-异丙基烯酰胺) 温敏凝胶的抗氧化活性, 同时保持异丙基烯酰胺生物材料的药物封装和持续释放能力, 治疗药物通过抑制氧化应激、降低高眼压、降低视网膜神经节细胞丢失, 显著改善青光眼相关神经退行性病变[31]。
1.3 聚乙二醇-聚酯类聚乙二醇(polyethylene glycol, PEG) 可与聚丙交酯乙交酯[poly(lactide-co-glycolide), PLGA] 形成B-A-B三嵌段共聚物PLGA-PEG-PLGA (图 4), 溶于水后会形成一种具有核壳结构的球状胶束, 良好的温敏性使其广泛用于药物递送系统中。共聚物的温敏性由高分子中的亲水性基团PLGA和疏水性基团PEG所控制。温度低于相转变温度时, 疏水的PLGA内核和亲水性的PGE外壳自组装形成胶束呈现溶液状态, 当温度上升至相转变温度, PLGA链之间的相互作用力增强并伴有PEG外壳脱水, 胶束聚集增加, 使聚合物溶液形成凝胶[32]。聚合物发生溶胶-凝胶转变的温度可通过PEG、PLGA的比例来调控, 随着分子链中亲水性基团PLGA增多, 相转变温度升高, 相反, 疏水性基团PEG增多, 相转变温度降低。当PLGA-PEG-PLGA共聚物中PEG/PLGA比值为0.56或更低以及在溶质中浓度超过15 wt%时, 在37 ℃可实现温度响应型的溶胶-凝胶转变[33]。

|
Figure 4 PLGA-PEG-PLGA structural formula |
PLGA-PEG-PLGA温敏凝胶作为药物递送载体, 其亲水性药物包载于PEG嵌段中, 通过凝胶亲水链的扩散释放; 疏水性药物包载于PLGA嵌段中, 通过凝胶基质的侵蚀降解释放。PLGA-PEG-PLGA温敏凝胶在释放药物的前期主要是通过凝胶亲水链的扩散, 后期为扩散与降解协同作用。这一特性使得凝胶可同时包载亲水性和疏水性两种药物, 亲水性药物可快速从凝胶中释放出来, 产生药效, 而疏水性药物随凝胶基质降解缓慢而持续释放, 达到一定缓释效果。
术后疼痛的治疗中, 通常是注射局部麻醉药, 但半衰期短、不良反应大, PLGA-PEG-PLGA温敏凝胶负载镇痛药物原位持续输送可明显减轻术后疼痛, 生物相容性好, 不良反应小, 且在室温下是流动的, 易于注射[34]。利用PLGA-PEG-PLGA聚合物的温敏成胶性、缓释特性及增溶特性来改善眼科药物的递送, 碱烧伤诱导的角膜新生血管疾病的治疗中, 结膜下注射的温敏凝胶可显著延长负载的疏水药物的释放, 并持续保持高浓度长达几周。因此, PLGA-PEG-PLGA具有很大潜力, 可进一步作为新的眼科药物传递系统, 用于治疗需长期治疗的眼部疾病[35]。
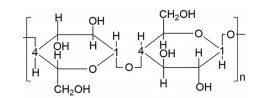
1.4 纤维素类纤维素类衍生物是葡萄糖分子通过β-1, 4-糖苷键连接成的生物大分子(图 5), 纤维素分子中含有大量氢键, 使得纤维素类温敏材料在低温下, 在疏水基团周围只形成简单缠结而无聚合, 温度上升后, 氢键被破坏逐渐失去其水合作用, 纤维素分子间强烈的疏水相互作用导致三维网络的形成[36], 进而构成温度敏感型的凝胶。以纤维素为基质的温敏凝胶由于其无毒、良好的生物相容性和生物降解性, 已被广泛用作生物医学材料。甲基纤维素和羟丙甲纤维素是纤维素类形成温敏凝胶的代表性聚合物。甲基纤维素水溶液在40~50 ℃能形成凝胶, 而羟丙甲纤维素在75~90 ℃之间发生相变。
|
Figure 5 Cellulose structural formula |
腹膜黏连仍是腹腔内手术的一个常见不良反应, 最广泛使用的抗黏附策略之一是物理屏障, 指将防黏连材料覆盖在手术创伤部位或易受黏连影响的组织与器官表面, 在黏连组织形成的关键时期(术后0~7天为黏连高发期) 形成物理隔离, 减少相邻组织或器官间的接触, 进而达到预防术后黏连的目的。纤维素类温敏凝胶以液体形式在创伤组织表面快速凝胶化形成防黏连物理屏障, 具有优良的降解性和生物相容性[37], 但亦有报道称羧甲基纤维素可能会导致伤口部位血凝块的形成[38]。Huang等[17]以2-甲基丙烯酰氧乙基磷胆碱共轭甲基纤维素(MC-g-MPC) 构建温敏凝胶, 注射MC-g-MPC水凝胶后, 大鼠损伤后的术后黏附能力与对照组相比有所改善。此外, Western blot结果表明, MC-g-MPC-0.25水凝胶可通过抑制胶原蛋白(Col-Ⅰ和Col-Ⅳ) 产生抗黏附作用, 从而发挥其抗蛋白吸收能力。在体外细胞毒性和免疫毒性及溶血性实验中, MC-g-MPC水凝胶表现出良好的生物相容性。
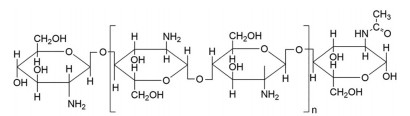
1.5 壳聚糖壳聚糖是由甲壳素脱乙酰制备而成的一种天然碱性氨基多糖, 广泛存在于自然界。由β-1, 4糖苷键连接的N-乙酰氨基葡萄糖基团和氨基葡萄糖残基组成[39] (图 6)。因具有良好的生物相容性、低细胞毒性和可被生物降解等优点, 壳聚糖被广泛应用于生物医学领域。
|
Figure 6 Chitosan structural formula |
单独的壳聚糖并不具有温敏性, 通常是通过共混甘油磷酸钠, 使壳聚糖上的氨基与甘油磷酸钠的磷酸根形成静电吸引, 当温度升高时, 静电吸引被破坏, 壳聚糖链发生脱水而形成凝胶化; 或接枝疏水性强的高聚物, 当温度升高到一定程度时壳聚糖发生脱乙酰基, 聚合物链上的亲水和疏水性成分发生相互作用, 黏度上升形成凝胶。能制备的温敏凝胶主要包括壳聚糖-甘油磷酸钠温敏凝胶[39]、壳聚糖接枝凝胶、巯基壳聚糖水凝胶及壳聚糖/胶原水凝胶[40]。Mohammed等[15]将甲氨蝶呤和5-氟尿嘧啶负载在壳聚糖温敏凝胶中, 壳聚糖与不同交联剂如β-甘油磷酸钠、Pluronic127、羟基磷灰石交联制备壳聚糖温敏凝胶。用β-甘油磷酸钠和10% Pluronic127作为交联剂制备的壳聚糖温敏水凝胶药效长达4周以上, 具有较高黏度和良好的通针性, 该温敏凝胶能持续定量释放抗癌药物。
壳聚糖温敏凝胶在室温下为液体状态, 可通过喷涂方式覆盖整个创面并迅速凝胶化, 具良好的组织相容性和固有的止血能力, 能加速伤口处组织再生, 预防和治疗伤口感染, 高含水量具有一定保水作用而促进药物透皮吸收[41]。多孔、互联的网状结构使壳聚糖温敏凝胶具有良好的生物学性能, 能负载骨生长促进相关蛋白因子, 引导骨再生[42], 不仅生物相容性好、可降解, 还具有一定的生物力学稳定性和骨矿化诱导能力[43]。
2 在不同给药部位的应用 2.1 鼻腔给药人鼻腔黏膜表面积约150 cm2[44], 有丰富的血管与毛细淋巴管, 渗透性高。鼻黏膜给药能使药物快速吸收进入体循环, 不经过胃肠道直达作用部位, 避免了肝脏首过效应。药物通过黏膜上纤毛规律性的运动进行转运, 但这种转运方式易导致药物随纤毛运动而被快速清除, 达不到预期药效, 这是鼻黏膜给药的技术瓶颈之一。温敏凝胶药物在鼻腔黏膜上迅速发生溶胶-凝胶转变, 这一特性使其具有良好的生物黏附性, 能显著增加药物在鼻腔黏膜上的滞留时间, 提高药物的生物利用度[45]。
Kumar等[46]用20%泊洛沙姆407和0.1%卡波姆934P构建含有马来酸氯苯那敏纳米粒的温敏凝胶, 以液体形式易于给药至鼻腔, 快速从溶胶转变为凝胶, 有较好黏附性, 增强了鼻黏膜与药物间的接触, 并降低了纤毛清除率延长制剂在鼻腔的停留时间。此外, 在安全性评估实验中, 与75%异丙醇相比, 温敏凝胶制剂对上皮无显著刺激性。
温敏凝胶还能递送免疫抗原, 在鼻黏膜免疫研究中发挥独特优势, 但鼻黏膜纤毛高频率的摆动能引起抗原的快速清除, 且鼻黏膜上皮细胞层阻止了抗原进入机体。在体温下形成的凝胶既保护了凝胶中结合的生物分子免受酶降解, 也增加了鼻黏膜中免疫抗原递送至机体的能力。Pastor等[47]开发一种新的温敏凝胶用于鼻腔疫苗递送, 该传递系统由聚合物Gantrez®AN119和表面活性剂Pluronic®F127组合而成, 并在凝胶中载入OMV-抗原复合物。在体温下快速形成凝胶, 延长了BALB/c小鼠鼻腔内OMV-抗原的停留时间, 此外, 体外研究显示OMV-抗原能从凝胶中快速释放。安全性研究结果表明温敏凝胶对HeLa细胞系和鼻上皮几乎没有细胞毒性。免疫组织化学研究表明, 鼻内给药后, OMV可到达鼻相关淋巴组织。
药物经鼻腔给药实现脑靶向也是近年来研究的热点之一, 研究表明温敏凝胶药物经鼻腔给药后, 药物分子可通过黏膜, 沿嗅神经进入大脑和脑脊液, 绕过血脑屏障进入中枢神经系统, 发挥药效。这是由于温敏凝胶增加了药物在鼻腔的停留时间, 且使黏膜纤毛清除和酶促降解最小化, 从而克服了直接向鼻-脑传递的限制[48]。吴瑾瑾等[49]以灯盏花为主药制备鼻用温敏凝胶, 结果表明灯盏花温敏凝胶与灯盏花素淀粉微球及灯盏细辛注射液相比, 对大鼠脑缺血均有改善作用, 改善程度为灯盏花温敏凝胶>淀粉微球>注射液, 原因可能是温敏凝胶增加了模型药物灯盏花在鼻腔的滞留时间, 比其他两种剂型表现出明显改善作用。Sridhar等[50]用泊洛沙姆407-壳聚糖组合制备了盐酸司来吉兰鼻用温敏凝胶(SNT-gel), 与鼻用溶液相比, SNT-gel明显延长了药物在鼻腔的停留时间, 体外12 h释放率为89.64% ± 1.2%, 此外脑多巴胺水平显著改善和单胺氧化酶B的降低表明温敏凝胶是通过鼻腔将SL有效地输送到大脑的制剂手段之一。
2.2 眼部给药眼部特殊的解剖学结构和生理特性使外源性药物难以进入角膜转运至眼后部发挥作用。眼部给药制剂进入眼部后与泪液混合, 然后沿着角膜向眼内运送, 泪液屏障、角膜和结膜屏障及血眼屏障, 这3种屏障都阻碍了药物在眼部的吸收, 常规滴眼液给药时会引起眼部应激反应, 频繁眨眼使得药物与眼球表面的接触时间较短, 透过角膜到达眼内组织的药量大大减少, 生物利用度较低。温敏凝胶以液体形式给药, 滴入眼后发生相变成凝胶, 提高了患者顺应性, 也显著延长药物在眼内的滞留时间, 提高了生物利用度[51]。
温敏凝胶在眼部给药方面已有药物上市, 分别在2007年、2009年、2016年上市了3种用于眼科疾病治疗的药品: Azasite®、Besivance®、Bromsite®。这些上市的温敏凝胶制剂均以泊洛沙姆407和聚卡波菲作为凝胶基质, 主要用于青光眼和眼部细菌感染的治疗(表 1)。
| Table 1 Ophthalmic thermosensitive gel products |
孙铜等[52]以泊洛沙姆407和泊洛沙姆188为基质制备加替沙星眼用温敏凝胶, 该凝胶在25 ℃以下为液态, 眼部给药后能迅速成胶, 在人工泪液中表现出良好的释放效果, 12 h的累积释放量达到61%。崔颖等[53]以泊洛沙姆407和泊洛沙姆188及聚卡波菲制备硫酸软骨素眼用温敏凝胶, 胶凝温度34.28 ℃, 在眼部快速成胶黏附, 克服了眨眼或应激反应导致的药物流失, 与溶液型眼用制剂相比, 温敏凝胶呈现出稳态释放的优点, 直到12 h才接近饱和。
脂质体是一种新型药物载体, 不仅可控制药物释放还可增加药物的角膜渗透性。马明珠等[54]将美洛昔康脂质体与温敏凝胶结合, 使难溶性药物美洛昔康的溶解度增加, 并在运用到眼部给药时利用了温敏凝胶相转变的优势。活体成像实验表明, 由于眨眼作用和泪液稀释, 给药10 min后, 美洛昔康滴眼液在兔眼角膜上被迅速清除, 几乎无药物存留, 而美洛昔康温敏凝胶还有大量药物蓄积, 眼部刺激实验中也表现出了比溶液制剂更低的刺激性。Shi等[55]以PLGA-PEG-PLGA三嵌段共聚物为凝胶基质制备了温敏凝胶, 结果表明该温敏凝胶体系延长了纳米粒在眼部的停留时间, 使pRNA-pent (五边形RNA纳米粒) 的体内半衰期延长2~4倍。
2.3 阴道给药阴道由于特殊的多褶皱生理结构和内部环境, 普通制剂在黏膜上分布不均匀, 且易于被阴道液稀释使得药物停留时间短[56]。黏膜黏附可使剂型与阴道黏膜紧密接触, 从而使药物通过阴道黏膜的量增加, 局部药物浓度增高[57]。温敏凝胶具有相转变的特点, 刚进入阴道时低黏度的液态有利于药物在褶皱的阴道黏膜上铺展, 能解决由于阴道褶皱而给药不均的问题, 之后达到胶凝温度迅速变成半固体黏附在黏膜上, 增加药物的滞留时间, 并可达到缓慢释放药物的目的。
2012年一种新型阴道润滑剂—酸缓冲热敏润滑剂获生产上市许可[58], 并同时获得国家发明专利一项。该产品是由凝胶基质Poloxamer、酸缓冲系统、保湿剂、防腐剂等组成, 在急性皮肤毒性实验、阴道黏膜刺激性实验、最大耐受量实验和长期毒性实验中均表明该凝胶具有很好安全性。该产品提供了一种新的医用凝胶, 随温度变化可由常温的液态变为体温下的凝胶态, 并具有比市售润滑剂更优异的生物黏附性, 延长润滑剂在阴道的滞留时间。
Velázquez等[13]以壳聚糖-β甘油磷酸钠制备孕酮温敏凝胶, 与市售制剂黄体酮缓释凝胶(Crinone®) 相比, 壳聚糖温敏凝胶在模拟阴道液中具有更好的抗降解性, 并在扩散实验中表现出与市售制剂类似的扩散特性, 表明了孕酮可通过壳聚糖温敏凝胶在阴道直接给药。陈晓等[59]以姜黄素为模型药物, 泊洛沙姆407、泊洛沙姆188为凝胶基质, 制得姜黄素温敏型原位凝胶, 胶凝温度29 ℃, 当温度上升到约26 ℃以后, 体系为次级键网状结构, 即其弹性固体性质优于液体性质, 具有较好的阴道滞留能力, 且与对照组相比, 姜黄素凝胶能明显抑制白色念珠菌生长。曲晓宇等[60]以泊洛沙姆407和泊洛沙姆188作为基质制备出盐酸布替萘芬温敏型原位凝胶, 胶凝温度为35 ℃, 接近人体阴道温度, 且具有较好的黏度, 释放度实验结果表明具有一定的缓释效果。
2.4 牙周给药局部给药是牙周炎治疗的一种有效手段, 温敏凝胶呈现半固体状态并黏附于给药部位, 使牙周袋内有较高的血药浓度, 并且能实现药物缓慢释放, 维持较长时间的药物浓度。此外, 药物是液体状态给药, 能与牙周袋不规则形状完全贴合, 相较全身给药不良反应小, 患者依从性更好。
刘延丰[61]研究了大黄素壳聚糖温敏凝胶治疗急性智齿牙周炎, 实验组为大黄素壳聚糖温敏凝胶, 对照组为碘甘油, 结果表明实验组的有效率是79.6%, 显著高于对照组的48.1%, 而且急性智齿牙周炎是厌氧菌引起的局部感染, 局部给药可避免全身给药而导致的抗生素乱用。在复方米诺环素奥硝唑温敏凝胶治疗慢性牙周炎的应用中, 王莉等[62]将其与使用米诺环素软膏治疗的对照组相比较, 结果显示复方米诺环素奥硝唑温敏凝胶治疗的有效率为95.45%, 显著高于比对照组的83.33%, 且实验组的不良反应也比对照组低9.11%。温敏凝胶通过口腔局部给药, 可有效避免米诺环素和奥硝唑的胃肠道反应。
2.5 皮肤给药温敏凝胶经皮给药可避免口服药物引起的胃肠道反应, 药物以液体状态涂抹于皮肤, 迅速发生相转变形成凝胶, 黏附于给药部位, 在局部持续释放药物, 可减少给药次数, 改善患者用药的依从性, 且一旦发现药物不良反应, 可随时中断给药。
夏晓爱等[63]以泊洛沙姆407和泊洛沙姆188及透皮吸收促进剂薄荷脑-噻酮构建马来酸噻吗洛尔温敏凝胶透皮给药系统, 用于治疗婴幼儿血管瘤, 以解决滴眼液易挥发、用纱布敷压、生物利用度低、多次给药等弊端。温敏凝胶剂增加了皮肤的黏附性, 降低了给药频率等。透皮实验表明, 凝胶组12 h累计渗透量显著高于溶液组, 并且凝胶组稳态透皮速率是溶液组的2.26倍, 温敏凝胶剂释放更持久, 且局部浓度更高。
盐酸倍他司汀是一种组胺类似物, 用来改善耳内微循环, 但其半衰期只有3~4 h, 且口服给药会发生一系列胃相关不良反应, 为改善上述缺点, Elkomy等[64]构建了盐酸倍他司汀温敏凝胶透皮吸收制剂, 以20%泊洛沙姆407和1.5%卡波姆为凝胶基质制备了温敏凝胶, 12 h内在大鼠皮肤上释放了96.97%的药物, 胶凝温度和时间分别为36 ± 0.35 ℃和6 ± 0.7 min, 黏合力高达8 835.68 dyne·cm-2, 具有极强黏附性, 显著延长了盐酸倍他司汀在皮肤的透皮释放时间。此外, BH具有体重增加控制活性, 在实验中与对照组相比, 使用BH温敏凝胶制剂可显著降低大鼠的食物摄入, 这种统计学上的显著降低表明BH从凝胶基质中经皮吸收, 说明温敏凝胶剂是盐酸倍他司汀透皮吸收的一种极具潜力的剂型。
2.6 瘤内给药温敏凝胶在瘤内直接注射给药可控制和延长药物的释放, 确保药物在肿瘤细胞分裂周期内充分扩散及抑制癌细胞生长, 并且能避免化疗药物全身循环造成的不良反应, 这种治疗策略极大迎合了临床需要[65]。同时, 原发性局部肿瘤的治疗多以手术切除为主, 但手术切除仍存在复发风险。温敏凝胶可在疾病发生部位直接使用, 因此其在肿瘤切除防止术后复发方面的应用也成为药学工作者研究的热点之一。
Zhuang等[66]以吉西他滨、多柔比星为模型药构建羧甲基壳聚糖-透明质酸双重载药温敏凝胶(GD-HA/CS-凝胶), 凝胶体系中吉西他滨迅速释放, 多柔比星缓慢释放, 对4T1细胞表现出协同抗癌作用。研究结果表明空白凝胶组和单一药物凝胶组均有不同程度的肿瘤复发, 而在术后腔注入GD-HA/CS-凝胶可完全预防肿瘤复发和肺转移。谢明华等[67]以泊洛沙姆407和泊洛沙姆188为凝胶基质制备去甲斑蝥素温敏凝胶, 与普通注射剂组比较, 甲斑蝥素温敏型凝胶能有效抑制肿瘤生长, 延长荷瘤鼠存活时间。Shan等[68]构建载有甲氨蝶呤和阿仑磷酸盐的聚酯(L-缬氨酸) 温敏凝胶, 在肿瘤部位持续释放甲氨蝶呤和阿仑磷酸盐抑制骨肉瘤, 与注射液组相比, 温敏凝胶制剂有效抑制了肿瘤生长, 并显著减少了骨肉瘤引起的骨破坏及肺转移, 在病理学研究中, 心脏和脾脏组织中没有病理变化或炎症细胞浸润, 突显了温敏凝胶增强了肿瘤药物治疗的靶向性, 降低了对正常组织的不良反应在给药安全性方面的优势。
2.7 关节腔给药目前常规注射剂关节腔给药后药物易渗漏进入体循环, 治疗效果差, 给药频率较高, 作用时间较短, 患者依从性差, 而以温敏凝胶搭载药物构建关节腔给药, 药物在注入关节腔后, 在局部形成半固体状黏附, 能减少药物流失, 增加药物在关节腔的持续释放时间, 提高生物利用度。
Gong等[69]制备了温敏PLGA-PEG-PLGA凝胶递送shRNA, 用于基因治疗骨关节炎。质粒不断地从该凝胶复合物中释放出来, 提高了WISP-1shRNA的转染效率。温敏凝胶使质粒维持在原位高浓度水平, 局部持续释放而治疗骨关节炎。良好的生物安全性、有效的基因传递和持续稳定的基因表达为温敏凝胶负载WISP-1shRNA治疗骨关节炎提供新思路。
张廷婷[70]构建盐酸氨基葡萄糖温敏凝胶用于治疗骨关节炎, 氨基葡萄糖水溶液和温敏凝胶完全释放时间为3和12 h, 温敏凝胶的缓释作用明显。治疗效果与模型组相比, 凝胶组抑制骨关节肿胀和炎症因子的产生程度明显优于水溶液组, 这项研究丰富了氨基葡萄糖的临床剂型种类, 也为骨关节治疗药物开发了新的策略。
温敏凝胶已发展成为一种新型的给药系统, 高分子凝胶材料在一定温度下呈现溶胶-凝胶转换, 延长药物在给药部位的滞留时间, 给予了药物充分的吸收时间, 近年来, 研究者将氨甲环酸[43]、奥菲芬[71]、粉防己碱[72]、左卡尼汀[73]等药物用于温敏凝胶递药系统的研究(表 2), 在诸多疾病中发挥显著药效。
| Table 2 Application of thermosensitive gel in different drug delivery sites |
温敏凝胶具备能随环境温度改变而使自身状态发生改变的特性, 这种特殊优势可延长药物在体内的停留时间, 使局部药物浓度增高, 提高生物利用度, 实现在疾病发生部位直接给药, 拓展了药物应用范围, 具有很好的临床应用前景。但温敏凝胶也存在一定的不足之处, 温敏凝胶作为药物缓控释材料, 其本身的缓释效果并不能满足临床需求, 可与微球、脂质体、纳米粒、包合物结合形成复合制剂实现缓控释。温敏凝胶在不同给药部位中发挥了独特优势, 但对材料本身毒性、局部刺激性的研究还存在一定欠缺, 温敏凝胶的黏度、机械强度、流变学性质、稳定性及体外释放方法等还未有健全的评价标准, 这些都是温敏凝胶能成功应用于临床而亟待解决的问题。但随着研究的深入, 更多的温敏凝胶制剂将会应用于临床医学、生物工程、组织工程等领域中, 有着广泛的应用前景。
作者贡献: 范冉冉负责文献查阅及文章撰写; 刘原兵、张婷、王增明负责文献搜集和整理分析; 张慧、李见春、郑爱萍负责综述的框架设计及文章的校审。
利益冲突: 所有作者声明不存在任何利益冲突。
| [1] |
Drozdov AD, Christiansen JD. Modulation of the volume phase transition temperature of thermo-responsive gels[J]. J Mech Behav Biomed Mater, 2021, 114: 104215. DOI:10.1016/j.jmbbm.2020.104215 |
| [2] |
Zhao Y, Wang XB, Zhang YR, et al. Research and application progress of thermosensitive gel[J]. Chin Pharm (中国药房), 2015, 26: 132-135. |
| [3] |
Boonlai W, Tantishaiyakul V, Hirun N, et al. Thermosensitive Poloxamer 407/poly(acrylic acid) hydrogels with potential application as injectable drug delivery system[J]. AAPS PharmSciTech, 2018, 19: 2103-2117. DOI:10.1208/s12249-018-1010-7 |
| [4] |
Dang LH, Huynh NT, Pham NO, et al. Injectable nanocurcumin-dispersed gelatin–pluronic nanocomposite hydrogel platform for burn wound treatment[J]. Bull Mater Sci, 2019, 42: 53-59. DOI:10.1007/s12034-018-1715-y |
| [5] |
Shriky B, Kelly A, Isreb M, et al. Pluronic F127 thermosensitive injectable smart hydrogels for controlled drug delivery system development[J]. J Colloid Interface Sci, 2020, 565: 119-130. DOI:10.1016/j.jcis.2019.12.096 |
| [6] |
Petkova-Olsson Y, Oelschlaeger C, Ullsten H, et al. Structural, microrheological and kinetic properties of a ternary silica-Pluronic F127-starch thermosensitive system[J]. J Colloid Interface Sci, 2018, 514: 459-467. DOI:10.1016/j.jcis.2017.12.051 |
| [7] |
Ma S, Zheng H, Chen Y, et al. Nanocomposite polymer hydrogels reinforced by carbon dots and hectorite clay[J]. J Wuhan Univ Technol Mater Sci Ed, 2020, 35: 287-292. DOI:10.1007/s11595-020-2255-z |
| [8] |
Yang Y, Zhu H, Tsai YT, et al. Study on the thermal stability of thermosensitive hydrogel[J]. Procedia Eng, 2016, 135: 501-509. DOI:10.1016/j.proeng.2016.01.162 |
| [9] |
Goncharuk O, Samchenko Y, Sternik D, et al. Thermoresponsive hydrogels physically crosslinked with magnetically modified LAPONITE® nanoparticles[J]. Soft Matter, 2020, 16: 5689-5701. DOI:10.1039/D0SM00929F |
| [10] |
Wu WX, Huang YC, Lee WF. Effect of poly(ethylene glycol)-derived crosslinkers on the properties of thermosensitive hydrogels[J]. Iran Polym J, 2020, 29: 679-691. DOI:10.1007/s13726-020-00831-7 |
| [11] |
Maeda T, Kitagawa M, Hotta A. Degradation of thermoresponsive laponite/PEG-b-PLGA nanocomposite hydrogels controlled by blending PEG-b-PLGA diblock copolymers with different PLGA molecular weights[J]. Polym Degrad Stab, 2021, 187: 222-228. |
| [12] |
Norouzi M, Firouzi J, Sodeifi N, et al. Salinomycin-loaded injectable thermosensitive hydrogels for glioblastoma therapy[J]. Int J Pharm, 2021, 598: 120316. DOI:10.1016/j.ijpharm.2021.120316 |
| [13] |
Velázquez NS, Turino LN, Luna JA, et al. Progesterone loaded thermosensitive hydrogel for vaginal application: Formulation and in vitro comparison with commercial product[J]. Saudi Pharm J, 2019, 27: 1096-1106. DOI:10.1016/j.jsps.2019.09.006 |
| [14] |
Tentor FR, de Oliveira JH, Scariot DB, et al. Scaffolds based on chitosan/pectin thermosensitive hydrogels containing gold nanoparticles[J]. Int J Biol Macromol, 2017, 102: 1186-1194. DOI:10.1016/j.ijbiomac.2017.04.106 |
| [15] |
Mohammed AM, Osman SK, Saleh KI, et al. In vitro release of 5-fluorouracil and methotrexate from different thermosensitive chitosan hydrogel systems[J]. AAPS PharmSciTech, 2020, 21: 131. DOI:10.1208/s12249-020-01672-6 |
| [16] |
Zheng W, Wang J, Xie L, et al. An injectable thermosensitive hydrogel for sustained release of apelin-13 to enhance flap survival in rat random skin flap[J]. J Mater Sci Mater Med, 2019, 30: 106. DOI:10.1007/s10856-019-6306-y |
| [17] |
Huang Y, Guo W, Zhang J, et al. Thermosensitive hydrogels based on methylcellulose derivatives for prevention of postoperative adhesion[J]. Cellulose, 2019, 27: 1555-1571. |
| [18] |
Nigmatullin R, Gabrielli V, Muñoz-García JC, et al. Thermosensitive supramolecular and colloidal hydrogels via self-assembly modulated by hydrophobized cellulose nanocrystals[J]. Cellulose, 2019, 26: 529-542. DOI:10.1007/s10570-018-02225-8 |
| [19] |
Dashtimoghadam E, Salimi-Kenari H, Nasseri R, et al. Tunable viscoelastic features of aqueous mixtures of thermosensitive ethyl(hydroxyethyl)cellulose and cellulose nanowhiskers[J]. Colloids Surf A Physicochem Eng Asp, 2020, 590: 124489. DOI:10.1016/j.colsurfa.2020.124489 |
| [20] |
Fu C, Ren F, Zhang Q, et al. Effects of collagen incorporation on thermogelation and hydrogel characteristics of aqueous Pluronic F127 copolymer system[J]. Colloid Polym Sci, 2015, 293: 2191-2200. DOI:10.1007/s00396-015-3573-0 |
| [21] |
Jarak I, Varela CL, Tavares da Silva E, et al. Pluronic-based nanovehicles: recent advances in anticancer therapeutic applications[J]. Eur J Med Chem, 2020, 206: 112526. DOI:10.1016/j.ejmech.2020.112526 |
| [22] |
Long KH, Huang XY, Wang CL, et al. Optimization of paeonol NLC thermosensitive gel formulation by box-behnken response surface methodology[J]. Chin J Inf Tradit Chin Med (中国中医药信息杂志), 2018, 25: 73-76. |
| [23] |
Zarrintaj P, Ramsey JD, Samadi A. Poloxamer A versatile tri-block copolymer for biomedical applications[J]. Acta Biomater, 2020, 110: 37-67. |
| [24] |
Wei D, Ge L, Guo R. Effect of hydrophilically modified ibuprofen on thermoresponsive gelation of pluronic copolymer[J]. Colloids Surf A Physicochem Eng Asp, 2018, 553: 1-10. DOI:10.1016/j.colsurfa.2018.05.012 |
| [25] |
Sivashanmugam A, Arun Kumar R, Vishnu Priya M, et al. An overview of injectable polymeric hydrogels for tissue engineering[J]. Eur Polym J, 2015, 72: 543-565. DOI:10.1016/j.eurpolymj.2015.05.014 |
| [26] |
Al Sabbagh C, Seguin J, Agapova E, et al. Thermosensitive hydrogels for local delivery of 5-fluorouracil as neoadjuvant or adjuvant therapy in colorectal cancer[J]. Eur J Pharm Biopharm, 2020, 157: 154-164. DOI:10.1016/j.ejpb.2020.10.011 |
| [27] |
Lu W, Jiang GW. New progress in the application of carbomer and polycarbofe in pharmacy[J]. Chin J Hosp Pharm (中国医院药学杂志), 2002, 22: 491-493. |
| [28] |
Tang JL, Ma J. Synthesis and properties of thermo-sensitive and pH-sensitive poly(N-isopropylacrylamide)/AAC[J]. J Funct Mater (功能材料), 2017, 9: 9157. |
| [29] |
Feng Q, Zhao Y, Li H, et al. Frontal polymerization and characterization of interpenetrating polymer networks composed of poly(N-isopropylacrylamide) and polyvinylpyrrolidone[J]. Colloid Polym Sci, 2017, 296: 165-172. |
| [30] |
Klouda L. Thermoresponsive hydrogels in biomedical applications: a seven-year update[J]. Eur J Pharm Biopharm, 2015, 97: 338-349. DOI:10.1016/j.ejpb.2015.05.017 |
| [31] |
Luo LJ, Nguyen DD, Lai JY. Benzoic acid derivative-modified chitosan-g-poly(N-isopropylacrylamide): methoxylation effects and pharmacological treatments of Glaucoma-related neurodegeneration[J]. J Control Release, 2020, 317: 246-258. DOI:10.1016/j.jconrel.2019.11.038 |
| [32] |
Yu L, Zheng Z, Zhang H, et al. Mixing a sol and a precipitate of block copolymers with different block ratios leads to an injectable hydrogel[J]. Biomacromolecules, 2009, 10: 1547-1553. DOI:10.1021/bm900145g |
| [33] |
Kitagawa M, Maeda T, Hotta A. PEG-based nanocomposite hydrogel: thermo-responsive sol-gel transition and degradation behavior controlled by the LA/GA ratio of PLGA-PEG-PLGA[J]. Polym Degrad Stab, 2018, 147: 222-228. DOI:10.1016/j.polymdegradstab.2017.11.024 |
| [34] |
Guo XF, He ZJ. A PLGA-PEG-PLGA thermosensitive gel enabling sustained delivery of ropivacaine hydrochloride for postoperative pain relief[J]. Chem Pharm Bull, 2017, 65: 229-235. DOI:10.1248/cpb.c16-00471 |
| [35] |
Chan PS, Li Q, Zhang B, et al. In vivo biocompatibility and efficacy of dexamethasone-loaded PLGA-PEG-PLGA thermogel in an alkali-burn induced corneal neovascularization disease model[J]. Eur J Pharm Biopharm, 2020, 155: 190-198. DOI:10.1016/j.ejpb.2020.08.022 |
| [36] |
Zhu L, Zhang YQ. Postoperative anti-adhesion ability of a novel carboxymethyl chitosan from silkworm pupa in a rat cecal abrasion model[J]. Mater Sci Eng C Mater Biol Appl, 2016, 61: 387-395. DOI:10.1016/j.msec.2015.12.080 |
| [37] |
Zhang Y, Gao C, Li X, et al. Thermosensitive methyl cellulose-based injectable hydrogels for post-operation anti-adhesion[J]. Carbohydr Polym, 2014, 101: 171-178. DOI:10.1016/j.carbpol.2013.09.001 |
| [38] |
Zhang E, Guo Q, Ji F, et al. Thermoresponsive polysaccharide-based composite hydrogel with antibacterial and healing-promoting activities for preventing recurrent adhesion after adhesiolysis[J]. Acta Biomater, 2018, 74: 439-453. DOI:10.1016/j.actbio.2018.05.037 |
| [39] |
Schnell CN, Galván MV, Zanuttini MA, et al. Hydrogels from xylan/chitosan complexes for the controlled release of diclofenac sodium[J]. Cellulose, 2019, 27: 1465-1481. |
| [40] |
Zang BJ, Zou ZH, Nie XQ. Research progress in chitosan thermosensitive hydrogel[J]. Shandong Chem Indust (山东化工), 2020, 49: 49-52. |
| [41] |
Fang W, Yang L, Hong L, et al. A chitosan hydrogel sealant with self-contractile characteristic: from rapid and long-term hemorrhage control to wound closure and repair[J]. Carbohydr Polym, 2021, 271: 118428. DOI:10.1016/j.carbpol.2021.118428 |
| [42] |
Aparna RL, Prasad RV, Nirmal NP. An injectable in-situ conducting thermosensitive gel for controlled delivery of vancomycin in osteomyelitis treatment and bone regeneration[J]. Sci Adv Mater, 2016, 8: 1470-1477. DOI:10.1166/sam.2016.2691 |
| [43] |
Tao F, Cheng Y, Shi X, et al. Applications of chitin and chitosan nanofibers in bone regenerative engineering[J]. Carbohydr Polym, 2020, 230: 115658. DOI:10.1016/j.carbpol.2019.115658 |
| [44] |
Xia Y, Li L, Huang X, et al. Performance and toxicity of different absorption enhancers used in the preparation of Poloxamer thermosensitive in situ gels for ketamine nasal administration[J]. Drug Dev Ind Pharm, 2020, 46: 697-705. DOI:10.1080/03639045.2020.1750625 |
| [45] |
Gu FG, Zhang YX, Wang Y, et al. Preparation and in vitro quality evaluation of rasagiline mesylate nasal gel[J]. Chin J New Drugs (中国新药杂志), 2017, 26: 351-356. |
| [46] |
Kumar MUP, Shankar R, Joshi M, et al. Chlorpheniramine maleate containing chitosan-based[J]. Drug Deliv Transl Res, 2019, 9: 1017-1026. DOI:10.1007/s13346-019-00639-w |
| [47] |
Pastor Y, Ting I, Martinez AL, et al. Intranasal delivery system of bacterial antigen using thermosensitive hydrogels based on a Pluronic-Gantrez conjugate[J]. Int J Pharm, 2020, 579: 119-154. |
| [48] |
Agrawal M, Saraf S, Saraf S, et al. Stimuli-responsive in situ gelling system for nose-to-brain drug delivery[J]. J Control Release, 2020, 327: 235-265. |
| [49] |
Wu JJ, Sheng AQ, Wu YY, et al. Pharmacodynamic effects of breviscapine in situ nasal thermoreversible gel in experimental cerebral infarction[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2017, 35: 1690-1695. |
| [50] |
Sridhar V, Wairkar S, Gaud R, et al. Brain targeted delivery of mucoadhesive thermosensitive nasal gel of selegiline hydrochloride for treatment of Parkinson's disease[J]. J Drug Target, 2018, 26: 150-161. DOI:10.1080/1061186X.2017.1350858 |
| [51] |
Xu K, Chen Q, Liang LN. Research progress on topical administration of drug for retinal diseases[J]. China J Chin Ophthalmol (中国中医眼科杂志), 2017, 27: 128-131. |
| [52] |
Sun T, Xu WN, Leng JW, et al. Study on rheological properties and release of gatifloxacin eye thermosensitive gel in vitro[J]. J Pharm Res (药学研究), 2019, 38: 468-470. |
| [53] |
Cu Y, Zhao Y. Preparation and quality evaluation of chondroitin sulfate ophthalmic thermosensitive gels[J]. China Pharm (中国药师), 2020, 23: 651-654. |
| [54] |
Ma MZ, Yu SH, Yu YB, et al. Irritation study on insoluble drug meloxicam liposome thermo sensitive hydrogel for ocular delivery[J]. Cent South Pharm (中南药学), 2017, 15: 288-292. |
| [55] |
Shi Z, Li SK, Charoenputtakun P, et al. RNA nanoparticle distribution and clearance in the eye after subconjunctival injection with and without thermosensitive hydrogels[J]. J Control Release, 2018, 270: 14-22. DOI:10.1016/j.jconrel.2017.11.028 |
| [56] |
Caramella CM, Rossi S, Ferrari F, et al. Mucoadhesive and thermogelling systems for vaginal drug delivery[J]. Adv Drug Deliv Rev, 2015, 92: 39-52. DOI:10.1016/j.addr.2015.02.001 |
| [57] |
Wang YH, Li HJ, Yang L, et al. Research progress of vaginal mucosal drug delivery system[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2019, 25: 219-225. |
| [58] |
Zhou XB. New vaginal lubricant - acid buffered thermosensitive gel lubricant is licensed for sale[J]. Chin J Fam Plann (中国计划生育学杂志), 2012, 2: 102. |
| [59] |
Chen X, Chen WY, Ma PP, et al. Curcumin temperature-sensitive in situ hydrogels for treatment of vaginal candidiasis[J]. J Int Pharm Res (国际药学研究杂志), 2017, 44: 947-952. |
| [60] |
Qu XY, Zhang SX, Tao LN, et al. Investigation on preparation and release property in vitro of butenafine hydrochloride thermosensitive hydrogel for vagina administration[J]. Chin J Hosp Pharm (中国医院药学杂志), 2015, 35: 1572-1575. |
| [61] |
Liu YF. Clinical observation of emodin thermosensitive hydrogel in the treatment of acute wisdom tooth pericoronitis[J]. Jilin Med J (吉林医学), 2017, 38: 1884-1885. |
| [62] |
Wang L, Yang XY. Evaluation on efficacy of thermosensitive minoeycline and omidazole complex gel in treatment of chronic periodontis[J]. J Oral Sci Res (口腔医学研究), 2019, 35: 647-650. |
| [63] |
Xia XA, Jiang ZL, Li SY, et al. Preparation and transdermal penetration of timolol maleate thermosensitive gel[J]. China Pharm (中国药师), 2020, 23: 1453-1458. |
| [64] |
Elkomy MH, El-Menshawe SF, Ali AA, et al. Betahistine dihydrochloride transdermal delivery via optimized thermosensitive gels: percutaneous absorption evaluation using rat growth as a biomarker[J]. Drug DelivTransl Res, 2018, 8: 165-177. |
| [65] |
Guan L, Zhang ZP, Liu YJ, et al. Application of injectable thermosensitive gels in local cancer therapy[J]. Chin J Pharm (中国医药工业杂志), 2020, 51: 1091-1098. |
| [66] |
Zhuang B, Chen T, Xiao Z, et al. Drug-loaded implantable surgical cavity-adaptive hydrogels for prevention of local tumor recurrence[J]. Int J Pharm, 2020, 577: 119048. |
| [67] |
Xie MH, Cai XJ, Peng JB, et al. Study on preparation and anti-hepatoma of norcantharidin thermosensitive in-situ gel[J]. Chin J Mod Appl Pharm (中国现代应用药学), 2017, 34: 1262-1265. |
| [68] |
Shan H, Li K, Zhao D, et al. Locally controlled release of methotrexate and alendronate by thermo-sensitive hydrogels for synergistic inhibition of osteosarcoma progression[J]. Front Pharmacol, 2020, 11: 573. |
| [69] |
Gong YB, MH, Liu JG. Controlled WISP-1 shRNA delivery using thermosensitive biodegradable hydrogel in the treatment of osteoarthritis[J]. J Bionic Eng, 2015, 12: 285-293. |
| [70] |
Zhang TT. Preparation of Thermosensitive In Situ Gel of Glucosamine Hydrochloride for Intra-articular Injection and Its Pharmacological Effects on Osteoarthritis (盐酸氨基葡萄糖关节腔注射用温敏凝胶的制备及其对骨关节炎的药效研究) [D]. Chengdu: Sichuan Agricultural University, 2019.
|
| [71] |
Mura P, Mennini N, Nativi C, et al. In situ mucoadhesive-thermosensitive liposomal gel as a novel vehicle for nasal extended delivery of opiorphin[J]. Eur J Pharm Biopharm, 2018, 122: 54-61. |
| [72] |
Pang LL, Gao Y, Zhang LH, et al. Intranasal tetrandrine temperature-sensitive gel for treatment of post-traumatic stress disorder[J]. Acta Pharm Sin (药学学报), 2019, 54: 1680-1687. |
| [73] |
Huang PQ, Gao LL, Yu YC, et al. Preparation and quality evaluation of levocarnitine thermosensitive in situ gel[J]. Acta Pharm Sin (药学学报), 2019, 54: 1115-1122. |
 2022, Vol. 57
2022, Vol. 57


