2. 北京大学药学院, 北京 100191
2. School of Pharmaceutical Sciences, Peking University, Beijing 100191, China
离子液体(ionic liquid, IL) 是由有机阳离子和无机或有机阴离子构成的在室温下呈液态的有机盐, 又称为室温熔融盐, 最早由Wilks和Zaworotko在1992年提出[1]。选用胆碱、氨基酸和糖等天然成分制备的第三代IL具有低挥发性、离子的高度可调性、生物相容性等特性, 再加上制备工艺简单, 使其在药物合成、递送及大分子药物的保护和稳定等方面有巨大应用潜力, 在生物医学领域受到越来越多的关注[2, 3]。
在药物口服递送方面, IL可用于增加难溶性药物的溶解度、保护大分子药物, 提高其在消化道环境中的稳定性, 增强药物在肠上皮的渗透性, 从而提高药物的口服生物利用度[4-6]。Shi等[4]采用一种胆碱基离子液体(CAGE) 口服递送BCS Ⅱ类难溶性小分子药物索拉非尼, 使索拉非尼溶解度由0.04 μg·mL-1增至500 mg·mL-1, 提高约106倍, 口服生物利用度显著提高。Banerjee等[5]将CAGE用于蛋白多肽类药物胰岛素的口服递送, 发现CAGE可保护胰岛素免受消化道内酶的降解, 同时可通过打开肠上皮紧密连接促进胰岛素的细胞旁路转运, 显著提高口服生物利用度, 当口服给药10 U·kg-1时, 胰岛素-CAGE制剂可使大鼠血糖持续下降高达45%, 取得了空前的递送效果, 该研究还发现胰岛素可在CAGE中室温稳定保存2个月, 在4 ℃条件下至少稳定保存4个月。Angsantikul等[6]采用另一种胆碱基IL口服递送IgG抗体, 亦取得了积极的递送效果。这些研究结果表明胆碱基IL在解决难溶性药物和生物大分子药物的口服吸收方面有特殊优势, 是非常有应用前景的递送载体。然而胆碱基IL对溶解性和透膜性都很差的BCS Ⅳ类药物口服吸收的影响迄今未见报道。
环孢素A (cyclosporine A, CsA) 又名环孢菌素A、环孢霉素A、山地明、环孢灵或环孢多肽A, 是由11个氨基酸组成的环状多肽, 1972年由Borel发现, 1979年被Calne首次应用于器官移植, 1983年被美国食品药品监督管理局(Food and Drug Adiministration, FDA) 批准用于器官移植, 用作免疫抑制剂[7]。CsA具有高亲脂性, 水溶性极差, 属于BCS Ⅳ类药物[8, 9]。此外, CsA口服生物利用度的个体差异性极大, 同时还是窄治疗指数药物。迄今为止, 如何提高CsA的体内性能一直是人们广泛关注的问题, 并相继报道有如脂质体[10]、自微乳化药物递送系统[11]、固体脂质纳米粒[12]、嵌段共聚物胶束[13]及固体分散体[14]、纳米混悬剂[15]等多种CsA口服药物递送系统的研究。虽然这些研究分别取得了很多积极结果, 但因脂质体载药量低、嵌段共聚物胶束原料不易得及纳米混悬剂物理稳定性差等诸多问题使其临床应用受限, 迄今只有CsA的口服自微乳化药物递送系统(Sandimmun Neoral®) 成功上市。因此目前CsA制剂主要为微乳口服液及注射剂。
本研究选用一种胆碱基离子液体COCA ([Cho][CA], 胆碱与香茅酸以1∶2摩尔比合成) 作为口服递送载体, 选择CsA作为BCS Ⅳ类药物模型, 研制了CsA的离子液体制剂(CsA-COCA), 通过开展大鼠体内药代动力学研究, 探讨IL对溶解性和渗透性都很差的BCS Ⅳ类药物CsA口服吸收的影响。
材料与方法仪器 岛津LC-20AD高效液相色谱系统(日本Shimadzu公司); API4000型三重四级杆串联质谱仪及Analyst 1.6.3数据工作站, 配备Turbo ionspray离子源(美国AB SCIEX公司); 傅里叶变换红外(FTIR) 光谱仪(美国Thermo Fisher公司); 紫外分光光度计(UH5300型, 日立科学仪器公司); Bruker-AVANCEIII 400 M型超导NMR波谱仪及Topspin 3.1处理软件(美国Bruker公司); 真空干燥箱(上海一恒科学仪器公司); 马尔文激光粒度仪Malvern Zetasizer (英国Malvern公司)。
试剂 CsA (98%)、环孢素D (CsD, 95%) (上海源叶生物科技有限公司); 香茅酸(95%, 四级试剂, 美国Aladdin试剂公司); 胆碱碳酸氢盐(80%, 四级试剂)、七水硫酸锌(99.5%) (美国Sigma-Aldrich公司); 羧甲基纤维素钠(sodium carboxymethyl cellulose, CMC-Na, 99%, 美国Selleck生物科技有限公司); 大鼠肠溶胶囊(上海玉研科学仪器有限公司); 甲醇(HPLC/MS级)、乙腈(HPLC/MS级) (美国Fisher Scientific公司); 甲酸(HPLC级, 北京迪科马科技有限公司)。
实验动物 雌性SD (Sprague Dawley) 大鼠, 6~8周龄, 体重200 ± 10 g, 购自北京维通利华实验动物中心。动物福利和实验过程均遵循北京大学医学部动物伦理委员会的规定。
COCA的合成及表征 精密称量两当量的香茅酸(3.405 g), 一当量的胆碱碳酸氢盐(2.065 g), 将香茅酸放入100 mL圆底烧瓶中, 放入1.0 cm搅拌子, 将胆碱碳酸氢盐缓慢滴加到圆底烧瓶中, 将上述混合物在40 ℃下搅拌反应16 h后, 旋转蒸发2 h除去水分, 随后真空干燥48 h, 即得COCA。待COCA合成之后, 采用核磁共振氢谱、质谱和红外光谱法对其进行表征。
LC-MS/MS条件 色谱柱: HALO 90 Å, AQ-C18反相柱(2.7 μm, 2.1 mm × 50 mm)。色谱条件: 流动相A为0.1%甲酸-水、B为0.1%甲酸-甲醇; 洗脱梯度: (0.00~0.50 min, 40% B; 0.50~1.30 min, 40%→100% B; 1.30~3.00 min, 100% B; 3.00~3.01 min, 100%→40% B; 3.01~4.00 min, 40% B); 流速: 0.4 mL·min-1; 进样量: 5 μL; 柱温: 55 ℃; 自动进样器温度: 8 ℃。质谱条件: 电喷雾-正离子模式; 离子源喷射电压(ion spray voltage, IS): 5 500 V; 气帘气(curtain gas, CUR): 13 psi; 雾化气(nebulizing gas, Gas1): 13 psi; 辅助加热气(heater gas, Gas2): 15 psi; 离子源温度(ion source temperature, TEM): 150 ℃。CsA及其内标CsD的监测离子对、去簇电压、碰撞能(CE) 等质谱参数及保留时间见表 1。
| Table 1 LC-MS/MS measurement parameters of the determinand. CE: Collision energy; DP: Declustering potential; CsA: Cyclosporin A; CsD: Cyclosporin D |
CsA-COCA的制备及其CsA的含量测定 精密量取适量COCA离子液体置于1.5 mL EP管中, 精密称量适量CsA加入其中, 使得药物浓度为50 mg·mL-1, 涡旋30 s, 将EP管避光25 ℃条件下超声15 min, 即得CsA-COCA制剂。然后在天平称取CsA-COCA适量溶于甲醇, 先用甲醇梯度稀释至10 μg·mL-1, 再用50%甲醇-水(含0.1%甲酸) 梯度稀释得到100 ng·mL-1浓度, 加入内标CsD工作液配成CsA终浓度为50 ng·mL-1的样品溶液, CsD终浓度为1 μg·mL-1, 平行制备3个样品。使用CsA对照品溶液及CsD储备液, 配制25~1 250 ng·mL-1范围内的5个标准系列溶液。将上述样品采用LC-MS/MS法进行分析。
全血样本处理 精密称取CsD对照品2 mg (含量为95%, 含CsD 1.9 mg), 放入1.5 mL EP管中, 加入950 μL甲醇得到2 mg·mL-1的储备液, 用50%甲醇水-0.1%甲酸稀释成50 μg·mL-1的内标工作溶液, 4 ℃储存备用。
将备好的100 μL的全血样品(空白全血样品、质控样品或加标全血样品等) 转移到1.5 mL EP管中, 加入ZnSO4溶液(0.1 mol·L-1, 100 μL), 涡旋混匀40 s, 加入300 μL乙腈和10 μL内标工作液, 再次涡旋1 min, 4 ℃条件下离心(13 000 r·min-1, 15 min), 将上清液转移到液相小瓶, 进样采用LC-MS/MS法分析[15-18]。
全血样品分析用LC-MS/MS方法学考察 参考中美两国的食品药品监督管理局推荐的生物样品定量分析方法验证指导原则, 选取待测物不同浓度水平的质控样品, 对所建立分析方法的专属性、线性、定量限、精密度、提取回收率、基质效应(matrix effect, ME) 进行验证[19, 20]。
专属性考察 取6个不同个体的大鼠空白全血(后续简称空白全血; 加入甲醇代替内标溶液)、空白全血加内标溶液、空白全血加CsA标准样本(加入甲醇代替内标溶液) 和受试大鼠在服药4 h后的血样加入内标溶液, 按照“全血样本处理”项下方法操作, 所得样品进行LC-MS/MS进样分析, 分别得到相应色谱图。
标准曲线 在室温和避光条件下, 精密称取CsA对照品适量溶于甲醇制得2 mg·mL-1的储备液, 用50%甲醇水-0.1%甲酸稀释制得系列浓度作为标准曲线工作液, 分别取标准曲线工作液与内标及全血混合后, 制得内标浓度为1 μg·mL-1, CsA浓度分别为1 250、1 000、500、250、100、50、25、20、10、5 ng·mL-1的标准系列样本, 采用LC-MS/MS法分析。以CsA峰面积(analyte area) 与内标峰面积(IS area) 的比值对血药浓度作回归计算得到标准曲线。
准确度和精密度 按“标准曲线”项下的溶液配制方法制备50、100、500 ng·mL-1共3个浓度的质控样品。每个浓度6个平行样本, 分别进样分析, 以标准曲线求得CsA浓度, 计算CsA回收率, 并考察精密度。
提取回收率 制备低、中、高质控样品对应浓度下的未提取样品E。按照“全血样本处理”项下方法操作, 使用沉淀蛋白法处理空白全血(将内标工作液换为乙腈), 得处理后的空白样品溶液。在3个EP管中分别加入低、中、高浓度的药物工作液、内标工作液和处理后的空白样品, 吹吸混匀后进行液质联用分析, 测定未提取样品中的药物和内标的峰面积比值(SE), 将对应的质控样品中药物和内标的峰面积比值(S0) 代入公式R = S0/SE × 100%计算提取回收率(R)。每种样品平行制备3份, 计算不同浓度样品提取回收率及其RSD。
基质效应考察 制备低、中、高质控样品对应浓度下的纯溶剂样品S。使用沉淀蛋白法处理水, 在3个EP管中分别加入低、中、高浓度的药物工作液、内标工作液和处理后的水, 吹吸混匀后进行液质联用分析, 测定纯溶剂样品中的药物和内标的峰面积比值(SS); 按照上述方法制备未提取样品E并测定药物和内标的峰面积比值(SE), 代入公式ME = SE/SS × 100%计算基质效应(ME)。平行制备3份各浓度的纯溶剂样品, 各浓度基质效应应处于85%~115%之间。
CsA-COCA在SD大鼠体内药代动学研究 将SD大鼠随机分为A、B组, 每组6只, 给药前禁食12 h, 不禁水。A组口服CsA-COCA制剂, 将CsA-COCA装入大鼠用胶囊给药; B组灌胃CsA混悬液(临用前用1% CMC-Na配成混悬液, 为CsA-suspension), 两组给药剂量均为10 mg·kg-1。给药后0、0.5、1、2、4、6、8、12、16、21、26 h在眼眶静脉丛取0.5 mL全血, 立即置于预装EDTA-K2的无菌抗凝管中, 保存于-20 ℃待测。将上述血样按照“全血样本处理”项下方法处理制备成色谱分析用样本, 采用上述HPLC-MS/MS方法分析, 标准曲线法计算每个时间点的药物浓度, 将平均血药浓度对时间作图, 并按下述方法计算药代动力学参数。
药代动力学参数和统计学分析 使用DAS 2.0软件以房室模型计算主要药代动力学参数平均药时曲线下面积(AUC)、平均驻留时间(MRT)、体内半衰期(T1/2)、药峰时间(Tmax)、最大血药浓度(Cmax), 并结合Excel软件采用双侧t检验对药代动力学参数进行显著性检验[21], 对各参数进行统计比较, 数据以
COCA的合成路线如图 1A所示, 合成所得的COCA (1∶2) 清澈透明、略带微黄色(图 1B), 有松木香味, 其微观离子结构如图 1C。

|
Figure 1 Synthesis of ionic liquid ([Cho][CA], COCA). A: Synthesis route of COCA; B: The image of COCA (1∶2); C: Structure of COCA (1∶2) |
对所合成的COCA采用质谱方法表征, 采用蠕动泵进样, 仪器调谐模式检测。质谱条件为: 电喷雾-正离子模式, IS: 5 500 V; CUR: 10 psi; Gas1: 13 psi; Gas2: 0 psi; 去簇电压(declustering potential, DP): 120 V; TEM : 0 ℃。采用上述条件在m/z 50~500 Da范围内扫描所得的Q1图谱如图 2A。图中显示胆碱的分子离子峰105.0, 子离子峰60.4, 离子簇峰207.6。离子液体在质谱分析时常会形成[(AB)A]+离子簇, A为其阳离子基团, B为其阴离子基团[22-25]。质荷比为148.9的离子峰归属为[AB+H+Na]2+, 质荷比为351.3的离子峰归属为[AB+2K+H]+。质荷比为377.1的离子峰, 为[(AB)A]+离子簇所对应的峰, 与文献所述离子液体的特征峰规则相符。质荷比为462.3的离子峰归属为[(A2B)+IsoProp+Na+H]+。
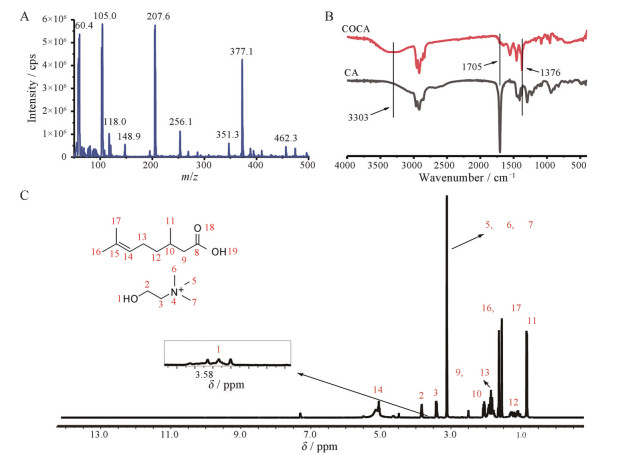
|
Figure 2 Characterization of COCA. A: Mass spectrum of COCA; B: Fourier transform infrared (FTIR) spectrum of citronellic acid and COCA; C: 1H nuclear magnetic resonance (NMR) spectrum of COCA |
采用FITR光谱仪测定CA和COCA的红外光谱(图 2B)。CA红外光谱图中-COOH的吸收峰在1 705.5 cm-1处, 而COCA红外光谱图中相应位置的峰明显减弱, 说明COCA中-COOH比例减少。此外, COCA在3 303.2 cm-1处有特征吸收峰, 说明有胆碱引入的-OH。同时, COCA在1 376.08 cm-1处的吸收峰强度增加, 说明体系内烷烃比例增加。
1.3 核磁共振氢谱分析采用核磁共振氢谱1H NMR对所合成的COCA进行表征, 所得图谱见图 2C。氢谱信号的归属是: δ 0.83处为香茅酸编号11碳上(C11) 甲基的质子峰; δ 1.11处是香茅酸C12上亚甲基质子峰; δ 1.55处是香茅酸C16和17上的甲基质子峰; δ 2.03处为香茅酸C9和C13的亚甲基质子峰; δ 2.06处为香茅酸C10上的质子峰; δ 3.12处为胆碱上C5、6和7上的甲基峰; δ 3.41和3.83处为胆碱上C3和C2上的质子峰; δ 3.57处为胆碱上羟基质子峰, 限于被羰基氧屏蔽, 氢谱图信号弱, 如图 2C所示; δ 5.04处为香茅酸C14上质子峰; 而胆碱碳酸氢盐中的碳酸氢根上的氢一般在δ 12.00处出现, 但在图 2C中并未发现有相应的信号反应, 说明体系中的碳酸氢根反应完全。因而, 这些信息结合质谱及红外光谱的结果可验证离子液体COCA的合成。
2 CsA-COCA中CsA的含量不含血的标准系列样本用LC-MS/MS法测定, 所得的标准曲线为y = 0.008 9x + 0.072 5 (r2 = 0.997 0), 线性良好, 用该法测得CsA-COCA制剂中CsA的含量为49.43 ± 4.76 mg·mL-1。
3 全血样品分析用LC-MS/MS方法学考察经过对比分析, CsA的药物峰保留时间为约2.71 min, 空白全血样品在此液质分析条件下不出峰, 可见全血中内源性物质不干扰CsA的含量测定, 方法的专属性好。将标准系列样本用LC-MS/MS法分析, 所得数据赋予权重因子1/x, 得回归方程为y = 0.006 43x - 0.003 02 (r = 0.999 2), 表明CsA在5.0~1 250 ng·mL-1范围内线性良好。按上述方法测得全血中CsA的最低浓度为5 ng·mL-1 (定量限)。采用上述LC-MS/MS法测得低、中、高3个浓度的平均回收率分别为100.2%、99.2%和106.9%, 精密度(RSD) 分别为14.5%、13.1%和0.9%, 表明该法的准确度和精密度均符合含量测定要求。同时, 该法测得50、100、500 ng·mL-1浓度的提取回收率分别为77.82%、82.65%和75.36%, 相应RSD值分别为12.5%、13.1%和5.1%。三组数据RSD均不超过15%, 符合要求。此外, CsA在低、中、高浓度下的ME值分别为88.4%、93.8%和90.9%, RSD值分别为3.0%、3.1%和1.9%, 表明样本基质对CsA及其内标的检测无明显影响。
4 CsA-COCA在SD大鼠体内药代动学研究结果大鼠单次口服CsA-COCA制剂和CsA-suspension的平均血药浓度-时间曲线见图 3。使用DAS 2.0软件分析, 采用二室模型拟合得到CsA-COCA制剂及CsA-suspension的主要药动学参数, 见表 2。CsA-COCA制剂组的AUC是混悬液组的2.81倍, MRT是混悬液组的1.77倍, T1/2是混悬液组的4.40倍, 两组间的AUC、MRT及T1/2均有显著性差异(P < 0.05)。两组的血药浓度分别在给药9.67和4.33 h达峰, 离子液体组的最大血药浓度[Cmax = (135.00 ± 37.24) μg·L-1] 远大于混悬剂组[Cmax = (45.98 ± 14.75) μg·L-1], 这些参数的差异说明在相同剂量(10 mg·kg-1) 下, 离子液体能有效提高CsA的口服吸收。相比于CsA混悬剂, CsA-COCA制剂组CsA的血药浓度具有更大误差, 可能是由于CsA-COCA的口服吸收存在较大的个体差异性。

|
Figure 3 Blood mean concentration-time profile of CsA after single dose administration of CsA-COCA and CsA-suspension in rats respectively. |
|
Table 2 Pharmacokinetic parameter of CsA in rat blood after oral administration of CsA-COCA and CsA-suspension. *P < 0.05 vs CsA-suspension ( |
本研究以胆碱碳酸氢盐和香茅酸1∶2的摩尔比采用一步中和法制备了COCA, 将CsA原料药溶解在COCA中, 只需超声即可完成CsA-COCA的制备, 将CsA-COCA灌装于胶囊中即可给药, 制剂的制备不需要特殊设备, 具有操作工艺简单, 易于放大的优点。
由于CsA在血中与血浆蛋白和红细胞结合率很高, 33%~47%存在于血浆中, 4%~9%存在于淋巴细胞, 5%~12%存在于粒细胞, 47%~58%集中在红细胞, 且入血后药物能快速分布到红细胞中, 故选择全血作为检测CsA的基质[26], 基于AB SCIEX API4000质谱平台及SHIMADZU LC-20AD液相平台, 建立了LC-MS/MS分析方法。
离子液体已被广泛用于提高难溶性药物的溶解度, CsA固体粉末加入到离子液体COCA中短时超声后, 即可得到澄清透明的液态制剂。目前药物的研究、生产和监管重点在固体活性成分, 而忽略了液体形式。离子液体增溶难溶性药物制成液体制剂, 与固体形式相比, 液体形式制剂有更好的溶解性、吸收性和稳定性, 更易被机体吸收[27]。此外, CsA离子液体制剂在水相中稀释可形成较稳定的纳米复合物, 随着稀释倍数的增加, 粒径变化没有显著性差异, 与文献中疏水型离子液体在水相中可形成稳定的纳米复合物的结论一致[4, 28], 表明CsA能很好地增溶在COCA中, 还提示CsA-COCA口服后, 可能在消化道内随着胃肠蠕动被消化液稀释成具有纳米结构的复合物。CsA可能以氢键及疏水相互作用力与COCA作用而增溶在离子液体中, 在肠道内, 随着消化液稀释形成易被吸收的具有微观结构的单元[4], 另外, IL结构中的长链烷烃结构可能起到表面活性剂的作用, 通过扰乱肠上皮细胞膜而提高药物的渗透性[28], 胆碱基IL的亲水基团还可促进药物的细胞旁转运[5], 因而CsA的口服吸收得到提高, 相应机制还需要更进一步研究来证明。
此外, 本研究选用了COCA这一种离子液体, 对离子液体能否促进BCS Ⅳ类药物CsA的口服吸收进行了初步研究, 后续还需筛选有潜力的其他离子液体, 进一步优化处方, 以期得到更理想的制剂, 促进离子液体在难溶性药物口服递送方面的应用转化。
作者贡献: 闫鑫和曹玉珍负责研究工作的实施及论文初稿的撰写; 姜小梅和汪曣协助论文修改; 石玉杰负责论文选题、研究工作指导与论文修改。
利益冲突: 所有作者声明不存在任何利益冲突。
| [1] |
Lei Z, Chen B, Koo YM, et al. Introduction: ionic liquids[J]. Chem Rev, 2017, 117: 6633-6635. DOI:10.1021/acs.chemrev.7b00246 |
| [2] |
Deetlefs M, Fanselow M, Seddon KR. Ionic liquids: the view from mount improbable[J]. RSC Adv, 2016, 6: 4280-4288. DOI:10.1039/C5RA05829E |
| [3] |
Egorova KS, Gordeev EG, Ananikov VP. Biological activity of ionic liquids and their application in pharmaceutics and medicine[J]. Chem Rev, 2017, 117: 7132-7189. DOI:10.1021/acs.chemrev.6b00562 |
| [4] |
Shi Y, Zhao Z, Gao Y, et al. Oral delivery of sorafenib through spontaneous formation of ionic liquid nanocomplexes[J]. J Control Release, 2020, 322: 602-609. DOI:10.1016/j.jconrel.2020.03.018 |
| [5] |
Banerjee A, Ibsen K, Brown T, et al. Ionic liquids for oral insulin delivery[J]. Proc Natl Acad Sci U S A, 2018, 115: 7296-7301. DOI:10.1073/pnas.1722338115 |
| [6] |
Angsantikul P, Peng K, Curreri AM, et al. Ionic liquids and deep eutectic solvents for enhanced delivery of antibodies in the gastrointestinal tract[J]. Adv Funct Mater, 2020, 31: 2002912. |
| [7] |
Guada M, Beloqui A, Kumar M, et al. Reformulating cyclosporine A (CsA): more than just a life cycle management strategy[J]. J Control Release, 2016, 225: 269-282. DOI:10.1016/j.jconrel.2016.01.056 |
| [8] |
Rohan G, Neha D. BCS class Ⅳ drugs: highly notorious candidates for formulation development[J]. J Control Release, 2017, 248: 71-95. DOI:10.1016/j.jconrel.2017.01.014 |
| [9] |
Wang K, Qi JP, Weng EF, et al. Enhancement of oral bioavailability of cyclosporine A: comparison of various nanoscale drug-delivery sustems[J]. Int J Nanomedicine, 2014, 9: 4991-4999. |
| [10] |
Guan P, Lu Y, Qi J, et al. Enhanced oral bioavailability of cyclosporine A by liposomes containing a bile salt[J]. Int J Nanomedicine, 2011, 6: 965-974. |
| [11] |
Keohane K, Rosa M, Coulter IS, et al. Enhanced colonic delivery of ciclosporin A self-emulsifying drug delivery system encapsulated in coated minispheres[J]. Drug Dev Ind Pharm, 2016, 42: 245-253. DOI:10.3109/03639045.2015.1044905 |
| [12] |
Guada M, Lana H, Gil AG, et al. Cyclosporine A lipid nanoparticles for oral administration: pharmacodynamics and safety evaluation[J]. Eur J Pharm Biopharm, 2016, 101: 112-118. DOI:10.1016/j.ejpb.2016.01.011 |
| [13] |
Tsipotis E, Gupta NR, Raman G, et al. Bioavailability, efficacy and safety of generic immunosuppressive drugs for kidney transplantation: a systematic review and meta-analysis[J]. Am J Nephrol, 2016, 44: 206-218. DOI:10.1159/000449020 |
| [14] |
Beig A, Miller JM, Lindley D, et al. Head-to-head comparison of different solubility‐enabling formulations of etoposide and their consequent solubility-permeability interplay[J]. J Pharm Sci, 2015, 104: 2941-2947. DOI:10.1002/jps.24496 |
| [15] |
Yan R, Xu L, Wang Q, et al. Cyclosporine A nanosuspensions for ophthalmic delivery: a comparative study between cationic nanoparticles and drug-core mucus penetrating nanoparticles[J]. Mol Pharm, 2021, 18: 4290-4298. DOI:10.1021/acs.molpharmaceut.1c00370 |
| [16] |
Zhao P, Zhang XQ, Jiang XH, et al. LC-MS/MS determination of cyclosporine A in Beagle blood and bioequivalence study of cyclosporine A microemulsion[J]. Chin J Pharm Anal (药物分析杂志), 2015, 35: 1965-1970. |
| [17] |
Wu ZH. A New Method for Liquid Chromatography Coupled with Tandem Mass Spectrometry Method by Detection of Four Immunosuppressants in Whole Blood and Dried Blood Spots (LC-MS/MS法定量检测全血和干血斑中4种免疫抑制剂的研究) [D]. Tianjin: Tianjin University, 2020.
|
| [18] |
Zhai XH, Liu XX, Lu JQ, et al. Establishment of LC-MS/MS assay for the determination of blood immunosuppressive agents level simultaneously[J]. Chin Hosp Pharm (中国医院药学杂志), 2019, 39: 774-780. |
| [19] |
Guo W, Chen WX, Shang H, et al. Recommendations for clinical application of liquid chromatography-mass spectrometry[J]. Chin J Lab Med (中华检验医学杂志), 2017, 40: 770-779. |
| [20] |
Sobolesky PM, Smith BE, Hubbard JA, et al. Validation of a liquid chromatography-tandem mass spectrometry method for analyzing cannabinoids in oral fluid[J]. Clin Chim Acta, 2019, 491: 30-38. DOI:10.1016/j.cca.2019.01.002 |
| [21] |
Song S, Yu HZ, Zhu CL, et al. Cyclosporin A osmotic pump tablets which can form supersaturated micelles[J]. Acta Pharm Sin (药学学报), 2019, 54: 22-28. |
| [22] |
Han YH, Ouyang P, Zhang YF, et al. Comprehensive analysis of chloroaluminate and composite ionic liquids using direct analysis in real time mass spectrometry[J]. Sci China Chem (中国科学: 化学), 2020, 50: 720-728. |
| [23] |
Cecchini MM, Steinkoenig J, Reale S, et al. Universal mass spectrometric analysis of poly(ionic liquid)s[J]. Chem Sci, 2016, 10: 1039. |
| [24] |
Steinkoenig J, Cecchini MM, Goldmann AS, et al. Just add salt: a mass spectrometric analysis method for imaging anion‐exchanged poly(ionic liquid)s[J]. Macromol Rapid commun, 2016, 37: 1662-1666. DOI:10.1002/marc.201600376 |
| [25] |
Liu WH. Synthesis and Study on Extraction of Benzimidazolium Ionic Liquids (苯并咪唑类离子液体的合成及其萃取性能研究)[D]. Jinan: Shandong University, 2019.
|
| [26] |
Peng Y, Huang H, Nie B, et al. Research progress of individualized dosage regimens of cyclosporin A based on its population pharmacokinetics[J]. Prog Pharm Sci (药学进展), 2020, 44: 426-432. |
| [27] |
Shamshina JL, Kelley SP, Gurau G, et al. Chemistry: develop ionic liquid drugs[J]. Nature, 2015, 528: 188-189. DOI:10.1038/528188a |
| [28] |
Nurunnabi M, Ibsen KN, Tanner EEL, et al. Oral ionic liquid for the treatment of diet-induced obesity[J]. Proc Natl Acad Sci U S A, 2019, 116: 25042-25047. DOI:10.1073/pnas.1914426116 |
 2022, Vol. 57
2022, Vol. 57


