2. 中山大学附属第一医院, 科研与学科建设处, 广东 广州 510030
2. Research and Disciplinary Development Office, the First Affiliated Hospital, Sun Yat-sen University, Guangzhou 510030, China
近年来, 纳米递送系统在改善药物溶解度、稳定性、功效和靶向特异性等方面取得较为显著的成果。然而受限于机体的免疫原性、快速的血液清除率、载体的细胞毒性和较差的生物分布, 纳米制剂的临床转化研究仍处于起步阶段。以内源性生物材料为基础构建纳米载药系统, 作为一种潜在的治疗策略备受关注, 有望克服上述问题并增加治疗的有效性和安全性, 而其中以外泌体为基础进行药物递送已成为当今研究的热点。
外泌体是由细胞主动分泌、直径约40~100 nm、脂质双分子层包绕的囊泡小体, 可携带大量与其来源和功能密切相关的蛋白质、脂质和RNA分子, 几乎所有细胞均可分泌[1-3]。外泌体作为内源性载体, 具有天然的归巢能力, 与细胞膜有更高的亲和力, 能通过其表面的膜蛋白与靶细胞膜融合, 从而将其负载的药物直接运送到受体细胞[4], 同时极大地减小载体自身毒性及免疫原性, 保持良好的血浆稳定性。体外构建基于外泌体的载药系统受提取条件和负载药物方法的限制, 导致其血液半衰期短、靶向性较弱、药物包封率低, 尚不足以解决肿瘤的靶向治疗问题[5-7]。
已有报道通过对外泌体进行工程化改造, 在保留外泌体特性的同时, 引入其他载体或材料, 用以实现特定需求。例如, Srivastava等[8]将与多柔比星(doxorubicin) 偶联的金纳米颗粒负载于外泌体中构建nanosomes, 提高多柔比星在肺癌细胞中的分布并延长其作用时间(72 h)。Alvarez-erviti等[9]利用经特异性狂犬病病毒糖蛋白(rabies virus glycoprotein) 修饰的外泌体, 成功介导miRNA通过小鼠血脑屏障递送至大脑。又如, 将外泌体与脂质体膜融合构建杂化外泌体用于药物递送。已知人工合成的脂质体拥有与外泌体相似的膜结构, 具有高药物负载率、长循环性和表面易于修饰等优点, 是目前有广泛应用前景的纳米载药系统之一[10], 故将外泌体与脂质体膜融合后自组装, 以二者优势互补可获得兼具外泌体和脂质体特点的杂化外泌体[11-14]。
通过膜融合形成的杂化外泌体主要包括来自外泌体中源自癌细胞的细胞膜成分, 以及脂质体中外源性脂质和功能性脂质(如PEG) 所共同构成的脂膜成分。由于脂质体和外泌体均带负电, 这些带负电的膜成分重新自组装后, 最终可形成带负电的杂化外泌体。前期研究表明, 一般脂质膜的融合共包括4个步骤: 两种脂质膜发生紧密接触; 双层膜产生不稳定; 融合中间体的形成; 两者的内容物进行混合而最终完成融合[15]。作为膜融合过程中的关键步骤, 现有研究通过对脂质体间融合的探索, 已提出两种中间体, 即“反胶束(inverted micelles)”和“茎和跨膜接触(stalk and transmembrane contact, TMC)”[15-17]。在“反胶束”中间体中, 脂质烷基链平行于原始膜表面, 使相邻膜之间形成“反胶束”, 形成融合“孔”或直接导致层间附着[15, 17, 18], 从而完成融合。在“茎和跨膜接触”中间体中, 脂质烷基链可通过原始膜突出而形成三层结构, 使得外单层向侧面弯曲, 并与内单层连接形成茎后, 径向扩展成TMC排列[17-19], 进而由于曲率和间隙应力, 使TMC膨胀破裂并产生融合孔, 在张力诱导下融合孔扩张并重排, 最终完成膜融合。
目前常用的较为温和的杂化外泌体制备方法主要包含反复冻融法和37 ℃孵育法。然而, 有关杂化外泌体的制备方法和优化方面的报道有限, 上述2种制备方法对杂化外泌体的功能性质和实验重复性的潜在影响尚不清楚。故在本研究中, 应用薄膜分散法制备脂质体, 在最优培养时间内收集外泌体, 进而经冻融法和37 ℃孵育法分别制备所得的杂化外泌体, 并以粒径、zeta电位和膜融合度为指标, 对杂化外泌体的制备方法进行考察比较和表征研究, 以初步确定杂化外泌体在实验室规模下的最优制备条件。
材料与方法细胞系 人胰腺癌Panc0403和HuP-T3细胞系受赠于美国梅奥医学中心。Panc0403细胞培养在含有10%胎牛血清的DMEM培养液中; HuP-T3细胞培养在含有10%胎牛血清的RPMI1640培养液中; 细胞生长至汇合度到达80%~90%时, 用含0.25% EDTA的胰酶对细胞进行消化, 按1∶3~1∶5比例进行传代培养。所有细胞均培养在含5% CO2的37 ℃培养箱中。
材料与试剂 DMEM、RPMI1640、磷酸盐缓冲液(PBS)、0.25%胰蛋白酶-EDTA、青霉素-链霉素(中科迈晨北京科技有限公司); 新生胎牛血清(美国Grand Island公司); 蛋黄卵磷脂、胆固醇、香豆素6 (Sigma-Aldrich公司); PEG2000-DSPE [1, 2-distearoyl-sn-glycero-3-phosphoethanolamine-N-(polyethylene glycol)-2000, 上海艾伟拓医药科技有限公司]; NBD-DMPE [1, 2-distearoyl-sn-glycero-3-phosphoethanolamine-N-(7-nitro-2-1, 3-benzoxadiazol-4-yl) (ammonium salt)]、rho-DMPE [1, 2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(lissamine rhodamine B sulfonyl) (ammonium salt)]、DiD (1, 1′-dioctadecyl-3, 3, 3′, 3′-tetramethylindodicarbocyanine, 4-chlorobenzenesulfonate salt) (Thermo Fisher Scientific公司); 葡聚糖凝胶Sephadex G-50 (GE Healthcare公司); 甲醇、氯仿(北京通广精细化工公司); 30 kDa孔径超滤膜、200 mL超滤杯(Millipore公司); BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司); ExoQuick试剂盒(System Biosciences公司)。
主要仪器 Nano-ZS 90型激光粒度及电位分析仪(英国Malvern仪器公司); ELx800酶标仪(BioTek公司); 全内反射荧光显微镜(TIRFM, LEICA Microsystems公司); SpectraMax ID5多功能酶标仪(Molecular Device公司)。
香豆素6脂质体的制备 按照59∶39∶4的微摩尔比精密称取蛋黄卵磷脂、胆固醇和PEG2000-DSPE适量, 并以香豆素6∶脂材= 1∶200 (w/w) 的比例, 溶解于适当体积的氯仿中, 40 ℃旋转蒸发至完全除去有机溶剂形成膜, 加入适量蒸馏水至完全水化。水化后样品置于超声波细胞粉碎机中冰浴超声, 设置超声工作时间10 s, 间歇时间10 s, 全程时间6 min, 保护温度35 ℃。脂质体囊泡依次挤压通过孔径为400和200 nm的聚碳酸酯膜各1次。将制备得到的香豆素6脂质体通过葡聚糖凝胶Sephadex G-50层析柱洗脱, 收集脂质体洗脱液, 并将收集到的脂质体洗脱液用蒸馏水稀释到100 μmol·L-1 (磷脂浓度) 备用。
香豆素6含量的测定 采用荧光酶标仪法测定香豆素6的含量。配制浓度梯度为0.312 5、0.625、1.25、2.5、5和10 μg·mL-1的香豆素6标准溶液。在激发波长466 nm、发射波长506 nm处测定标准样品的荧光强度, 以荧光强度对浓度(C, μg·mL-1) 作线性回归绘制香豆素6的标准曲线图。
香豆素6脂质体的包封率和载药量测定 精密量取香豆素6脂质体1 mL上柱, 用蒸馏水进行洗脱, 接取脂质体洗脱液并测量其体积, 随后用甲醇稀释破膜。在激发波长466 nm、发射波长506 nm处测定其荧光强度, 计算脂质体中的药物含量(W脂)。同时, 精密量取未过柱的香豆素6脂质体100 μL, 用蒸馏水稀释到脂质体洗脱液相同体积, 加入等体积甲醇破膜, 在特定激发和发射波长处测定荧光强度, 计算总药量(W总)。
按公式(1) 计算包封率(EE):
| $ \mathrm{E}\mathrm{E}\left(\mathrm{\%}\right)=\frac{{W}_{\mathrm{脂}}}{{W}_{\mathrm{总}}}\times \mathrm{ }100\mathrm{\%} $ | (1) |
按公式(2) 计算载药量(DL):
| $ \mathrm{D}\mathrm{L}\left(\mathrm{\%}\right)=\frac{{W}_{\mathrm{脂}}}{{W}_{\mathrm{脂}\mathrm{总}}}\times \mathrm{ }100\mathrm{\%} $ | (2) |
其中, W脂总为脂质体的总重。
外泌体制备 采用ExoQuick试剂法结合超滤法分离、纯化和提取人胰腺癌Panc0403和HuP-T3细胞分泌至上清培养液中的外泌体。Panc0403和HuP-T3正常培养至密度为60%, 换为含无外泌体血清的培养基, 分别于24、48和72 h后收集细胞上清, 4 ℃、2 000 ×g离心10 min。上清液再于4 ℃、12 000 ×g离心30 min。取上清液经30 kDa超滤膜进行外泌体截取和浓缩。所得的含外泌体的浓缩液按ExoQuick沉淀剂/上清比例1∶5加入ExoQuick沉淀剂, 轻柔混合均匀后, 4 ℃竖直放置12 h以上。过夜沉淀后, 于4 ℃、1 500 ×g离心30 min, 收集沉淀, 再于4 ℃、1 500 ×g离心5 min, 即得到外泌体沉淀。用适量PBS混悬外泌体沉淀, 于4 ℃储存。
杂化外泌体制备 分别取质量浓度为300 μg·mL-1的外泌体和磷脂浓度为100 μmol·L-1的脂质体各2份。根据文献和预实验结果, 为保证样品的稳定性的同时提高膜融合度, 一份经冻融法制备—通过循环10次液氮冷冻-室温解冻10 min操作制备杂化外泌体[12]; 另一份采用孵育法—将外泌体和脂质体混合物于37 ℃孵育12 h[11], 得到杂化外泌体。
粒径及zeta电位的检测 采用动态光散射(dynamic light scattering, DLS) 测定制备的脂质体、外泌体和杂化外泌体的粒径和zeta电位。将外泌体、脂质体及杂化外泌体用去离子水适当稀释后, 置于专用测量杯中, 用激光粒度及电位分析仪测定其粒径、多分散指数(polydispersity index, PDI) 及zeta电位, 并比较三者的差异。
杂化外泌体融合指数的测定 荧光共振能量转移(fluorescence resonance energy transfer, FRET) 法定量测定脂质体与外泌体的融合程度。将1 mol% NBD-DMPE和rho-DMPE (体积比1∶1) 标记的脂质体100 μmol·L-1与外泌体混合, 采用冻融法或孵育法制备杂化外泌体, 使用SpectraMax ID5多功能酶标仪测量混合物的荧光, 在460 nm处激发NBD-DMPE, 测定溶液中NBD-DMPE (530 nm) 和rho-DMPE (588 nm) 的荧光强度。由于外泌体与脂质体的膜融合导致荧光脂质被稀释, 使得溶液中530 nm处的荧光强度增加, 588 nm处的强度降低。因此, 利用磷脂稀释率间接评价脂质体与外泌体的融合程度。按公式(3) 计算脂质体与外泌体混合物的FRET效率(EFD):
| $ {E}_{\mathrm{F}\mathrm{D}}=\frac{{F}_{530}}{{F}_{530}+{F}_{588}} $ | (3) |
其中, F530和F588分别代表530和580 nm处的荧光强度值[12]。
制备一系列分别含有0.650、0.500、0.250、0.125和0.063 mol% NBD-DMPE和rho-DMPE的脂质体标准溶液, 对应的磷脂稀释率分别为0.65、1、2、4和5。按照上述方法测定在530和588 nm波长处的各荧光强度值, 计算出FRET效率EFD, 并以磷脂稀释率为自变量, 对其相应的FRET效率EFD进行线性回归, 求得标准曲线。随后分别测定脂质体、孵育法和冻融法制备的HuP-T3杂化外泌体, 以及孵育法和冻融法制备的Panc0403杂化外泌体在530和580 nm处的各荧光强度值, 从而根据标准曲线计算出各自的膜融合度[12]。
超灵敏单分子动力学指纹图谱检测 采用TIRFM最大限度地捕获外泌体、脂质体和两者融合的实时图像。
将外泌体(300 μg·mL-1) 与DiD (10 μmol·L-1) 于37 ℃孵育30 min制得荧光外泌体。然后将所得的标记红色荧光的外泌体(300 μg·mL-1) 与带有绿色荧光的香豆素6脂质体(100 μmol·L-1) 等体积混合后, 分别按上述2种杂化方法得到荧光标记杂化外泌体。
取上述稀释10倍后的杂化外泌体10 μL于载玻片上, 轻轻加上盖玻片, 采用TIRFM在特定激发和发射波长下, 分别检测脂质体中香豆素6和外泌体中DiD的荧光, 再通过Image J软件分析脂质体与外泌体的融合程度。
数据分析与统计 本研究中每组实验至少重复3次, 实验数据以
采用荧光酶标仪对香豆素6的含量进行测定。在激发波长为466 nm、发射波长为506 nm条件下, 线性回归方程为: y = 8×107x + 2×107, R2 = 0.996 3, 线性范围为0.312 5~10 μg·mL-1, 符合制备脂质体的要求。
2 香豆素6脂质体的包封率和载药量采用荧光分光光度仪在激发波长466 nm、发射波长506 nm处分别测定过柱前后的荧光强度, 计算脂质体的EE和DL。结果表明, 香豆素6的EE为(99.16 ± 0.29) %, DL为(0.31 ± 0.29) %。
3 外泌体的提取和优化在细胞长至汇合度为60%时, 分别对HuP-T3细胞和Panc0403细胞用不含外泌体的血清培养24、48和72 h后, 采用BCA蛋白定量法计算外泌体产量。提取外泌体的产率如图 1所示, 在连续培养48 h后, 两种细胞系提取得到的外泌体产量最高。HuP-T3和Panc0403细胞系中外泌体产率分别为0.83 ± 0.07 mg/108细胞和0.79 ± 0.10 mg/108细胞。

|
Figure 1 Effect of cell culture time on the production of exosomes. n = 3, |
外泌体粒径和电位的测定结果如图 2所示, 所提取的外泌体的平均粒径为106.47 ± 4.39 nm (左图), PDI为0.29 ± 0.04, 说明粒径分布均一。Zeta电位为-0.66 ± 0.66 mV (右图), 说明外泌体在pH 7.4 (1×PBS) 条件下表面带负电荷, 这可能与外泌体膜的脂材和表面蛋白有关。
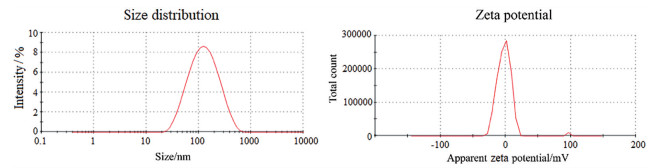
|
Figure 2 The size distribution and zeta potential of exosomes |
采用不同制备方法构建杂化外泌体并测定粒径和电位, 以比较观察其理化特性的区别。具体而言, 以激光粒度及电位分析仪测定杂化外泌体(冻融法)、杂化外泌体对照组(孵育0 h)、杂化外泌体(孵育12 h) 的粒径、PDI和zeta电位, 结果如表 1所示。与纯外泌体相比, 杂化外泌体的大小略增加, 这可能与杂化外泌体中水分子的相互作用点增加从而增加了水化层有关[13]; 冻融法制备的杂化外泌体的粒径和PDI值分别为119.9 nm和0.24, 均小于12 h孵育法制备的杂化外泌体, 且前者zeta电位为-11.45, 绝对值最大, 提示冻融法制备的杂化外泌体比孵育法制备的杂化外泌体稳定性更好。
|
Table 1 Physicochemical properties of hybrid exosomes prepared by different methods. n = 3, |
当含有两种荧光磷脂(NBD-DMPE和rho-DMPE) 的脂质体与外泌体膜融合形成杂化外泌体后, 由于外泌体膜成分的插入导致两种荧光磷脂距离变远, 共振能量转移荧光强度变弱。如图 3A、B所示, 相比脂质体的高峰值, 杂化外泌体的峰值降低。荧光脂质体的标准曲线为y = 0.054 3 x + 0.245 1, R2 = 0.990 2。结果表明, 磷脂稀释率在0.6~5内线性良好。随后, 分别测定脂质体、孵育法和冻融法制备的HuP-T3杂化外泌体、Panc0403杂化外泌体在530和580 nm处的荧光强度(图 3A、B) 并计算出各自的膜融合度(图 3C)。结果显示, 相比单一的脂质体, 杂化外泌体均显示出较高的磷脂稀释率, 即外泌体与脂质体膜融合程度较好, 而且, 经冻融法制备的HuP-T3细胞和Panc0403细胞的杂化外泌体均高于孵育法的膜融合率。
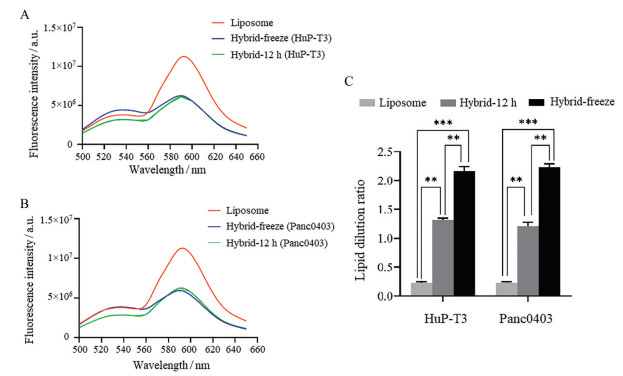
|
Figure 3 Fusion curves of hybrid exosomes under different methods. A: The fusion curve of hybrid exosomes derived from the HuP-T3 cells; B: The fusion curve of hybrid exosomes derived from the Panc0403 cells; C: Lipid dilution rate of different nano composites. n = 3, |
利用全内反射荧光显微镜(TIRFM) 检测技术进行单分子动力学指纹分析, 以实时观测到融合后杂化外泌体中分别以不同荧光标记的外泌体与脂质体。TIRFM检测结果如图 4所示, 脂质体中香豆素6呈现绿色荧光(激发波长466 nm, 发射波长504 nm) 而外泌体中DiD为红色荧光(激发波长644 nm, 发射波长665 nm)。图 4A、B分别展示脂质体和不同细胞来源(HuP-T3、Panc0403) 的外泌体经两种方法杂化后融合的共定位图像。由图可知, 脂质体和外泌体的荧光图像重叠后呈现橙色荧光, 更直观地观察到外泌体与脂质体的融合, 且融合程度也不尽相同。进一步证实了冻融法的杂化外泌体均比孵育12 h的杂化外泌体的融合程度更高。
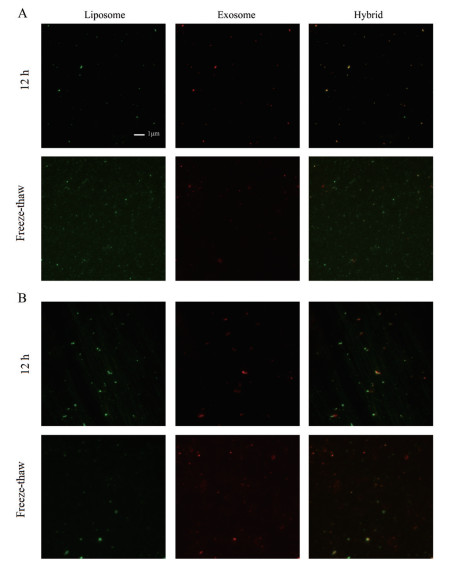
|
Figure 4 Quantitative characterizations of membrane fusion efficiency of hybrid exosomes made either by 12 h incubation or repeated freeze-thaw cycles by total internal reflection fluorescence microscopy (TIRFM). A: Membrane fusion efficiency between HuP-T3 derived exosomes and liposomes via two different methods; B: Membrane fusion efficiency between Panc0403 derived exosomes and liposomes via two different methods. Scale bar is 1 μm. Green indicates liposomes labeled with coumarin 6, and red indicates DiD-labeled exosomes, and orange indicates the colocalization between exosomes and liposomes analyzed by image J |
本研究分别采用冻融法和12 h孵育法, 经脂质体与外泌体膜之间自组装而制备杂化外泌体, 其融合机制可能也是通过产生“反胶束”或“茎和跨膜接触”中间体进行融合, 且具体融合机制可能受脂质成分的影响[20]。当然, 前期有关两种脂质体之间(因其不涉及脂膜相关蛋白的参与) 的融合机制是否完全阐释了杂化外泌体的融合, 仍需后续实验验证。此外, 外泌体膜中所含蛋白也可能通过与脂质体相互作用参与并促进融合。Sato等[12]研究表明, 在相同冻融条件下, 脂质体与外泌体间的融合效率要远高于脂质体间的融合效率(磷脂稀释率3.3 ± 0.2 vs 2.1 ± 0.1)。然而考虑到反复冻融及长时间孵育对蛋白功能和性质的影响, 这些膜蛋白在参与膜融合过程中的作用及其作用是否与生理条件相同, 目前尚不清楚, 有待于进一步确证。
评估了两种不同制备方法所得杂化外泌体的理化特性和融合率结果证明, 冻融法比12 h孵育法制备的杂化外泌体的稳定性更好, 融合率更高。作者推测, 冻融制备方法采用液氮冷冻和室温解冻的多次循环, 在高度冷冻区域(> 20 ℃·min-1) 可促使混合物中脂质体和外泌体迅速结冰, 进而产生较大压力, 诱导二者的磷脂双层膜脱水、破裂[21, 22]; 而水的凝固将导致剩余物质浓度增高, 促进脂质体与外泌体聚集或黏附, 因而更易于使相邻膜层之间发生融合[15, 23, 24]。反观孵育法的结果较不理想, 其可能与所选取的孵育温度和脂质体表面的PEG链有关。首先, 孵育温度过高可能导致其中的胆固醇限制膜流动, 而降低膜融合度。胆固醇对饱和脂质膜的流动性起着双重调节作用, 当温度过高时, 增加脂膜刚性, 而过低则增强膜的流动性[25]。已知蛋黄卵磷脂的相变温度大约在-4 ℃, 当孵育温度远高于相变温度时(如本实验选取的37 ℃), 为维持膜的稳定, 胆固醇会通过聚集磷脂并增加分子间作用力而限制脂质体的流动性, 因而不利于融合的发生; 其次, 较大比例的膜融合度发生在特定的温度条件下, 膜流动增加, 结构发生变化, 利于融合的发生[26, 27]。实验表明, 以蛋黄磷脂酰胆碱为材料的膜融合临界温度一般在43 ℃[26], 而本实验中采用37 ℃孵育可能使脂质体, 甚至外泌体膜处于不完全流动状态, 而致融合效率较低。当然, 本实验中外泌体膜成分及其最佳的膜融合温度尚需后续实验进一步确证。此外, 相比冻融法中通过冷冻脱水和浓缩促进外泌体和脂质体的膜之间相接触, 孵育法中的PEG枝链可能产生空间屏障, 一定程度上抑制了脂质体和外泌体膜相互靠近, 从而减少膜融合发生的可能[28, 29]。针对此问题, 后续孵育时通过给予适当的搅拌和调整杂化脂质体的制备顺序(先将脂质体和外泌体融合, 后用“后插入法”引入PEG枝链), 可能得以改善。总之, 受限于脂质体中磷脂的成分、电荷和盐浓度等影响因素[26, 27], 杂化外泌体的融合率和稳定性均有可能不同。在未来选取何种制备方法时还需权衡多方因素, 才能获得最优制备条件。此外, 也不排除尚有其他可能的影响机制, 例如不同特异性组织和细胞来源的外泌体与脂质体相融合的差异、外泌体膜成分的差异及脂质体的组成均有可能与杂化外泌体的稳定性和膜相容性有关, 尚有待进一步验证。
前期研究已证实, 外泌体相关标志蛋白CD9、CD81和Hsc70等, Western blot结果均显示杂化外泌体中仍含有上述蛋白[11, 13]; 此外, Sato和Cheng等[12, 14]分别对由特定基因修饰细胞分泌的外泌体蛋白HER2和CD47等进行观察比较发现, 外泌体和杂化外泌体中均表达上述蛋白。这些研究表明制备所得的杂化外泌体很好地保留了外泌体中相关标志蛋白, 提示其相应的功能特性可能也得以保持。并且, 透射电镜观察比较了杂化前后的形态学变化, 结果发现杂化外泌体、脂质体和外泌体均呈圆形, 膜融合前后的外泌体没有明显的形态差异[11, 12, 14]。由于本研究旨在考察比较两种不同杂化外泌体的制备工艺和表征, 因而对于外泌体杂化前后的蛋白表达和形态变化未进行详细比较, 尚有待后续实验加以确证。
本研究还发现, 在不改变人胰腺癌细胞状态和外界影响因素(饥饿、酸碱性等) 的前提下, 不同培养时间对细胞分泌外泌体的含量也有影响, 其产率随着培养时间延长而增加, 至48 h达到峰值后, 反而随时间延长而减少。目前, 有关外泌体释放的动力学研究并不常见, 作者初步推断这种现象可能与细胞增殖的半衰期、细胞密度和生长状态, 以及组织特异性等方面有关。有研究指出细胞接种密度是影响胞外囊泡产率的重要因素, 会随密度的增加而减少[30-32]。本研究中的HuP-T3细胞生长半衰期约为36 h, 随着培养时间的延长(72 h), 该细胞密度增大, 培养基中营养成分逐渐耗竭, 细胞状态可能因此而改变, 从而导致外泌体的生产效率降低。
已有报道提示, 杂化外泌体作为一种新型载药系统可更有效地改善药物的稳定性、靶向性和疗效, 降低免疫原性和不良反应。体外实验证明, 以带负电的脂质体制备所得的杂化外泌体展示了其对肿瘤细胞和同源亲本细胞良好的靶向和摄取能力[12, 13]。Lin等[11]采用孵育法制备得到载有CRISPR/Cas9表达载体的杂化外泌体, 且在间充质干细胞内表达被包裹的基因方面, 该载体展示出比脂质体更好的结果。此外, 体内和体外实验均验证了杂化外泌体对肿瘤细胞的强亲和力[12, 14], 与脂质体相比, 杂化外泌体具有靶向速度快、积累量大和作用时间长的特点[14]。
本研究也将为后续进一步利用杂化外泌体进行药物递送, 奠定了前期实验基础。将抗肿瘤药物包载后递送到实体瘤如胰腺癌组织中, 可进一步利用PEG链、抗体或靶向肽修饰以构建靶向性载药的杂化外泌体, 从而发挥其高生物相容性、药物释放可控性、高生物利用度和高细胞亲和力等优势, 并降低药物不良反应; 减少自身毒性及免疫原性。最终使药物产生高效、特异和稳定的抗肿瘤活性。
作者贡献: 周晓菲和庄月棠共同负责实验的数据收集、整理归纳和文章撰写; 李亮负责本研究的思路设计、实验指导和文章的撰写审阅; 姚红娟负责数据整理归纳和实验设计指导; 李睿和张丽参与文章的撰写和提供建议。
利益冲突: 所有作者声明本文无任何利益冲突。
| [1] |
Johnstone RM, Adam M, Hammond JR. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes)[J]. J Biol Chem, 1987, 262: 9412-9420. DOI:10.1016/S0021-9258(18)48095-7 |
| [2] |
Deng S, Zhang L, Wang P, et al. Design and in vitro evaluation of delivery systems for co-delivery of siRNA and proteins by mimetic exosomes[J]. Acta Pharm Sin (药学学报), 2020, 55: 139-145. |
| [3] |
Johnsen KB, Gudbergsson JM, Skov MN, et al. A comprehensive overview of exosomes as drug delivery vehicles-endogenous nanocarriers for targeted cancer therapy[J]. Biochim Biophys Acta, 2014, 1846: 75-87. |
| [4] |
Tian Y, Li S, Song J, et al. A doxorubicin delivery platform using engineered natural membrane vesicle exosomes for targeted tumor therapy[J]. Biomaterials, 2014, 35: 2383-2390. DOI:10.1016/j.biomaterials.2013.11.083 |
| [5] |
Kooijmans SAA, Stremersch S, Braeckmans K, et al. Electroporation-induced siRNA precipitation obscures the efficiency of siRNA loading into extracellular vesicles[J]. J Control Release, 2013, 172: 229-238. DOI:10.1016/j.jconrel.2013.08.014 |
| [6] |
Si Y, Kim S, Zhang E, et al. Targeted exosomes for drug delivery: biomanufacturing, surface tagging, and validation[J]. Biotechnol J, 2019, 15: e1900163. |
| [7] |
Takahashi Y, Nishikawa M, Shinotsuka H, et al. Visualization and in vivo tracking of the exosomes of murine melanoma B16-BL6 cells in mice after intravenous injection[J]. J Biotechnol, 2013, 165: 77-84. DOI:10.1016/j.jbiotec.2013.03.013 |
| [8] |
Srivastava A, Amreddy N, Babu A, et al. Nanosomes carrying doxorubicin exhibit potent anticancer activity against human lung cancer cells[J]. Sci Rep, 2016, 6: 38541. DOI:10.1038/srep38541 |
| [9] |
Alvarez-erviti L, Seow Y, Yin H, et al. Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes[J]. Nat Biotechnol, 2011, 29: 341-345. DOI:10.1038/nbt.1807 |
| [10] |
Abu Lila AS, Ishida T. Liposomal delivery systems : design optimization and current applications[J]. Biol Pharm Bull, 2017, 40: 1-10. DOI:10.1248/bpb.b16-00624 |
| [11] |
Lin Y, Wu J, Gu W, et al. Exosome-liposome hybrid nanoparticles deliver CRISPR/Cas9 system in MSCs[J]. Adv Sci (Weinh), 2018, 5: 1700611. DOI:10.1002/advs.201700611 |
| [12] |
Sato YT, Umezaki K, Sawada S, et al. Engineering hybrid exosomes by membrane fusion with liposomes[J]. Sci Rep, 2016, 6: 21933. DOI:10.1038/srep21933 |
| [13] |
Rayamajhi S, Nguyen TDT, Marasini R, et al. Macrophage-derived exosome-mimetic hybrid vesicles for tumor targeted drug delivery[J]. Acta Biomater, 2019, 94: 482-494. DOI:10.1016/j.actbio.2019.05.054 |
| [14] |
Cheng L, Zhang X, Tang J, et al. Gene-engineered exosomes-thermosensitive liposomes hybrid nanovesicles by the blockade of CD47 signal for combined photothermal therapy and cancer immunotherapy[J]. Biomaterials, 2021, 275: 120964. DOI:10.1016/j.biomaterials.2021.120964 |
| [15] |
Foldvari M. Observations of membrane fusion in a liposome dispersion: the missing fusion intermediate?[J]. F1000Res, 2020, 4: 4. |
| [16] |
Hafez IM, Cullis PR. Roles of lipid polymorphism in intracellular delivery[J]. Adv Drug Deliv Rev, 2001, 47: 139-148. DOI:10.1016/S0169-409X(01)00103-X |
| [17] |
OhtaIino S, Pasenkiewicz-Gierula M, Takaoka Y, et al. Fast lipid disorientation at the onset of membrane fusion revealed by molecular dynamics simulations[J]. Biophys J, 2001, 81: 217-224. DOI:10.1016/S0006-3495(01)75693-7 |
| [18] |
Bailey AL, Cullis PR. Lipid Polymorphism and Membrane Properties [M]. Vol 9. Toronto: Academic Press, 1997: 359-373.
|
| [19] |
Chernomordik LV, Kozlov MM. Membrane hemifusion: crossing a chasm in two leaps[J]. Cell, 2005, 123: 375-382. DOI:10.1016/j.cell.2005.10.015 |
| [20] |
Peter MK, Vijay S. Control of membrane fusion mechanism by lipid composition: predictions from ensemble molecular dynamics[J]. PLoS Comput Biol, 2007, 3: 2228-2238. |
| [21] |
Callow RA, Mcgrath JJ. Thermodynamic modeling and cryomicroscopy of cell-size, unilamellar, and paucilamellar liposomes[J]. Cryobiology, 1985, 22: 251-267. DOI:10.1016/0011-2240(85)90146-4 |
| [22] |
Costa AP, Xu X, Burgess DJ. Freeze-anneal-thaw cycling of unilamellar liposomes: effect on encapsulation efficiency[J]. Pharm Res, 2014, 31: 97-103. DOI:10.1007/s11095-013-1135-z |
| [23] |
Macdonald RC, Jones FD, Qiu R. Fragmentation into small vesicles of dioleoylphosphatidylcholine bilayers during freezing and thawing[J]. Biochim Biophys Acta, 1994, 1191: 362-370. DOI:10.1016/0005-2736(94)90187-2 |
| [24] |
Oku N, Macdonald RC. Differential effects of alkali metal chlorides on formation of giant liposomes by freezing and thawing and dialysis[J]. Biochem, 1983, 22: 855-863. DOI:10.1021/bi00273a023 |
| [25] |
Chakraborty S, Doktorova M, Molugu TR, et al. How cholesterol stiffens unsaturated lipid membranes[J]. Proc Natl Acad Sci U S A, 2020, 117: 21896-21905. DOI:10.1073/pnas.2004807117 |
| [26] |
Breisblatt W, Ohki S. Fusion in phospholipid spherical membranes I. Effect of temperature and lysolecithin[J]. J Membr Biol, 1975, 23: 385-401. DOI:10.1007/BF01870259 |
| [27] |
Prestegard JH, Fellmeth B. Fusion of dimyristoyllecithin vesicles as studied by proton magnetic resonance spectroscopy[J]. Biochemistry, 1974, 13: 1122-1126. DOI:10.1021/bi00703a011 |
| [28] |
Käsbauer M, Lasic DD, Winterhalter M. Polymer induced fusion and leakage of small unilamellar phospholipid vesicles: effect of surface grafted polyethylene-glycol in the presence of free PEG[J]. Chem Phys Lipids, 1997, 86: 153-159. DOI:10.1016/S0009-3084(97)02665-0 |
| [29] |
Mare R, Paolinob D, Celiacet C, et al. Post-insertion parameters of PEG-derivatives in phosphocholine-liposomes[J]. Int J Pharm, 2018, 552: 414-421. DOI:10.1016/j.ijpharm.2018.10.028 |
| [30] |
Patel DB, Gray KM, Santharam Y, et al. Impact of cell culture parameters on production and vascularization bioactivity of mesenchymal stem cell-derived extracellular vesicles[J]. Bioeng Transl Med, 2017, 2: 170-179. DOI:10.1002/btm2.10065 |
| [31] |
Théry C, Witwer KW, Aikawa E, et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines[J]. J Extracell Vesicles, 2018, 7: 1535750. DOI:10.1080/20013078.2018.1535750 |
| [32] |
Hessvik NP, Llorente A. Current knowledge on exosome biogenesis and release[J]. Cell Mol Life Sci, 2018, 75: 193-208. DOI:10.1007/s00018-017-2595-9 |
 2022, Vol. 57
2022, Vol. 57


