2. 中国药科大学药学院, 江苏 南京 211198
2. School of Pharmacy, China Pharmaceutical University, Nanjing 211198, China
药物共晶是指将一种活性药物与小分子辅料或另一种活性药物通过非共价键以固定化学计量比结合在同一晶格中形成的晶体[1], 共晶技术近几年来已成为改善药物溶解溶出度[2, 3]和生物利用度[4]、提高稳定性[5]、并获得新的适应症或降低不良反应的创新性晶体工程学技术[6]。由诺华公司研发经美国食品药品监督管理局(FDA) 和欧洲药品管理局(EMA) 批准上市的治疗心力衰竭的共晶制剂沙库比曲缬沙坦片[7], 即是运用共晶技术提高难溶性药物的溶解溶出度并产生协同药理作用的成功案例。
氯诺昔康(lornoxicam, LOR) 是一种具有解热镇痛和抗炎作用的昔康类非甾体抗炎药(nonsteroidal anti-inflammatory drugs, NSAIDs)[6], 其化学结构式如图 1A。LOR常用于治疗骨关节炎、类风湿关节炎、急性坐骨神经痛和腰痛等[8]。临床实践表明, 与许多其他NSAIDs一样, LOR可作为替代或佐剂用于治疗中度至重度疼痛, 并具有更好的耐受性[9]。LOR属于BCS Ⅱ类药物[10], 具有低溶解度、高渗透性的特点, 低溶解度已成为其体内生物利用度低的主要原因。且研究发现, LOR在压片过程中易发生层裂, 可压片性极差, 这些问题均会限制LOR固体制剂的开发。葛根素(puerarin, PUE) 是从中药葛根(Radix Puerariae) 中提取的主要活性成分[11], 化合物名称为8-β-D葡萄吡喃糖-4′, 7-二羟基异黄酮, 其化学结构式如图 1B。PUE为BCS Ⅳ类药物, 具有低溶解度、低渗透性的特点[12]。已有临床报道[13], PUE可改善微循环, 去除骨内的静脉淤积, 对治疗风湿性关节炎、类风湿性关节有确切疗效。LOR与PUE具有潜在的药理协同作用, 本研究将LOR和PUE制备成共晶, 以改善其溶解溶出度及可压片性, 为两者联合用药的制剂开发奠定基础。
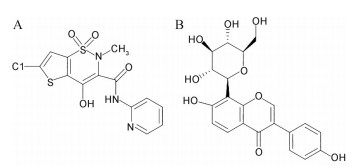
|
Figure 1 Chemical structures of lornoxicam (LOR, A) and puerarin (PUE, B) |
药品与试剂 LOR (纯度99.5%)、PUE (纯度99.5%) (浙江震元制药有限公司); 甲醇与乙腈均为色谱纯(上海安谱科技仪器有限公司); 实验用水由Milli-Q水纯化系统(美国Millipore公司) 制备; 其余试剂均为分析纯。
主要仪器 V20卡尔费休水分测定仪(瑞士梅特勒-托利多公司); FADT-800RC智能溶出仪(上海富科思分析仪器有限公司); 4350L型液压机(美国Carver公司); CJY-2C型片剂硬度仪(上海黄海药检仪器有限公司); 高效液相色谱仪(SPD-10A检测器, LC-10AD泵, LC-Solution色谱工作站)、Affinity-1S型傅里叶红外光谱仪(日本岛津公司); D8 Advance X-射线衍射仪(德国Bruker AXS公司); NETZSCH DSC 204 F1型差示扫描热分析仪、NETZSCH TG 209C型热重分析仪(德国Netzsch公司)。
LOR-PUE共晶的制备 称取LOR 371 mg (1.0 mmol) 和PUE 434 mg (1.0 mmol) 溶于200 mL甲醇-氯仿混合溶剂(40∶150) 中, 于55 ℃减压旋转蒸发, 室温条件下真空干燥24 h后, 即得LOR-PUE共晶氯仿溶剂化物。将LOR-PUE共晶氯仿溶剂化物在电阻炉内165 ℃加热5 min除去氯仿溶剂, 即得LOR-PUE共晶, 将上述产物过150目筛后置于室温干燥环境保存。
LOR-PUE共晶的物理化学表征
差示扫描量热法(differential scanning calorimetry, DSC) 采用差示扫描热分析仪对LOR晶体、PUE晶体、LOR和PUE晶体物理混合物、LOR-PUE共晶氯仿溶剂化物、LOR-PUE共晶进行热行为分析。称取约3 mg上述样品置于坩埚中, 升温速率10 ℃·min-1, 范围为50~250 ℃。
热重分析法(thermo-gravimetric analyzer, TGA)采用热重分析仪对LOR晶体、PUE晶体、LOR和PUE晶体物理混合物、LOR-PUE共晶氯仿溶剂化物、LOR-PUE共晶进行热重分析。称取约3 mg上述样品置于坩埚中, 升温速率10 ℃·min-1, 范围为25~300 ℃。
粉末X-射线衍射法(powder X-ray diffraction, PXRD) 使用X-射线衍射仪进行分析, 以Cu靶Kα射线为光源进行样品X-射线衍射。使用石墨单色仪和0.3 mm单针孔准直仪, 以反射模式进行样品的PXRD测量。管电压和电流强度分别设定为50 kV和50 mA, 波长为1.540 6 Å, 步长0.02°, 扫描速度为2°·min-1。将样品置于单晶硅样品盘上, 收集5~40°/2θ内的谱图。
傅里叶红外光谱法(Fourier transform infrared spectroscopy, FTIR) 将1 mg样品(LOR晶体、PUE晶体、LOR和PUE晶体物理混合物、LOR-PUE共晶氯仿溶剂化物、LOR-PUE共晶) 与200 mg干燥KBr进行混合、研磨后, 压成透明薄片。采用红外光谱仪进行扫描, 扫描次数32次, 波数范围为400~4 000 cm-1。
化学计量比的测定 称取LOR-PUE共晶10 mg于25 mL量瓶中, 精密称定, 加入二甲基亚砜溶解并定容至刻度, 摇匀。精密移取上述溶液1 mL于10 mL量瓶中, 加入流动相溶解并定容至刻度。取上述续滤液20 μL采用下述HPLC法进样测定, 记录色谱图。计算LOR与PUE物质的化学计量比。
HPLC分析方法 采用Shimadzu LC-2010 AHT HPLC系统, 色谱柱为Ultimate XB-C18柱(250 mm × 4.6 mm, 5 μm); LOR与PUE的检测波长分别为376和250 nm; 流动相中水相为磷酸盐缓冲液(pH 5.0), 有机相为90%乙腈水溶液, 按照表 1所示程序进行梯度洗脱; 流速为1 mL·min-1; 柱温40 ℃; 灵敏度0.05 aufs; 进样量20 μL。LOR和PUE的线性范围分别为0.16~19.25和0.21~25.49 μg·mL-1。该方法分离度良好, 重复性好、准确度高。
| Table 1 Mobile phase ratio |
溶解度与溶出度测定
平衡溶解度测定 分别以水和磷酸盐缓冲溶液(pH 4.5、6.8、7.4) 为介质, 采用《中国药典》规定的摇瓶法进行LOR晶体、PUE晶体、LOR和PUE晶体物理混合物、LOR-PUE共晶的平衡溶解度测定。分别称取过量的各样品至具塞玻璃试管中, 加入4 mL上述不同介质, 在恒温25 ℃条件下震荡48 h后, 经0.22 μm亲水聚四氟乙烯(poly tetra fluoroethylene, PTFE) 微孔滤膜过滤并经适当稀释后注入HPLC进行测定, 每组平行3次。此外, 还对LOR-PUE共晶在上述4种介质中的动态溶解度进行测定。分别称取过量的LOR-PUE共晶, 加入12 mL上述不同介质, 在恒温(25 ℃) 条件下震荡, 分别于0.5、1、2、4、6、8、12、18、24和48 h取样1 mL后, 经0.22 μm亲水PTFE微孔滤膜过滤并经适当稀释后注入HPLC, 测定LOR的浓度, 每组平行3次。
粉末溶出实验 分别称取LOR晶体、PUE晶体、LOR和PUE晶体物理混合物、LOR-PUE共晶(相当于LOR 8 mg) 投入900 mL磷酸盐缓冲溶液(pH 7.4) 中, 介质温度为37 ℃, 搅拌桨转速设为50 r·min-1。在溶出过程中, 分别于3、5、10、20、30、45、60、90、120 min取样3 mL, 并及时补充3 mL等温的溶出介质。取出后的溶液经0.22 μm亲水PTFE微孔滤膜过滤并经适当稀释后进行HPLC测定, 每组样品平行3次。
特性溶出实验 特性溶出速率(intrinsic dissolution rate, IDR) 是指药物在表面积、溶出媒介和装置转速固定时的溶出速率[14]。作为一项动态测定过程, 其相比于平衡溶解度更能反映过程中的一些现象, 且可能与体内动力学更加密切相关[15]。
分别称取LOR晶体、PUE晶体、LOR和PUE晶体物理混合物、LOR-PUE共晶约250 mg粉末, 使用液压机进行压片。将上述压制的样品插入特性溶出装置样品槽中, 使其只有一个圆形表面与溶出介质接触, 其表面积为1.33 cm2。依照《中国药典》2020年版通则0931第二法(桨法) 装置, 900 mL水为溶出介质, 温度为37 ℃, 转速设定为50 r·min-1。在溶出过程中, 分别于1、3、5、10、20、30、45、60、80、100、120、150和180 min取样3 mL, 并及时补充3 mL等温的溶出介质。取出后的溶液经0.22 μm亲水PTFE微孔滤膜过滤并经适当稀释后进行HPLC测定, 按“化学计量比的测定”项下色谱条件进行分析, 每组样品平行3次。用单位表面积的累积溶出量(mg·cm-2) 对应时间(min) 绘制线性回归曲线, 该曲线的斜率即为特性溶出速率。
可压片性研究 为了避免样品粒径差异对可压片性能研究的影响, 压片前, 将LOR晶体、PUE晶体、LOR和PUE晶体物理混合物、LOR-PUE共晶均过100目(150 μm) 筛网预处理。实验时, 采用液压机进行压片, 分别称取约250 mg样品粉末并填充入模具中, 在1~5 ton压力范围内进行压片。压制好的片子在室温环境中放置48 h以使其充分恢复弹性形变。片剂的径向破碎力使用CJY-2C型片剂硬度仪测定, 通过公式(1) 计算抗张强度(σ, MPa)。
| $ \sigma =\frac{2F}{\pi DT} $ | (1) |
其中, F是测定的破碎力(N); D是片剂的直径(mm); T是片剂的厚度(mm)。以压片压力为横坐标、片剂的抗张强度为纵坐标绘制可压片性曲线。
稳定性研究 将LOR晶体、PUE晶体、LOR和PUE晶体物理混合物、LOR-PUE共晶分别置于40 ℃电热鼓风干燥箱、25 ℃/75% RH恒温恒湿箱中, 放置10、30和60天后取出, 对其含量进行测定, 分别评估高温和高湿条件对所制备共晶化学稳定性的影响。
结果与讨论 1 LOR-PUE共晶的物理化学表征 1.1 DSC和TGADSC图谱如图 2所示, LOR晶体在222.5 ℃出现尖锐的放热峰(图 2A-a), TGA表明在此温度下失重明显(图 2B-a), 说明LOR熔融时发生降解, 与文献中报道一致[16]。如图 2A-b所示, PUE晶体在115.9 ℃处出现较宽的吸热峰, TGA表明该过程失重4.2% (图 2B-b), 通过卡尔费休水分测定表明脱去的溶剂为水, 经计算脱水量表明PUE晶体为一水合物形式; 随着温度升高, 脱水后的PUE在215.2 ℃出现吸热熔融峰(图 2A-b), TGA图谱表明PUE无水物在220 ℃附近失重明显(图 2B-b), 表明在此温度发生了降解, 与文献报道一致[17]。
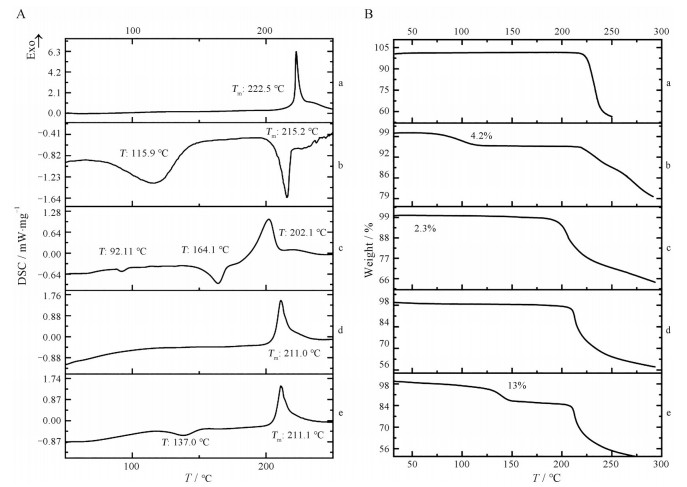
|
Figure 2 Differential scanning calorimetry (DSC) curves (A) and thermo-gravimetric analyzer thermograms (B) of LOR (a), PUE (b), physical mixture of LOR and PUE (c), LOR-PUE cocrystal (d) and LOR-PUE cocrystal solvate (e) |
如图 2A-c所示, LOR和PUE晶体的物理混合物在92.1 ℃出现脱水峰, 在164.1 ℃处出现的吸热熔融峰可能是由于二者产生了低共熔现象, 而在202.1 ℃产生的放热峰可能由剩余的LOR晶体降解导致的, 与TGA在200 ℃附近明显的失重现象相对应(图 2B-c)。
如图 2A-d所示, LOR-PUE共晶在211.0 ℃处存在不同于二者物理混合物的唯一吸热熔融峰, 表明了新固相物质的生成。TGA图谱表明, 该共晶在210 ℃左右失重明显(图 2B-d), 由此推断共晶的熔融与降解现象同时发生。
如图 2A-e所示, LOR-PUE共晶氯仿溶剂化物在137.0 ℃时出现脱溶剂吸热峰, 由TGA图谱可知, 该温度下脱溶剂比重为13% (图 2B-e), 经计算为一氯仿溶剂化物; 脱溶剂后, 在211.1 ℃处出现与无水共晶一致的熔融降解峰。
1.2 PXRD由图 3可知, LOR晶体的特征衍射峰位于8.78°、13.04°、13.86°、18.91°、21.56°、22.98°、24.71°和27.33°/2θ (图 3a), 与文献报道一致[13]。PUE晶体在23.68° 2θ处出现较强的特征衍射峰(图 3b), 与文献报道一致[18]。LOR和PUE晶体物理混合物的PXRD衍射峰为LOR和PUE晶体衍射峰的简单叠加(图 3c)。
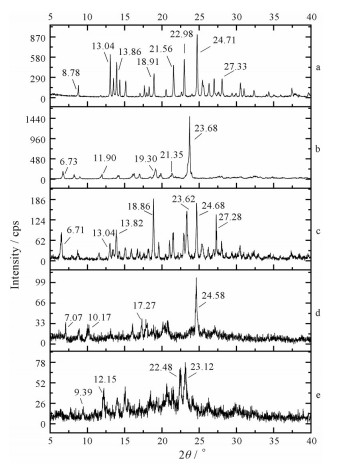
|
Figure 3 Powder X-ray diffraction patterns of LOR (a), PUE (b), physical mixture of LOR and PUE (c), LOR-PUE cocrystal solvate (d) and LOR-PUE cocrystal (e) |
LOR-PUE共晶氯仿溶剂化物的特征衍射峰位于7.07°、10.17°、17.27°和24.58°/2θ (图 3d), 与单体及物理混合物的衍射峰位差异较大, 表明形成了新的结晶形态。共晶溶剂化物脱去溶剂后衍射峰位出现显著变化, 位于9.39°、12.15°、22.48°和23.12°/2θ (图 3e), 说明氯仿分子可能参与了溶剂化物晶格结构形成, 脱溶剂改变了溶剂化物晶体结构。
1.3 FTIRLOR晶体的v(O-H)伸缩振动位于3 390 cm-1, v(N-H)伸缩振动位于3 064 cm-1, v(C=O)伸缩振动位于1 646 cm-1, v(N-H)弯曲振动位于1 593 cm-1 (图 4a); PUE的v(O-H)伸缩振动位于3 346 cm-1, v(C=O)伸缩振动位于1 632 cm-1 (图 4b), 与文献一致[19-21]。LOR和PUE晶体物理混合物的FTIR图谱为LOR和PUE晶体红外吸收峰的简单叠加(图 4c)。

|
Figure 4 Fourier transform infrared spectroscopy spectra for LOR (a), PUE (b), physical mixture of LOR and PUE (c), LOR-PUE cocrystal (d) and LOR-PUE cocrystal solvate (e) |
LOR-PUE共晶中LOR的v(N-H)伸缩振动和v(N-H)弯曲振动峰分别蓝移至3 093 cm-1和1 600 cm-1。此外, PUE的v(C=O)伸缩振动蓝移至1 639 cm-1 (图 4d), 初步推测PUE的羰基与LOR的仲胺基团之间形成了分子间氢键作用。
与LOR-PUE共晶的FTIR图谱比较, LOR-PUE共晶氯仿溶剂化物中v(C=O)伸缩振动由1 639 cm-1蓝移至1 643 cm-1 (图 4e), 这可能是氯仿的伯氢原子与LOR的羰基间发生相互作用, 从而形成溶剂化物。
2 化学计量比测定HPLC测定结果表明, LOR-PUE共晶中的LOR和PUE百分含量分别为(52.96 ± 0.56) %和(47.38 ± 0.61) %, 可推断在共晶中LOR和PUE的化学计量比为摩尔比1∶1。
3 溶解度与溶出度测定 3.1 平衡溶解度测定LOR晶体、PUE晶体、LOR和PUE物理混合物、LOR-PUE共晶的平衡溶解度如图 5所示, LOR与PUE的溶解度均呈pH依赖性, 且随着pH值升高, 溶解度增大。在纯水中, 物理混合物的溶解度与LOR晶体无显著性差异, 而共晶可以显著提高LOR的溶解度(约4倍, 图 5A); 在pH 4.5、6.8和7.4 PBS中, 共晶在48 h时的溶解度稍高于物理混合物和单独的LOR晶体, 但未表现出显著性差异。通过动态溶解度实验发现, 共晶中LOR的溶解在上述4种介质中于4 h内均能达到平衡, 直至24 h保持稳定。但24 h后药物浓度开始降低, 48 h时降至接近晶体LOR的溶解水平(除水中未降至LOR晶体的溶解度外), 这主要是由于共晶在水溶液中24 h后发生了相分离所致。在24 h前, 与LOR晶体相比, 共晶在pH 4.5、6.8、7.4及水中的溶解度分别提高了约7、3、3和8倍。由于LOR在体内的tmax为0.5 h, t1/2为3~5 h[22]。因此, 共晶在24 h内的较高溶解度将会加快药物在肠道的吸收及体内生物利用度的提高。
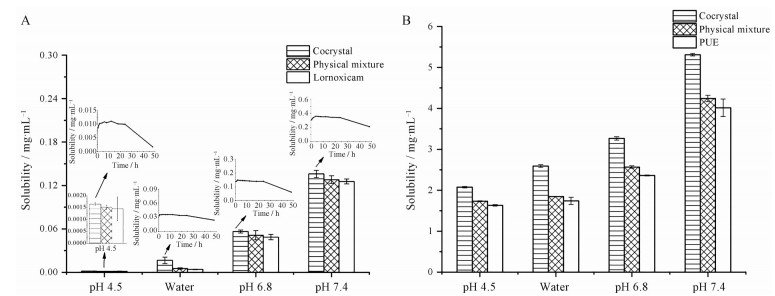
|
Figure 5 LOR (A) and PUE (B) solubilities for crystalline LOR, crystalline PUE, physical mixture of LOR and PUE, and LOR-PUE cocrystal in media with different pH values at 25 ℃. n = 3, |
在PUE的溶解度研究中, 形成共晶后可提高PUE在4种介质中的溶解度(1.3~1.5倍, 图 5B)。在实验中观察到, LOR-PUE共晶的润湿性优于其单独晶体及二者的物理混合物, 在保证粒径相同的条件下, 润湿性越好则表示药物的表面积越大, 从而使共晶体现较高的溶解度。此外, PUE的引入使得LOR形成共晶后晶格能改变, 这也将在某种程度上对共晶LOR的溶出产生影响, 从而改善了共晶的溶解性。
3.2 粉末溶出度LOR晶体、PUE晶体、LOR和PUE物理混合物、LOR-PUE共晶粉末在pH 7.4 PBS中的粉末溶出曲线如图 6所示, LOR晶体溶出较慢, 90 min时溶出度为90%; 物理混合物与其起点相同, 但速度稍快些, 30 min时溶出接近90%, 表明物理混合物中PUE的存在增加了LOR的溶出; LOR-PUE共晶的溶解速率显著高于LOR晶体和物理混合物, 20 min时溶出接近完全(图 6A)。此外, 与PUE晶体及物理混合物相比, 共晶中PUE的溶出明显增加, 在3 min时接近溶出完全(图 6B)。共晶在接触介质后, 水溶性更高的PUE从晶格中溶出进入到介质中, 共晶在溶液中瞬间“崩塌”, 留下类似于无定形结构的LOR, 呈现出无定形特有的高能态, 使得LOR浓度快速达到峰值, 并在较长一段时间内维持在高浓度水平, 在布洛芬-烟酰胺共晶的“弹簧-降落伞”模型研究中也出现类似的现象[23]。共晶不同于物理混合物与单独晶体药物的溶出行为, 表明了共晶溶出度的增加不仅是因为PUE的简单引入, 而是由于共晶的形成改变了LOR原有的晶格堆积和分子间相互作用[24]。
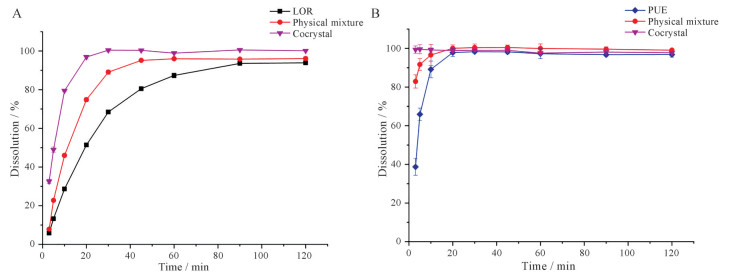
|
Figure 6 LOR (A) and PUE (B) dissolution profiles of crystalline LOR, crystalline PUE, physical mixture of LOR and PUE, and PUE and LOR cocrystal in pH 7.4 phosphate buffer. n = 3, |
由图 7可知, 对于LOR而言, LOR晶体、物理混合物和共晶的IDR分别为0.001 79、0.001 46和0.002 43 mg·cm-2·min-1。形成共晶后较单纯的LOR的溶出提高至1.36倍, 共晶中LOR的溶出均高于其单体和物理混合物, 表明共晶改善了LOR的溶出速率, 在黄芩素-咖啡因共晶多晶型的研究[25]中也存在类似的现象。而对于PUE在水中的特性溶出, PUE晶体的IDR为0.132 3 mg·cm-2·min-1, 共晶的IDR为0.184 9 mg·cm-2·min-1, 是PUE单体的1.40倍。
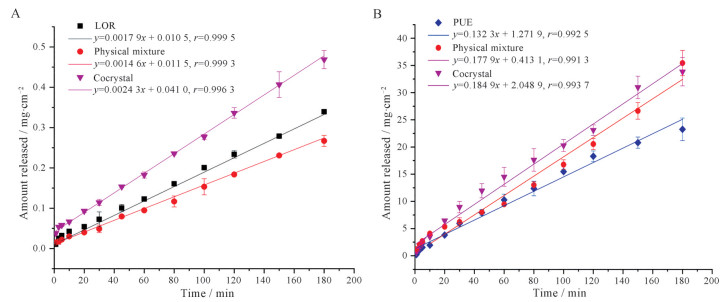
|
Figure 7 LOR (A) and PUE (B) intrinsic dissolution rates of crystalline LOR, crystalline PUE, physical mixture of LOR and PUE, and LOR-PUE cocrystal in water. n = 3, |
可压片性定义为在一定压力下粉末可被压制成具一定硬度片剂的能力[26]。LOR、PUE、物理混合物和LOR-PUE共晶的可压片性如图 8所示, LOR晶体的可压片性较差, 当压力范围在75~275 MPa时, LOR晶体难以压制成片; 当压力超过275 MPa时, 虽然可以压制成片, 但抗张强度较低, 且常有碎片现象发生。PUE可压片性较好, 但随着压力升高, 其抗张强度呈现先升后降的趋势, 这可能是由于压片压力过大导致药物粉体储存的弹性势能增加, 引起高压力下的弹性复原增加, 使得颗粒间键合面积减小, 从而导致可压片性下降[27, 28]。共晶的抗张强度在75~225 MPa内一直保持着增大的趋势, 且任一压力下的抗张强度均大于单独的LOR晶体和其物理混合物, 表明了共晶结构的形成显著改善了LOR的可压片性。粉末的可压片性与颗粒间的结合强度密切相关, 较强的非共价键(如氢键) 有利于形成较强的结合强度, 对稳定晶体结构起到重要作用。共晶的形成改变了LOR原有的分子排列方式, LOR与PUE通过非共价键(氢键) 形成共晶后, 增强了颗粒间的结合强度, 使得粉末在压片过程中嵌合的更加紧密[26]。

|
Figure 8 Tabletability of LOR, PUE, physical mixture of LOR and PUE, and LOR-PUE cocrystal. n = 3, |
为考察共晶组分之间的相容性, 将LOR晶体、PUE晶体、LOR和PUE物理混合物, 以及LOR-PUE共晶分别在高温40 ℃及25 ℃/75% RH条件下放置60天并考察其化学稳定性。如图 9所示, 上述几种样品在40 ℃条件下放置60天后, LOR和PUE的含量均无显著变化(98.0%~100.3%), 表明上述样品在高温条件下具有较好的化学稳定性。同时, LOR晶体、PUE晶体、LOR和PUE物理混合物, 以及LOR-PUE共晶在25 ℃/75% RH条件下放置60天后, LOR和PUE的含量也均无显著变化(97.3%~99.4%, 图 10), 表明上述样品在25 ℃/75% RH条件储存时具有较好的化学稳定性。综上分析, LOR-PUE共晶在高温40 ℃及25 ℃/75% RH条件下均表现出良好的化学稳定性。
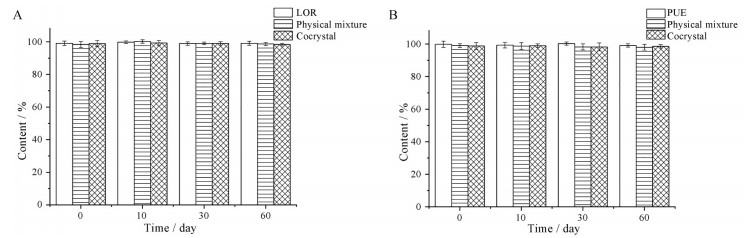
|
Figure 9 LOR (A) and PUE (B) contents of crystalline LOR, crystalline PUE, physical mixture of LOR and PUE, and LOR-PUE cocrystal after 60 days under 40 ℃ condition. n = 3, |

|
Figure 10 LOR (A) and PUE (B) contents of crystalline LOR, crystalline PUE, physical mixture of LOR and PUE, and LOR-PUE cocrystal after 60 days under 25 ℃/75% RH condition. n = 3, |
本实验采用减压旋转蒸发法制备LOR-PUE共晶。与单独LOR和PUE晶体相比, 共晶不仅提高了二者的特性溶出速率和平衡溶解度, 且明显改善了LOR的可压片性。稳定性实验表明, LOR-PUE共晶在高温和高湿条件下均具有良好的化学稳定性。本研究为提高难溶性药物的溶出速率及改善药物可压片性提供了理论及技术支持, 为今后联合用药的制剂开发奠定了研究基础。
作者贡献: 华韵和吴宇申负责实验设计和实施、结果分析及文章的撰写和修改; 郑道一、翁兴业和程冉参与实验操作、资料整理、文章图表格式处理与修改; 衡伟利、魏元锋、张建军和高缘参与理论指导, 负责对实验设计、数据分析、文章撰写和修改进行指导。
利益冲突: 所有作者声明本研究内容不存在任何利益冲突。
| [1] |
Gao Y, Zu H, Zhang JJ. Pharmaceutical cocrystals[J]. Prog Chem (化学进展), 2010, 22: 829-836. |
| [2] |
Gao Y, Zu H, Zhang JJ. Enhanced dissolution and stability of adefovir dipivoxil by cocrystal formation[J]. J Pharm Pharmacol, 2011, 63: 483-490. DOI:10.1111/j.2042-7158.2010.01246.x |
| [3] |
Weng XY, Pang ZT, Qian S, et al. Druggability enhancement by modification of physicochemical properties of drugs via crystal engineering[J]. Acta Pharm Sin (药学学报), 2020, 55: 2883-2891. |
| [4] |
Huang YT, Zhang BW, Gao Y, et al. Baicalein-nicotinamide cocrystal with enhanced solubility, dissolution, and oral bioavailability[J]. J Pharm Sci, 2014, 103: 2330-2337. DOI:10.1002/jps.24048 |
| [5] |
Peng B, Wang JR. Advances in drug-drug complexes based on the crystal engineering design[J]. Acta Pharm Sin (药学学报), 2020, 55: 2358-2367. |
| [6] |
Radhofer-Welte S, Rabasseda X. Lornoxicam, a new potent NSAID with an improved tolerability profile[J]. Drugs Today, 2000, 36: 55-76. DOI:10.1358/dot.2000.36.1.566627 |
| [7] |
Yu B, Ding JW, Wang XA. Progress of Entresto in the treatment of heart failure[J]. Hainan Med J (海南医学), 2018, 29: 1420-1422. |
| [8] |
Kidd B, Frenzel WA. Multicenter, randomized, double blind study comparing lornoxicam with diclofenac in osteoarthritis[J]. J Rheumatol, 1996, 23: 1605-1611. |
| [9] |
Das SK, Banerjee M, Mondal S, et al. A comparative study of efficacy and safety of lornoxicam versus tramadol as analgesics after surgery on head and neck[J]. Indian J Otolaryngol, 2013, 65: 126-130. |
| [10] |
Shah N, Patel R, Seth AK, et al. Solubility enhancement techniques as a strategy to improve the solubility of lornoxicam[J]. Pharma Sci Monit, 2015, 6: 168-175. |
| [11] |
Zhou YX, Zhang H, Peng C. Puerarin: a review of pharmacological effects[J]. Phytother Res, 2014, 28: 961-975. DOI:10.1002/ptr.5083 |
| [12] |
Tu LX, Yi YN, Wu W, et al. Effects of particle size on the pharmacokinetics of puerarin nanocrystals and microcrystals after oral administration to rat[J]. Int J Pharm, 2013, 458: 135-140. DOI:10.1016/j.ijpharm.2013.10.001 |
| [13] |
Xiao C, Li J, Dong XX, et al. Anti-oxidative and TNF-α suppressive activities of puerarin derivative (4AC) in RAW264.7 cells and collagen-induced arthritic rats[J]. Eur J Pharmacol, 2011, 666: 242-250. DOI:10.1016/j.ejphar.2011.05.061 |
| [14] |
Qiao N, Wang K, Schlindwein W, et al. In situ monitoring of carbamazepine-nicotinamide cocrystal intrinsic dissolution behavior[J]. Eur J Pharmacol, 2013, 83: 415-426. |
| [15] |
Lawrence XY, Carlin AS, Amidon GL, et al. Feasibility studies of utilizing disk intrinsic dissolution rate to classify drugs[J]. Int J Pharm, 2004, 270: 221-227. DOI:10.1016/j.ijpharm.2003.10.016 |
| [16] |
Zhang JJ, Tan X, Gao J, et al. Characterization of two polymorphs of lornoxicam[J]. J Pharm Pharmacol, 2013, 65: 44-52. |
| [17] |
Zhong ZY, Wu M, Qian S, et al. Inhibition of transformation from puerarin monohydrate to puerarin dihydrate by polyvinylpyrrolidones during dissolution[J]. Acta Pharm Sin (药学学报), 2017, 52: 302-308. |
| [18] |
Pang ZT, Wei YF, Wang NN, et al. Gel formation of puerarin and mechanistic study during its cooling process[J]. Int J Pharm, 2018, 548: 625-635. DOI:10.1016/j.ijpharm.2018.07.038 |
| [19] |
Gowda DV, Srivastava A, Aravind Ram AS, et al. Encapsulation of lornoxicam into spermaceti microspheres and comparative bioavailability study[J]. Int J Drug Deliv, 2014, 6: 7-13. |
| [20] |
Tao H, Meng Q, Li M, et al. HP-β-CD-PLGA nanoparticles improve the penetration and bioavailability of puerarin and enhance the therapeutic effects on brain ischemia-reperfusion injury in rats[J]. Naunyn Schmiedebergs Arch Pharmacol, 2013, 386: 61-70. DOI:10.1007/s00210-012-0804-5 |
| [21] |
Chen AZ, Li Y, Chau FT, et al. Application of organic nonsolvent in the process of solution-enhanced dispersion by supercritical CO2 to prepare puerarin fine particles[J]. J Supercrit Fluids, 2009, 49: 394-402. DOI:10.1016/j.supflu.2009.02.004 |
| [22] |
Skjodt NM, Davies DNM. Clinical pharmacokinetics of lornoxicam[J]. Clin Pharmacokinet, 1998, 34: 421-428. DOI:10.2165/00003088-199834060-00001 |
| [23] |
Wei YF, Zhang L, Wang NN, et al. Mechanistic study on complexation-induced spring and hover dissolution behavior of ibuprofen-nicotinamide cocrystal[J]. Cryst Growth Des, 2018, 18: 7343-7355. DOI:10.1021/acs.cgd.8b00978 |
| [24] |
Qiao N, Li M, Schlindwein W, et al. Pharmaceutical cocrystals: an overview[J]. Int J Pharm, 2011, 419: 1-11. DOI:10.1016/j.ijpharm.2011.07.037 |
| [25] |
Zhou SY, Zhang BW, Wei YF, et al. Enhanced dissolution and oral bioavailability of baicalein by cocrystallization[J]. J China Pharm Univ (中国药科大学学报), 2018, 49: 682-688. |
| [26] |
Cheng H, Wei YF, Wang SR, et al. Improving tabletability of excipients by metal-organic framework-based cocrystallization: a study of mannitol and CaCl2[J]. Pharm Res, 2020, 37: 130. DOI:10.1007/s11095-020-02850-8 |
| [27] |
Sun CC. Decoding powder tabletability: roles of particle adhesion and plasticit[J]. J Adhes Sci Technol, 2011, 25: 483-499. DOI:10.1163/016942410X525678 |
| [28] |
Wang CG, Paul S, Wang K, et al. Relationships among crystal structures, mechanical properties, and tableting performance probed using four salts of diphenhydramine[J]. Cryst Growth Des, 2017, 17: 6030-6040. DOI:10.1021/acs.cgd.7b01153 |
 2022, Vol. 57
2022, Vol. 57


