在全球范围内, 细菌感染已成为人类健康的巨大威胁。长期以来, 抗生素是治疗细菌感染性疾病最为广泛使用的疗法, 然而抗生素的滥用导致耐药菌的不断增加, 迫切需要开发新的非抗生素策略来快速杀灭细菌[1, 2]。近几年, 光热治疗(photothermal therapy, PTT) 作为一种治疗细菌感染的非侵入性治疗方法引起了人们的广泛关注[3]。PTT是在近红外激光(near-infrared light, NIR, 700~1 400 nm) 照射下, 利用光热纳米材料将光能转化为热能, 使局部温度升高, 导致细菌细胞膜破坏、蛋白质变性和生物被膜分散[4]。PTT具有组织渗透性、时空可控性、广谱抗菌及不产生耐药性等优点[5, 6]。目前已有各种各样的光热纳米材料被开发用于抗菌治疗, 包括石墨烯衍生物、碳基纳米共轭物、以金银为主的贵金属纳米材料、过渡金属二硫化物、纳米复合材料及聚合物等[7]。其中, 介孔碳纳米球(mesoporous carbon nanospheres, MCN) 以合成简单、特殊的三维结构、较高的光热转换效率和良好的生物相容性而备受关注[8, 9]。Meng等[10]构建了一个PTT与基因疗法协同抗癌的平台, 通过将聚乙烯亚胺接枝在具有光热转换性能的MCN上, 实现光热抗癌治疗。但是实现PTT的高效杀菌效果需要极高温度(55~65 ℃), 不可避免对正常细胞造成损伤。而温和的温度不足以在短时间内完全根除顽固性细菌感染[11]。因此, 单一PTT在治疗细菌性感染中并不如预期的有效。这些问题突出了对联合治疗和低温PTT治疗体系的需求。
银纳米粒(AgNPs) 已成为纺织行业、食品储存、容器和个人护理中最吸引人的商业化纳米材料之一, 表现出广谱抗菌活性, 且不引起细菌耐药性[12]。然而, 过量的AgNPs可能导致人类的腹痛(如痉挛、胃肠失调), 甚至死亡[13]。为了避免AgNPs过度使用的问题, 研究需专注于高抗菌效率和最低剂量的Ag+, 而不是直接使用AgNPs。银离子(Ag+) 在无机抗菌剂中占有主导地位, 其抗菌机制: 一种是Ag+与细菌蛋白质和酶的相互作用, 导致细菌细胞膜的严重结构变形; 另一种可能是高活性氧(reactive oxygen species, ROS) 的产生[14, 15]。因此, 迫切需要开发一种具有高效抗菌活性而减少贵金属Ag浪费, 以及良好生物相容性的Ag+传递系统。
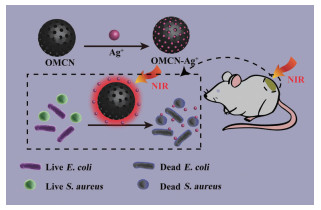
基于以上研究, 本课题拟采用氧化后的介孔碳纳米球(oxidized mesoporous carbon nanospheres, OMCN) 作为光热材料负载Ag+制备复合材料用于实现高效的体内外抗菌效果(OMCN的使用是为了提高MCN分散性), 如图 1所示。
|
Figure 1 Preparation of oxidized mesoporous carbon nanospheres-Ag+ (OMCN-Ag+) and its application in photothermal therapy (PTT) for local bacterial infection |
药品与试剂 苯酚(开封市德恩化学试剂有限公司); 甲醛、氢氧化钠(天津市福晨化学试剂厂); 硫酸、硝酸(开封化学试剂总厂); 甲醇(天津市富宇精细化工有限公司); 聚(乙二醇)-block-聚(丙二醇)-block-聚(乙二醇) (Pluronic F-127)、噻唑蓝染料[3-(4, 5-dimethylthiazol-2-yl)-2, 5-diphenyltetrazolium bromide, MTT] (上海阿拉丁生化科技股份有限公司); 硝酸银(部关科亚精细化工有限公司); 溴化钾(天津市科密欧化学试剂有限公司); 营养琼脂(北京陆桥技术有限责任公司); 蛋白胨、酵母浸粉(山东王宝生物科技有限公司); 二乙酸荧光素(fluorescein diacetate, FDA)、碘化丙啶(propidium iodide, PI) (北京索莱宝科技有限公司)。
仪器 Nano-ZS90型激光粒度及电位分析仪(英国马尔文仪器有限公司); JEM-2100型扫描电子显微镜(scanning electron microscope, SEM)、JEM-F200型透射电子显微镜(transmission electron microscope, TEM) (日本JEOL公司); Quadrasorb SI-4型比表面及孔隙度分析仪(美国康塔仪器公司); DX-2700B型X射线衍射仪(X-ray diffraction, XRD, 丹东浩元仪器有限公司); UV-2600型紫外可见分光光度计(UV-Vis, 日本岛津公司); VERTEX70型傅里叶变换红外光谱仪(FTIR, 德国布鲁克公司); iCAP-7200型ICP电感耦合等离子发射光谱仪(ICP-MS, 美国热电公司); ECLIPSE Ti2型倒置荧光显微镜(日本尼康公司)。
动物 昆明小鼠, SPF级, 雄性, 6~8周, 体重20~25 g, 购自山东斯科贝斯生物科技股份有限公司。合格证号: 410983211100001483, 生成许可证号: SCXK (豫) 2020-0005。本研究的全部动物实验按照河南大学动物实验伦理委员会的指导方针进行(HUSOM 2021-304)。
MCN的制备 取苯酚0.6 g和NaOH溶液(0.1 mol·L-1, 15 mL) 混合均匀, 再逐滴加入甲醛溶液(37 wt%, 2.1 mL), 置于70 ℃条件下搅拌30 min。之后再逐滴加入Pluronic F-127 (0.064 g·mL-1) 15 mL, 2 h后, 加入蒸馏水50 mL, 充分反应18~20 h。待反应结束, 量取反应液以一定比例进行稀释, 转移至反应釜中, 温度130 ℃, 持续24 h。随后, 冷却至室温并用蒸馏水洗涤3~5次, 再进行冷冻干燥。冻干产物冷却至室温, 蒸馏水洗涤3~5次, 冷冻干燥。产物在通氮气、700 ℃条件下持续碳化3 h, 即可获得MCN粉末[16]。
OMCN的制备 将制备的MCN溶解在蒸馏水中, 超声处理2 h, 然后在60 ℃温度下, 加入硫酸和硝酸体积比为3∶1的混合酸溶液反应5 h。用蒸馏水多次洗涤除去过量的酸后, 冷冻干燥, 即可获得OMCN粉末。
OMCN-Ag+的制备 精确称取5 mg OMCN粉末溶解在10 mL去离子水中, 超声分散30 min后, 缓慢加入盛有AgNO3 (1 mL, 0.1 mol·L-1) 溶液的三口烧瓶中。避光保温搅拌数小时, 以避免Ag+被氧化。待反应完全结束后, 自然冷却至室温, 取出产物。用去离子水和乙醇进行洗涤, 直至无游离的Ag+。真空干燥, 室温保存, 即可获得OMCN-Ag+粉末。
MCN、OMCN和OMCN-Ag+的表征 取MCN和OMCN溶液各10 µL滴于硅片上, 真空干燥过夜, 采用SEM观察MCN与OMCN的形貌; 取MCN、OMCN和OMCN-Ag+溶液各10 µL滴于铜网上, 真空干燥过夜, 用TEM观察MCN与OMCN的形态及OMCN-Ag+的元素分布; 取适量的MCN、OMCN干燥粉末分别平铺在样品台上, 通过XRD测定MCN与OMCN的晶型; 取适量干燥的OMCN粉末, 用比表面及孔隙度分析仪测定OMCN的孔径大小、比表面积和孔径分布; 取适量的MCN和OMCN的溶液, 用UV-Vis测定溶液的吸收光谱图; 取适量干燥的MCN和OMCN粉末, 分别加入溴化钾并研磨(质量比为1∶100), 压片, 用FTIR分析样品的化学键和官能团; 取适量的MCN、OMCN和OMCN-Ag+溶液, 用激光纳米粒度仪测定其粒径分布和zeta电位; 取OMCN-Ag+ (10 mg) 干燥粉末分散在磷酸盐缓冲液中(PBS, pH 7.4), 在37 ℃下搅拌混合物, 并在不同时间点取出1 mL溶液, 用ICP-MS测定银离子的释放量; 取适量干燥的OMCN-Ag+粉末铺在导电胶上, 用扫描电镜能谱(energy dispersive spectrometer, EDS) 进行检测分析OMCN-Ag+的元素组成。
光热性能检测 制备不同浓度(40、60、80 μg·mL-1) OMCN溶液, 分别使用不同功率的激光(808 nm, 1.0、1.5、2.0 W·cm-2) 进行照射, 以PBS作为对照, 通过温度的变化来评估OMCN的光热转换性能, 辐照过程中使用红外热成像仪记录溶液的温度变化。
细菌培养 所有抗菌实验采用的模型菌为革兰阳性菌金葡菌(S. aureus) 和革兰阴性菌大肠杆菌(E. coli)。将这两种菌培养基(蛋白胨、酵母浸粉、NaCl) 置于37 ℃环境中培养, 然后将菌悬液稀释至约1×104 CFU·mL-1的浓度。
材料抗菌活性 以S. aureus和E. coli为研究对象, 将适量的OMCN、Ag+及OMCN-Ag+分别与这两种菌悬浮液(1×104 CFU·mL-1) 混合, 共分为8组: PBS、PBS + NIR、OMCN、OMCN + NIR、Ag+、Ag+ + NIR、OMCN-Ag+和OMCN-Ag+ + NIR。PBS作为空白对照组, 光照组首先进行NIR (808 nm, 1.5 W·cm-2, 10 min) 照射, 随后置于摇床恒温孵育6 h (37 ℃, 120 r·min-1); 非光照组不进行NIR光照, 与细菌孵育10 min后直接置于摇床。孵育结束后, 分别吸取上述细菌悬浮液各100 μL, 进行平板涂布, 并在37 ℃培养18 h, 计数并记录菌落数量。在细菌活/死染色实验中, 将FDA (10 μL, 10 mg·mL-1) 和PI (5 μL, 1 mg·mL-1) 分别加入上述菌悬液(1 mL) 中, 在黑暗条件下孵育0.5 h, 通过倒置荧光显微镜观察细菌的染色情况。
体外生物相容性实验 采用MTT法测定OMCN和OMCN-Ag+对人体正常肝细胞HL-7702的细胞毒性。首先, 将HL-7702细胞接种在96孔板中(每孔1×104个细胞) 并孵育24 h。随后弃去培养基, 分别加入40 μg·mL-1 OMCN和OMCN-Ag+的培养基溶液, 在37 ℃下进一步孵育24 h。为了检测细胞活性, 首先去除培养基, 接着用PBS洗涤, 然后向每个孔中加入MTT溶液100 μL, 并在37 ℃下培养4 h, 随后, 在96孔板中加入100 μL DMSO溶解细胞。最后, 以630 nm为参比波长, 在490 nm处测定每孔的吸光度值, 计算细胞存活率。
体内抗菌实验 用生理盐水制备40 μg·mL-1的OMCN和OMCN-Ag+两种抗菌溶液。将40只雌性小鼠分为8组(PBS、PBS + NIR、OMCN、OMCN + NIR、Ag+、Ag+ + NIR、OMCN-Ag+和OMCN-Ag+ + NIR), 每组5只。麻醉后, 在小鼠背部通过手术形成直径为5 mm的创面, 用E. coli悬液(1×104 CFU·mL-1) 感染创面。24 h后, 在相应组的创面处分别滴加OMCN和OMCN-Ag+溶液, 10 min后, 光照组采用NIR (1.5 W·cm-2) 照射创面10 min, 非光照组不进行照射。随后, 自制无菌棉创可贴覆盖在伤口上, 每隔24 h更换1次。每天拍摄1次伤口, 治疗5天后, 切除创面组织进行组织病理学检查。此外, 为了检测体内抗菌活性, 手术后24 h, 每组的细菌样本均用无菌拭子从创面处采集, 放入5 mL液体培养基中, 在37 ℃下摇匀8 h。采用100 μL细菌悬液的培养液涂布在琼脂培养板, 在37 ℃孵育18 h形成细菌菌落。最后, 剪切小鼠的伤口感染部位, 用10%甲醛溶液固定, 常规石蜡包埋切片, 进行苏木精和伊红(H & E) 染色分析。
生物安全性评价 将上述实验中各组小鼠的主要器官(心、肝、脾、肺和肾) 用10%甲醛溶液固定, 常规石蜡包埋切片, 进行H & E染色后, 在光学显微镜下观察组织病理变化[17]。
统计学分析 所有数据以均数±标准差(
首先, 采用SEM观察了MCN与OMCN的形貌, 如图 1A、B所示, MCN和OMCN的尺寸在200~300 nm, 呈现均匀分散的球形, 表明氧化后MCN的形貌没有发生明显改变。然后, 采用TEM进一步分析MCN和OMCN的形貌, 如图 1C、D所示, 其直径大小与SEM结果相对应, 且具有明显的介孔结构, 说明氧化过程没有对MCN形貌产生影响。然后, 采用动态光散射(dynamic light scattering, DLS) 法对MCN和OMCN的粒径进行分析(图 1E), 结果表明氧化后的OMCN粒径大小并未发生较大改变, 而且分散性良好。采用XRD对其结构进行分析的结果见图 1F、G, MCN与OMCN在2θ值处的峰分别为21.5°和43.2°, 对应MCN特征晶型为002和100, 表明氧化后的OMCN的晶型没有发生改变。利用比表面及孔隙度分析仪测定OMCN比表面及孔体积大小结果见图 1H、I, 在P/P0 0.6~0.9处吸附分支有明显的跳跃, 表明OMCN具有介孔结构, 通过布鲁诺-埃梅特-特勒法可知OMCN的比表面积为490.371 m2·g-1, 孔径为3.157 nm, 孔容积为0.319 cm3·g-1。采用UV-Vis测定MCN与OMCN溶液的吸收光谱及对纳米材料的水分散性进行拍摄(图 1J), 相比MCN, OMCN在808 nm处有更强的吸收, 为OMCN的光热性能研究打下基础。此外, 水分散性结果表明, 氧化后的MCN分散性得到提高。根据文献报道[18], 氧化后MCN的FTIR有较明显的羧基峰的出现。本实验对MCN和OMCN进行了FTIR分析, 结果见图 1K。OMCN在1 723 cm-1处则出现一条吸收峰, 为-COOH的伸缩振动, 表明了MCN的氧化成功。图 1L是MCN、OMCN及OMCN-Ag+的zeta电位分析, 结果显示MCN氧化后的电位明显降低, 表明MCN表面大量的羟基基团转化为带负电荷的羧基基团, 所以测得的电位为负值, 但负载Ag+后, OMCN-Ag+的电位得到了大幅度提高, 这是因为Ag+中和了OMCN所带的负电荷, 表明银离子成功负载在OMCN上。银离子与OMCN的结合机制可归于OMCN表面大量带负电荷的羧基与带正电荷的银离子的作用。根据ICP-MS结果, 复合材料OMCN-Ag+中Ag+的包封率和载药量分别为1%和20.13 μg·mg-1。采用TEM对OMCN-Ag+的形貌及元素映射进行分析(图 1M), 负载Ag+的OMCN形貌及大小并没有发生改变, 与此同时, TEM元素分布结果表明了OMCN-Ag+中C、O、Ag的存在(图 1O~Q), 进一步验证该复合材料的成功制备。另外, 采用EDS对OMCN-Ag+进行了元素分析(图 1R), 检测出了C、O、Ag信号, 充分说明OMCN-Ag+复合材料的成功制备。

|
Figure 1 Scanning electron microscope (SEM) images of mesoporous carbon nanospheres (MCN, A) and oxidized mesoporous carbon nanospheres (OMCN, B). Transmission electron microscope (TEM) images of MCN (C) and OMCN (D). E: Size distribution of MCN and OMCN. F, G: X-ray diffraction (XRD) patterns of MCN and OMCN. H: N2 adsorption-desorption isotherms of OMCN. I: Pore-size distribution curve of OMCN. J: Ultraviolet and visible spectrophotometry (UV-Vis) spectra and corresponding dispersity photo of MCN and OMCN at a concentration of 40 μg·mL-1. K: Fourier transform infrared spectrometer (FTIR) spectra of MCN and OMCN. L: Zeta potential of MCN and OMCN. TEM images of OMCN-Ag+ (M). Dark-field TEM image of OMCN-Ag+ (N), and corresponding TEM elemental mappings of C-K (O), O-K (P), and Ag-L (Q) edge signals. R: Energy dispersive spectrometer (EDS) spectrum of OMCN-Ag+. S: Cumulative silver ion release profiles from OMCN-Ag+ samples. n = 3, |
为了评估负载到OMCN上Ag+是否能被充分利用, 对Ag+在水中的释放情况进行了研究, 采用ICP-MS分析了Ag+含量, 结果如图 1S所示, 70 h内Ag+的释放量约62.5%。OMCN-Ag+的释放机制可能是由于Ag+本身为亲水性, 较易溶解在水相介质中, 而OMCN与Ag+仅通过静电作用结合, 两者作用的叠加实现了对Ag+的缓释[19, 20]。
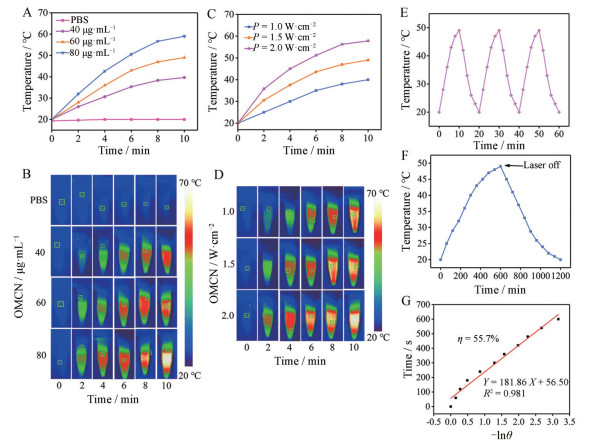
3 OMCN的光热性能测定根据UV-Vis测试结果, OMCN在808 nm处有良好吸收现象(图 1J), 因此采用808 nm激光(P = 1.0 W·cm-2) 对OMCN进行辐照, 测试其光热性能。如图 2A所示, 在808 nm激光照射不同浓度的OMCN悬浮液, 温度随辐照时间延长和OMCN浓度的增加而升高, 而PBS组的温度在相同条件下几乎没有变化, 这一结果与热红外成像记录的数据(图 2B) 相一致, 结果表明OMCN良好的光热性能具有浓度依赖性。为了进一步评价OMCN的光热效应, 采用不同的激光功率进行测试, 结果如图 2C所示, 在辐射相同时间内, OMCN (40 μg·mL-1) 的温度随激光功率的增加而升温, 图 2D所示的热红外成像数据也与之相对应, 表明OMCN的光热性能具有激光功率依赖性。此外, 还通过光热性能循环实验评估了OMCN的光热稳定性[21], 如图 2E所示, 经过3次激光开/关后, 温度升高幅度没有明显衰减, 说明OMCN能承受长时间的激光重复照射, 具有较高的光热稳定性。最后, 通过监测光热转换过程的温度来计算过热转换效率, 如图 2F、G所示, OMCN光热转换效率为55.7%, 这表明OMCN具有将808 nm NIR快速高效转化为热能的能力。
|
Figure 2 Photothermal effect of OMCN. A: Photothermal curves of OMCN at different concentrations (40, 60, and 80 μg·mL-1) irradiated with near infrared light (NIR) laser (808 nm, 1.0 W·cm-2); B: Corresponding infrared thermal images; C: Photothermal curves of OMCN (40 μg·mL-1) irradiated with NIR laser by different power intensities (808 nm, 1.0, 1.5, 2.0 W·cm-2); D: Corresponding infrared thermal images; E: Recycling-heating profiles of OMCN dispersion (40 μg·mL-1) irradiated for three on/off cycles; F: The photothermal response of the OMCN aqueous solution (40 μg·mL-1) for 600 s with an NIR laser (808 nm, 1.5 W·cm-2) and then the laser was shut off; G: Linear time data vs -lnθ obtained from the cooling period of E. Time constant (τs) for heat transfer from OMCN was determined to be 181.86 s by applying the linear time data from the cooling period (after 600 s) vs negative natural logarithm |
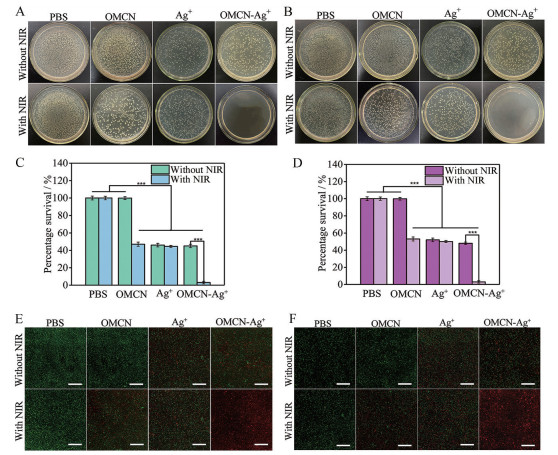
利用平板涂布法和细菌生长抑制实验来评估复合材料OMCN-Ag+对革兰阳性菌金葡菌(S. aureus) 和革兰阴性菌大肠杆菌(E. coli) 体外抗菌性能。如图 3A、B所示, 只有在NIR照射下, OMCN才对S. aureus和E. coli具有抗菌效果, 表现出广谱抗菌作用, 但杀菌率都仅为50%左右, 说明在温和的温度条件下难以达到高效的抗菌效果。而在非光照条件下, OMCN则完全没有抗菌作用, 此外, 无论是否具有光照条件, Ag+都表现出一定的抗菌效果。OMCN-Ag+在非光照的条件下杀菌率可达到47%以上, 证明Ag+的释放具有杀菌作用, 且OMCN-Ag+在NIR照射下对两种菌的杀菌率都达到了99%。此外, 细菌生长抑制实验(图 3C、D) 进一步评价了该体系联合抗菌能力, 结果证明协同杀菌的效果远高于单一抗菌作用。为了进一步解释上述体外抗菌作用, 采用活/死细菌细胞染色法来表征体外光热协同抗菌效果(图 3E、F), 此结果与平板涂布法结果(图 3A、B) 相一致, 更加充分验证了该体系具有较强的抗菌作用。
|
Figure 3 Photographs of bacterial colonies formed by Staphylococcus aureus (S. aureus, A) and Escherichia coli (E. coli, B) after exposed to PBS, PBS + NIR, OMCN, OMCN + NIR, Ag+, Ag+ + NIR, OMCN-Ag+ and OMCN-Ag+ + NIR. Concentration: 40 μg·mL-1. Percentage survival of S. aureus (C) and E. coli (D) after incubation with PBS, OMCN (40 μg·mL-1), OMCN-Ag+ (40 μg·mL-1) for 10 min without or with NIR laser irradiation (808 nm, 1.5 W·cm-2, 10 min), determined by measuring the optical density at 600 nm. n = 3, |
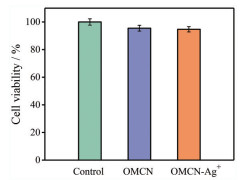
生物相容性是OMCN-Ag+在体内应用的先决条件。因此, 在OMCN-Ag+用于体内细菌感染治疗之前, 需评估其生物相容性。以不加纳米材料的细胞为空白对照, 测定OMCN-Ag+在抗菌浓度下(40 μg·mL-1) 人体正常肝细胞HL-7702的细胞毒性。如图 4所示, OMCN-Ag+对HL-7702细胞无细胞毒性。
|
Figure 4 In vitro cell viability of HL-7702 cells after treating with OMCN, OMCN-Ag+ respectively. n = 3, |
在小鼠背部创建E. coli感染的创面模型, 评估所设计体系的体内抗菌能力[22-24]。将40只小鼠分为8组(PBS、PBS + NIR、OMCN、OMCN + NIR、Ag+、Ag+ + NIR、OMCN-Ag+和OMCN-Ag+ + NIR), 观察5天内创面愈合情况。结果如图 5A所示, 在治疗3天后, 对照组和未光照处理组出现明显化脓, 在第5天时创面依然处于溃烂状态。而OMCN-Ag+ + NIR组小鼠创面的面积小, 并有恢复的趋势, 证明协同抗菌具有良好的治疗效果。利用H & E染色评估该抗菌体系对创面皮肤的治愈情况见图 5B, 在NIR照射下, 与对照组相比, OMCN-Ag+ + NIR组的小鼠皮肤组织并未观察到较多的炎症细胞及破损表皮。这些结果表明, OMCN-Ag+ + NIR能有效治疗细菌感染的创面部位。采用平板涂布法及计数法评估创面感染部位细菌的生长情况见图 5C、D, 在NIR照射下, OMCN-Ag+能有效杀灭细菌, 从而促进小鼠伤口的愈合。利用红外热像仪记录小鼠创面感染部位在NIR照射后的温度变化见图 5E, 在NIR照射10 min后, 加入OMCN-Ag+创面部位的温度明显升高, 而PBS + NIR组的温度无明显变化, 结果表明OMCN-Ag+在体内仍具有优异的光热转换性能。
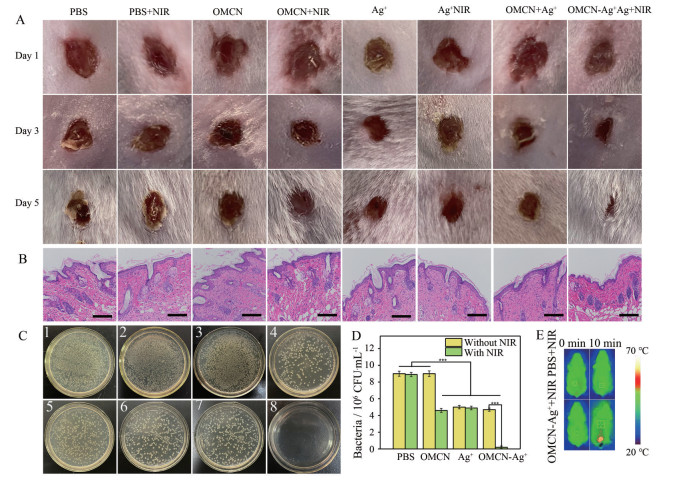
|
Figure 5 Antibacterial activity in vivo. A: Photographs of wound on the mice after different times during the therapeutic process; B: Photomicrographs showing section of skin tissues with H & E staining. Scale bars are 50 μm; C: The bacteria separated from wound tissue are cultured on agar plates (1. PBS, 2. PBS + NIR, 3. OMCN, 4. OMCN + NIR, 5. Ag+, 6. Ag+ + NIR, 7. OMCN-Ag+, 8. OMCN-Ag+ + NIR); D: The counted number of the surviving bacteria in the wound tissue. n = 3, |
为了研究OMCN-Ag+的体内生物安全性, 在创面感染治疗后, 采用H & E染色法对小鼠的主要器官(心、肝、脾、肺和肾) 进行组织学分析, 结果表明这些器官没有明显的组织学异常或损伤(图 6), 进一步证明了OMCN-Ag+具有良好的生物相容性。
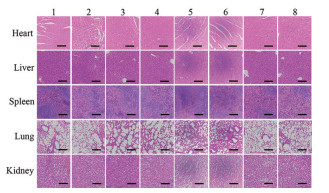
|
Figure 6 Histological analysis of the organs of mice after 5 days. 1: PBS; 2: PBS + NIR; 3: OMCN; 4: OMCN + NIR; 5: Ag+; 6: Ag+ + NIR; 7: OMCN-Ag+; 8: OMCN-Ag+ + NIR. Scale bars are 50 μm |
本研究成功构建了一个基于OMCN-Ag+的新型光热协同抗菌体系。该复合抗菌材料不仅可有效减少银离子的用量, 降低其生物毒性作用, 而且精确控制的温和光热可克服传统光热抗菌过程中温度过高对正常组织造成的损伤。体外和体内抗菌实验表明, OMCN-Ag+具有显著的协同抗菌作用和良好的生物安全性。研究结果表明, 通过将Ag+的释放与PTT结合, 能获得高效的抗菌活性, 为抗菌剂的开发提供了新的研究思路。
作者贡献: 马陇豫和刘超群提出研究思路及设计研究方案; 马陇豫、冯闪、张审和胜金金负责进行实验; 马陇豫、冯闪和张审采集和分析数据; 马陇豫和胜金金负责论文起草; 刘超群负责最终版本修订。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Yang X, Yang J, Wang L, et al. Pharmaceutical intermediate-modified gold nanoparticles: against multidrug-resistant bacteria and wound-healing application via an electrospun scaffold[J]. ACS Nano, 2017, 11: 5737-5745. DOI:10.1021/acsnano.7b01240 |
| [2] |
Sharma VK, Johnson N, Cizmas L, et al. A review of the influence of treatment strategies on antibiotic resistant bacteria and antibiotic resistance genes[J]. Chemosphere, 2016, 150: 702-714. DOI:10.1016/j.chemosphere.2015.12.084 |
| [3] |
Liu Y, Guo Z, Li F, et al. Multifunctional magnetic copper ferrite nanoparticles as fenton-like reaction and near-infrared photothermal agents for synergetic antibacterial therapy[J]. ACS Appl Mater Interfaces, 2019, 11: 31649-31660. DOI:10.1021/acsami.9b10096 |
| [4] |
Fan X, Yang F, Huang J, et al. Metal-organic-framework-derived 2D carbon nanosheets for localized multiple bacterial eradication and augmented anti-infective therapy[J]. Nano Lett, 2019, 19: 5885-5896. DOI:10.1021/acs.nanolett.9b01400 |
| [5] |
Wang M, Zhao Y, Chang M, et al. Azo initiator loaded black mesoporous titania with multiple optical energy conversion for synergetic photo-thermal-dynamic therapy[J]. ACS Appl Mater Interfaces, 2019, 11: 47730-47738. DOI:10.1021/acsami.9b17375 |
| [6] |
Su LN, Zhang JX, Deng YH, et al. Black phosphorus loaded with zinc ions for enhanced photothermal therapy of prostate cancer[J]. Acta Pharm Sin (药学学报), 2020, 55: 1666-1671. |
| [7] |
Xu JW, Yao K, Xu ZK. Nanomaterials with a photothermal effect for antibacterial activities: an overview[J]. Nanoscale, 2019, 11: 8680-8691. DOI:10.1039/C9NR01833F |
| [8] |
Peng L, Hung CT, Wang S, et al. Versatile nanoemulsion assembly approach to synthesize functional mesoporous carbon nanospheres with tunable pore sizes and architectures[J]. J Am Chem Soc, 2019, 141: 7073-7080. DOI:10.1021/jacs.9b02091 |
| [9] |
Qiu H, Pu F, Liu Z, et al. Depriving bacterial adhesion-related molecule to inhibit biofilm formation using CeO2-decorated metal-organic frameworks[J]. Small, 2019, 15: 1902522. DOI:10.1002/smll.201902522 |
| [10] |
Meng Y, Wang S, Li C, et al. Photothermal combined gene therapy achieved by polyethyleneimine-grafted oxidized mesoporous carbon nanospheres[J]. Biomaterials, 2016, 100: 134-142. DOI:10.1016/j.biomaterials.2016.05.033 |
| [11] |
Yang GG, Zhou DJ, Pan ZY, et al. Multifunctional low-temperature photothermal nanodrug with in vivo clearance, ROS-scavenging and anti-inflammatory abilities[J]. Biomaterials, 2019, 216: 119280. DOI:10.1016/j.biomaterials.2019.119280 |
| [12] |
Kim T, Zhang Q, Li J, et al. A gold/silver hybrid nanoparticle for treatment and photoacoustic imaging of bacterial infection[J]. ACS Nano, 2018, 12: 5615-5625. DOI:10.1021/acsnano.8b01362 |
| [13] |
Wu S, Li A, Zhao X, et al. Silica-coated gold-silver nanocages as photothermal antibacterial agents for combined anti-infective therapy[J]. ACS Appl Mater Interfaces, 2019, 11: 17177-17183. DOI:10.1021/acsami.9b01149 |
| [14] |
Cao F, Ju E, Zhang Y, et al. An efficient and benign antimicrobial depot based on silver-infused MoS2[J]. ACS Nano, 2017, 11: 4651-4659. DOI:10.1021/acsnano.7b00343 |
| [15] |
Li W, Dong K, Wang H, et al. Remote and reversible control of in vivo bacteria clustering by NIR-driven multivalent upconverting nanosystems[J]. Biomaterials, 2019, 217: 119310. DOI:10.1016/j.biomaterials.2019.119310 |
| [16] |
Sang Y, Huang Y, Li W, et al. Bioinspired design of Fe3+-doped mesoporous carbon nanospheres for enhanced nanozyme activity[J]. Chem Eur J, 2018, 24: 7259-7263. DOI:10.1002/chem.201801010 |
| [17] |
Wang C, Xiao Y, Zhu W, et al. Photosensitizer-modified MnO2 nanoparticles to enhance photodynamic treatment of abscesses and boost immune protection for treated mice[J]. Small, 2020, 16: 2000589. DOI:10.1002/smll.202000589 |
| [18] |
Fang Y, Gu D, Zou Y, et al. A low-concentration hydrothermal synthesis of biocompatible ordered mesoporous carbon nanospheres with tunable and uniform size[J]. Angew Chem Int Ed, 2010, 49: 7987-7991. DOI:10.1002/anie.201002849 |
| [19] |
Richter AP, Brown JS, Bharti B, et al. An environmentally benign antimicrobial nanoparticle based on a silver-infused lignin core[J]. Nat Nanotechnol, 2015, 10: 817-823. DOI:10.1038/nnano.2015.141 |
| [20] |
Zhang Y, Sun P, Zhang L, et al. Silver-infused porphyrinic metal-organic framework: surface-adaptive, on-demand nanoplatform for synergistic bacteria killing and wound disinfection[J]. Adv Funct Mater, 2019, 29: 1808594. DOI:10.1002/adfm.201808594 |
| [21] |
Hu D, Zou L, Li B, et al. Photothermal killing of methicillin-resistant Staphylococcus aureus by bacteria-targeted polydopamine nanoparticles with nano-localized hyperpyrexia[J]. ACS Biomater Sci Eng, 2019, 5: 5169-5179. DOI:10.1021/acsbiomaterials.9b01173 |
| [22] |
Yin W, Yu J, Lv F, et al. Functionalized nano-MoS2 with peroxidase catalytic and near-infrared photothermal activities for safe and synergetic wound antibacterial applications[J]. ACS Nano, 2016, 10: 11000-11011. DOI:10.1021/acsnano.6b05810 |
| [23] |
Qiao Y, He J, Chen W, et al. Light-activatable synergistic therapy of drug-resistant bacteria-infected cutaneous chronic wounds and nonhealing keratitis by cupriferous hollow nanoshells[J]. ACS Nano, 2020, 14: 3299-3315. DOI:10.1021/acsnano.9b08930 |
| [24] |
Dai X, Zhao Y, Yu Y, et al. Single continuous near-infrared laser-triggered photodynamic and photothermal ablation of antibiotic-resistant bacteria using effective targeted copper sulfide nanoclusters[J]. ACS Appl Mater Interfaces, 2017, 9: 30470-30479. DOI:10.1021/acsami.7b09638 |
 2022, Vol. 57
2022, Vol. 57


