2. 南京中医药大学国家教育部中药炮制规范化及标准化工程研究中心, 江苏 南京 210023;
3. 浙江中医药大学药学院, 浙江 杭州 310053;
4. 山西中医药大学中药与食品工程学院, 山西 晋中 030619
2. Engineering Center of State Ministry of Education for Standardization of Chinese Medicine Processing, Nanjing University of Chinese Medicine, Nanjing 210023, China;
3. School of Pharmacy, Zhejiang Chinese Medical University, Hangzhou 310053, China;
4. School of Chinese Medicine and Food Engineering, Shanxi University of Chinese Medicine, Jinzhong 030619, China
杜仲系杜仲科植物杜仲(Eucommia ulmoides Oliv.) 的干燥树皮, 是我国历史悠久的药用名贵中药材, 其性温, 味甘, 归肝、肾经, 具有补肝肾, 强筋骨, 安胎的功效[1]。杜仲化学成分群庞杂, 大致可分为木脂素类、环烯醚萜类、苯丙素类、有机酸类、黄酮类、萜类和甾体类、多糖类等, 具有降压、降血糖、抗骨质疏松、抗炎、肝肾保护、神经保护和抗肿瘤等药理作用[2, 3], 国内外临床应用广泛。
肾纤维化是各种慢性肾脏疾病的进行性进展, 主要病理基础为肾小管萎缩、细胞外基质异常增加和过度沉积, 导致肾小球硬化和肾间质纤维化, 最终可发展为肾功能衰竭直至终末期肾病[4]。近年来有学者研究发现, 杜仲提取物对糖尿病肾病[5]、高血压肾损伤[6]、腺嘌呤致肾损伤[7]等引发的大鼠肾纤维化均具有一定的抑制与改善作用, 但其药效物质基础尚不明确。根据中药血清药物化学的研究思路, 考察中药复杂成分中吸收入血的原形成分及其代谢产物将有助于药效物质基础的阐明[8]。目前有关杜仲入血成分的研究较少, 关于其代谢产物的研究也仅局限于几种单体化合物[9], 且不同状态下机体对药物的吸收与代谢存在差异[10], 缺乏对病理状态下整体入血原形成分及其代谢产物的探究。
因此, 本研究采用UHPLC-Q-TOF-MS/MS技术, 对腺嘌呤致肾纤维化模型大鼠灌胃杜仲提取物后的血中移行成分进行解析, 以期为阐明杜仲抗肾纤维化药效物质基础及其作用机制提供参考依据。
材料与方法仪器 Shimadzu 30AD超高效液相色谱仪(日本Shimadzu公司); Q-TOF-MS/MS 5600+质谱仪(美国AB Sciex公司); Milli-Q Intagral-3型超纯水仪(美国Millipore公司); GeneSpeedX1微量离心机(基因生物技术国际贸易有限公司); AG-285型十万分之一天平(瑞士Mettler Toledo公司); Multi Reax全能型涡旋振荡器(德国Heidolph公司); QE-500高速粉碎机(浙江屹立工贸有限公司); LC-C18 SPE固相萃取小柱(上海安谱实验科技股份有限公司)。
药物及试剂 杜仲购自浙江中医药大学中药饮片有限公司(批号: 190801), 经南京中医药大学中药鉴定教研室陈建伟教授鉴定为杜仲科植物杜仲Eucommia ulmoides Oliv.的干燥树皮; 甲醇(LC-MS级, 批号: 10929835751)、乙腈(LC-MS级, 批号: 10901229730) 均购自德国Merck公司; 甲酸(UPLC级, 批号: 75C1812LP) 购自美国Anaqua化学公司; 乙醇(分析纯, 批号: 20210325)、羧甲基纤维素钠(化学纯, 批号: 20200713) 均购自国药集团化学试剂有限公司; 腺嘌呤(批号: J10GS151411) 购自源叶生物科技有限公司(高纯, 98%); 肝素钠(批号: L1903067) 购自上海阿拉丁生化科技股份有限公司; 肌酐(批号: 20211015)、尿素氮(批号: 20210707) 检测试剂盒均购自南京建成生物工程研究所; 桃叶珊瑚苷(批号: 190109)、京尼平苷酸(批号: 190304)、京尼平苷(批号: 190322)、绿原酸(批号: 190310)、松脂醇二葡萄苷(批号: 190512)、松脂醇单葡萄糖苷(批号: 190810) 和咖啡酸(批号: 191028) 等均购自成都植标化纯生物技术有限公司(纯度: HPLC ≥ 98%)。
实验动物 健康SD雄性大鼠(200 ± 20 g, SPF级), 由杭州医学院提供, 许可证号: SCXK (浙) 2019-0002。本实验中的所有实验动物均饲养于南京中医药大学实验动物中心, 饲养条件: 恒温(22 ± 2) ℃, 恒湿(50 ± 10) %, 12 h/12 h明暗交替, 自由饮水摄食。整个实验研究过程严格遵守动物实验的各项伦理规定, 并获得南京中医药大学实验动物伦理委员会批准(批准号: 202103A008)。
杜仲提取物的制备 取杜仲饮片, 粉碎过筛(10目), 精密称定, 加入10倍量70%乙醇浸泡30 min, 加热回流提取1.5 h, 四层纱布滤过, 滤液回收乙醇后药液备用; 残渣加入10倍量纯水再次回流提取1.5 h, 四层纱布滤过, 滤液与上述回收乙醇后的溶液合并, 60 ℃减压浓缩, 冷冻干燥, 所得冻干粉于-20 ℃保存, 用时以0.5%羧甲基纤维素钠(carboxymethylcellulose sodium, CMC-Na) 溶液混悬, 制成4 g·mL-1 (生药量计) 的杜仲提取物混悬液。
杜仲供试品溶液的制备 精密吸取杜仲提取物混悬液1 mL, 3倍量超纯水稀释, 取1 mL加入至预先活化的SPE固相萃取柱, 依次以5%、25%、50%、75%和100%的甲醇溶液各2 mL梯度洗脱, 收集全部洗脱液, 涡旋混匀, 13 000 r·min-1离心10 min, 取上清, 4 ℃保存待测。
大鼠肾纤维化模型的制备 12只SD大鼠适应性饲养一周后, 随机分为空白对照组与模型组, 每组6只, 模型组每日灌服0.5% CMC-Na腺嘌呤混悬液150 mg·kg-1, 空白对照组每日灌服等体积0.5% CMC-Na溶液, 于造模第29天经眼底静脉丛取血0.3 mL, 检测各大鼠血清肌酐与尿素氮含量, 确证造模成功。
含药血浆的制备 模型组大鼠实验前12 h禁食不禁水, 给药前取自身空白血浆作为对照, 随后灌胃给予杜仲提取物40 g·kg-1 (生药量计), 给药后2 h经眼底静脉丛取血0.3 mL于预先涂有肝素钠的1.5 mL离心管中, 3 000 r·min-1离心10 min, 取上清液, -80 ℃保存待测。
血浆样品的预处理 取含药血浆与空白对照血浆样品各100 μL, 加入300 μL甲醇, 涡旋混匀5 min, 13 000 r·min-1离心10 min, 吸取上清液再次13 000 r·min-1离心10 min, 取上清液用于UHPLC-Q-TOF-MS/MS检测分析。
液相条件 Waters ACQUITY UPLC BEH C18色谱柱(100 mm × 2.1 mm, 1.7 μm); 流动相: 0.1%甲酸水(A)-乙腈(B); 流速: 0.3 mL·min-1; 进样量: 1 μL; 柱温: 35 ℃; 梯度洗脱程序: 0~3 min, 5%~15% B; 3~7 min, 15%~20% B; 7~8 min, 20%~35% B; 8~10 min, 35% B; 10~11 min, 35%~75% B; 11~18 min, 75%~95% B; 18~20 min, 95% B; 20~22 min, 95%~5% B; 22~24 min, 5% B。
质谱条件 开启动态背景扣除(DBS) 功能, 使用ESI电喷雾离子源在负离子模式下进行高灵敏度扫描。具体参数如下: 喷雾辅助气体: 氮气; 辅助加热气、雾化气: 55 psi (1 psi ≈ 6.895 kPa); 气帘气: 35 psi; 离子源温度: 550 ℃; 离子喷雾电压: -4 500 V; 去簇电压: -60 V; 碰撞能量: -40 V; 碰撞能量扩展: 20 V; TOF/MS扫描范围: 100~2 000 Da; Product Ion MS扫描范围: 50~1 500 Da。负离子模式选取403.112 7的内标离子作实时质量数校正; 原始数据的采集由Q-TOF-MS/MS 5600+质谱仪配置的Analyst® TF 1.6工作站进行。
结果与讨论 1 腺嘌呤致肾纤维化大鼠模型鉴定灌胃腺嘌呤(150 mg·kg-1) 四周后, 空白对照组大鼠体型较大, 毛发柔顺有光泽, 精神状态良好, 而模型组大鼠体形消瘦, 毛发枯燥且光泽暗淡, 精神萎靡, 畏寒怕冷。空白对照组大鼠血清肌酐和尿素氮水平均在正常范围内, 而模型组大鼠血清肌酐和尿素氮水平上升, 与空白对照组相比具有极显著性差异(P < 0.01); 空白对照组大鼠肾脏体积重量均正常, 呈暗红色且表面光滑, 而模型组肾脏呈典型“大白肾”状: 体积肿胀, 质量增加, 颜色苍白, 表面凹凸不平且有颗粒样物质。病理切片结果显示: 空白对照组大鼠肾组织结构完好, 肾小球饱满完整, 肾小管排列整齐, 而模型组肾组织出现大量空泡, 肾小球结构紊乱, 肾小管扩张并沉积腺嘌呤棕褐色结晶, 肾间质水肿且炎性细胞浸润明显, 有大量蓝色胶原纤维沉积(图 1)。
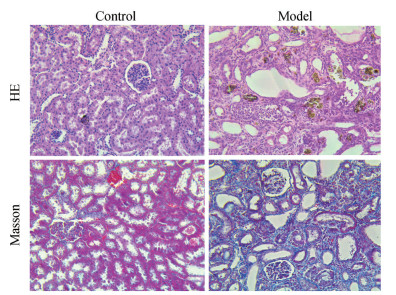
|
Figure 1 Histological observation of kidney in normal rats and rats with renal fibrosis induced by adenine (×200) |
课题组前期建立了杜仲化学成分数据库, 包含化合物名称、分子式和化学结构式等信息, 借助高分辨质谱完成了对杜仲提取物化学成分的鉴别。在此基础上, 对比杜仲提取物、含药血浆及空白血浆色谱图(图 2A), 结合体外杜仲化学成分库、对照品与参考文献, 并借助PeakViewTM 1.2软件(美国AB Sciex公司) 提取各化合物离子峰(图 2B), 根据保留时间、精确相对分子质量及二级质谱裂解碎片, 在含药血浆中初步鉴定出入血原形成分24种, 其中木脂素类9种、环烯醚萜类4种、苯丙素类8种、有机酸类3种, 主要鉴定信息见表 1。
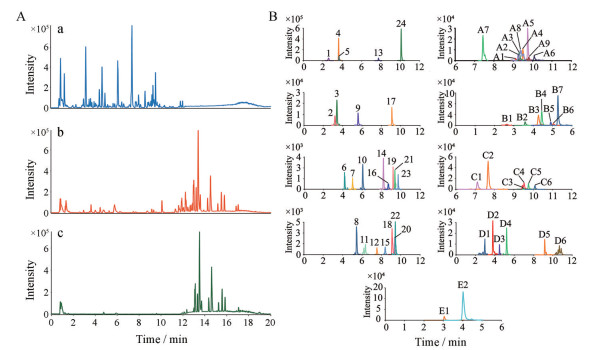
|
Figure 2 Typical base peak chromatograms (BPCs) of Eucommiae Cortex (EC) extracts and medicated and blank rat plasma in negative ion mode (A) and extracted ion chromatograms (EICs) of prototype ingredients absorbed into blood and their metabolites of EC extracts in negative ion mode (B). a: EC extracts; b: Medicated plasma; c: Blank plasma. A1-A9: Lignans 4/di-O-glucopyranoside; B1-B7: Geniposidic acid; C1-C6: Geniposide; D1-D6: Aucubin; E1-E2: Vanillic acid 4-O-glucopyranoside |
| Table 1 Analysis and identification of prototype ingredients in rat plasma of EC extracts based on UHPLC-Q-TOF-MS/MS. *Compared with reference substances |
入血原形木脂素类成分共9种(8, 12, 14, 15, 17, 19, 20, 22, 23), 均为双环氧木脂素糖苷类化合物, 其在负离子模式下易形成[M-H]-准分子离子和[M+HCOOH-H]-加和离子, 质谱裂解存在一定的共性规律: [M-H]-准分子离子首先丢失1~2分子葡萄糖基, 随后四氢呋喃环开裂, 丢失CH3、CH2O、CO、CH3O和CH3OH等基团, 生成特征碎片离子m/z 151[11-13]。以松脂醇单/双葡萄糖苷为例简析木脂素糖苷类成分鉴定过程: 化合物17在负离子模式下形成[M-H]-准分子离子峰m/z 681, 子离子m/z 519和m/z 357由母离子在40 V碰撞电压下连续丢失两分子葡萄糖基(glucopyranoside, Glc, 162 Da) 所得, 特征碎片离子m/z 151的出现提示化合物17可能是一种木脂素双糖苷类化合物。与之类似, 化合物23在负离子模式下形成[M-H]-准分子离子峰m/z 519、碎片离子m/z 357和m/z 151, 推测为与化合物17具有相同苷元的木脂素单糖苷类化合物, 经与化学对照品比对, 确定化合物17和23分别为松脂醇双葡萄糖苷和松脂醇单葡萄糖苷, 裂解途径见图 3A。
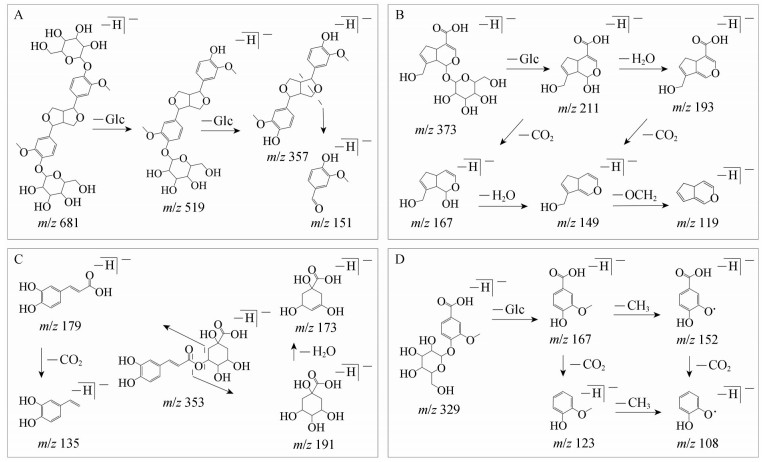
|
Figure 3 Proposed fragmentation pathways of prototype ingredients in rat plasma of EC extracts. A: Pinoresinol di-O-glucopyranoside; B: Geniposidic acid; C: Chlorogenic acid; D: Vanillic acid 4-O-glucopyranoside. Glc: Glucopyranoside |
入血原形环烯醚萜类成分共4种(1, 4, 13, 24), 多数为环戊烯型环烯醚萜苷类化合物, 在负离子模式下易形成[M-H]-准分子离子和[M+HCOOH-H]-加和离子, 具有m/z 101和/或m/z 119和/或m/z 147等特征碎片离子[11-13]。以京尼平苷酸为例简析此类化合物鉴别过程: 化合物4在负离子模式下产生[M-H]-准分子离子峰m/z 373, 丢失一分子Glc得到苷元碎片离子m/z 211, 继续丢失一分子H2O (18 Da) 和/或一分子CO2 (44 Da) 等中性基团裂解为碎片离子m/z 193、167和149, 碎片m/z 119由m/z 149丢失一分子OCH2 (30 Da) 形成。由于环烯醚萜类化合物的基本母核为环烯醚萜醇, 具有性质不稳定的半缩醛结构, 易断裂形成含有二醛结构的同分异构体, 碎片离子m/z 123来源于母核断裂后的γH重排, 裂解途径见图 3B。此外, 化合物24在40 V碎片电压下产生显著的[M-H]-准分子离子峰m/z 187, 子离子m/z 169、143、125和97由母离子连续丢失H2O、C2H2 (26 Da)、H2O和CO (28 Da) 等基团所得, 结合文献[11, 12]推测化合物24为杜仲醇。
2.3 苯丙素类成分鉴定入血原形苯丙素类成分共8种, 可分为咖啡酰奎宁酸类(6, 9, 10, 18) 与咖啡酸类(5, 11, 16, 21)。化合物6、9和10互为同分异构体, 负离子模式下产生[M-H]-准分子离子峰m/z 353, 且具有相同碎片离子m/z 191、179、173和135等。m/z 191为奎宁酸特征碎片离子, 继续丢失一分子H2O裂解为碎片m/z 173; m/z 179为咖啡酸特征碎片离子, 继续丢失一分子CO2裂解为碎片m/z 135。以上碎片提示此三种化合物均由一分子奎宁酸与一分子咖啡酸脱水缩合而成, 经与化学对照品比对确定化合物9为绿原酸, 裂解途径见图 3C, 参考文献[11-13]推测化合物6和10分别为隐绿原酸和新绿原酸。化合物5 [M-H]-准分子离子峰为m/z 213, 碎片离子m/z 169、165、151、139和121等由母离子丢失OCH2、CH2 (14 Da) 和H2O等中性基团形成, 结合文献[11-13]推测化合物5为愈创木基丙三醇。化合物11 [M-H]-准分子离子峰为m/z 179, 碎片离子m/z 135和134由母离子丢失一分子CO2/COOH (45 Da) 生成, 经与对照品比对, 确定化合物11为咖啡酸。化合物16 [M-H]-准分子离子峰为m/z 163, 碎片离子m/z 145和m/z 119由母离子丢失一分子H2O/CO2形成, 推测化合物16为4-羟基肉桂酸。
2.4 有机酸类成分鉴定入血原形有机酸类成分共3种(2, 3, 7), 鉴别过程如下: 化合物3 [M-H]-准分子离子峰为m/z 329, m/z 167为母离子失去一分子Glc所得苷元碎片离子, 该碎片继续丢失一分子CH3 (15 Da) 和/或一分子CO2等中性碎片得到碎片离子m/z 152、123和108, 推测化合物3为香草酸葡萄糖苷, 裂解途径见图 3D。化合物2和7 [M-H]-准分子离子峰为m/z 315和m/z 153, 二者相差162 Da, 且具有相同碎片离子m/z 108, 结合文献[11-13]推测二者分别为原儿茶苷与原儿茶酸。
3 基于UHPLC-Q-TOF-MS/MS的杜仲提取物入血原形成分代谢产物鉴定借助MetabolitePilotTM (美国AB Sciex公司) 软件, 扣除空白血浆内源性物质的干扰, 利用质量亏损技术, 在误差小于5×10-6范围内寻找符合代谢修饰的代谢产物准分子离子峰, 再结合质谱二级碎片解析代谢产物结构特征, 鉴定出入血原形成分代谢产物共30种, 主要来自木脂素类、环烯醚萜类和有机酸类化合物(提取离子流色谱图见图 2B, 主要鉴定信息见表 2)。
| Table 2 Analysis and identification of metabolites in rat plasma of EC extracts based on UHPLC-Q-TOF-MS/MS |
入血木脂素类化合物代谢产物共9种, 均来自木脂素糖苷类, 此类化合物进入大鼠体内后首先脱去葡萄糖基, 而后发生开环、硫酸酯化和葡萄糖醛酸化等反应生成相应代谢产物[13]。化合物A1和A2 [M-H]-准分子离子峰为m/z 695和m/z 599, 丢失一分子Glc生成碎片离子m/z 533和m/z 437, 随后碎片m/z 533丢失一分子葡萄糖醛酸(glucuronide acid, GluA, 176 Da), 碎片m/z 437丢失一分子硫酸酯(SO3, 80 Da), 均生成碎片离子m/z 357, 该碎片再进一步裂解形成特征碎片m/z 151, 推测化合物A1和A2分别为松脂醇单葡萄糖苷葡萄糖醛酸化和硫酸酯化代谢产物。与之类似, 化合物A3 [M-H]-准分子离子峰为m/z 613, 碎片离子m/z 357由母离子丢失一分子GluA和一分子SO3生成, 推测为松脂醇葡萄糖醛酸化-硫酸酯化代谢产物。化合物A4 [M-H]-准分子离子峰为m/z 535, 丢失一分子GluA生成苷元碎片离子m/z 359, 碎片m/z 341和329由其进一步丢失一分子H2O/OCH2生成, 推测为松脂醇开环后葡萄糖醛酸化代谢产物。化合物A5 [M-H]-准分子离子峰为m/z 533, 较化合物A1小162 Da, 其余碎片相同, 推测为松脂醇葡萄糖醛酸化代谢产物。化合物A6 [M-H]-准分子离子峰为m/z 437, 较化合物A2小162 Da, 其余碎片相同, 推测为松脂醇硫酸酯化代谢产物。化合物A7、A8和A9 [M-H]-准分子离子峰为m/z 551、549和563, 各自丢失一分子GluA生成碎片离子m/z 375、373和387, 对照入血原形成分和体外化学成分, 推测化合物A7、A8和A9分别为橄榄脂素、8-羟基松脂醇和中脂素等苷元的葡萄糖醛酸化代谢产物。由于入血原形成分中包含松脂醇、橄榄脂素和8-羟基松脂醇单/双葡萄糖苷, 而单/双葡萄糖苷仅在结构上相差一分子Glc, 机体内代谢途径相同, 故仅从结构上无法判断代谢产物A1~A6、A7和A8准确基源(代谢途径见图 4)。
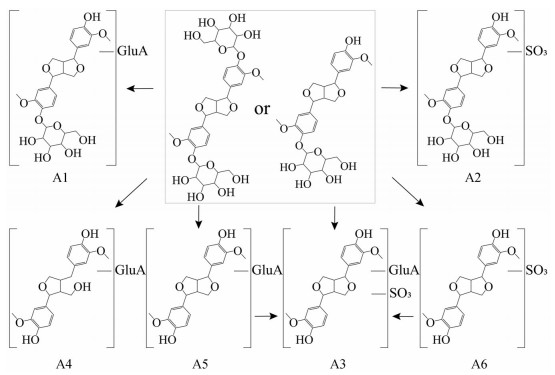
|
Figure 4 Possible metabolic pathways of pinoresinol di-O-glucopyranoside/pinoresinol 4-O-glucopyranoside in rats. GluA: Glucuronide acid |
入血环烯醚萜类化合物代谢产物共19种, 均来自环烯醚萜苷类, 其中京尼平苷酸7种, 京尼平苷6种, 桃叶珊瑚苷6种。环烯醚萜苷类成分经大鼠肠道菌群代谢发生去糖基化, 以苷元形式吸收入血, 随后发生去羟基、脱水、去氢氧亚甲基、去羧基、开环、氢化、羟基化、硫酸酯化和葡萄糖醛酸化等代谢反应[9, 13, 14]。
京尼平苷酸: 化合物B1 [M-H]-准分子离子峰为m/z 389, 较京尼平苷酸大16 Da, 子离子m/z 227和m/z 209由母离子连续丢失一分子Glc和一分子H2O所得, 其余碎片与京尼平苷酸相同, 推测为京尼平苷酸羟基化代谢产物。化合物B2、B5、B6和B7 [M-H]-准分子离子峰为m/z 357、369、371和343, 丢失一分子GluA生成相应苷元碎片离子m/z 181、193、195和167, 相较于京尼平酸碎片离子m/z 211分别小30、18、16和44 Da, 其余碎片特征与京尼平苷酸相似, 推测化合物B2、B5、B6和B7分别为京尼平酸葡萄糖醛酸化后去氢氧亚甲基、脱水、去羟基和去羧基代谢产物。此外, 化合物B3推测为京尼平酸开环+ 2 ×氢化代谢产物, m/z 217为其[M-H]-准分子离子峰, 碎片离子m/z 199和m/z 173由母离子丢失一分子H2O/CO2生成。化合物B4推测为京尼平酸去氢氧亚甲基代谢产物, m/z 181为其[M-H]-准分子离子峰, 碎片离子m/z 163和m/z 119由母离子连续丢失一分子H2O和一分子CO2所得(代谢途径见图 5A)。
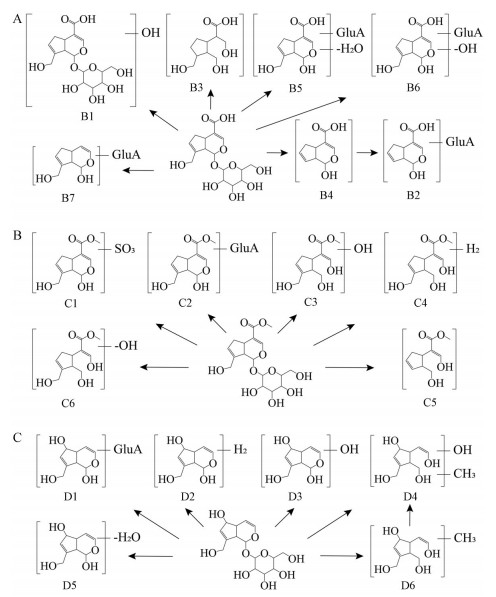
|
Figure 5 Possible metabolic pathways of (A) geniposidic acid, (B) geniposide, and (C) acubin in rats |
京尼平苷: 化合物C1和C2 [M-H]-准分子离子峰为m/z 305和m/z 401, 随后母离子m/z 305丢失一分子SO3, 母离子m/z 401丢失一分子GluA, 得到共同碎片离子m/z 225, 其余碎片与京尼平苷相同, 推测化合物C1和C2分别为京尼平硫酸酯化和京尼平葡萄糖醛酸化代谢产物。化合物C3 [M-H]-准分子离子峰为m/z 243, 丢失O和一分子CO/OCH2得到碎片离子m/z 199和197, 碎片离子m/z 181和m/z 163由m/z 199连续丢失两分子H2O所得, 推测化合物C3为京尼平开环后羟基化代谢产物。化合物C4和C5 [M-H]-准分子离子峰为m/z 229和m/z 197, 各自连续丢失一分子CH2和一分子OCH2生成碎片离子m/z 185和153, 推测化合物C4和C5分别为京尼平开环后氢化代谢产物和开环后去氢氧亚甲基代谢产物。化合物C6 [M-H]-准分子离子峰为m/z 209, 碎片离子m/z 163由母离子丢失一分子OCH2与O得到, 推测化合物C6为京尼平开环后去羟基化代谢产物(代谢途径见图 5B)。
桃叶珊瑚苷: 化合物D1 [M-H]-准分子离子峰为m/z 359, 碎片离子m/z 183由母离子脱去一分子GluA所得, 其余碎片特征与桃叶珊瑚苷相似, 推测为桃叶珊瑚苷元葡萄糖醛酸化代谢产物。化合物D2和D5 [M-H]-准分子离子峰为m/z 185和m/z 165, 失去一分子H2O得到碎片离子m/z 167和m/z 147, 继续丢失一分子CO得到碎片离子m/z 139和m/z 119, 推测化合物D2和D5分别为桃叶珊瑚苷苷元氢化和脱水代谢产物。化合物D3 [M-H]-准分子离子峰为m/z 199, 碎片离子m/z 181和m/z 137由母离子连续丢失一分子H2O、O和一分子CO等形成, 推测为桃叶珊瑚苷苷元羟基化代谢产物。化合物D4 [M-H]-准分子离子峰为m/z 215, 丢失一分子H2O形成碎片离子m/z 197, 继续丢失两分子H2O和O形成碎片离子m/z 145, 推测为桃叶珊瑚苷苷元开环后羟基化+ 甲基化代谢产物。化合物D6 [M-H]-准分子离子峰为m/z 199, 丢失一分子H2O形成碎片离子m/z 181, 继续丢失一分子C2H2形成碎片离子m/z 155, 推测为桃叶珊瑚苷苷元开环后甲基化代谢产物(代谢途径见图 5C)。
3.3 有机酸类化合物代谢产物鉴定化合物E1和E2在负离子模式下形成[M-H]-准分子离子峰m/z 343和m/z 247, 随后母离子m/z 343丢失一分子GluA, 母离子m/z 247丢失一分子SO3, 得到相同子离子m/z 167, 继续丢失一分子CH3和/或一分子CO2生成碎片离子m/z 152、123和108等, 以上碎片特征与香草酸葡萄糖苷相同, 推测化合物E1和E2分别为香草酸葡萄糖醛酸化和香草酸硫酸酯化代谢产物。
讨论本研究采用UHPLC-Q-TOF-MS/MS技术研究杜仲提取物在腺嘌呤致肾纤维化模型大鼠中的入血成分, 扣除空白血浆后分析鉴定出入血原形成分24种及其代谢产物30种, 主要来自木脂素类、环烯醚萜类、苯丙素类及有机酸类化合物, 代谢途径主要包括去糖基、去羟基、脱水、去氢氧亚甲基、去羧基、开环、氢化、羟基化、硫酸酯化和葡萄糖醛酸化等的单一或复合反应。与现有文献对杜仲入血原形成分及其代谢产物的报道存在一定的交集与差异, 原因可能与饮片的提取方式、给药方式、检测条件以及动物模型的差异有关[13, 15]。炎症感染、氧化应激、糖尿病、高血压以及局部缺血、缺氧等因素均会引起肾脏病变, 进而导致肾纤维化[16]。本研究所得杜仲入血化学成分群多具有抗炎、抗氧化和抗纤维化等药理活性, 可能是杜仲发挥抗肾纤维化作用的药效物质基础。
18种木脂素类成分在肾纤维化大鼠血浆中主要以原形(单/双糖苷) (9种)、单糖苷/苷元葡萄糖醛酸化和/或硫酸酯化代谢产物(9种) 等形式存在。近年来研究发现, 杜仲木脂素可抑制高血压肾损伤大鼠体内肾醛糖还原酶的表达, 降低Ⅲ型胶原蛋白的生成, 有效改善肾小管和肾小球损伤, 促进肾脏功能恢复[6]。松脂醇二葡萄苷作为杜仲木脂素类化合物的主要代表性成分, 具有抗高血压和抗氧化应激反应等药理活性, 体内/体外均可抑制AKT/mTOR/NF-κB信号通路的激活, 改善心脏组织纤维化和炎症[17]。松脂醇单葡萄糖苷具有抗氧化应激、抗肝损伤和抗糖尿病等作用[18], 其苷元松脂醇可在小肠中被吸收和代谢, 具有抗炎作用[19]。
肾纤维化大鼠血浆中鉴定得到环烯醚萜类原形成分共有4种, 其中3种为环烯醚萜苷类(桃叶珊瑚苷、京尼平苷及京尼平苷酸), 负离子模式下具有较强响应, 且这3种成分在大鼠体内发生复杂多样的Ⅰ、Ⅱ相代谢反应, 生成多达19种代谢产物。京尼平苷酸具有保肝利胆、抗炎等多种生物活性, 可显著改善Dahl盐敏感型大鼠肾小球硬化和间质纤维化, 降低血压并改善肾脏血流动力学[20]。京尼平苷具有抗炎、抗氧化和抗糖尿病等药理作用, 可有效改善糖尿病肾病小鼠肾小球、肾小管损伤和间质纤维化, 其机制可能与APMK/SIRT1/NF-κB等通路有关[21]。桃叶珊瑚苷是一种高活性化合物, 主要通过肾脏排泄, 具有广泛的抗氧化、抗炎、抗纤维化、抗肿瘤和神经保护等作用[22], 苷及其苷元均能抑制转化生长因子-β诱导的人肝星状细胞的活化和细胞外基质沉积[23]。
苯丙素类化合物主要以原形形式(8种) 存在于肾纤维化大鼠血浆中, 绿原酸作为其中代表性成分, 质谱响应值较高, 且广泛分布于自然植物中, 具有抗氧化、抗炎、保肝护肾等多种药理活性, 是开发抗纤维化药物的潜在来源。近年来研究发现, 绿原酸能够抑制促炎细胞因子和肌成纤维细胞的生成, 减轻肾缺血/再灌注损伤, 并通过抗氧化、调节肝细胞生长因子和骨形态发生蛋白-7的表达, 减少细胞外基质沉积, 发挥抗纤维化作用[24]。有机酸类成分在肾纤维化大鼠血浆中以原形(3种) 和苷元葡萄糖醛酸化/硫酸酯化代谢产物(2种) 等形式存在, 其中原儿茶酸是一种具有高抗氧化能力的天然化合物, 有抗高血压的药理作用[25]。
此外, 中药多组分、多靶点的特点与机体肾脏病变中的复杂机制相似, 网络药理学整体性、系统性的特点与中医药整体观、辨证论治原则一致, 被广泛应用于中药活性化合物的发现和整体作用机制的阐释等方面, 进一步推动了中药药效物质基础与作用机制的研究进展。通过运用网络药理学方法, 已预测筛选出杜仲治疗糖尿病肾病的核心有效成分为咖啡酸、桃叶珊瑚苷和杜仲醇, 作用机制可能与细胞增殖分化、氧化应激、炎症反应和纤维化等方面相关[26]。另有研究发现, 全杜仲胶囊可能通过抗炎、抗氧化和调节机体代谢平衡等方面来改善肾脏结构与功能, 降低高血压对机体肾脏的损害, 其潜在药效成分包含原儿茶酸、中松脂醇和杜仲醇等化合物[27]。
综上所述, 本研究通过UHPLC-Q-TOF-MS/MS技术快速分析和鉴定了杜仲提取物在腺嘌呤致肾纤维化模型大鼠中的入血原形成分及其代谢产物, 研究结果有助于进一步阐明杜仲抗肾纤维化的效应物质基础, 并为杜仲临床用药的开发提供了参考依据。
作者贡献: 蔡皓负责整体设计及文章修改, 王梦晴负责设计、实验操作、数据处理及文章撰写, 于慧、刘鑫、宋健涛协助完成动物实验, 曹岗、朱慧、段煜、裴科协助指导实验。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典) [S]. Vol I. Beijing: China Medical Science Press, 2020: 172.
|
| [2] |
Wang CY, Tang L, He JW, et al. Ethnobotany, phytochemistry and pharmacological properties of Eucommia ulmoides: a review[J]. Am J Chin Med, 2019, 47: 259-300. DOI:10.1142/S0192415X19500137 |
| [3] |
Liu C, Guo FF, Xiao JP, et al. Research advances in chemical constituents and pharmacological activities of different parts of Eucommia ulmoides[J]. China J Chin Mater Med (中国中药杂志), 2020, 45: 497-512. |
| [4] |
Liu YP, Su YY, Yang Q, et al. Stem cells in the treatment of renal fibrosis: a review of preclinical and clinical studies of renal fibrosis pathogenesis[J]. Stem Cell Res Ther, 2021, 12: 333. DOI:10.1186/s13287-021-02391-w |
| [5] |
Niu HS, Liu IM, Niu CS, et al. Eucommia bark (Du-Zhong) improves diabetic nephropathy without altering blood glucose in type 1-like diabetic rats[J]. Drug Des Devel Ther, 2016, 10: 971-978. |
| [6] |
Li L, Yan J, Hu K, et al. Protective effects of Eucommia lignans against hypertensive renal injury by inhibiting expression of aldose reductase[J]. J Ethnopharmacol, 2012, 139: 454-461. DOI:10.1016/j.jep.2011.11.032 |
| [7] |
Li A, Yuan JF, Gong Q, et al. Effects of Eucommia ulmoides extract against renal injury caused by long-term high purine diets in rats[J]. Food Funct, 2021, 12: 5607-5620. DOI:10.1039/D0FO02802A |
| [8] |
Wu XW, Hao YY, Nie CX, et al. An overview of methodology and research progress on application of serum pharmacochemistry of traditional Chinese medicine[J]. Chin J Exper Tradit Med Form (中国实验方剂学杂志), 2019, 25: 173-179. |
| [9] |
Li Y, Cai W, Cai Q, et al. Comprehensive characterization of the in vitro and in vivo metabolites of geniposide in rats using ultra-high-performance liquid chromatography coupled with linear ion trap-orbitrap mass spectrometer[J]. Xenobiotica, 2016, 46: 357-368. DOI:10.3109/00498254.2015.1079746 |
| [10] |
Shi YH, Yang H, Ran HF, et al. Analysis of blood components of Yougui Yin in normal rats and rats with kidney deficiency caused by adenine based on UPLC-MS technology[J]. China J Chin Mater Med (中国中药杂志), 2021, 46: 2287-2297. |
| [11] |
He MZ, Jia J, Li JM, et al. Application of characteristic ion filtering with ultra-high performance liquid chromatography quadrupole time of flight tandem mass spectrometry for rapid detection and identification of chemical profiling in Eucommia ulmoides Oliv[J]. J Chromatogr A, 2018, 1554: 81-91. DOI:10.1016/j.chroma.2018.04.036 |
| [12] |
Guo JD, Li J, Yang XJ, et al. A metabolomics coupled with chemometrics strategy to filter combinatorial discriminatory quality markers of crude and salt-fired Eucommiae Cortex[J]. Front Pharmacol, 2020, 11: 838. DOI:10.3389/fphar.2020.00838 |
| [13] |
Jia J, Liu M, Wen Q, et al. Screening of anti-complement active ingredients from Eucommia ulmoides Oliv. branches and their metabolism in vivo based on UHPLC-Q-TOF/MS/MS[J]. J Chromatogr B, 2019, 1124: 26-36. DOI:10.1016/j.jchromb.2019.05.029 |
| [14] |
Wang CX, Wang L, Qian DW, et al. Identification of metabolites of Reduning injection in rat plasma, bile, urine and feces after intravenous administration[J]. Acta Pharm Sin (药学学报), 2018, 53: 1148-1155. |
| [15] |
Wang YL, Xiang WY, Lu Y, et al. Serum pharmacochemistry of stem bark of Eucommia ulmoides[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 1101-1105. |
| [16] |
Wang ML, Ding YF, Yin X, et al. Progress in understanding hepatic fibrosis and renal fibrosis based on the gut-liver-kidney axis[J]. Acta Pharm Sin (药学学报), 2021, 56: 9-20. |
| [17] |
Chen YS, Pan RY, Zhang JJ, et al. Pinoresinol diglucoside (PDG) attenuates cardiac hypertrophy via AKT/mTOR/NF-κB signaling in pressure overload-induced rats[J]. J Ethnopharmacol, 2021, 272: 113920. DOI:10.1016/j.jep.2021.113920 |
| [18] |
Youssef FS, Ashour ML, El-Beshbishy HA, et al. Pinoresinol-4-O-β-D-glucopyranoside: a lignan from prunes (Prunus domestica) attenuates oxidative stress, hyperglycaemia and hepatic toxicity in vitro and in vivo[J]. J Pharm Pharmacol, 2020, 72: 1830-1839. DOI:10.1111/jphp.13358 |
| [19] |
During A, Debouche C, Raas T, et al. Among plant lignans, pinoresinol has the strongest antiinflammatory properties in human intestinal Caco-2 cells[J]. J Nutr, 2012, 142: 1798-1805. DOI:10.3945/jn.112.162453 |
| [20] |
Ishimitsu A, Tojo A, Satonaka H, et al. Eucommia ulmoides (Tochu) and its extract geniposidic acid reduced blood pressure and improved renal hemodynamics[J]. Biomed Pharmacother, 2021, 141: 111901. DOI:10.1016/j.biopha.2021.111901 |
| [21] |
Li FT, Chen Y, Li YJ, et al. Geniposide alleviates diabetic nephropathy of mice through AMPK/SIRT1/NF-κB pathway[J]. Eur J Pharmacol, 2020, 886: 173449. DOI:10.1016/j.ejphar.2020.173449 |
| [22] |
Zeng XC, Guo F, Ouyang DS, et al. A review of the pharmacology and toxicology of aucubin[J]. Fitoterapia, 2020, 140: 104443. DOI:10.1016/j.fitote.2019.104443 |
| [23] |
Lv PY, Feng H, Huang WH, et al. Aucubin and its hydrolytic derivative attenuate activation of hepatic stellate cells via modulation of TGF-β stimulation[J]. Environ Toxicol Phar, 2017, 50: 234-239. DOI:10.1016/j.etap.2017.02.012 |
| [24] |
Nwafor EO, Lu P, Zhang Y, et al. Chlorogenic acid: potential source of natural drugs for the therapeutics of fibrosis and cancer[J]. Transl Oncol, 2022, 15: 101294. DOI:10.1016/j.tranon.2021.101294 |
| [25] |
Safaeian L, Hajhashemi V, Javanmard SH, et al. The effect of protocatechuic acid on blood pressure and oxidative stress in glucocorticoid-induced hypertension in rat[J]. Iran J Pharm Res, 2016, 15: 83-91. |
| [26] |
Huang Q, Liu Q, Zhang FY, et al. Active ingredient analysis of Eucommia ulmoides Oliv. in treating diabetic nephropathy by using UPLC-Q-TOF-MS and network pharmacology[J]. Chin J New Drugs Clin Rem (中国新药与临床杂志), 2021, 40: 460-469. |
| [27] |
Guo FF, Zhang W, Su J, et al. Prediction of drug positioning for Quan-du-zhong capsules against hypertensive nephropathy based on the robustness of disease network[J]. Front Pharmacol, 2019, 10: 49. DOI:10.3389/fphar.2019.00049 |
 2022, Vol. 57
2022, Vol. 57


