2. 广东联捷生物科技有限公司, 广东 东莞 523000;
3. 南方医科大学药学院, 广东 广州 510515
2. Guangdong RangerBio Technologies Co., Ltd., Dongguan 523000, China;
3. School of Pharmaceutical Sciences, Southern Medical University, Guangzhou 510515, China
电喷雾电离(electrospray ionization, ESI) 适用于不同理化性质药物的分析检测, 具有灵敏度高、专属性强等优点, 是目前分析化学领域应用最广泛的电离技术之一。根据ESI气相离子的形成机制, 任何降低液滴形成速率的因素均可影响气相离子的形成, 最终产生基质效应, 其中离子抑制是ESI中基质效应的常见形式[1]。1993年, Tang和Kebarle首次描述了基质效应(matrix effect, ME)[2], 研究结果证明, 在电喷雾电离过程中目标待测物的响应会因第二种物质的存在而受到影响, 导致待测物响应降低(即离子抑制) 或者响应升高(即离子增强)。基质效应可严重影响定量分析的检测下限、线性范围、准确度和精密度等[3-5]。
液相色谱(liquid chromatography, LC) 具有良好的分离作用, 在一定程度上可减少基质干扰, 降低ESI的基质效应, 因此液相色谱-电喷雾串联质谱(liquid chromatography coupled with electrospray ionization tandem mass spectrometry, LC-ESI-MS/MS) 成为目前定量分析的常用方法之一, 被广泛应用于各领域的定性及定量检测分析中[6, 7]。
原位电离技术是近年来质谱技术的研究热点[8]。原位电离技术可在大气环境下对样品进行电离, 无色谱分离, 无需或只需简单的样品前处理, 具有简便、快速、高通量等诸多优点[9]。探针电喷雾电离(pen electrospray ionization, PESI) 技术是以ESI为电离原理的原位电离技术, 可进行质谱的直接定量。目前, PESI及其衍生的原位电离技术被广泛应用于化学反应的监测、生物样品快速分析、质谱成像、单细胞分析等领域[10]。然而, 由于PESI的探针为非亲水表面, 探针直径较小, 因此对液体样品的载样量小, 样品易挥干; 同时, 不同待测样品由于基质差异, 其液体表面张力不同, 从而导致载样量的偏差[11]。微探针电喷雾(micro pen electrospray ionization, μPen-ESI) 离子源是基于现有的PESI技术设计的新型电喷雾离子源, 通过对喷雾针表面进行激光蚀刻, 形成微细凹槽, 以保证探针可控的载样量。该离子源以毛细作用为载样原理, 在探针末端施加高电压实现电喷雾。μPen-ESI可与质谱搭接, 形成微探针电喷雾串联质谱(μPen-ESI-MS/MS) 分析技术。前期研究提示, μPen-ESI-MS/MS具有快速定量检测的优越性能。但是, μPen-ESI-MS/MS用于血浆样品药物定量分析的基质效应尚需进一步评价和考察。
因此, 本研究旨在评价μPen-ESI-MS/MS方法用于血浆样品药物定量分析的基质效应, 并与LC-ESI-MS/MS方法的基质效应进行比较, 为μPen-ESI-MS/MS新方法用于生物样品定量分析提供实验数据和科学依据。
材料和方法药品和试剂 他克莫司一水合物(批号: 0000121680, 纯度≥ 98%, 美国Sigma-Aldrich有限公司); 子囊霉素(批号: 1-OBI-122-1, 纯度≥ 95%, 加拿大TRC有限公司); 利血平(批号: GZDD-0526, 纯度≥ 98%, 贵州迪大生物科技有限公司); 利血平-d9 (批号: B0002638, 纯度为99.7%, 北京曼哈格生物科技有限公司); 氟桂利嗪(批号: 100844-201803, 纯度为99.9%, 中国食品药品检定研究院); 氟桂利嗪-d8 (批号: 1-LLH-47-2, 纯度为99.8%, 加拿大TRC有限公司); 地氯雷他定(批号: 100919-201703, 纯度为99.9%, 中国食品药品检定研究院); 地氯雷他定-d5 (批号: C4X-143010-1809, 纯度为99.8%, 美国Cato化学研究中心); 盐酸二甲双胍(批号: 100664-201604, 纯度为99.9%, 中国食品药品检定研究院); 盐酸二甲双胍-d6 (批号: 2750-012A5, 纯度为99.0%, 加拿大TLC有限公司); HPLC级甲醇和HPLC级乙腈(安徽时联特种溶剂股份有限公司); 甲酸(天津大茂化学试剂厂); 乙酸铵(批号: 2019092093, 纯度≥ 98%, 天津致远化学试剂有限公司); 大鼠空白血浆(中山大学动物实验中心)。
仪器 Thermo LTQ XL质谱仪(美国Thermo公司); Agilent 1100液相色谱仪(美国Agilent公司); Milli Q-plus超纯水系统(美国Millipore公司); 高速低温冷冻离心机(德国Eppendorf公司); 高速离心机TG16-W (湖南湘仪实验室仪器开发有限公司); 涡旋混合器Thermolyne 16700 (美国Thermo公司); 干式氮吹仪JHD-001 (上海极恒实业有限公司); 十万分之一电子分析天平Sartorius RC210D (德国Sartorius公司); 微量移液器(德国Eppendorf公司)。
液相色谱条件 使用Agilent 1100液相色谱仪进行检测分析, 通过Xcalibuur 2.2软件进样操作及数据处理。色谱柱柱温为40 ℃, 自动进样器温度为20 ℃, 进样量为3 μL。
他克莫司(FK506) 色谱条件: Hypersil GOLD aQ色谱柱(50 mm × 2.1 mm, 1.9 μm), 流动相为10 mmol·L-1乙酸铵(A)-甲醇(B)。梯度洗脱程序为0.0~0.3 min, 70% B; 0.3~1.0 min, 70%~95% B; 1.0~3.5 min, 95% B; 3.5~5.5 min, 70% B。流速为0.250 mL·min-1。
利血平(RSP) 色谱条件: HALO PFP色谱柱(50 mm × 2.1 mm, 2.7 μm), 流动相为0.1%甲酸水(v/v) (A)-0.1%甲酸乙腈(v/v) (B)。梯度洗脱程序为0.0~0.3 min, 25% B; 0.3~1.3 min, 25%~95% B; 1.3~2.0 min, 95% B; 2.0~3.0 min, 25% B。流速为0.400 mL·min-1。
氟桂利嗪(FNZ) 色谱条件: HALO PFP色谱柱(50 mm × 2.1 mm, 2.7 μm), 流动相为0.1%甲酸水(v/v) (A)-0.1%甲酸乙腈(v/v) (B)。梯度洗脱程序为0.0~0.3 min, 45% B; 0.3~1.0 min, 45%~95% B; 1.0~3.0 min, 95% B; 3.0~4.0 min, 45% B。流速为0.400 mL·min-1。
地氯雷他定(DLT) 色谱条件: Xterra C18色谱柱(50 mm × 2.1 mm, 3.5 μm), 流动相为0.1%甲酸水(v/v) (A)-0.1%甲酸乙腈(v/v) (B)。梯度洗脱程序为0.0~0.3 min, 5% B; 0.3~1.5 min, 5%~95% B; 1.5~2.5 min, 95% B; 2.5~4.0 min, 5% B。流速为0.400 mL·min-1。
二甲双胍(MET) 色谱条件: ZIC-HILIC色谱柱(50 mm × 2.1 mm, 3.5 μm), 流动相为0.1%甲酸水(v/v) (A)-0.1%甲酸乙腈(v/v) (B)。等度洗脱程序为70% B洗脱3.0 min, 流速为0.300 mL·min-1。
μPen-ESI设备 微探针通过激光在长为3.5 cm, 直径约0.6 mm的不锈钢针表面刻槽而成, 槽长约为1.0 cm, 槽宽0.46 mm, 将凹槽末端打磨成圆弧状。3.0~4.5 kV的直流高压电直接施加在探针末端, 形成μPen-ESI装置。
质谱条件 由Thermo LTQ XL质谱仪以正离子扫描模式, 进行选择反应监测(selected reaction monitoring, SRM) 方式检测。FK506、RSP、FNZ、DLT和MET的毛细管电压分别为15.00、44.00、1.00、12.00和19.00 V; 透镜电压分别为250.00、250.00、0.00、50.00和45.00 V。5种药物μPen-ESI-MS/MS方法的离子源电压均设为4.00 kV, 无鞘气、辅助气和吹扫气, 毛细管温度除FK506为300.00 ℃外, 其余4种药物均为250.00 ℃。5种药物LC-ESI-MS/MS方法的离子源电压均设为5.00 kV, 鞘气、辅助气和吹扫气流速分别为50.00、20.00和10.00 arb (1 arb ≈ 5×10-6 m3·s-1), 毛细管温度均为350.00 ℃。
标准储备液配制 称取适量FK506、RSP、FNZ、DLT和MET的对照品, 通过适量甲醇溶解, 得到浓度为1.0 mg·mL-1标准储备液。
工作液配制 分别称取适量子囊霉素(FK520)、利血平-d9、氟桂利嗪-d8、地氯雷他定-d5、二甲双胍-d6, 用甲醇溶解并稀释至1.0 mg·mL-1, 得内标储备液。取适量FK520、利血平-d9、氟桂利嗪-d8、地氯雷他定-d5、二甲双胍-d6储备液, 分别用甲醇稀释至2.0、10、1.0、1.0和4.0 μg·mL-1, 得内标工作液。用甲醇对标准储备液进行稀释, 得到低浓度及高浓度水平工作液。FK506、FNZ和DLT的两个浓度水平工作液分别为8.0×101和1.0×104 ng·mL-1; RSP和MET两个浓度水平工作液分别为8.0×102和4.0×104 ng·mL-1。
空白血浆前处理 取200.0 μL空白大鼠血浆至1.5 mL EP管中, 加入800 μL甲醇, 涡旋混匀1 min; 置于离心机中, 15 000 r·min-1离心10 min, 上清液转移至EP管中, 备用。
基质效应考察 参照2020版中国药典四部通则中“生物样品定量分析方法验证指导原则”相关要求[12], 分别取6个不同来源的空白大鼠血浆, 按“空白血浆前处理”项操作后在490 μL上清液中分别加入待测物工作液及对应的内标工作液各5.00 μL, 测定得到基质存在下的峰面积; 在490 μL甲醇溶液中分别加入待测物工作液及对应内标工作液各5.00 μL, 测定得到不含基质的相应峰面积。测定均分别在低浓度及高浓度两个浓度水平下进行。按公式1计算基质因子(matrix factor, MF) 及按公式2计算内标归一化的基质因子(IS normalised MF)。如MF的值为100%, 则不存在基质效应; 如小于100%, 则认为存在基质效应(离子抑制); 如大于100%, 则认为存在基质效应(离子增强)。2020版中国药典四部通则中“生物样品定量分析方法验证指导原则”要求从6批基质计算的内标归一化的基质因子的RSD不得大于15%。
| $ \mathrm{基}\mathrm{质}\mathrm{因}\mathrm{子}=\frac{\mathrm{基}\mathrm{质}\mathrm{存}\mathrm{在}\mathrm{下}\mathrm{的}\mathrm{峰}\mathrm{面}\mathrm{积}}{\mathrm{不}\mathrm{含}\mathrm{基}\mathrm{质}\mathrm{的}\mathrm{相}\mathrm{应}\mathrm{峰}\mathrm{面}\mathrm{积}}\times 100\mathrm{\%} $ | (1) |
| $ \mathrm{内}\mathrm{标}\mathrm{归}\mathrm{一}\mathrm{化}\mathrm{的}\mathrm{基}\mathrm{质}\mathrm{因}\mathrm{子}=\frac{\mathrm{待}\mathrm{测}\mathrm{物}\mathrm{基}\mathrm{质}\mathrm{因}\mathrm{子}}{\mathrm{内}\mathrm{标}\mathrm{基}\mathrm{质}\mathrm{因}\mathrm{子}}\times 100\mathrm{\%} $ | (2) |
数据统计 首先使用Xcalibur 2.2将数据导出至Microsoft Excel 2019软件, 对数据进行分析与计算, 然后使用GraphPad Prism 8.0软件对数据进行图表处理。
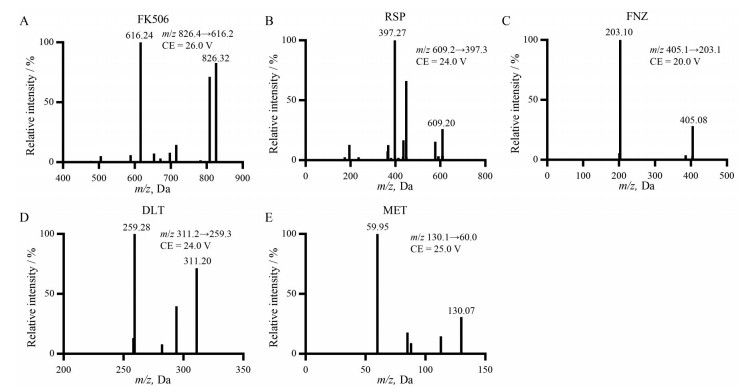
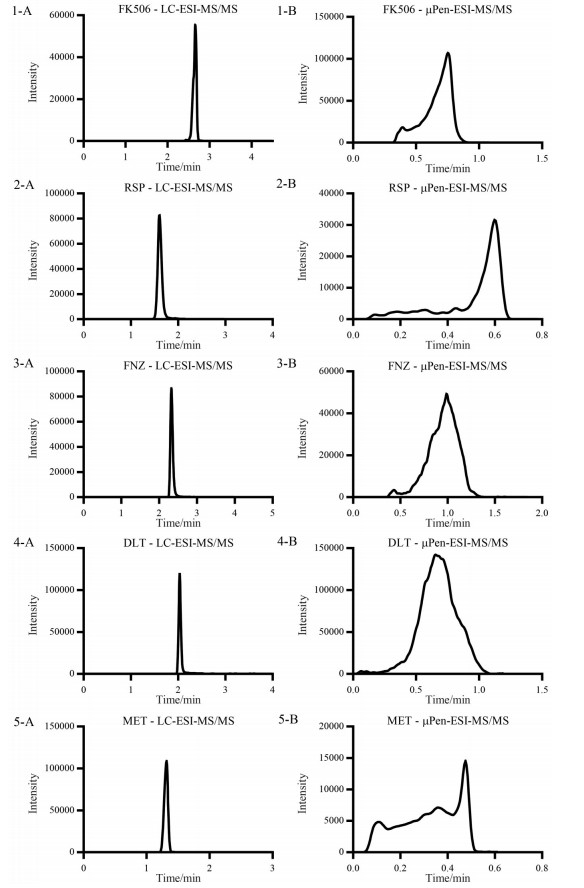
结果 1 质谱分析选择5种理化性质各异的药物(他克莫司、利血平、氟桂利嗪、地氯雷他定和二甲双胍) 作为研究对象, 在ESI正离子模式下对它们进行扫描, 如图 1所示, 得到准分子离子峰[M+Na]+或[M+H]+, 分别为m/z 826.4, m/z 609.2, m/z 405.1, m/z 311.2和m/z 130.1。选择性对准分子离子峰进行离子扫描, 生成碎片离子, 分别为m/z 616.2, m/z 397.3, m/z 203.1, m/z 259.3和m/z 60.0。本文将上述碎片离子作为待测物定量分析时检测的产物离子, 用SRM扫描模式对样品进行分析。5种药物经LC-ESI-MS/MS和μPen-ESI-MS/MS进样分析所得SRM图谱如图 2所示。
|
Figure 1 MS/MS product ion spectrum and the collision energy (CE) of tacrolimus (FK506, A), reserpine (RSP, B), flunarizine (FNZ, C), desloratadine (DLT, D), and metformin (MET, E) in positive ion mode using electrospray ionization (ESI+) |
|
Figure 2 Selected reaction monitoring (SRM) chromatograms of the FK506 (1), RSP (2), FNZ (3), DLT (4), and MET (5) in plasma samples using the LC-ESI-MS/MS (A) and μPen-ESI-MS/MS (B) methods. The plasma concentration of FK506, FNZ, and DLT was 5.0×102 ng·mL-1, and that of RSP and MET was 2.0×103 ng·mL-1 |
分别对5种药物选择合适的色谱柱及流动相, 通过优化梯度洗脱程序, 从中选择受基质干扰最小的洗脱程序, 作为此部分的色谱方法。由表 1所示, 地氯雷他定低浓度和高浓度样品的基质因子分别约为71.2%和76.6%, 离子抑制率约为26%; 他克莫司、利血平和氟桂利嗪3种药物基质因子在90%~110%之间, 可认为无基质效应; 二甲双胍的基质因子大于110%, 呈现离子增强。5种药物的两个浓度水平的基质因子较为接近, 差异最大的药物为二甲双胍, 相差16.5%。利血平、地氯雷他定和二甲双胍的基质因子RSD均小于15%。除他克莫司外, 其余4种药物内标归一化的基质因子RSD小于15%, 符合中国药典的相关要求。
|
Table 1 Matrix effect of the five analytes at low and high concentration levels using the LC-ESI-MS/MS methods. n = 6, |
由表 2所示, 在5种药物的μPen-ESI-MS/MS方法中, 高浓度他克莫司和低浓度地氯雷他定的基质因子在90%~110%之间, 可认为无基质效应; 氟桂利嗪、低浓度他克莫司和高浓度地氯雷他定的基质因子大于110%, 呈现离子增强, 此3种药物的离子抑制程度小于LC-ESI-MS/MS方法结果; 利血平和二甲双胍的基质因子小于30%, 离子抑制率大于70%, 与LC-ESI-MS/MS方法结果相比, 抑制程度严重。除利血平外, 5种药物的两个浓度水平的基质因子差异均比LC-ESI-MS/MS方法大, 其中差异最大的药物为地氯雷他定, 其高浓度样品的基质因子比低浓度样品高24.0%。他克莫司和氟桂利嗪的基质因子的RSD小于15%。5种药物内标归一化的基质因子RSD均小于15%, 包括LC-ESI-MS/MS方法不合格的他克莫司, 5种药物的μPen-ESI-MS/MS方法基质效应均符合中国药典的相关要求。
|
Table 2 Matrix effect of the five analytes at low and high concentration levels using the μPen-ESI-MS/MS methods. n = 6, |
ESI-MS因能产生完整的、多电荷的气相离子, 并且易与在线分离技术(如液相色谱) 耦合, 已成为生物分析和药物研究的常用工具。尽管如此, ESI-MS仍存在局限, 例如, 亲水性化合物在高流速技术下灵敏度低[13]; 此外, 溶液中的盐、添加剂及其他化合物的存在会导致基质效应, 降低方法灵敏度等[14]。
液相色谱的在线分离作用是降低基质效应的一种强有力手段, 可减少基质成分与待测物共流出。开发LC-ESI-MS/MS方法需考虑的关键因素包括色谱柱的型号和规格、流动相组成、洗脱程序等。前期通过选择保留效果好的色谱柱, 在常用的梯度洗脱方式下(有机相5%~95%梯度升高) 不断改变初始流动相比例, 再通过改变流动相、缓冲盐等方式对色谱方法进行优化, 选择基质效应最小的LC-ESI-MS/MS方法。例如, 二甲双胍在反相柱中保留较差, 死体积流出, 更换为HILIC柱后采用等度洗脱得到良好色谱峰; 通过将甲酸水更换成乙酸铵溶液, 改善他克莫司的峰形。为避免基质沉积引起柱效降低, 保证洗脱较为充分, LC-ESI-MS/MS方法分析时长设置为4 min左右。然而, 在基质效应考察中, 他克莫司的LC-ESI-MS/MS方法内标归一化的基质因子RSD仍超过推荐范围, 不符合中国药典相关要求。
ESI-MS的灵敏度很大程度上取决于溶液中待测物分子产生气相离子的效率(电离效率) 和气相离子进入到质量分析器低压区的能力(传输效率)[2, 15]。电离效率受流速、溶剂成分和待测物性质等诸多因素的影响。一般来说, 电离效率随着电喷雾喷射口液体流量的减少而增加[16, 17]。在较低的流速下电喷雾产生带电液滴较小, 液滴越小, 去溶剂化越快, 产生气相离子所需的库仑裂变事件越少[18]。此外, 随着流速的降低, 每个待测物分子可获得的表面电荷数增加。最终, 较小的初始液滴和增加的表面电荷量可改善低表面活性的待测物的电离效率, 降低离子抑制, 提高定量性能[19, 20]。Wilm等[21]研发的纳升电喷雾电离在高电压作用下产生细小液滴, 当流速达到20 nL·min-1时, 离子抑制现象消失, 分析方法灵敏度提高。
离子传输效率受质谱仪入口和截取锥处的离子损失的影响。库仑斥力导致带电液滴/离子羽流快速扩张, 电场使样品分散区域远大于质谱仪入口范围, 由此导致部分离子在质谱入口处的损失。减小毛细管或探针与对电极(质谱入口) 的距离, 使电喷雾羽流范围集中, 或是扩大采样孔径或入口毛细管的内径, 均可提高传输效率[22-24], 最终提高分析灵敏度。
前期研究结果表明, μPen-ESI-MS/MS属于微量电喷雾技术范畴, 流速约为2.5 μL·min-1。由于μPen-ESI为开放式离子源, 相比传统的喷雾毛细管具有更大的气-液相界面及电离区域, 因此能形成更大的喷雾羽流, 提高电离效率。另一方面, 减小μPen尖端与质谱入口的距离, 可使电喷雾羽流范围集中, 提高传输效率。由此推测μPen-ESI-MS/MS可能具有一定降低离子抑制、提高待测物响应的能力。本研究结果显示, 5种药物中他克莫司和氟桂利嗪无离子抑制, 与初步优化后的LC-ESI-MS/MS方法相当; 地氯雷他定无离子抑制, 相比建立的LC-ESI-MS/MS方法抑制程度更低。然而, 利血平和二甲双胍在μPen-ESI-MS/MS上仍被抑制超过70%。推测原因为μPen-ESI-MS/MS尚未达到20 nL·min-1的纳流, 对于实现亲水化合物的高灵敏分析、消除待测物的离子抑制仍有不足; 另外, 相比于LC-ESI-MS/MS方法, μPen-ESI-MS/MS缺乏含有pH调节剂的流动相的缓冲, 因此两种方法中待测物电离的pH条件存在差异。
综上所述, 本研究使用μPen-ESI-MS/MS新方法对5种药物血浆样品进行定量分析, 内标归一化的基质因子RSD小于15%, 表明这5种药物的μPen-ESI-MS/MS方法的基质效应符合2020版中国药典“生物样品定量分析方法验证指导原则”的相关要求, 部分药物离子抑制程度等于甚至小于初步优化后的LC-ESI-MS/MS方法, 表明μPen-ESI-MS/MS具有一定降低离子抑制的作用, 为μPen-ESI-MS/MS作为一种潜在的简单、高效、灵敏的新方法用于生物样品定量分析提供了实验数据和科学依据。
致谢: 感谢广东省东莞市研究生联合培养(实践) 工作站项目(编号: 20201900300012) 对本研究的支持。
作者贡献: 张思敏负责实验部分设计、实验实施、结果分析与统计、撰写论文; 瞿向阳负责部分实验的实施; 刘倩负责部分实验的设计与指导; 朱建雄、黄民和毕惠嫦负责研究思路的提出、实验设计以及论文修订。
利益冲突: 本文所有作者声明不存在利益冲突。
| [1] |
Marchi I, Viette V, Badoud F, et al. Characterization and classification of matrix effects in biological samples analyses[J]. J Chromatogr A, 2010, 1217: 4071-4078. DOI:10.1016/j.chroma.2009.08.061 |
| [2] |
Kebarle P, Tang L. From ions in solution to ions in the gas phase - the mechanism of electrospray mass spectrometry[J]. Anal Chem, 1993, 65: 972A-986A. |
| [3] |
Jiang F, Liu Q, Li Q, et al. Signal drift in liquid chromatography tandem mass spectrometry and its internal standard calibration strategy for quantitative analysis[J]. Anal Chem, 2020, 92: 7690-7698. DOI:10.1021/acs.analchem.0c00633 |
| [4] |
Guo H, Breitbach ZS, Armstrong DW. Reduced matrix effects for anionic compounds with paired ion electrospray ionization mass spectrometry[J]. Anal Chim Acta, 2016, 912: 74-84. DOI:10.1016/j.aca.2016.01.038 |
| [5] |
Liu Q, Jiang F, Zhu J, et al. Development, validation, and application of a new method to correct the nonlinearity problem in LC-MS/MS quantification using stable isotope-labeled internal standards[J]. Anal Chem, 2019, 91: 9616-9622. DOI:10.1021/acs.analchem.9b00947 |
| [6] |
Gao YX, Zhong DF. Advances in bioanalysis of antibody drugs by LC-MS[J]. Acta Pharm Sin (药学学报), 2020, 55: 453-462. |
| [7] |
Sun XC, Lin FF, Wan MM, et al. Determination of insulin lispro in rat plasma by LC-MS/MS and its application in a pharmacokinetics study[J]. Acta Pharm Sin (药学学报), 2021, 56: 2383-2388. |
| [8] |
Takats Z. Mass spectrometry sampling under ambient conditions with desorption electrospray ionization[J]. Science, 2004, 306: 471-473. DOI:10.1126/science.1104404 |
| [9] |
Cooks RG, Ouyang Z, Takats Z, et al. Detection technologies. ambient mass spectrometry[J]. Science, 2006, 311: 1566-1570. DOI:10.1126/science.1119426 |
| [10] |
Hiraoka K, Ariyada O, Usmanov DT, et al. Probe electrospray ionization (PESI) and its modified versions: dipping PESI (dPESI), sheath-flow PESI (sfPESI) and adjustable sfPESI (ad-sfPESI)[J]. Mass Spectrom, 2020, 9: A0092. DOI:10.5702/massspectrometry.A0092 |
| [11] |
Yoshimura K, Chen LC, Asakawa D, et al. Physical properties of the probe electrospray ionization (PESI) needle applied to the biological samples[J]. J Mass Spectrom, 2009, 44: 978-985. DOI:10.1002/jms.1576 |
| [12] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典) [S]. 2020 Ed. Vol 4. Beijing: China Medical Science Press, 2020: 466-472.
|
| [13] |
Hu Q, Tang H, Wang Y. Challenges in analysis of hydrophilic metabolites using chromatography coupled with mass spectrometry[J]. J Anal Test, 2020, 4: 140-162. DOI:10.1007/s41664-020-00126-z |
| [14] |
Panuwet P, Hunter RE, D'Souza PE, et al. Biological matrix effects in quantitative tandem mass spectrometry-based analytical methods: advancing biomonitoring[J]. Crit Rev Anal Chem, 2016, 46: 93-105. DOI:10.1080/10408347.2014.980775 |
| [15] |
Cech NB, Enke CG. Practical implications of some recent studies in electrospray ionization fundamentals[J]. Mass Spectrom Rev, 2001, 20: 362-387. DOI:10.1002/mas.10008 |
| [16] |
Wilm MS, Mann M. Electrospray and Taylor-Cone theory, Dole's beam of macromolecules at last?[J]. Int J Mass Spectrom Ion Process, 1994, 136: 167-180. DOI:10.1016/0168-1176(94)04024-9 |
| [17] |
Wahl JH, Goodlett DR, Udseth HR, et al. Use of small-diameter capillaries for increasing peptide and protein detection sensitivity in capillary electrophoresis-mass spectrometry[J]. Electrophoresis, 1993, 14: 448-457. DOI:10.1002/elps.1150140170 |
| [18] |
De La Mora JF, Loscertales IG. The current emitted by highly conducting Taylor cones[J]. J Fluid Mech, 1994, 260: 155-184. DOI:10.1017/S0022112094003472 |
| [19] |
Tang K, Page JS, Smith RD. Charge competition and the linear dynamic range of detection in electrospray ionization mass spectrometry[J]. J Am Soc Mass Spectrom, 2004, 15: 1416-1423. DOI:10.1016/j.jasms.2004.04.034 |
| [20] |
Schmidt A, Karas M, Dülcks T. Effect of different solution flow rates on analyte ion signals in nano-ESI MS, or: when does ESI turn into nano-ESI?[J]. J Am Soc Mass Spectrom, 2003, 14: 492-500. DOI:10.1016/S1044-0305(03)00128-4 |
| [21] |
Wilm M, Mann M. Analytical properties of the nanoelectrospray ion source[J]. Anal Chem, 1996, 68: 1-8. |
| [22] |
Schneider BB, Javaheri H, Covey TR. Ion sampling effects under conditions of total solvent consumption[J]. Rapid Commun Mass Spectrom, 2006, 20: 1538-1544. DOI:10.1002/rcm.2511 |
| [23] |
Kim T, Udseth HR, Smith RD. Improved ion transmission from atmospheric pressure to high vacuum using a multicapillary inlet and electrodynamic ion funnel interface[J]. Anal Chem, 2000, 72: 5014-5019. DOI:10.1021/ac0003549 |
| [24] |
Bruins AP. Mass spectrometry with ion sources operating at atmospheric pressure[J]. Mass Spectrom Rev, 1991, 10: 53-77. DOI:10.1002/mas.1280100104 |
 2022, Vol. 57
2022, Vol. 57


