2. 河南省中药开发工程技术研究中心, 河南 郑州 450046
2. The Engineering and Technology Center for Chinese Medicine Development of Henan Province, Zhengzhou 450046, China
急性肾损伤(acute kidney injury, AKI) 是一种在短期内发生的肾脏结构或功能异常, 属于危重的临床急症, 具有高发病率和高死亡率的特点[1], 其发病机制复杂, 涉及免疫炎症反应、细胞凋亡、线粒体功能异常、代谢废物蓄积等[2], 目前临床治疗AKI的方式主要集中在抗感染、复苏液体和机械通气等基础生命维持手段[3]。因此, 深入探究AKI发病机制, 发现有效药物是当前亟待解决的问题。
代谢组学在AKI模型以及药物干预方面已有相应的研究。Waltz等[4]使用GC/MS和LC/MS在AKI小鼠模型的肾脏组织中检测了300多种代谢物, 结果发现糖酵解途径中间产物增多, 三羧酸循环中间产物减少, 提示线粒体功能降低; 代谢物中与炎症相关的代谢物增加, 而抗氧化剂减少, 表明机体中存在氧化应激。Zheng等[5]采用GC/MS技术, 对黄连提取物干预的AKI小鼠的血清进行了代谢组学分析, 获得16个可能与AKI相关的生物标志物, 这些标志物主要参与氨基酸代谢和糖代谢。代谢组学技术通过定性、定量地检测细胞、组织、器官中小分子代谢物的组成及变化, 获得机体对外界刺激的整体反应, 从代谢物的水平反映机体整体状态[6]。且内源性代谢物作为机体各种生理病理过程的最终产物, 可为病理机制的研究提供重要线索。因此, 代谢组学技术在AKI等复杂病理的机制研究中具有天然的优势。
原阿片碱(protropine) 是土元胡中的一种生物碱成分, 具有抗炎[7]、抗寄生虫[8]、抗菌[9]和肝脏保护等作用。本实验室前期研究表明, 原阿片碱对AKI小鼠亦具有良好的保护作用[10], 但相关机制尚未明晰。本研究拟通过血清代谢组学技术研究土元胡中原阿片碱对AKI小鼠的保护作用, 以期发现原阿片碱治疗AKI的生物标志物并探讨其保护机制。
材料与方法药材与试剂 原阿片碱由本实验室从土元胡(Corydalis humosa Migo.) 中分离得到, 土元胡采自河南省新郑市始祖山, 由河南中医药大学陈随清教授和董诚明教授鉴定为罂粟科植物土元胡的干燥块茎。凭证号为: No. 20171026, 原阿片碱和土元胡样本存放在河南中医药大学药学院中药药效物质基础重点研究室。脂多糖(lipopolysaccharide, LPS, 批号: L2880, 纯度>98%), 购自美国Sigma公司; 色谱级乙腈(批号: 203022, 纯度: 99.95%)、甲醇(批号: 195912, 纯度: 99.9%), 均购自美国Fisher Chemical公司; 实验用水为屈臣氏蒸馏水(批号: GB19298), 购自中国广州屈臣氏食品饮料有限公司; 质谱级甲酸(批号: 202674, 纯度>99%), 购自美国Anaqua Chemicals Supply Inc.公司。
实验仪器 四极杆-飞行时间质谱(maXis HD Q/TOF, 德国Bruker公司); 超高效液相色谱仪(Ultimate 3000, 美国Dionex公司, 配有四元泵、在线脱气机、自动进样器、紫外检测器、色谱工作站); Advantage A10超纯水仪(德国Sartorius公司); 58108高速冷冻离心机(德国Eppendorf公司); SK-1快速混匀器(中国常州国宇仪器制造有限公司); BCD-206TAS低温冰箱(中国海尔公司); 1 000 μL移液器(法国Gilson公司), SB-5200DTD超声波清洗机(中国宁波新芝生物科技股份有限公司)。
实验动物 雄性BALB/c小鼠购于北京维通利华动物实验中心, 共45只, 体重18~22 g, 批号SCXK2016-0006。提供标准的饲料和饮水, 控制外界环境为12 h光照、12 h黑暗。温度和湿度分别控制在22 ± 2 ℃和45% ± 15%范围内。所有程序均符合《河南中医药大学实验动物护理与使用指南》, 实验经河南中医药大学动物伦理委员会批准(编号: SYXK2015-0005)。
原阿片碱的制备 取土元胡块茎35 kg, 用组织破碎法将块茎用70%丙酮萃取3次, 浓缩并蒸发, 通过水提醇沉法得到水溶性物质。将水溶性物质在Diaion HP-20大孔吸附树脂柱上分离, 并依次用甲醇-水(0∶100, 20∶80和40∶60) 洗脱, 得到3个馏分(F1~F3)。F3 (37.2 g) 分散在甲醇中, 在氧化铝柱上用二氯甲烷-甲醇(80∶1~1∶1) 梯度洗脱色谱分离。氧化铝柱通过重复柱色谱纯化, 并结合制备液相重结晶方法获得原阿片碱(20 mg)。
实验动物分组、造模及给药 小鼠适应环境一周后, 随机分为正常组(CON)、模型组(LPS, 5 mg·kg-1)、原阿片碱组(PRO, 30 mg·kg-1), 每组15只。原阿片碱溶液是由原阿片碱直接溶于灭菌的蒸馏水配制而成, 浓度为3 mg·mL-1, 给药剂量为30 mg·kg-1。除正常组腹腔注射生理盐水外, 所有小鼠均腹腔注射脂多糖溶液, 复制AKI小鼠模型。3 h后, 原阿片碱组灌胃给予原阿片碱溶液, 正常组和模型组灌胃给予等量的蒸馏水。每天给药2次, 连续给药3天。
血清样本的采集与制备 末次给药24 h后, 进行小鼠摘眼球取血, 收集血液样本。将血液样本放至凝固后, 以3 000 r·min-1离心10 min, 获得血清样本, 并保存在-80 ℃以供下一步分析。血清样本检测前, 冰浴复融, 取血清100 μL, 加入500 μL的4 ℃冷乙腈, 涡旋振荡90 s, 于4 ℃、12 000 r·min-1条件下离心10 min, 精密移取上清液至进样小瓶待测。
检测条件 血清样品在UHPLC系统中分离, 该系统配有RSLC120 C18柱(100 mm × 2.1 mm, 2.2 μm), 柱温40 ℃, 流动相由纯乙腈(A) 和0.1%的甲酸水溶液(B) 组成, 流速0.3 mL·min-1, 梯度洗脱程序如下: 0~3 min, 5% A; 3~5 min, 5%~72% A; 5~6 min, 72%~73% A; 6~19 min, 73% A, 19~20 min, 73%~90% A。样品初步分离后, 通过配备电喷雾离子源(ESI) 的Q/TOF-MS进行分析: 全扫描质量数据范围为50~1 500 Da; 扫描时间0.2 s; 去溶剂化温度230 ℃; 去溶剂气体流量8 L·min-1; 离子源能量3.0 eV; 毛细管电压分别为3.5 kV (正离子模式) 和3.2 kV (负离子模式); 校正液为甲酸钠, 流速为50 μL·h-1。
数据处理 将UHPLC-Q/TOF-MS采集的原始数据导入Profile Analysis (Version 2.1, 德国Bruker公司) 进行预处理, 包括峰值对齐、降噪、归一化、修正缺失值等, 得到Bucket表格。将Bucket表格导入SIMCA 14.0软件进行多变量分析, 包括主成分分析(principal component analysis, PCA) 和正交偏最小二乘法判别分析(orthogonal partial least squares discrimination analysis, OPLS-DA), 以R2和Q2评估模型的适应度和预测能力, 判断其是否过拟合。然后, 通过VIP值(VIP>3) 和t检验(P<0.05) 筛选潜在生物标志物, 利用HMDB (Human Metabolome Database, http://www.hmdh.ca), KEGG (Kyoto Encyclopedia of Genes and Genomes, https://www.kegg.jp) 和METLIN (https://metlin.scripps.edu) 等数据库富集相关代谢通路, 并通过Mev软件对生物标志物水平进行聚类分析和热图绘制。
结果 1 原阿片碱的结构鉴定与解析原阿片碱为白色半球状结晶, 溶于氯仿。三氯化铁-铁氰化钾试剂不显色; 改良碘化铋钾试剂显色反应为阳性, 提示为生物碱类成分。1H NMR (DMSO-d6, 500 MHz): δ 6.98 (1H, s, H-1), 6.80 (1H, s, H-4), 6.73 (1H, d, J = 7.5 Hz, H-11), 6.68 (1H, d, J = 7.5 Hz, H-12), 5.99 (2H, s, C9, 10-OCH2O-), 5.97 (2H, s, C2, 3-OCH2O-), 3.64 (2H, br.s), 3.32 (2H, br.s), 2.85 (2H, br.s), 2.58 (2H, br.s), 1.96 (3H, s, N-CH3); 13C NMR (DMSO-d6, 125 MHz): δ 131.5 (C-1a), 107.1 (C-1), 147.3 (C-2), 145.4 (C-3), 110.0 (C-4), 134.8 (C-4a), 29.4 (C-5), 56.7 (C-6), 51.1 (C-8), 117.0 (C-8a), 145.3 (C-9), 145.3 (C-10), 106.5 (C-11), 124.5 (C-12), 128.6 (C-12a), 44.7 (C-13), 194.0 (C-14), 41.3 (N-CH3)。综合以上解析并与文献[11]对照, 确定化合物的结构为原阿片碱。
2 代谢轮廓分析本课题组前期研究表明, 模型组小鼠的血清肌酐、尿素氮水平明显升高, 肾脏发生明显病理变化, 包括肾小球萎缩、肾小管细胞空泡化等, 体内炎性细胞因子积累, 原代肾细胞活性氧升高, 外周血中性粒细胞和巨噬细胞增多等提示模型复制成功, 而经过原阿片碱治疗之后, 上述指标均显著改善或逆转[10]。在本研究PCA得分图中, 正常组与模型组的样本点各自聚为一类, 并且显著分离, 说明小鼠在腹腔注射脂多糖之后其代谢轮廓发生了明显的变化, 进一步印证模型复制成功(图 1A和1C)。在给予原阿片碱之后, 小鼠的代谢轮廓向正常组靠近, 说明原阿片碱对AKI小鼠有良好的干预作用, 如图 1B和1D所示。

|
Figure 1 Principal component analysis (PCA) of normal group (CON), model group (lipopolysaccharide, LPS), and protropine group (PRO) in positive (A, B) and negative (C, D) source modes. Each sample point represents a serum sample of a single animal. The CON group, LPS group and PRO group correspond to green circle, blue square and yellow inverted triangle respectively. A: R2X = 0.743, Q2 = 0.669; B: R2X = 0.727, Q2 = 0.673; C: R2X = 0.632, Q2 = 0.566; D: R2X = 0.696, Q2 = 0.601 |
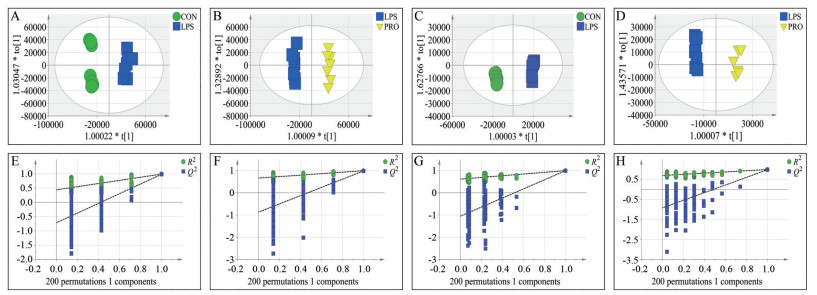
在PCA分析的基础上, 对正常组与模型组、模型组与原阿片碱组, 进行OPLS-DA分析, 结果显示两对比组均显著分离, 如图 2A~D所示。通过置换检验对OPLS-DA模型进行验证, 如图 2E~H所示, 位于左侧的R2Y值均低于最右侧的R2Y值, 位于左侧的Q2Y值均低于最右侧的Q2Y值, 且Q2的回归线截距为负, 说明未发生过拟合, 模型具有良好的区分能力和预测能力。对OPLS-DA进行S-plot分析, 根据VIP>3, P<0.05, 选出对OPLS-DA分析中差异贡献值较大的数据。结合HMDB和KEGG在线数据库筛选出潜在的生物标志物, 最后正常组与模型组中筛选出70个(正源模式下35个, 负源模式下35个) 生物标志物, 模型组与原阿片碱组中筛选出67个(正源模式下37个, 负源模式下30个) 生物标志物, 其中两对比组共有的标志物共34个(正源模式下18个, 负源模式下16个), 如表 1所示。
|
Figure 2 Screening of potential biomarkers. A, B, C, D: OPLS-DA of CON group vs LPS group, LPS group vs PRO group in positive (A, B) and negative (C, D) source modes. The CON group, LPS group and PRO group correspond to green circle, blue square and yellow inverted triangle respectively. A: R2X = 0.833, R2Y = 0.989, Q2 = 0.98; B: R2X = 0.833, R2Y = 0.995, Q2 = 0.983; C: R2X = 0.831, R2Y = 0.999, Q2 = 0.992; D: R2X = 0.818, R2Y = 0.995, Q2 = 0.984. E, F, G, H: OPLS-DA model verification of CON group vs LPS group, LPS group vs PRO group in positive (E, F) and negative (G, H) source modes. Intercepts: E: R2 = (0.0, 0.438), Q2 = (0.0, -0.715); F: R2 = (0.0, 0.662), Q2 = (0.0, -0.87); G: R2 = (0.0, 0.615), Q2 = (0.0, -1.05); H: R2 = (0.0, 0.698), Q2 = (0.0, -0.922) |
| Table 1 Summary of biomarkers in the CON group vs LPS group and LPS group vs PRO group. RT indicates the retention time of the compound in the liquid chromatography, "a" indicates that the compound comes from the CON group vs LPS group, "b" indicates that the compound comes from the LPS group vs PRO group, "a, b" indicates that the compound is shared by the two comparison groups. "+" indicates the positive detection mode, and "-" indicates the negative detection mode. MW: Molecular weight |
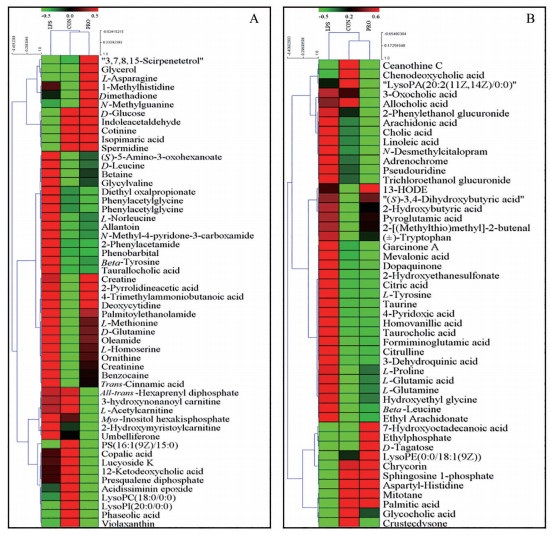
对筛选出的所有标志物进行相对定量和聚类分析, 结果发现, 从横向来看, 相对于模型组, 原阿片碱组与正常组聚为一类, 并且这些标志物能够显著区分正常组、模型组和原阿片碱组, 如图 3所示。其中在正常组与模型组和模型组与原阿片碱组中筛选出的34个共有生物标志物, 有32个标志物在原阿片碱干预之后显著回调。
|
Figure 3 The heatmap of biomarkers in positive (A) and negative (B) source modes. In the figure, each row represents a compound, and each column represents a experimental group. The three rectangles in each row represent the content of the compound in the three groups. The closer the color is to green, the lower its content, and the closer it is to red, the higher its content |
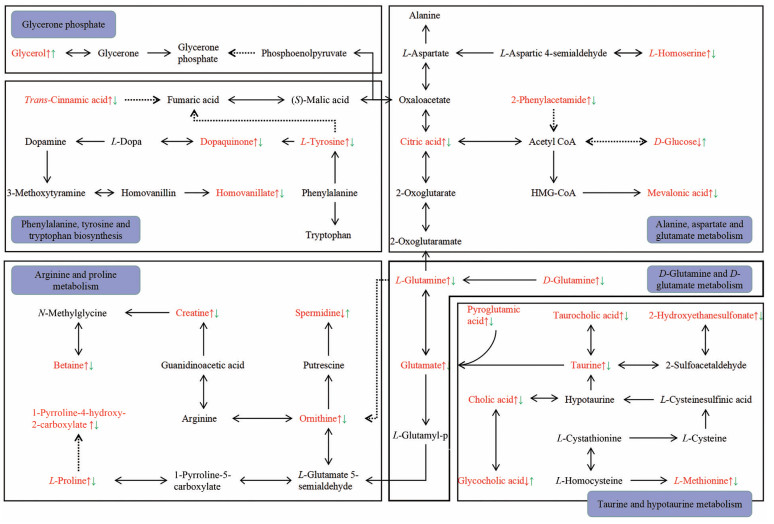
对表 1中所有的生物标志物进行通路富集分析, 并最终筛选出影响值较大的亚油酸代谢、D-谷氨酰胺与D-谷氨酸代谢、精氨酸和脯氨酸代谢、苯丙氨酸、酪氨酸和色氨酸生物合成、花生四烯酸代谢、牛磺酸和亚牛磺酸代谢、丙氨酸、天冬氨酸和谷氨酸代谢等8条代谢通路。这些通路与脂多糖诱导的AKI的发病机制以及原阿片碱对AKI小鼠的保护机制密切相关, 且这些通路主要涉及氨基酸代谢、能量代谢、脂质代谢。结合KEGG数据库和MetaboAnalyst构建代谢通路网络, 如图 4所示。
|
Figure 4 The metabolic network of protropine protecting AKI mice. The red ones indicate the common biomarkers of the CON group vs LPS group and LPS group vs PRO group. The red arrows indicate the trend of the marker in the LPS group vs CON group, and the green arrows indicate the trend of the marker in the PRO group vs LPS |
原阿片碱是从土元胡中分离得到的一种生物碱类化合物, 已报道具有多种生物学和药理活性, 但其对AKI的保护机制尚不清楚。本研究从血清代谢组学的角度发现原阿片碱对AKI小鼠的体内代谢状态有改善作用, 并探讨了其可能的作用机制, 为原阿片碱治疗AKI提供了一些新的信息。
谷氨酰胺是人体血浆和组织中含量最多的游离氨基酸[12]。谷氨酰胺在体内可以为生物大分子比如蛋白质、核酸的合成提供充足的氮源[13]; 参与能量代谢三羧酸循环, 为机体提供能量[14]。在正常生理状态下, 血液中的谷氨酰胺被肾脏获取, 从而参与能量代谢以及合成其他氨基酸。在机体紧急状态比如外伤、感染、AKI时, 组织或器官里的谷氨酰胺急剧消耗[15]。在本研究中, 模型组小鼠血清谷氨酰胺含量显著升高, 说明AKI小鼠体内存在肾脏损伤及肾功能紊乱, 肾脏对谷氨酰胺吸收和利用的稳态失衡造成了血清谷氨酰胺大量堆积。而经原阿片碱治疗之后, 谷氨酰胺含量明显降低, 说明原阿片碱可通过调节D-谷氨酰胺与D-谷氨酸代谢, 使其发挥正常的供能和氨基酸合成作用, 进而修复肾脏损伤, 改善肾功能。
精氨酸在人体内分布广泛, 参与大多数蛋白质的合成[16], 且精氨酸和脯氨酸可以相互转化[17]。有研究表明, 当机体中出现肾脏功能不全、肾衰竭、肾损伤时, 精氨酸含量显著升高, 与血清肌酐、表皮生长因子受体、尿素氮等炎症因子的含量呈正相关[18]。在本研究中, 模型组小鼠血清脯氨酸的含量明显上升, 提示精氨酸含量也存在上升趋势, 说明AKI小鼠体内存在肾损伤。而经原阿片碱治疗之后, 脯氨酸的含量显著下降并恢复至正常水平, 说明原阿片碱可通过调节精氨酸和脯氨酸代谢而改善肾功能。
苯丙氨酸在体内的主要代谢途径是转化成酪氨酸, 且反应不可逆[19]。酪氨酸有多种代谢途径: 可以代谢生成甲状腺激素, 促进糖、脂和蛋白质代谢以及能量代谢; 可经酪氨酸转氨酶氧化分解生成对羟基苯丙酮酸, 并进一步转变成乙酰乙酸和延胡索酸, 分别参与酮体或糖代谢, 为机体提供能量。此外, 色氨酸也是一种生酮生糖氨基酸, 可以为机体提供能量[20]。且经查阅文献发现, 色氨酸经吲哚胺-2, 3-双加氧酶催化生成的犬尿氨酸与AKI的严重程度呈正相关。本实验中, 模型组小鼠血清酪氨酸含量显著上升, 说明AKI小鼠体内存在酪氨酸分解代谢障碍, 能量供给不足。而经原阿片碱治疗之后, 酪氨酸含量显著下降, 说明原阿片碱能够通过干预苯丙氨酸、酪氨酸和色氨酸的生物合成而恢复机体的能量供应。
花生四烯酸是一种半必需型氨基酸, 在人体内游离的含量很少, 可由亚油酸直接转化而来。花生四烯酸大部分结合在细胞膜磷脂上, 需要时再解离出来[21]。有研究表明, 炎症反应和细胞凋亡时均可导致花生四烯酸的大量释放[22]。同时, 花生四烯酸是前列腺素、血栓素、白三烯等炎症物质的前体, 这些物质会进一步介导多种器官及生理系统的炎症反应和细胞凋亡[23], 形成恶性循环。在本研究中, 模型组小鼠血清花生四烯酸的含量显著升高, 说明AKI小鼠体内出现严重的炎症反应和细胞凋亡。而经原阿片碱治疗之后, 花生四烯酸含量明显下降, 说明原阿片碱可通过影响花生四烯酸代谢而显著减轻肾脏炎症反应和细胞凋亡。
经查阅文献发现, Li等[24]采用相似方法在AKI模型小鼠的血清中筛选出18个标志物, 而本研究一共找到103个标志物, 其中只有6个相同。与之相比, 本研究找到了更多的标志物, 在表征AKI相关的机制时更加全面。总体来说, 目前关于AKI研究还有很大的不足, 首先是缺乏大型多中心的临床试验; 其次, 多数研究只包含AKI的早期、中期或者晚期的某一个阶段, 缺乏系统性的研究[25]。因此, 目前所鉴定的生物标志物缺乏特异性, 还需要更加完善的研究去验证。本研究虽筛选出一些与AKI相关的标志物, 但是同样需要更深入的研究去讨论和验证。
本研究采用血清代谢组学技术发现原阿片碱可通过调节氨基酸代谢、能量代谢、脂质代谢来改善AKI小鼠体内的肾脏损伤、能量供给不足、炎症反应。综上所述, 本研究从代谢组学的角度探究原阿片碱对AKI小鼠的保护机制, 发现了D-谷氨酰胺、脯氨酸、花生四烯酸等生物标志物, 为原阿片碱治疗AKI提供了证据。
作者贡献: 刘振辉、周宁、刘振负责实验设计、实验开展、论文撰写及修改文章; 张贝贝、曾梦楠、李孟负责实验设计、提供样品; 郑晓珂负责实验设计、指导写作、修改及校对文章; 冯卫生负责审阅文章。
利益冲突: 所有作者声明无任何利益冲突。
| [1] |
Xue X, Gong LK, Ren J. Progress of the study of mechanism on drug induced kidney injury[J]. Acta Pharm Sin (药学学报), 2010, 45: 1199-1204. |
| [2] |
Kang LK, Li XY, Zhang Q. Advances in pathogenesis and novel biomarkers of sepsis associated acute kidney injury[J]. J Pract Med (实用医学杂志), 2021, 37: 705-708. |
| [3] |
Zhuang SY, Nie SN. Research progress on early biomarkers of sepsis associated acute kidney injury[J]. J Med Postgrad (医学研究生学报), 2021, 34: 211-216. |
| [4] |
Waltz P, Carchman E, Gomez H, et al. Sepsis results in an altered renal metabolic and osmolyte profile[J]. Surg Res, 2016, 202: 8-12. DOI:10.1016/j.jss.2015.12.011 |
| [5] |
Zheng YN, Shao GJ, Zhang YF, et al. The protective effect of Rhizoma Coptidis extracts against the sepsis associated with acute kidney injury based on metabolic analysis[J]. J Pharm Pract (药学实践杂志), 2020, 38: 435-440. |
| [6] |
Zhou N, Zheng XK, Wang QH, et al. Metabolic study of Mori Cortex on nephrogenic edema in rats[J]. Chin Tradit Pat Med (中成药), 2018, 40: 788-795. |
| [7] |
Alam MB, Ju MK, Kwon YG, et al. Protopine attenuates inflammation stimulated by carrageenan and LPS via the MAPK/NF-κB pathway[J]. Food Chem Toxicol, 2019, 131: 110583. DOI:10.1016/j.fct.2019.110583 |
| [8] |
Wang GX, Zhou Z, Jiang DX, et al. In vivo anthelmintic activity of five alkaloids from Macleaya microcarpa (Maxim) Fedde against Dactylogyrus intermedius in Carassius auratus[J]. Vet Parasitol, 2010, 171: 305-313. DOI:10.1016/j.vetpar.2010.03.032 |
| [9] |
Kosina P, Gregorova J, Gruz J, et al. Phytochemical and antimicrobial characterization of Macleaya cordata herb[J]. Fitoterapia, 2010, 81: 1006-1012. DOI:10.1016/j.fitote.2010.06.020 |
| [10] |
Zhang BB, Zeng MN, Li M, et al. Protopine protects mice against LPS-induced acute kidney injury by inhibiting apoptosis and inflammation via the TLR4 signaling pathway[J]. Molecules, 2019, 25: 15. DOI:10.3390/molecules25010015 |
| [11] |
Liu C, Zhao SX. Chemical constituents of the tubers of Jiangsu Yuanhu[J]. J China Pharm Univ (中国药科大学学报), 1989, 20: 261-265. |
| [12] |
Xu LY. Effects of glutamine enhanced enteral nutrition support on nutritional indicators, immune function and quality of life in elderly patients with advanced gastric cancer[J]. Chin J Mod Drug Appl (中国现代药物应用), 2021, 15: 11-13. |
| [13] |
Hu XY, Jin HC, Zhu LY. Effect of glutamine metabolism on chemoresistance and its mechanism in tumors[J]. J Zhejiang Unive Med Sci (浙江大学学报医学版), 2021, 50: 32-40. |
| [14] |
Pang FF. Effect of compound Lactobacillus acidophilus tablets combined with glutamine in the treatment of diarrheal irritable bowel syndrome[J]. Henan Med Res (河南医学研究), 2021, 30: 1663-1665. |
| [15] |
Wang LJ. Effects of Penehyclidine Hydrochloride Pretreatment in Endotoxemia of Neonatal Rats (盐酸戊乙奎醚预先给药对新生大鼠内毒素性肾脏损伤的影响) [D]. Zhengzhou: Zhengzhou University, 2015.
|
| [16] |
Shan LL, Zhang YK. The metabolic mechanism of arginine and its supplementary effect during exercise[J]. Chin J Sports Med (中国运动医学杂志), 2008, 27: 129-132. |
| [17] |
Fan YJ, Wang XX, Bao K, et al. Research progress on the role of arginine in animal nutrition and physiology[J]. Spec Wild Econ Anim Plant Res (特产研究), 2021, 43: 101-105. |
| [18] |
Zhang F, Wang QH, Xia TY, et al. Diagnostic value of plasma tryptophan and symmetric dimethylarginine levels for acute kidney injury among tacrolimus-treated kidney transplant patients by targeted metabolomics analysis[J]. Sci Rep, 2018, 8: 558-565. DOI:10.1038/s41598-017-19072-5 |
| [19] |
Qu XY, Gao H, Sun JM, et al. Identification of key metabolites during cisplatin-induced acute kidney injury using an HPLC-TOF/MS-based non-targeted urine and kidney metabolomics approach in rats[J]. Toxicology, 2020, 431: 152366. DOI:10.1016/j.tox.2020.152366 |
| [20] |
Zheng XK. Biochemistry (生物化学)[M]. 3rd Ed. Beijing: People's Medical Publishing House, 2016: 210.
|
| [21] |
Tian J, Xiang XL, Wang XY, et al. Application progress on detection of arachidonic acid metabolites by LC-MS/MS[J]. Chin J Pharm Anal (药物分析杂志), 2019, 39: 957-966. |
| [22] |
Wang XY, Li D, Yu JQ, et al. Study on protective effect of Chinese patent medicine Liuwei Dihuang Pill on acute kidney injury[J]. J Instrum Anal (分析测试学报), 2017, 36: 621-626. |
| [23] |
Tian J. Construction of Contour Spectrum of Arachidonic Acid and its Metabolites Based on UPLC-QTOF-MS/MS (基于UPLC-QTOF-MS/MS技术的花生四烯酸及其代谢物轮廓谱的构建) [D]. Wuhan: Hubei University of Chinese Medicine, 2020.
|
| [24] |
Li P, Liao ST, Wang JS, et al. Protection by Huang-Lian-Jie-Du decoction and its constituent herbs of lipopolysaccharide-induced acute kidney injury[J]. FEBS Open Bio, 2017, 7: 221-236. DOI:10.1002/2211-5463.12178 |
| [25] |
Mei CL, Liu SY. Advances in diagnosis and treatment of acute kidney injury[J]. Med J Chin People's Lib Army (解放军医学杂志), 2013, 38: 342-346. |
 2022, Vol. 57
2022, Vol. 57


