2. 贵州省中国科学院天然产物化学重点实验室/贵州省天然药物工程研究中心, 贵州 贵阳 550014;
3. 贵州中医药大学, 贵州 贵阳 550025;
4. 贵州医科大学药学院, 贵州 贵阳 550025
2. The Key Laboratory of Chemistry for Natural Products of Guizhou Province and Chinese Academy of Sciences/Guizhou Provincial Engineering Research Center for Natural Drugs, Guiyang 550014, China;
3. Guizhou University of Traditional Chinese Medicine, Guiyang 550025, China;
4. School of Pharmacy, Guizhou Medical University, Guiyang 550025, China
马蹄金素[MTS, N-(N-苯甲酰基-L-苯丙氨酰基)-O-乙酰基-L-苯丙氨醇] 是本课题组从民族药马蹄金(Dichondra repens Forst.) 中分离得到具有抗乙肝病毒(HBV) 活性的苯丙氨酸二肽类化合物[1]。通过以其为先导化合物设计合成了一系列MTS衍生物[2-7], 并以其中一个优选的MTS衍生物Y101开展了系统的临床前研究获得药物临床试验批件(药物名称: 替芬泰)[8], 现已完成Ⅰ期临床试验。Y101的体内代谢试验结果显示其结构中有一个酰胺键在体内容易被水解, 在人和大鼠体内的主要代谢产物均为M8[9], 且M8的体外抗HBV活性明显低于Y101。为克服含酰胺结构类药物(或活性分子) 的体内代谢不稳定性, 对该类分子常用的结构优化方法之一是生物电子等排体替换(通常为非经典的生物电子等排体) 法, 将酰胺键替换成各种不同的结构单元设计合成新型酰胺模拟物[10]。三氟甲基由于具有很强的吸电子性和稳定性、理想的脂溶性、以及更好的生物通透性和靶向选择性, 这使得三氟甲基取代的甲氨结构单元可以被引入先导化合物的结构修饰中作为酰胺结构的生物电子等排体[11], 设计合成具有更好代谢稳定性的酰胺模拟物[12]。因此, 为拓展马蹄金素二肽衍生物结构多样性, 以获得新型抗乙肝病毒活性目标分子, 本文选择前期发现的一些具有较好抗HBV活性的MTS衍生物为原型分子, 将其中容易水解的酰胺键以含有三氟甲基取代的甲氨单元替换, 开展了新型MTS二肽模拟物设计与合成及其抗HBV活性研究(图 1)。
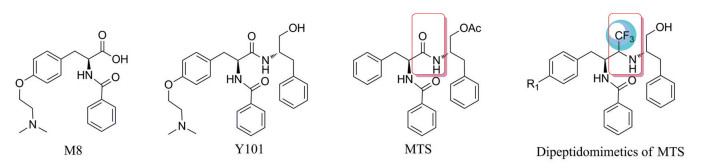
|
Figure 1 Chemical structures of Y101, M8 and the target molecules. MTS: Matijin-Su |
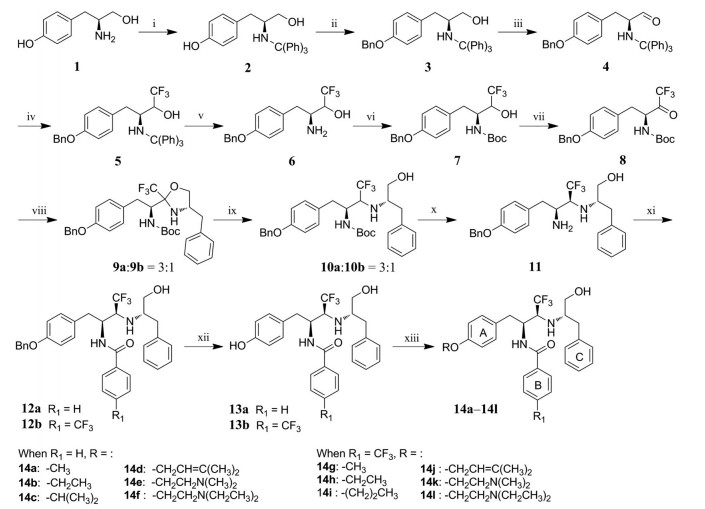
|
Scheme 1 Synthetic route for the target compounds Reagents and conditions: (ⅰ) Trt-Cl, DIPEA, DCM, 0 ℃, 4 h; (ⅱ) BnBr, K2CO3, DMF, r.t., 12 h; (ⅲ) DMSO, (COCl)2, Et3N, DCM, -78 ℃, 2 h; (ⅳ) TMSCF3, TBAF, DMF, -50 ℃ 2 h; (ⅴ) TsOH·H2O, MeOH, 0 ℃, 0.5 h; (ⅵ) (Boc)2O, NaHCO3, 0 ℃ to r.t., 12 h; (ⅶ) Dess-Martin, DCM; r.t., 4 h; (ⅷ) L-Phenylalaninol, toluene, 140 ℃ reflux, 24 h; (ⅸ) LiAlH4, THF, -78 ℃ to 0 ℃, 8 h; (ⅹ) DL-Camphorsulfonic acid, DCM, r.t., 12 h; (ⅹⅰ) Benzoic acid or 4-(trifluoromethyl)benzoic acid, EDCI, NMM, 0 ℃, 4 h; (ⅹⅱ) H2, Pd/C, MeOH, r.t., 24 h; (ⅹⅲ) MeI (EtI, (CH3)2CHI, (CH3)2C=CHBr, ClCH2CH2N(CH3)2·HCl or ClCH2CH2N(CH2CH3)2·HCl), K2CO3, DMF, r.t., 12 h. |
以L-酪氨醇(1) 为原料, 依次与三苯基氯甲烷(Trt-Cl) 和溴化苄(BnBr) 反应分别保护其氨基和酚羟基得中间体2和3, 3经Swern[13]氧化得中间体4, 4在四丁基氟化铵(TBAF) 作用下和三氟甲基三甲基硅烷(TMSCF3) 反应引入三氟甲基得中间体5, 5经酸催化脱去三苯甲基得中间体6, 6与二碳酸二叔丁酯[(Boc)2O] 在碳酸氢钠存在下反应得中间体7, 7经Dess-Martin[14]氧化得中间体8, 将所得8的粗品直接与L-苯丙氨醇在甲苯中于140 ℃回流偶联得混合物9a/9b, 9a/9b在四氢铝锂作用下开环得混合物10a/10b, 10a/10b在DL-樟脑磺酸催化下脱去叔丁氧羰基(Boc) 保护得到中间体11; 将11分别与苯甲酸/4-三氟甲基苯甲酸进行偶联反应得中间体12a/12b, 脱去苄基得中间体13a/13b, 最后将其A环上的酚羟基修饰即得化合物14a~14l (合成路线1)。
在以上合成路线中, 三氟甲基的引入是关键, 在成功制备中间体5之前, 作者曾参照文献方法, 直接对N-Boc保护的醛为底物进行三氟甲基化反应[15, 16], 以及以N-Cbz保护的醛或N, N-双苄基保护醛为原料与TMSCF3在TBAF等促进剂存在条件下反应[17, 18], 实验均未成功, 最终通过文献[19]的方法对氨基进行三苯甲基保护后, 制备了中间体5, 且为单一构型产物, 推测其原因可能是在-50 ℃的低温反应条件下, 中间体4中醛基的α-位N-(三苯基甲基)-氨基取代诱导了立体选择性加成反应。而在三氟甲基取代的酮与苯丙氨醇的偶联反应中, 其α-位的取代基为-NH-Trt底物不发生反应, 换作-NH-Boc保护时反应收率较高。从化合物13a或13b合成制备化合物14a~14l羟基烷基化反应过程中, 其游离仲氨基无需保护, 且在反应体系中未检测到N-烷基化产物生成, 这可能是由于仲氨基相邻的α-碳上的三氟甲基(CF3) 的强吸电子特性, 以及与仲胺相连部分为大位阻基团两个原因导致该仲氨基氮原子亲核性很弱, 导致其不与卤代烷发生N-烷基化反应。
2 化合物10′的晶体结构为确定目标化合物的绝对构型, 在对化合物10a进行单晶培养失败后, 经过多方尝试, 最终完成了10a催化脱苄基所得化合物10′的单晶培养, 并成功测定其绝对构型。将化合物10a采用Pd(OH)2/C催化氢化脱苄基保护得化合物10′, 再对其进行X射线单晶衍射分析(CCDC号为2108826), 结果表明: 化合物10′分子式为C24H31F3N2O4, 相对分子质量Mr = 468.51, 晶型: 三斜晶系, 空间群: P1, 晶胞参数: a = 19.699 (14) nm, b = 19.699 nm, c = 5.366 (2) nm, α = 90°, β = 90°, γ = 120°, V = 1 803.2 (14) nm3; Z = 1; Dc = 1.303 g·cm-3; μ = 0.106 mm-1; F (000) = 747.0, 晶体结构修正后的一致性因子: R1 = 0.066 1 [I ≥ 2σ (I)], wR2 = 0.122 5, R1 = 0.223 6, wR2 = 0.179 7, 具体晶体结构见图 2。
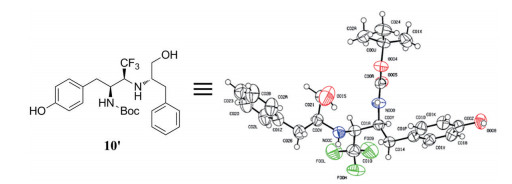
|
Figure 2 Crystal structure of the title compound 10′ |
以HBV-DNA克隆转染人肝癌细胞HepG2 2.2.15细胞株为实验模型, 采用荧光定量PCR检测法, 对合成所得目标分子进行了体外抗HBV的活性检测, 结果见表 1。
| Table 1 Anti-HBV activities of compounds |
通过以L-酪氨醇为原料, 经过氨基选择性保护、酚羟基保护、Swern氧化、与三氟甲基三甲基硅烷反应引入三氟甲基、将氨基的三苯甲基保护基替换为Boc保护基、将游离醇羟基以Dess-Martin氧化、与苯丙氨醇偶联、开环、脱氨基保护基、酰胺化、脱酚羟基保护基、酚羟基烷基化等反应, 首次合成了含三氟甲基的马蹄金素二肽模拟物16个, 并以HepG2 2.2.15细胞模型对所得目标分子进行了-HBV DNA的抑制活性测定, 结果显示部分目标分子具有抗HBV活性, 当B环无取代基团, A环为羟基取代时化合物活性相对较高(化合物12a、12b、13a、13b); 对化合物13a中A环上的酚羟基进行甲基化、乙基化、异丙基化取代后所得衍生物14a~14c中, 异丙基取代所得衍生物活性较优, 但对化合物13b的A环作类似烷基取代时, 所得衍生物14g~14i活性较差, 即B环为4-三氟甲基取代时, 活性普遍较低。化合物14e、14f及14k为Y101的三氟甲基替代物及其衍生物, 其IC50值分别为0.37、0.29、0.79 μmol·L-1, 与原型化合物相比[20], 该类化合物活性更优。综上, B环4位吸电子取代基导致衍生物活性整体降低; 衍生物活性随着A环4位取代基位阻增大呈升高趋势。因此含氟取代的马蹄金素二肽模拟物具有进一步研究的价值与意义。
实验部分Bruker Avance NEO 600 MHz核磁共振仪(Bruker Corporation); HP-5973质谱仪(Hewlett-Packard); 柱色谱硅胶(300~400目) 及高效薄层板均为青岛海洋化工厂生产; 无水二氯甲烷由分析纯二氯甲烷经CaH2回流蒸馏制得, 无水甲醇以及无水N, N-二甲基甲酰胺均经分子筛干燥, 其余试剂均为市售分析纯或化学纯产品。
1 化合物的合成 1.1 中间体的合成N-(三苯基甲基)-L-酪氨醇(2)[21]: 取化合物1 (15.4 g, 86.3 mmol) 于500 mL反应瓶中, 加入无水N, N-二甲基甲酰胺(100 mL) 搅拌溶解完全, 于0 ℃下加入三苯甲基氯甲烷(20.4 g, 73.4 mmol), 氩气保护下, 滴加N, N-二异丙基乙胺(15.1 mL, 86.3 mmol) 和无水N, N-二甲基甲酰胺(80 mL) 的混合液, 滴加完毕后继续于0 ℃搅拌4 h至薄层色谱检测反应完全。将反应液用乙酸乙酯萃取, 有机相依次用水、饱和氯化钠洗涤, 无水硫酸镁干燥, 减压回收溶剂至干, 所得残留物经硅胶柱色谱[V (石油醚)∶V (乙酸乙酯) = 3∶1] 纯化, 得无色油状液体18.04 g, 即中间体2, 产率51.0%。[α]
N-(三苯基甲基)-O-苄基-L-酪氨醇(3): 取中间体2 (18.0 g, 44.1 mmol) 于500 mL反应瓶中, 用无水N, N-二甲基甲酰胺(150 mL) 溶解, 加入碳酸钾(7.31 g, 52.9 mmol), 氩气保护下, 滴加溴化苄(6.6 mL, 48.5 mmol), 室温搅拌反应约12 h至薄层色谱检测反应完全。将反应液用乙酸乙酯萃取, 有机相依次用水、饱和氯化钠洗涤, 无水硫酸镁干燥, 减压回收溶剂至干, 所得粗品经硅胶柱色谱[V (石油醚)∶V (乙酸乙酯) = 10∶1] 纯化, 得无色油状液体17.3 g, 即中间体3, 产率77.2%。[α]
(S)-3-(4-苄氧基苯基)-2-[(三苯基甲基)氨基]-丙醛(4): 氩气保护下, 于500 mL的反应瓶中, 依次加入无水二氯甲烷(100 mL)、草酰氯(5.9 mL, 69.3 mmol), 将反应瓶置于-78 ℃搅拌15 min后缓慢加入二甲亚砜(7.4 mL, 104 mmol), 继续搅拌15 min, 缓慢加入含中间体3 (17.3 g, 34.6 mmol) 的无水二氯甲烷(70 mL) 溶液, 搅拌15 min后加入Et3N (19.2 mL, 138.5 mmol), 继续于-78 ℃搅拌2 h至薄层色谱检测反应完全。加入水(约10 mL) 淬灭反应, 减压浓缩回收大量二氯甲烷, 剩余反应液用乙酸乙酯萃取, 有机相依次用水、饱和氯化钠洗涤, 无水硫酸镁干燥, 减压回收溶剂至干, 所得淡黄色油状液体无需进一步纯化直接用于下一步反应。[α]
(3S)-4-(4-苄氧基苯基)-3-[(三苯基甲基)氨基]-1, 1, 1-三氟-2-丁醇(5): 取中间体4的粗品(小于17.2 g, 34.6 mmol) 加入250 mL的反应瓶中, 加入无水N, N-二甲基甲酰胺(100 mL), 快速加入四丁基氟化胺(5.4 g, 20.7 mmol), 氩气保护下, 于-50 ℃搅拌10 min后加入三氟甲基三甲基硅烷(12.8 mL, 86.4 mmol), 继续搅拌2 h至薄层色谱检测反应完全。将反应液用乙酸乙酯萃取, 所得有机相依次用水、饱和氯化钠洗涤, 无水硫酸镁干燥, 减压回收溶剂至干, 所得黄色油状液体未经纯化直接用于下一步反应。[α]
(3S)-4-(4-苄氧基苯基)-3-氨基-1, 1, 1-三氟-2-丁醇(6): 取中间体5的粗品(小于19.6 g, 34.6 mmol) 于250 mL的反应瓶中, 加入无水甲醇(100 mL) 溶解, 氩气保护条件下, 于0 ℃下缓慢滴加对甲苯磺酸一水合物(6.6 g, 34.6 mmol) 与甲醇(50 mL) 的混合溶液, 反应1 h至薄层色谱检测已反应完全, 反应液用乙酸乙酯和水分散, 加入碳酸钾调节pH至10~11, 萃取, 有机相用水、饱和氯化钠洗涤, 无水硫酸镁干燥, 减压回收溶剂至干, 所得粗品经硅胶柱色谱[V (石油醚)∶V (乙酸乙酯) = 3∶1] 纯化, 得单一构型淡黄色固体7.99 g, 即中间体6, 三步产率76.2%。mp 150~152 ℃; [α]
(3S)-4-(4-苄氧基苯基)-3-(N-Boc-氨基)-1, 1, 1-三氟代-2-丁醇(7): 取中间体6 (19.6 g, 34.6 mmol) 于250 mL的反应瓶中, 加入无水甲醇(170 mL) 溶解, 碳酸氢钠(4.4 g, 52.8 mmol), 氩气保护下, 滴加二碳酸二叔丁酯(7.3 mL, 31.6 mmol), 室温反应12 h至薄层色谱检测已反应完全, 将反应液用乙酸乙酯萃取, 有机相依次用水、饱和氯化钠洗涤, 无水硫酸镁干燥, 减压回收溶剂至干, 所得粗品经硅胶柱色谱[V (石油醚)∶V (乙酸乙酯) = 3∶1] 纯化, 得白色固体7.99 g, 即中间体7, 产率71.2%。mp 120~122 ℃; [α]
(3S)-4-(4-苄氧基苯基)-3-(N-Boc-氨基)-1, 1, 1-三氟代-2-丁酮(8): 取中间体7 (8.0 g, 18.9 mmol) 于250 mL的反应瓶中, 氩气保护下, 加入无水二氯甲烷(120 mL) 溶解, 加入Dess-Martin (20.7 g, 48.8 mmol), 室温反应4 h至薄层色谱检测已反应完全。加入饱和硫代硫酸钠溶液(20 mL) 搅拌30 min, 减压浓缩回收大量二氯甲烷, 剩余反应液用乙酸乙酯萃取, 合并有机相, 并依次用水、饱和碳酸氢钠、水、饱和氯化钠洗涤, 无水硫酸镁干燥, 减压回收溶剂至干, 得淡黄色油状液体, 即中间体8。未做纯化直接下一步反应。
(4S)-4-苄基-2-{(S)-2-[(4-苄氧基苯基)]-1-(N-Boc-氨基)-乙基}-2-(三氟甲基)-噁唑烷(9a): 取中间体8 (7.95 g, 18.8 mmol) 和L-苯丙胺醇(5.68 g, 37.5 mmol) 于250 mL反应瓶中, 氩气保护下注入无水甲苯(200 mL), 140 ℃下冷凝回流24 h至薄层色谱检测已反应完全, 减压回收甲苯至干得粗品, 所得粗品经硅胶柱色谱[V (石油醚)∶V (乙酸乙酯) = 20∶1] 纯化, 得白色固体5.79 g, 为难以完全分离的一对差向异构体混合物9a和9b (通过测试反应粗产物的1H NMR, 由9a和9b的特征氢峰面积比可得出9a与9b的比例约为3∶1), 该样品未经进一步纯化而直接用于下一步反应, 两步总产率55.4%。取少许混合物经柱色谱纯化得主产物9a。mp 124~126 ℃; [α]
N-[(2S, 3S)-4-(4-苄氧基苯基)-3-(N-Boc-氨基)-1, 1, 1-三氟代-丁-2-基]-L-苯丙氨醇(10a): 取混合物9a/9b (5.76 g, 10.4 mmol) 于100 mL的反应瓶中, 加入无水四氢呋喃(40 mL) 溶解, 氩气保护, 于-78 ℃加入四氢铝锂(21.0 mL, 20.1 mmol), 继续搅拌30 min, 搅拌升至0 ℃, 反应12 h至薄层色谱检测已反应完全, 加入饱和氯化铵水溶液(约10 mL) 处理, 反应液用乙酸乙酯萃取, 有机相依次用水、饱和氯化钠洗涤, 无水硫酸镁干燥, 减压回收溶剂至干, 得淡黄色固体粗品经硅胶柱色谱[V (石油醚)∶V (乙酸乙酯) = 3∶1] 纯化, 得白色固体3.84 g, 为一对差向异构体混合物10a和10b (比例约为3∶1, 测试方法同9a/9b的比例测试), 该样品未经进一步纯化而直接用于下一步反应, 产率66.6%。取少许混合物经柱色谱纯化得主产物10a。mp 105~107 ℃; [α]
N-[(2S, 3S)-4-(4-羟基苯基)-3-(N-Boc-氨基)-1, 1, 1-三氟代-丁-2-基]-L-苯丙氨醇(10′): 取中间体10a (518 mg, 0.92 mmol) 于25 mL的反应瓶中, 加入无水甲醇(5 mL) 溶解, 加入15%的Pd(OH)2/C (43 mg, 0.046 mmol), 于氢气氛围下反应约12 h至薄层色谱检测已反应完全, 抽滤, 减压浓缩, 粗品经硅胶柱色谱纯化, 得白色固体369 mg, 即中间体10′, 产率85%。
N-[(2S, 3S)-4-(4-苄氧基-苯基)-3-氨基-1, 1, 1-三氟代-丁-2-基]-L-苯丙氨醇(11): 取混合物10a/10b (3.85 g, 6.89 mmol) 于100 mL的反应瓶中, 加入无水二氯甲烷(15 mL) 溶解, 加入DL-樟脑磺酸(6.40 g, 27.6 mmol), 室温反应12 h至薄层色谱检测已反应完全。反应液用乙酸乙酯和水分散, 加入碳酸钾调节pH至10~11, 萃取, 合并有机相, 并依次用水、饱和氯化钠洗涤, 无水硫酸镁干燥, 减压回收溶剂至干, 所得粗品经硅胶柱色谱[V (石油醚)∶V (乙酸乙酯) = 1∶1] 纯化, 分离其主产物得白色固体2.1 g, 即中间体11, 产率66.4%。mp 60~62 ℃; [α]
N-[(2S, 3S)-4-(4-苄氧基苯基)-3-(苯甲酰氨基)-1, 1, 1-三氟代-丁-2-基]-L-苯丙氨醇(12a): 取中间体11 (80 mg, 0.18 mmol) 和苯甲酸(43 mg, 0.35 mmol) 于25 mL的反应瓶中, 加入无水二氯甲烷(3 mL) 溶解, 氩气保护下, 依次加入N-甲基吗啡啉(80 μL, 0.70 mmol)、1-乙基-(3-二甲基氨基丙基) 碳酰二亚胺盐酸盐(67 mg, 0.35 mmol), 置换氩气, 继续搅拌4 h至薄层色谱检测已反应完全。反应液用乙酸乙酯萃取, 有机相依次用水、饱和氯化钠洗涤, 无水硫酸镁干燥, 减压回收溶剂至干, 所得粗品经硅胶柱色谱[V (石油醚)∶V (乙酸乙酯) = 5∶1] 纯化, 得白色固体70 mg, 即目标化合物12a, 产率71.4%。mp 155~157 ℃; [α]
N-[(2S, 3S)-4-(4-苄氧基苯基)-3-(4-三氟甲基苯甲酰氨基)-1, 1, 1-三氟代-丁-2-基]-L-苯丙氨醇(12b): 参照目标化合物13a的合成方法, 将苯甲酸替换成4-三氟甲基苯甲酸, 得白色固体, 即目标化合物12b。产率90%; mp 170~172 ℃; [α]
N-[(2S, 3S)-4-(4-羟基-苯基)-3-(苯甲酰氨基)-1, 1, 1-三氟代-丁-2-基]-L-苯丙氨醇(13a): 取化合物12a (150 mg, 0.27 mmol) 于50 mL的反应瓶中, 加入甲醇(10 mL) 溶解, 加入5%的Pd/C (15 mg, 0.01 mmol), 置换氢气, 室温反应24 h至薄层色谱检测已反应完全。反应液用乙酸乙酯和水分散, 萃取2次, 合并所得有机层用水、饱和氯化钠洗涤, 无水硫酸镁干燥, 减压回收溶剂至干, 所得物经硅胶柱色谱[V (石油醚)∶V (乙酸乙酯) = 1∶1] 纯化, 得白色固体112 mg, 即目标化合物13a, 产率88.9%。mp 205~207 ℃; [α]
N-[(2S, 3S)-4-(4-羟基-苯基)-3-(4-三氟甲基苯甲酰氨基)-1, 1, 1-三氟代-丁-2-基]-L-苯丙氨醇(13b): 参照目标化合物13a的合成方法, 得白色固体, 即目标化合物13b。产率65%; mp 150~153 ℃; [α]
N-[(2S, 3S)-4-(4-甲氧基苯基)-3-(苯甲酰氨基)-1, 1, 1-三氟代-丁-2-基]-L-苯丙氨醇(14a): 取化合物13a (50 mg, 0.11 mmol) 于10 mL的反应瓶中, 依次加入N, N-二甲基甲酰胺(2 mL) 溶解、碳酸钾(44 mg, 0.32 mmol)、碘甲烷(18 μL, 0.21 mmol), 室温反应12 h, 薄层色谱检测至反应完全。反应液用乙酸乙酯和水分散, 所得有机层依次用水、饱和氯化钠洗涤, 无水硫酸镁干燥, 减压回收溶剂至干, 所得物经硅胶柱色谱[V (石油醚)∶V (乙酸乙酯) = 3∶1] 纯化, 得白色固体44 mg, 即目标化合物14a, 产率85.5%。mp 167~169 ℃; [α]
N-[(2S, 3S)-4-(4-乙氧基苯基)-3-(苯甲酰氨基)-1, 1, 1-三氟代-丁-2-基]-L-苯丙氨醇(14b): 参照目标化合物14a的合成方法, 将碘甲烷替换成碘乙烷, 得白色固体70 mg, 即目标化合物14b, 产率66.1%。mp 152~154 ℃; [α]
N-[(2S, 3S)-4-(4-异丙氧基苯基)-3-(苯甲酰氨基)-1, 1, 1-三氟代-丁-2-基]-L-苯丙氨醇(14c): 参照目标化合物14a的合成方法, 将碘甲烷换成碘代异丙烷, 得白色固体52 mg, 即目标化合物14c, 产率59.8%。mp 173~175 ℃; [α]
N-{(2S, 3S)-4-[4-(异戊烯氧基)苯基]-3-(苯甲酰氨基)-1, 1, 1-三氟代-丁-2-基}-L-苯丙氨醇(14d): 参照目标化合物14a的合成方法, 将碘甲烷换成1-溴-3-甲基-2-丁烯, 纯化得白色固体30 mg, 即目标化合物14d, 产率43.7%。mp 120~122 ℃; [α]
N-{(2S, 3S)-4-[4-(2-二甲基氨基乙氧基)苯基]-3-(苯甲酰氨基)-1, 1, 1-三氟代-丁-2-基}-L-苯丙氨醇(14e): 取化合物13a (80 mg, 0.17 mmol) 于25 mL的反应瓶中, 依次加入1, 4-二氧六环(3 mL)、碳酸钾(162 mg, 1.19 mmol)、二甲氨基氯乙烷盐酸盐(26 mg, 0.18 mmol), 90 ℃下反应12 h至薄层色谱检测已反应完全。反应液用乙酸乙酯和水分散, 所得有机层依次用水、饱和氯化钠洗涤, 无水硫酸镁干燥, 减压回收溶剂至干, 所得物经硅胶柱色谱[V (二氯甲烷)∶V (甲醇) = 8∶1] 纯化, 得淡黄色固体76 mg, 即目标化合物14e, 产率84.3%。mp 103~105 ℃; [α]
N-{(2S, 3S)-4-[4-(2-二乙基氨基乙氧基)苯基]-3-(苯甲酰氨基)-1, 1, 1-三氟代-丁-2-基}-L-苯丙氨醇(14f): 参照目标化合物14e的合成方法, 将二甲氨基氯乙烷盐酸盐替换成二乙氨基氯乙烷盐酸盐, 得淡黄色固体, 即目标化合物14f, 产率62.2%。mp 70~73 ℃; [α]
N-[(2S, 3S)-4-(4-甲氧基苯基)-3-(4-三氟甲基苯甲酰氨基)-1, 1, 1-三氟代-丁-2-基]-L-苯丙氨醇(14g): 参照目标化合物14a的合成方法, 将13a替换成13b, 得白色固体, 即目标化合物14g。产率70%; mp.145~147 ℃; [α]
N-[(2S, 3S)-4-(4-乙氧基苯基)-3-(4-三氟甲基苯甲酰氨基)-1, 1, 1-三氟代-丁-2-基]-L-苯丙氨醇(14h): 参照目标化合物14g的合成方法, 将碘甲烷替换成碘乙烷, 得白色固体, 即目标化合物14h。产率95%; mp 166~168 ℃; [α]
N-[(2S, 3S)-4-(4′-丙氧基苯基)-3-(4-三氟甲基苯甲酰氨基)-1, 1, 1-三氟代-丁-2-基]-L-苯丙氨醇(14i): 参照目标化合物14g的合成方法, 将碘甲烷替换成碘丙烷, 得白色固体, 即目标化合物14i。产率88%; mp 155~158 ℃; [α]
N-[(2S, 3S)-4-(4-(3′, 3′-二甲基烯丙基)苯基)-3-(4-三氟甲基苯甲酰氨基)-1, 1, 1-三氟代-丁-2-基]-L-苯丙氨醇(14j): 参照目标化合物14a的合成方法, 将碘甲烷替换成1-溴-3-甲基-2-丁烯, 得白色固体, 即目标化合物14j。产率54%; mp 165~168 ℃; [α]
N-[(2S, 3S)-4-(4-(2′-二甲基氨基乙氧基)苯基)-3-(4-三氟甲基苯甲酰氨基)-1, 1, 1-三氟代-丁-2-基]-L-苯丙氨醇(14k): 参照目标化合物14e的合成方法, 将苯甲酸替换成4-三氟甲基苯甲酸, 得白色固体, 即目标化合物14k。产率94%; mp 116~118 ℃; [α]
N-[(2S, 3S)-4-(4-(2′-二乙基氨基乙氧基)苯基)-3-(4-三氟甲基苯甲酰氨基)-1, 1, 1-三氟代-丁-2-基]-L-苯丙氨醇(14l): 参照目标化合物14f的合成方法, 将苯甲酸替换成4-三氟甲基苯甲酸, 得白色固体, 即目标化合物14l。产率68%; mp 162~165 ℃; [α]
选用对数生长期的HepG2 2.2.15细胞, 用0.02%乙二胺四乙酸(EDTA) 清洗2次, 再加入0.25%胰蛋白酶1 mL消化3~5 min, 吹打均匀, 计数到每毫升2×105个细胞, 接种至96孔细胞培养板中, 每孔0.2 mL。放入细胞培养箱培养, 待细胞贴壁后进行实验。用含2%胎牛血清(FBS) 的MEM分别配制成不同浓度的药液, 另设Y101阳性对照组、病毒对照组以及二甲基亚砜(DMSO) 对照组, 分别加入96孔细胞培养板中, 每孔0.2 mL, 每浓度3孔。每3天换液一次, 第6天收集细胞, 细胞用0.5% NP-40裂解。细胞裂解液用DNA Extraction Soln 1.0提取细胞内总DNA, RT-PCR法检测细胞中HBV DNA的载量。
根据药物效果计算公式: 检测的HBV DNA拷贝数用平均值及标准差(
| $ \mathrm{抑}\mathrm{制}\mathrm{百}\mathrm{分}\mathrm{率}=\frac{\mathrm{对}\mathrm{照}\mathrm{组}\mathrm{D}\mathrm{N}\mathrm{A}\mathrm{浓}\mathrm{度}-\mathrm{给}\mathrm{药}\mathrm{组}\mathrm{D}\mathrm{N}\mathrm{A}\mathrm{浓}\mathrm{度}}{\mathrm{对}\mathrm{照}\mathrm{组}\mathrm{D}\mathrm{N}\mathrm{A}\mathrm{浓}\mathrm{度}}\times 100\mathrm{\%} $ |
用Reed-Muench公式计算IC50:
| $ \begin{array}{l}\mathrm{I}{\mathrm{C}}_{50}=\mathrm{A}\mathrm{n}\mathrm{t}\mathrm{i}\mathrm{ }\;\mathrm{L}\mathrm{o}\mathrm{g}(\mathrm{B}+\\ \;\;\;\;\;\;\frac{50- < 50\mathrm{\%}\mathrm{抑}\mathrm{制}\mathrm{百}\mathrm{分}\mathrm{率}}{ > 50\mathrm{\%}\mathrm{抑}\mathrm{制}\mathrm{百}\mathrm{分}\mathrm{率}- < 50\mathrm{\%}\mathrm{抑}\mathrm{制}\mathrm{百}\mathrm{分}\mathrm{率}})\times \mathrm{C} \end{array}$ |
其中: A = log(>50%药物浓度), B = log(<50%药物浓度), C = A - B。
作者贡献: 黄维杰负责合成路线探索、目标化合物合成及初稿写作; 况安香、邵晓霜协助完成本论文的部分实验工作; 曾晓萍参与生物活性测试方面的工作; 梁光义教授协助相关文献查询; 孟雪玲协助本论文的写作、修改及投稿; 通讯作者徐必学研究员负责课题的总体设计、实验指导及稿件修改等工作。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Liu YM, Liang GY, Xu BX. Studies on the chemical constituents from Dichondra repens Forst[J]. Nat Prod Res Dev (天然产物研究与开发), 2003, 15: 15-17. |
| [2] |
Xu BX, Huang ZM, Liu CX, et al. Synthesis and anti-hepatitis B virus activities of Matijing-Su derivatives[J]. Bioorg Med chem, 2009, 17: 3118-3125. DOI:10.1016/j.bmc.2009.03.003 |
| [3] |
Qiu JY, Xu BX, Huang ZM, et al. Synthesis and biological evaluation of Matijing-Su derivatives as potent anti-HBV agents[J]. Bioorg Med Chem, 2011, 19: 5352-5360. DOI:10.1016/j.bmc.2011.08.001 |
| [4] |
Liang GP, Cao PX, Yang XX, et al. Synthesis and anti-hepatitis B virus activities of nitric oxide-releasing derivatives of Matijin-Su[J]. Chin J Org Chem (有机化学), 2014, 34: 973-979. DOI:10.6023/cjoc201312003 |
| [5] |
Yuan J, Liu QC, Xu GC, et al. Synthesis and anti-hepatitis B virus activities of Matijin-Su derivatives with potential for hepatic targeting[J]. Chin J Org Chem (有机化学), 2015, 35: 2176-2183. DOI:10.6023/cjoc201505011 |
| [6] |
Xu GC, Liu QC, Yuan J, et al. Synthesis and anti-hepatitis B virus activities of galactopyranosyl derivatives of Matijin-Su[J]. Chin J Org Chem (有机化学), 2016, 36: 1617-1625. DOI:10.6023/cjoc201512051 |
| [7] |
Liu Y, Lu W, Liu QC, et al. Synthesis and anti-HBV activity evaluation of Matijin-Su derivatives containing gallic acid moiety[J]. Acta Pharm Sin (药学学报), 2017, 52: 1140-1145. |
| [8] |
Hu ZX, An Q, Li KF, et al. Identification, synthesis, and strategy for minimization of potential impurities in the preclinical anti-HBV drug Y101[J]. Org Proc Res Dev, 2013, 17: 1156-1167. DOI:10.1021/op400119b |
| [9] |
Fan H, Hu Z, Li R, et al. Metabolite identification of bentysrepinine (Y101), a novel anti-HBV agent in rats using a five-step strategy based on a combined workflow with two different platforms of liquid chromatography-tandem mass spectrometry[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2017, 1040: 118-128. DOI:10.1016/j.jchromb.2016.12.008 |
| [10] |
Mei YC, Yang BW. Application of amide bioisosteres in the optimization of lead compounds[J]. Prog Chem (化学进展), 2016, 28: 1406-1416. |
| [11] |
Sani M, Volonterio A, Zanda M. The trifluoroethylamine function as peptide bond replacement[J]. ChemMedChem, 2007, 2: 1693-1700. DOI:10.1002/cmdc.200700156 |
| [12] |
Gauthier JY, Chauret N, Cromlish W, et al. The discovery of odanacatib (MK-0822), a selective inhibitor of cathepsin K[J]. Bioorg Med Chem Lett, 2008, 18: 923-928. DOI:10.1016/j.bmcl.2007.12.047 |
| [13] |
Ireland RE, Norbeck DW. Application of the Swern oxidation to the manipulation of highly reactive carbonyl compounds[J]. J Org Chem, 1985, 50: 2198-2200. DOI:10.1021/jo00212a041 |
| [14] |
Meyer SD, Schreiber SL. Acceleration of the Dess-Martin oxidation by water[J]. J Org Chem, 1994, 59: 7549-7552. DOI:10.1021/jo00103a067 |
| [15] |
Zeng C, Kerrigan SA, Katzenellenbogen JA, et al. Efficient synthesis of (2R, 3S)-2-amino-3-(benzyloxy)-4, 4, 4-trifluorobutanoic acid (4, 4, 4-trifluoro-OBn-d-allothreonine)[J]. Tetrahedron Lett, 2010, 51: 5361-5363. DOI:10.1016/j.tetlet.2010.07.147 |
| [16] |
Giovani S, Penzo M, Butini S, et al. Plasmodium falciparum subtilisin-like protease 1: discovery of potent difluorostatone-based inhibitors[J]. RSC Adv, 2015, 5: 22431-22448. DOI:10.1039/C5RA01170A |
| [17] |
Li YX, Kinami K, Hirokami Y, et al. Gem-difluoromethylated and trifluoromethylated derivatives of DMDP-related iminosugars: synthesis and glycosidase inhibition[J]. Org Biomol Chem, 2016, 14: 2249-2263. DOI:10.1039/C5OB02474A |
| [18] |
Andrés JM, Pedrosa R, Pérez-Encabo A. Diastereoselective synthesis of β-amino-α-(trifluoromethyl) alcohols from homochiral α-dibenzylamino aldehydes[J]. Eur J Org Chem, 2004, 7: 1558-1566. |
| [19] |
Rioton S, Orliac A, Antoun Z, et al. Stereoselective rearrangement of (trifluoromethyl) prolinols to enantioenriched 3-substituted 2-(trifluoromethyl) piperidines[J]. Org Lett, 2015, 17: 2916-2919. DOI:10.1021/acs.orglett.5b01084 |
| [20] |
Wang PL, Liu QC, Wang CY, et al. Inhibitory effect of tifentai on HBV-DNA in cultured cell line HepG2-2.2. 15 in vitro[J]. Pharm J Chin PLA (解放军药学学报), 2015, 31: 1-3. |
| [21] |
Wada Y, Harayama Y, Kamimura D, et al. The synthetic and biological studies of discorhabdins and related compounds[J]. Org Biomol Chem, 2011, 9: 4959-4976. DOI:10.1039/c1ob05058c |
 2022, Vol. 57
2022, Vol. 57


