2. 中国中医科学院中药研究所, 北京 100700
2. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
在类风湿关节炎(rheumatoid arthritis, RA) 的病理进程中, 滑膜组织所处的炎性微环境、血小板的过度活化等刺激打破了体内血管生成调节因子的平衡状态, 诱发滑膜血管过度新生, 进而形成的血管翳是引发关节病变、软骨破坏的始动因素之一[1, 2]。现代医学多采用改善病情类抗风湿药、血管内皮生长因子(vascular endothelial growth factor, VEGF) 靶向干预制剂以及抗肿瘤药物, 抑制RA受累滑膜血管的过度新生, 但长期应用上述药物往往会带来显著的不良反应[3]。出自《金匮要略》的热痹经方白虎加桂枝汤(Baihu-Guizhi Decoction, BHGZD), 具有清热除湿、通络止痛之功效[4], 临床用于治疗RA和痛风性关节炎等疾病, 疗效确切[5]。然而, 针对该方的作用机制研究多围绕调节机体炎症反应和免疫功能等方面[6, 7], 对其抑制滑膜血管新生的药效与机制尚未见报道。近年来, 系统生物学、网络药理学、转录组学等学科飞速发展, 其整体性、系统性的特点与中医药的整体观念、辨证论治、组方配伍原则相契合[8, 9]。因此, 本研究采用转录组学数据挖掘、生物网络分析与“动物-细胞”实验验证相结合的研究策略探讨BHGZD干预RA热证滑膜血管过度新生病理环节的潜能和分子机制, 为深入阐明该方治痹的科学内涵提供实验依据, 也为指导临床用药提供参考。
材料与方法实验用动物 雄性Lewis大鼠, 清洁级, 体重200 ± 20 g, 6~8周龄, 购于北京维通利华实验动物技术有限公司, 动物许可证号: SCXK (京) 2016-0006。实验期间自由饮水, 饲固体饲料, 恒温、恒湿, 饲养于中国中医科学院中医基础理论研究所实验动物中心, 适应性饲养3天后用于实验。所有实验动物符合中国中医科学院中医基础理论研究所伦理委员会实验动物福利与伦理的相关规定(编号: 2019-026)。
实验用细胞 人脐静脉内皮细胞(human umbilical vein endothelial cell, HUVEC) 购自上海子实生物公司, 取4~8代用于实验, 关节炎滑膜成纤维细胞(a cell line of human fibroblast-like synoviocytes, MH7A) 购自Riken Cell Bank, 均取4~8代用于实验。
实验药物及其制备方法、主要试剂及仪器 白虎加桂枝汤药材购自北京同仁堂药店, 由石膏(Gypsum Fibrosum, Shigao, 60 g)、知母(Rhizoma Anemarrhenae, Zhimu, 15 g)、桂枝(Ramulus Cinnamomi, Guizhi, 10 g)、甘草(Radix Glycyrrhizae, Gancao, 5 g)、粳米(Round-shaped Rice, Jingmi, 30 g), 共5味药材组成, 药粉的制备方法基于《中华人民共和国药典》 (2020年版) 及本课题组的前期研究[7]; 甲氨蝶呤片(通化茂祥制药有限公司, 国药准字号H22022674); 造模剂M tuberculosis H37 Ra (美国BD公司, #231141); 兔单克隆抗体: 血小板-内皮细胞黏附分子(CD31, 货号ab182981) (美国Abcam公司), 磷酸化丝-苏氨酸激酶(p-AKT, 货号4060T)、磷酸甘油醛脱氢酶(GAPDH, 货号5174T) (美国CST公司); 兔多克隆抗体: 磷酸化血管内皮生长因子受体2 (p-VEGFR2, 货号AP1095)、磷酸化磷脂酰肌醇3-激酶(p-PI3K, 货号AP0854) (武汉爱博泰克生物科技有限公司); BCA蛋白定量试剂盒(货号P0010S, 上海碧云天生物技术有限公司); 大鼠VEGF ELISA试剂盒(货号ml064294)、大鼠内皮抑素(endostatin, ES) ELISA检测试剂盒(货号ml003042)、大鼠内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS) 试剂盒(货号ml003124-C) (上海酶联生物科技有限公司); DMEM培养基(批号: SH30022.01B, 美国Hyclone公司); ECM培养基(批号: 1001, 美国Sciencell公司); Transwell转移小室(批号: 3422, 美国Costar公司); 基质胶(批号: 354234, 美国BD公司); 结晶紫(批号: DZ0055, LEAGENE公司)、4%多聚甲醛(批号: G1101, 武汉赛维尔生物科技有限公司); 重组人源VEGF165 (批号: 100-20)、重组人源TNF-α (批号: 300-01A) (美国PeproTech公司); 全基因组表达谱芯片(Agilent Whole Rat Genome Microarray 4 × 44K, 货号: G4131F, 上海伯豪生物技术有限公司); Agilent表达谱芯片配套试剂盒(Low Input Quick Amp Labeling Kit, One-Color, 货号: 5190-2305, 美国Agilent Technologies公司); RNeasy mini kit (货号: 74106, 德国QIAGEN公司)。正置显微镜、成像系统(广州市明美光电技术有限公司); 稳压稳流电泳仪、凝胶成像系统(上海天能科技有限公司); 水套式CO2细胞培养箱(美国Thermo公司); 烤片机(KPJ-1A)、轮转式切片机(QPJ-C)、生物组织包埋机(BMJ-1B) (天津天利航空机电有限公司)。
AIA热证大鼠模型的建立、分组及给药方式 选用健康6~8周龄雄性Lewis大鼠51只, 在造模前随机分为正常组(control, n = 15)、AIA-热证模型组(AIA-H, n = 15)、AIA-热证-白虎加桂枝汤给药组(AIA-H-BHGZD, n = 15)、AIA-热证-甲氨蝶呤给药组(AIA-H-MTX, n = 6)。AIA热证大鼠模型的造模方法同本课题组前期报道[7], 即每只大鼠单次尾根皮内注射0.1 mL完全弗式佐剂(10 mg·mL-1热灭活的结核分枝杆菌酪酸的液体石蜡混悬液) 诱导AIA模型, 从初次免疫日起, 大鼠饲养在风速(6 m·s-1)、温度(37 ℃)、湿度(90%) 的人工培养箱中, 持续15天, 每天2 h。期间按照本课题组前期研究的最佳给药剂量和方式进行给药[6, 10], 即从初次免疫当天开始给药, BHGZD给予21.4 g·kg-1, MTX给予0.2 mg·kg-1, 持续30天, 同时, 正常组和AIA组灌服等体积蒸馏水。AIA热证大鼠的疾病严重程度评价及BHGZD干预该模型的药效学评价均已在本课题组前期研究论文中报道[7]。
BHGZD候选靶标谱的收集与整理 基于TCMIP v2.0平台[11] (www.tcmip.cn/), 收集BHGZD中知母、桂枝、甘草、石膏和粳米5味药材所含成药性等级为中至高级的化学成分, 预测BHGZD所含化学成分的候选靶标谱(筛选条件: 可信度得分 > 0.8)。
AIA-热证相关基因集的收集与整理 利用本课题组前期开展的动物实验样本[7], 收集正常组、AIA热证模型组和BHGZD给药组大鼠的外周血细胞及滑膜组织, 分别表征全身病理状态和病变靶器官状态。进一步开展转录组表达谱芯片检测获得热证大鼠滑膜组织和外周血细胞的基因表达谱数据, 以fold change > 2.0, P < 0.05为标准, 筛选AIA热证模型组与正常组的组间差异基因集, 得到AIA-热证相关基因集; 筛选BHGZD给药组与AIA热证模型组的组间差异基因集, 得到BHGZD效应基因集。
“BHGZD效应基因-AIA热证基因”互作网络的构建与通路富集分析 利用String数据库[12] (http://string-db.org/, version: 11.5) 中基因间相互作用信息, 提取BHGZD效应基因及AIA热证基因之间的互作关联性, 进而构建“BHGZD效应基因-AIA热证基因”互作网络, 通过计算节点连接度、介度、紧密度这3个网络拓扑特征值, 选取其大于所有节点拓扑特征值中位数两倍的节点作为网络中的核心节点, 并基于KEGG[13] (https://www.kegg.jp/) 和Reactome数据库[14] (https://reactome.org/), 针对上述核心节点基因进行功能富集分析, 进一步推测BHGZD干预AIA热证的核心通路。
免疫组化法检测大鼠膝关节滑膜组织血管标志物CD31的表达 取膝关节石蜡切片, 依次放入二甲苯-100%乙醇-95%乙醇-90%乙醇-80%乙醇-70%乙醇中进行梯度脱蜡, PBS洗, 滴加复合消化液20 min-37 ℃, PBS洗, 滴加抗原修复液20 min-37 ℃, PBS洗, 3%过氧化氢室温10 min, PBS洗, 5% BSA封闭2 h-37 ℃, 滴加1∶1 000稀释后的CD31抗体, 4 ℃孵育过夜, 结合山羊抗兔二抗1 h-37 ℃、DAB显色、封片, 显微镜观察关节滑膜内CD31阳性表达的情况。
ELISA法检测大鼠血清中VEGF和ES的表达以及eNOS的酶活性 大鼠麻醉后采取腹主动脉取血, 离心取上清, -80 ℃保存。按说明书要求对大鼠血清中eNOS的酶活性、VEGF和ES的表达水平进行测定并计算VEGF/ES的比值, 比较各组别之间的差异并进行分析。
Western blot法检测大鼠膝关节中p-VEGFR2、p-PI3K、p-AKT蛋白表达 取大鼠左后肢样本通过研磨制备关节粉末样品, 用含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液提取蛋白, 采用BCA法测定蛋白浓度并定量, 加热法进行蛋白变性; 制备8% SDS-PAGE凝胶上样后进行电泳(90 V-30 min, 120 V-60 min)、转膜(200 mA-90 min或280 mA-90 min)、封闭, 4 ℃过夜孵育p-VEGFR2 (1∶2 000)、p-PI3K (1∶2 000)、p-AKT (1∶2 000) 及GAPDH (1∶10 000) 一抗, 次日用辣根过氧化物酶(HRP) 标记的兔二抗(1∶10 000) 室温孵育1 h后洗膜并显影; 利用Image J软件分析条带灰度值, 以各组目的蛋白条带与各组内参GAPDH条带的灰度值比值作为该蛋白的相对表达量并进行统计分析。
细胞培养 HUVEC置于15%胎牛血清, 青、链霉素各100 u·mL-1的ECM培养基, MH7A置于10%胎牛血清, 青、链霉素各100 u·mL-1的DMEM培养基, 均置于37 ℃、5% CO2培养箱中, 隔天换液, 细胞贴壁达80%左右胰酶消化传代。
Transwell共培养迁移实验检测HUVEC细胞的迁移能力 取对数生长期的MH7A细胞, 消化细胞, 10% FBS的DMEM培养基重悬后, 将MH7A细胞以每孔600 μL、5×104个细胞种于24孔板中。待MH7A种板24 h后, 取对数生长期的HUVEC细胞, 消化细胞, 将Transwell小室放于提前种板MH7A的24孔板中, 上室加入100 μL用无血清ECM培养基重悬的HUVEC 5×104个, 以及100 μL终浓度为7.14、14.28和28.54 μg·mL-1的BHGZD, 依次定义为低、中、高剂量组(BHGZD-L、BHGZD-M、BHGZD-H), 正常组和模型组加入等体积培养基, 下室即为提前24 h种板的MH7A细胞; 待细胞迁移6 h后, 将小室置于4%多聚甲醛中固定15 min, 0.1%结晶紫染色15 min, PBS清洗3次, 用润湿的棉签拭去Transwell小室上室中未迁移的细胞; 在光学显微镜下观察并拍照, 采用Image J软件自动分析迁移到小室下表面的细胞数。
Transwell迁移实验检测HUVEC细胞与MH7A细胞的迁移能力 取对数生长期的HUVEC细胞与MH7A细胞并分别消化。Transwell小室的上室中加入100 μL用无血清ECM培养基重悬的HUVEC 3×104个或100 μL用无血清DMEM培养基重悬的MH7A 5×104个, 以及100 μL低、中、高剂量的BHGZD, 正常组和模型组加入等体积培养基; 下室分别加入含15% FBS的ECM培养基和/或终浓度为20 ng·mL-1的VEGF (HUVEC细胞) 以及含10% FBS的DMEM培养基和/或终浓度为20 ng·mL-1的TNF-α (MH7A细胞); 待细胞迁移6 h后, 将小室置于4%多聚甲醛中固定15 min, 0.1%结晶紫染色15 min, PBS清洗3次, 用润湿棉签拭去Transwell小室上室中未迁移细胞; 在光学显微镜下观察并拍照, 采用Image J软件自动分析迁移到小室下表面的细胞数。
Transwell侵袭实验检测HUVEC细胞与MH7A细胞的侵袭能力 提前将基质胶置于4 ℃冰箱过夜融化, 用ECM基础培养基1∶8稀释(HUVEC细胞) 或DMEM基础培养基1∶8稀释(MH7A细胞), 每孔40 μL包被Transwell小室上室底部, 置于37 ℃培养箱中3 h使基质胶聚合成凝胶备用; Transwell上室中加入100 μL用无血清ECM培养基重悬的HUVEC 5×104个或100 μL用无血清DMEM培养基重悬的MH7A 5×104个, 以及100 μL低、中、高剂量的BHGZD, 正常组和模型组加入等体积培养基; 下室分别加入含20% FBS的ECM培养基和/或终浓度为20 ng·mL-1的VEGF (HUVEC细胞) 以及含20% FBS的DMEM培养基和/或终浓度为20 ng·mL-1的TNF-α (MH7A细胞); 待HUVEC细胞侵袭20 h后, MH7A细胞侵袭24 h后, 将小室置于4%多聚甲醛中固定20 min, 0.1%结晶紫染色15 min, PBS清洗3次, 用润湿棉签拭去Transwell小室上室中未侵袭细胞; 在光学显微镜下观察并拍照, 采用Image J软件自动分析迁移到小室下表面的细胞数。
管腔形成实验 提前将基质胶置于4 ℃冰箱过夜融化, 在冰上用基质胶每孔100 μL包被48孔板后37 ℃放置2 h使其凝固; 用含5% FBS的ECM培养基重悬HUVEC, 按每孔100 μL、2×104个接种至提前用基质胶包被的48孔板中, 加入终浓度为20 ng·mL-1的VEGF, 0.5 h后给药组分别加入100 μL低、中、高剂量的BHGZD, 正常组和模型组加入等体积培养基; 于37 ℃培养箱中孵育5 h后在光学显微镜下观察并拍照, 采用Image J软件自动分析形成管腔的分支点数及分支长度。
统计学分析 采用GraphPad Prism 8.0.1软件对实验数据进行统计, 组间差异采用单因素方差分析, 实验数据用均数±标准差(
AIA热证大鼠模型的疾病严重程度评价及BHGZD干预该模型的药效学评价均已在本项目组前期研究论文中报道[7]。结果表明, 模型组大鼠的关节红肿、畸形症状明显, 其最终发病率、关节炎临床积分、关节肿胀度和关节表面温度分别约为100%、43.56、10.95 cm和33.65 ℃, 机械痛阈值、冷痛阈值、热辐射反应时间及体重均显著降低, 表明造模成功, 而BHGZD可显著改善关节炎的严重程度, 升高大鼠的体重及疼痛阈值, 且药效与阳性药MTX相似。在此基础上, 本研究整合AIA热证组与正常组的组间差异基因作为“AIA-热证相关基因集”, 共485个基因; 基于TCMIP v2.0平台, 整合BHGZD反向调控AIA热证基因集与BHGZD候选靶标谱得到“BHGZD效应基因集”, 共635个基因; 基于String数据库, 构建上述“BHGZD效应基因-AIA热证基因”互作网络, 共包含659个节点和3 614条边; 经网络拓扑特征值计算, 筛选出196个核心节点作为BHGZD干预AIA热证的关键网络靶标。基于KEGG和Reactome数据库, 针对上述核心节点基因进行功能富集分析, 结果发现, 59个BHGZD关键网络靶标显著参与调节血管新生相关通路, 初步表明该方具有干预RA热证滑膜血管新生的潜能, 且VEGF、PI3K和AKT等核心靶标显著参与VEGFA-VEGFR2信号通路(富集显著性: P = 0.019 8, 图 1)。接下来本研究拟利用AIA热证大鼠模型以及RA靶细胞, 从该信号轴系统评价BHGZD对于RA热证滑膜血管新生的干预药效及作用机制(图 2)。
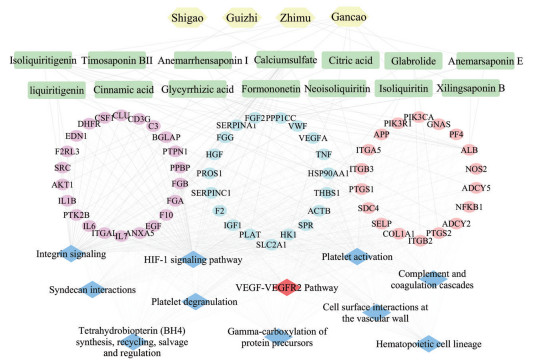
|
Figure 1 Interaction network of Baihu-Guizhi Decoction (BHGZD) key targets, AIA-hot syndrome (AIA-H) related genes and its involved pathway. The hexagonal nodes refer to the herbs from BHGZD, the rectangle nodes refer to the composition from herbs, the round nodes refer to the key network targets and the square node refers to the pathway |
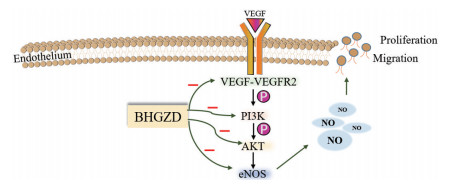
|
Figure 2 Illustration of regulatory mechanism of BHGZD against synovial angiogenesis in rheumatoid arthritis (RA) with hot syndrome. VEGF: Vascular endothelial growth factor; eNOS: Endothelial nitric oxide synthase; VEGFR2: Vascular endothelial growth factor receptor 2; PI3K: Phosphatidylinositol 3-kinase; AKT: Protein kinase |
与正常组相比, AIA-H组大鼠膝关节滑膜组织中CD31+染色(棕褐色) 细胞数量明显增多(P < 0.01); 与AIA-H组相比, AIA-H-BHGZD组以及AIA-H-MTX组大鼠膝关节滑膜组织中CD31+细胞的阳性表达存在不同程度降低(P < 0.01), 提示BHGZD与MTX均能显著抑制热证滑膜血管翳的生成(图 3)。
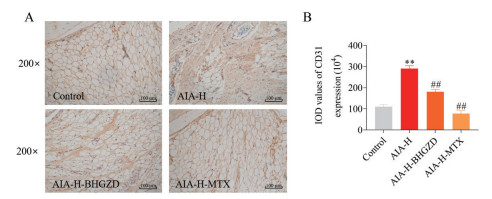
|
Figure 3 Effects of BHGZD on the expression of CD31 in knee joint synovium of AIA-H rats detected by immunohistochemistry. A: Representative images of immunohistochemical staining from different groups; B: Quantitative analysis of CD31 expression levels in knee joint synovium of AIA-H rats. n ≥ 3, |
与正常组相比, AIA-H组大鼠血清中VEGF含量、eNOS酶活性以及VEGF/ES的比值显著升高(P < 0.01), 而ES的含量显著降低(P < 0.01); 与AIA-H组相比, AIA-H-BHGZD组以及AIA-H-MTX组大鼠血清中VEGF含量、eNOS酶活性以及VEGF/ES的比值显著降低(P < 0.05, P < 0.01), 而ES的含量显著升高(P < 0.05), 提示BHGZD与MTX均能显著改善AIA热证大鼠血清中VEGF和ES含量以及eNOS酶活性的异常改变(图 4)。

|
Figure 4 Effects of BHGZD on the expression of VEGF (A), endostatin (ES, B), eNOS (C) and VEGF/ES (D) in serum of AIA-H rats detected by ELISA and the expression of phosphorylated VEGFR2 (p-VEGFR2, E), phosphorylated PI3K (p-PI3K, F) and phosphorylated AKT (p-AKT, G) proteins in joint tissues of AIA-H rats detected by Western blot. n ≥ 5, |
与正常组相比, AIA-H组大鼠关节组织中p-VEGFR2、p-PI3K以及p-AKT的蛋白质表达量表达显著升高(P < 0.01); 与AIA-H组相比, AIA-H-BHGZD组以及AIA-H-MTX组大鼠关节组织中p-VEGFR2、p-PI3K以及p-AKT的蛋白质表达量均有不同程度的降低(P < 0.05, P < 0.01), 提示BHGZD与MTX均能显著抑制AIA热证大鼠关节组织中p-VEGFR2、p-PI3K以及p-AKT蛋白质的异常升高(图 4)。
5 BHGZD可抑制共培养条件下HUVEC细胞迁移能力与正常组相比, MH7A诱导组迁移到下室的HUVEC数目明显增多(P < 0.01), 提示在MH7A的诱导条件下可显著提高HUVEC的迁移能力; 与MH7A诱导组相比, BHGZD低剂量组与正常组比较无统计学差异, 而BHGZD中、高剂量组HUVEC迁移的数目均不同程度的减少(P < 0.01), 提示BHGZD可以抑制由MH7A诱导的HUVEC的迁移能力(图 5)。

|
Figure 5 Effect of BHGZD on the migration of HUVEC and MH7A cells. HUVEC and MH7A cells were treated with the different doses of BHGZD and the cell migration was measured by using transwell assay. A: Representative photos of cell migration from different groups (scale bar: 100×, 200 μm); B: Quantitative analysis of cell coculture migration abilities of HUVEC cells; C: Quantitative analysis of cell migration abilities of HUVEC cells; D: Quantitative analysis of cell migration abilities of MH7A cells. n ≥ 5, |
与正常组相比, VEGF组HUVEC细胞以及TNF-α组MH7A细胞迁移数目均明显增多(P < 0.01), 提示VEGF (20 ng·mL-1) 与TNF-α (20 ng·mL-1) 可分别显著增强HUVEC与MH7A细胞的迁移能力; 与VEGF组相比, BHGZD低、中、高剂量组HUVEC细胞迁移的数目均显著减少(P < 0.05, P < 0.01), 与TNF-α组相比, BHGZD低、中、高剂量组MH7A细胞侵袭数目显著减少(P < 0.05, P < 0.01), 提示BHGZD能分别降低由VEGF和TNF-α诱导升高的HUVEC与MH7A细胞迁移能力, 且呈剂量依赖性(图 5)。
7 BHGZD分别对VEGF诱导HUVEC细胞以及TNF-α诱导MH7A细胞的侵袭能力产生抑制作用与正常组相比, VEGF组HUVEC细胞以及TNF-α组MH7A细胞侵袭数目均明显增多(P < 0.01), 提示VEGF (20 ng·mL-1) 与TNF-α (20 ng·mL-1) 可分别显著增强HUVEC与MH7A细胞侵袭能力; 与VEGF组相比, BHGZD高剂量组HUVEC细胞侵袭的数目总体呈下降趋势(P < 0.01), 但BHGZD低、中剂量组与模型组比较无统计学差异; 与TNF-α组相比, BHGZD低剂量组与模型组比较无统计学差异, 而BHGZD中、高剂量组MH7A细胞侵袭数目显著减少(P < 0.05), 以上结果提示, BHGZD能降低由VEGF和TNF-α分别诱导升高的HUVEC与MH7A细胞侵袭能力, 其中均以高剂量组作用效果为佳(图 6)。
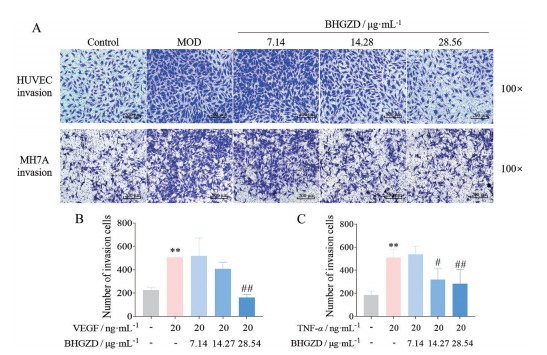
|
Figure 6 Effect of BHGZD on the invasion of HUVEC and MH7A cells. HUVEC and MH7A cells were treated with the different doses of BHGZD and the cell invasion was measured by using Transwell assay. A: Representative photos of cell invasion from different groups (scale bar: 100×, 200 μm); B, C: Quantitative analysis of cell invasive abilities of HUVEC (B) and MH7A (C) cells in different groups. n ≥ 5, |
与正常组相比, VEGF组HUVEC细胞管腔分支点数目及分支长度均显著增加(P < 0.01); 与VEGF组相比, BHGZD低、中、高剂量组HUVEC细胞管腔分支点数目均不同程度减少(P < 0.05, P < 0.01), BHGZD低剂量组与正常组管腔分支长度比较无统计学差异, 而BHGZD中、高剂量组管腔分支长度显著减少(P < 0.01), 提示BHGZD能降低由VEGF诱导升高的HUVEC细胞管腔形成能力(图 7)。
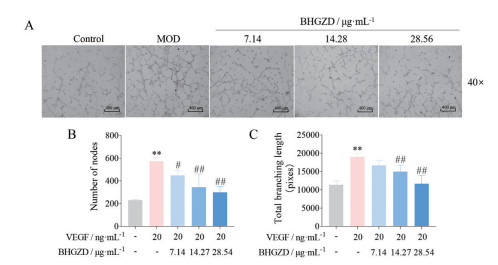
|
Figure 7 Effect of BHGZD on tube formation of HUVEC cells induced by VEGF. A: Tube formation in Matrigel (40×, scale bar: 400 μm); B, C: Quantitative analysis of tube formation of HUVEC cells in different groups. n ≥ 5, |
在RA的病理进程中, 由于体内血管生成调节因子的平衡状态被打破, 大量炎性因子的浸润诱发滑膜血管过度新生, 维持并促进形成的血管翳是引发关节病变、软骨破坏的始动因素之一[1, 2], 对于RA滑膜血管新生的调控研究一直都是中医药研究领域的热点。出自《金匮要略》的BHGZD是中医治疗热痹的经方, 全方由石膏、知母、桂枝、甘草、粳米5味药组成, 具有清热除湿、通络止痛之功效。临床多用BHGZD治疗RA、痛风性关节炎、皮肤病等[5], 疗效显著, 但对其机制的研究多围绕调节机体炎症反应和免疫功能等方面, 如通过抑制Toll样受体4介导的NOD样受体蛋白3炎性小体激活从而起到干预RA的作用[7], 尚未见其抗RA血管过度新生的相关研究报道。因此, 本研究整合转录组表达谱数据挖掘和生物网络计算, 初步发现BHGZD具有抑制RA热证滑膜血管过度新生的潜能及其候选作用靶标, 并通过基于AIA热证大鼠模型与RA靶细胞的体内、体外实验, 从VEGF/VEGFR2/PI3K/AKT信号轴所介导的血管新生调控轴探索BHGZD干预RA热证的作用机制。
BHGZD作为中医治疗热痹的经典方剂, 在运用系统生物学、网络药理学等现代科学手段阐释其作用原理时, 不仅要关注方剂本身所治疗的疾病, 同时还要注重方证对应的关系。因此, 建立符合临床病证特征的动物模型已经成为“病-证-方”关联研究的重要环节。本研究在中医理论指导下, 复制了项目组前期已成功建立的AIA热证大鼠模型[7, 10], 即在复制AIA大鼠模型的同时, 模拟RA热证患者致病因素, 施加风湿热(风速6 m·s-1, 相对湿度均为90%, 温度为37 ℃, 连续15天条件刺激)。与单纯AIA模型相比, 该模型大鼠发病率更高, 为100%, 其疾病严重程度较单纯AIA模型往往更为显著, 并符合临床热痹患者的实际发病情况, 也更能准确反映BHGZD的治疗效果[7, 10]。
CD31作为免疫球蛋白超家族成员之一, 存在于血小板、多数白细胞以及内皮细胞间的紧密连接处, 参与白细胞迁移、血管生成以及整合素激活等生物过程 [15, 16]。CD31作为血管内皮细胞标志物, 其表达水平能够反映出滑膜组织中的微血管密度, 可作为滑膜内血管新生活跃程度的评价指标之一。在本研究中, AIA热证组大鼠膝关节滑膜组织中CD31+染色(棕褐色) 细胞数量较正常组明显增多, 而BHGZD干预后能显著降低CD31+细胞的阳性表达, 从而抑制滑膜血管翳的生成。血管生成促进因子和血管生成抑制因子共同维持体内血管新生的平衡状态, 其中VEGF与ES分别作为目前作用最强的血管生成和抑制因子之一, 二者在体内的动态平衡影响着RA的病理进程[17, 18]。本研究结果表明, BHGZD干预能显著降低AIA热证大鼠血清中VEGF的水平, 升高ES的水平, 从而显著调节二者的比值, 缓解AIA热证大鼠滑膜血管的过度新生。VEGF作为血管新生的关键介质, 通过VEGF受体的IV类酪氨酸激酶受体家族进行信号传导, 而VEGFR1和VEGFR2均可与VEGF结合, 但VEGFR2比VEGFR1具有更强的促血管生成活性和更高的酪氨酸激酶活性, 因此VEGF主要还是与VEGFR2受体结合, 通过VEGFR2的磷酸化作用激活下游信号分子, 引起内皮细胞增殖和迁移, 增加血管通透性, 调节机体的血管新生等生物过程[19, 20]。本研究结果发现, BHGZD不仅能够显著改善AIA热证大鼠血清中VEGF的表达, 还可进一步抑制AIA热证大鼠关节中VEGFR2蛋白的磷酸化。PI3K/AKT信号通路作为VEGF-VEGFR2下游信号传导的重要组成部分, 与RA的滑膜血管新生密切相关[21, 22]。PI3K在VEGFR2激活后可随之激活, 它的活化促使AKT发生磷酸化, 活化后的AKT可进一步激活多种蛋白, 参与机体血管新生的调节[23]。本研究结果表明, AIA热证大鼠关节组织中p-VEGFR2蛋白质表达量显著升高, 同时伴随着p-PI3K和p-AKT蛋白质的表达量水平升高, 而在BHGZD的干预下, 以上升高的磷酸化蛋白表达水平均有不同程度的降低, 表明BHGZD可通过干预VEGF/VEGFR2/PI3K/AKT信号通路对RA热证的滑膜血管新生产生抑制作用。eNOS作为AKT下游的重要底物之一, 可被磷酸化的AKT直接激活, 释放产生的一氧化氮可促进内皮细胞的迁移、归巢等, 促进血管新生[24, 25], 而在本实验中, AIA热证大鼠血清中升高的eNOS酶活性可在BHGZD的干预下显著降低。
MH7A细胞作为人源RA病程中的效应细胞之一, 在TNF-α等炎症因子的诱导下过度活化引起的迁移、侵袭是RA滑膜血管新生的基础, 而血管新生的过程又依赖于血管内层HUVEC细胞的增殖、迁移、侵袭以及管腔形成能力。因此, 阐明BHGZD在体外对MH7A和HUVEC细胞功能的影响, 能为深入探究BHGZD干预RA滑膜血管新生提供更多强有力的证据。本研究结果表明, BHGZD不仅可剂量依赖性地降低由VEGF诱导的HUVEC细胞迁移、侵袭能力, 以及由TNF-α诱导的MH7A细胞迁移、侵袭能力, 对MH7A诱导HUVEC迁移的共培养体系也产生了一定的抑制效果, 同时还可显著抑制由VEGF诱导的HUVEC管腔形成能力, 提示BHGZD可能通过干预以上过程缓解RA滑膜血管的过度新生。
综上所述, BHGZD具有缓解RA热证滑膜血管过度新生的潜能, 其作用机制可能与干预VEGF/VEGFR2/PI3K/AKT信号通路相关。本研究结果为深入阐释BHGZD治疗热痹的科学内涵以及指导临床用药提供实验依据。
作者贡献: 李聪翀负责实验验证、数据统计和文章撰写; 李玮婕、毛霞、刘毓东和马兆臣参与部分实验验证与数据采集; 张彦琼、林雅和林娜负责总体研究方案设计、论文审阅指导以及研究经费支持。
利益冲突: 所有作者均声明不存在任何利益冲突。
| [1] |
Chinese Rheumatology Association. 2018 Chinese guideline for the diagnosis and treatment of rtheumatoid arthritis[J]. Chin J Intern Med (中华内科杂志), 2018, 57: 242-251. |
| [2] |
Wang Y, Wu H, Deng R, et al. Research progress of synovial microenvironment in rheumatoid arthritis[J]. Chin Pharmacol Bull (中国药理学通报), 2020, 36: 754-759. |
| [3] |
Maruotti N, Cantatore FP, Ribatti D. Putative effects of potentially anti-angiogenic drugs in rheumatic diseases[J]. Eur J Clin Pharmacol, 2014, 70: 135-140. DOI:10.1007/s00228-013-1605-6 |
| [4] |
Lang JR, Zeng J, Chen SL, et al. Research progress of classical Chinese medicine prescriptions in treating gout [J]. Pharmacol Clin Chin Mater Med (中药药理与临床), 2021. DOI: 10.13412/j.cnki.zyyl.20211206.012.
|
| [5] |
Wang C, Liu P, Qiu XP. Research on modern clinical application and experimental research of Baihu Guizhi decotion[J]. Clin J Chin Med (中医临床研究), 2021, 13: 122-125. |
| [6] |
Li W, Mao X, Wu H, et al. Deciphering the chemical profile and pharmacological mechanisms of Baihu-Guizhi decoction using ultra-fast liquid chromatography-quadrupole-time-of-flight tandem mass spectrometry coupled with network pharmacology-based investigation[J]. Phytomedicine, 2020, 67: 153156. DOI:10.1016/j.phymed.2019.153156 |
| [7] |
Li W, Mao X, Wang X, et al. Disease-modifying anti-rheumatic drug prescription Baihu-Guizhi Decoction attenuates rheumatoid arthritis via suppressing TLR4-mediated NLRP3 inflammasome activation[J]. Front Pharmacol, 2021, 12: 743086. DOI:10.3389/fphar.2021.743086 |
| [8] |
Li WJ, Lu JQ, Mao X, et al. A comparative study on the mechanisms of two classical herbal formulae for rheumatoid arthritis applying cold and heat patterns based on target network[J]. Acta Pharm Sin (药学学报), 2018, 53: 1387-1397. |
| [9] |
Zhang YQ, Li S. Progress in network pharmacology for modern research of traditional Chinese medicine[J]. Chin J Pharmacol Toxicol (中国药理学与毒理学杂志), 2015, 29: 883-892. |
| [10] |
Mao X. An Investigation into the Network Modulation Mechanism of Wutou Decoction Acting on Rheumatoid Arthritis with Cold Pattern (乌头汤治疗类风湿性关节炎寒证的网络调节机制研究) [D]. Beijing: China Academy of Chinese Medical Sciences, 2017.
|
| [11] |
Xu HY, Zhang YQ, Wang P, et al. A comprehensive review of integrative pharmacology-based investigation: a paradigm shift in traditional Chinese medicine[J]. Acta Pharm Sin B, 2021, 11: 1379-1399. DOI:10.1016/j.apsb.2021.03.024 |
| [12] |
Szklarczyk D, Gable AL, Lyon D, et al. STRING v11: protein-protein association networks with increased coverage, supporting functional discovery in genome-wide experimental datasets[J]. Nucleic Acids Res, 2019, 47: D607-D613. DOI:10.1093/nar/gky1131 |
| [13] |
Kanehisa M, Furumichi M, Sato Y, et al. KEGG: integrating viruses and cellular organisms[J]. Nucleic Acids Res, 2021, 49: D545-D551. DOI:10.1093/nar/gkaa970 |
| [14] |
Jassal B, Matthews L, Viteri G, et al. The reactome pathway knowledgebase[J]. Nucleic Acids Res, 2020, 48: D498-D503. |
| [15] |
Lertkiatmongkol P, Liao D, Mei H, et al. Endothelial functions of platelet/endothelial cell adhesion molecule-1 (CD31)[J]. Curr Opin Hematol, 2016, 23: 253-259. DOI:10.1097/MOH.0000000000000239 |
| [16] |
Qian K, Zeng LY, Zheng XX, et al. Inhibitory effect of Duanteng Yimu Decoction on Pannus formation in mice with collagen-induced arthritis based on VEGF pathway[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2021, 27: 63-71. |
| [17] |
Ahluwalia A, Jones MK, Deng X, et al. An imbalance between VEGF and endostatin underlies impaired angiogenesis in gastric mucosa of aging rats[J]. Am J Physiol Gastrointest Liver Physiol, 2013, 305: G325-G332. DOI:10.1152/ajpgi.00127.2013 |
| [18] |
Matsumoto G, Hirohata R, Hayashi K, et al. Control of angiogenesis by VEGF and endostatin-encapsulated protein microcrystals and inhibition of tumor angiogenesis[J]. Biomaterials, 2014, 35: 1326-1333. DOI:10.1016/j.biomaterials.2013.10.051 |
| [19] |
Peach CJ, Mignone VW, Arruda MA, et al. Molecular pharmacology of VEGF-A isoforms: binding and signalling at VEGFR2[J]. Int J Mol Sci, 2018, 19: 1264. DOI:10.3390/ijms19041264 |
| [20] |
Melincovici CS, Boşca AB, Şuşman S, et al. Vascular endothelial growth factor (VEGF)-key factor in normal and pathological angiogenesis[J]. Rom J Morphol Embryol, 2018, 59: 455-467. |
| [21] |
Liu Q, Li YP, Dong P, et al. Correlation between PI3K/AKT signaling pathway and rheumatoid arthritis[J]. Rheum Arthritis (风湿病与关节炎), 2021, 10: 62-66. |
| [22] |
Zhang XJ, Liu J, Wan L, et al. Relations of synovial angiogenesis and PTEN/PI3K/AKT signaling pathway in rats with adjuvant arthritis[J]. China J Orthop Traumatol (中国骨伤), 2015, 28: 71-74. |
| [23] |
Song F, Hu B, Cheng JW, et al. Anlotinib suppresses tumor progression via blocking the VEGFR2/PI3K/AKT cascade in intrahepatic cholangiocarcinoma[J]. Cell Death Dis, 2020, 11: 573. DOI:10.1038/s41419-020-02749-7 |
| [24] |
Li B, Zhang Y, Yin R, et al. Activating CD137 signaling promotes sprouting angiogenesis via increased VEGFA secretion and the VEGFR2/AKT/eNOS pathway[J]. Mediators Inflamm, 2020, 2020: 1649453. |
| [25] |
Liao WX, Feng L, Zheng J, et al. Deciphering mechanisms controlling placental artery endothelial cell migration stimulated by vascular endothelial growth factor[J]. Endocrinology, 2010, 151: 3432-3444. DOI:10.1210/en.2009-1305 |
 2022, Vol. 57
2022, Vol. 57


