癫痫是一种常见的中枢神经系统疾病, 我国约有1 000万癫痫患者[1]。癫痫在所有年龄段均可发病, 尤其以新生儿、幼儿及老年人发病率较高[2]。癫痫的终生患病率约为3%。目前引起癫痫发作的最常见原因是神经元的突触发生病理性改变, 引起中枢神经系统的兴奋性与抑制性递质失衡, 导致脑内神经元高度同步化异常放电。自发性反复发作是癫痫的特征, 并常常伴有记忆能力受损、认知障碍等并发症。目前临床上已有近20种不同的抗癫痫药物, 但仍有约1/3的患者对目前的药物不敏感, 是药物难治性癫痫[3]。此外, 临床常用抗癫痫药苯妥英钠、卡马西平等药物在长期服用时通常会引起较多的不良反应, 因此, 迫切需要寻找更为安全、有效的癫痫治疗药物。
胆南星是抗癫痫中成药中常用的一味药, 胆星宁痫颗粒、癫痫康胶囊、小儿抗痫胶囊和镇痫片等中成药的组成中均有胆南星。临床研究发现胆南星治疗癫痫具有较好的疗效, 特别是和其他药物联用时, 如胆南星和僵蚕共为君药的胆星宁痫颗粒联合栝蒌桂枝汤使用时, 除能缓解癫痫症状以外, 还能明显减少头痛、头晕、胸闷、失眠、抑郁和记忆障碍等并发症[4]。胆南星是天南星的炮制品, 通常为生天南星细粉与牛、羊或猪的胆汁混合均匀后经发酵而成。胆南星有清热化痰、息风定惊的功效, 常用于治疗痰热咳嗽、脑卒中、癫狂惊痫。现代药理研究表明, 胆南星有清热、抗炎镇痛、抗惊厥和抗氧化等作用[5]。但目前对胆南星治疗癫痫的作用机制研究尚不充分。本研究利用网络药理学结合膜片钳技术的方法, 对胆南星的有效成分、作用靶点进行筛选, 并对胆南星作用于癫痫的信号通路和生物学过程进行预测, 同时验证了胆南星的药效成分对神经元兴奋性的影响, 并探究其可能的作用机制。
材料与方法药品 β-谷甾醇(β-sitosterol, CAS: 83-46-5, 货号: B20347-20 mg, 规格: HPLC ≥ 98%, 生产批号: D07N11S130277), 鹅去氧胆酸(chenodeoxycholic acid, CDCA, CAS: 474-25-9, 货号: B21972-20 mg, 规格: HPLC ≥ 98%, 生产批号: Z01011LA14), 均购自上海源叶生物科技有限公司。β-谷甾醇溶解于无水乙醇, 配制成25 mmol·L-1储备液, 使用时于人工脑脊液(artificial cerebrospinal fluid, ACSF) 中稀释成0.1%的工作液; CDCA溶解于二甲基亚砜, 配制成100 mmol·L-1储备液, 使用时于ACSF中稀释成0.025%的工作液。
动物 C57BL/6J小鼠15只, 14日龄, 体重(6.5 ± 0.5) g, 雌雄不限, 由河北伊维沃生物科技有限公司提供, 许可证号: SCXK (冀) 2020-002。所有实验动物相关的实验设计和实验方案均获得河北医科大学实验动物福利伦理委员会同意和批准, 批准号: IACUC-Hebmu-2021022。所有实验动物均饲养于动物实验室内, 室温(22 ± 1) ℃, 相对湿度(50 ± 5) %, 可自由摄食、清洁饮水, 昼夜交替循环各12 h。
仪器及数据采集软件 自动振动切片机7000 smz (英国Campden Instruments公司); 红外成像系统IR-1000E S/N 12267 (美国DAGE-MTI公司); 玻璃微电极拉制仪MODEL P-97、电动微操作器MP-285 (美国Sutter Instrument公司); 红外微分干涉差显微镜LEICA DM6000 FS、SmartTouch遥控器LEICA STP6000 (德国徕卡公司); 膜片钳探头CV-7B、膜片钳放大器Axon MultiClamp 700B、数模转换器Axon Digidata 1440A、Clampex 10.6.2.2软件、MultiClamp 700B Commander软件(美国Molecular Devices公司)。
收集胆南星成分 通过检索中药系统药理学TCMSP数据库(https://tcmspw.com/tcmsp.php) 中天南星的有效成分, 得到成分吸收、分布、代谢和排泄特性, 包括口服生物利用度(oral bioavailability, OB) 和类药性(druglikeness, DL) 等信息。利用口服生物利用度OB (≥ 30%) 和类药性DL (≥ 0.18) 进行筛选[6], 得到符合条件的有效成分。猪、牛、羊胆汁有效成分通过中国知网(https://www.cnki.net/)、PubMed (https://www.ncbi.nlm.nih.gov/) 进行文献查阅后[5, 7, 8], 得到的成分导入PubChem (https://pubchem.ncbi.nlm.nih.gov) 解析化合物结构, 利用SwissADME (http://www.swissadme.ch/index.php) 进行药代动力学筛选。
靶点预测及筛选 利用TCMSP和SwissTargetPrediction (http://www.swisstargetprediction.ch) 进行有效成分靶点预测[9]。通过Uniprot数据库(https://www.uniprot.org) 将82个有效成分靶点进行蛋白名称与基因symbol转换[10]。通过GeneCards (https://www.genecards.org) 和OMIM (https://omim.org) 以“epilepsy”为关键词检索疾病靶点, 在不影响后续整合的前提下, 将从GeneCards中得到的疾病靶点以相关性评分(relevance score) 的中位数为标准筛选, 剔除相关性较小的疾病靶点, 与OMIM中得到的疾病靶点整合后去除重复值, 得到癫痫疾病靶点。符合条件的有效成分靶点和癫痫疾病靶点取交集, 得到的交集即为胆南星治疗癫痫的关键靶点(key targets)。
构建蛋白互作网络 将关键靶点导入STRING数据库(https://string-db.org), 利用“multiple proteins”功能, 物种选择“homo sapiens”, 构建蛋白互作PPI网络, 并导出PPI综合评分(combined score) 数据[6], 综合评分与蛋白互作能力有关, 综合评分越高, 两种蛋白之间的相互作用能力越强。将PPI网络导入Cytoscape 3.7.2软件, 并利用其网络分析功能“network analyzer”进行拓扑分析, 计算网络中各蛋白的度值(degree), 度值即节点(node) 在网络中的中心性, 度值越高, 认为节点中心性越大, 该节点在网络中越重要。
KEGG通路及GO富集分析 将关键靶点导入DAVID v6.8平台(https://david.ncifcrf.gov), 利用“functional annotation”功能, 识别编码选择“OFFICIAL_GENE_SYMBOL”, 物种选择“homo sapiens”, 对关键靶点进行KEGG信号通路和GO功能富集分析[11, 12], 其中GO富集得到包括生物过程(biological process, BP)、细胞成分(cellular component, CC) 和分子功能(molecular function, MF) 的分析结果。以P < 0.05为标准对结果进行筛选。利用语言软件R x64 4.0.2及ggplot2绘图包(https://ggplot2.tidyverse.org/) 绘制可视化KEGG信号通路分析图和GO富集分析图[13]。
构建“中药-有效成分-关键靶点-信号通路-疾病”网络 通过Cytoscape 3.7.2软件将胆南星、有效成分、关键靶点、信号通路及癫痫五者的关系可视化, 构建“中药-有效成分-关键靶点-信号通路-疾病”网络, 并计算各有效成分在网络中的度值, 以筛选出与治疗癫痫关联最大的有效成分。
溶液配制 电极内液(mmol·L-1): 140葡萄糖酸钾、10 HEPES、3 KCl、2 MgCl2·6H2O、0.2 EGTA (比利时Acros公司)、2 Na2-ATP (德国SERVA公司), 使用KOH将pH调至7.3, 渗透压调至290 mOsm[14], 使用前用0.22 μm微孔滤膜过滤。切片液(mmol·L-1): 210蔗糖、25 NaHCO3、10 D-(+)-葡萄糖、1.25 NaH2PO4·H2O、1.3 (+)-L-抗坏血酸钠、2.5 KCl、7 MgCl2·6H2O、0.5 CaCl2[14]。ACSF (mmol·L-1): 119 NaCl、11 D-(+)-葡萄糖、26.2 NaHCO3、1 NaH2PO4·H2O、2.5 KCl、1.3 MgCl2·6H2O、2.5 CaCl2, pH 7.4, 渗透压调至320 mOsm[15]。以上所有药品除特别说明外均购自美国Sigma-Aldrich公司。
制备急性脑切片 将小鼠随机分组, 断头, 快速取出全脑, 并将其置于冰冷(0~4 ℃) 切片液中降温, 利用自动振动切片机制备300 μm厚度的海马冠状面脑片。之后将脑片转移到32.5 ℃恒温水浴的ACSF中复温40 min, 随后在25 ℃室温下孵育1 h。切片液与ACSF全程充入95% O2 + 5% CO2混合气体, 使其达到氧饱和[14]。
电生理记录 将脑片转移到记录浴槽中, 在25 ℃室温环境下以0.5 mL·min-1持续灌流氧饱和的ACSF, 并使用MultiClamp 700B进行记录。玻璃微电极(外径: 1.5 mm, 内径: 0.84 mm) 充灌电极内液后电阻为3~6 MΩ, 电极钳制细胞后, 转换到电流钳模式下记录海马CA1区锥体神经元动作电位, 动作电位由跃阶刺激获得, 跃阶刺激电流持续500 ms, 由-100 pA至300 pA, 步阶20 pA, 间歇时间2.5 s。首次动作电位记录结束后, 以1 mL·min-1灌流含有药物且氧饱和的工作液3 min置换观察槽中的ACSF, 置换结束后以0.5 mL·min-1持续灌流工作液孵育6 min, 再次记录。系列电阻(series resistance, Rs) 为10~30 MΩ, 补偿60%~80%, 若Rs在记录或给药过程中变化 > 20%, 舍弃数据。记录时β-谷甾醇和CDCA的药物浓度均为25 μmol·L-1。
动作电位发放个数即每个步阶注入刺激电流后达超射(overshoot) 的峰电位数量; 基强度(rheobase) 即连续给予步阶电流刺激时, 诱发出的首个动作电位的注入电流; 输入阻抗(input resistance) 即每个步阶注入电流(I < 0) 的稳态电位(steady-state potential) 与注入电流之间的线性比率。其他检测参数包括: 发放延迟(delay)、幅值(amplitude)、半峰宽(half-width)、去极化时程(depolarization duration)、复极化时程(repolarization duration)、后超极化(after-hyperpolarization) 和阈电位(threshold potential)。
数据统计与分析 电生理数据应用Clampfit v10.7.0.3软件分析, 结果以均数±标准误(mean ± SEM) 表示, 统计检验使用GraphPad Prism 8软件进行分析, 配对样本的统计采用双因素方差分析(two-way ANOVA)、配对t检验(paired t test) 和Wilcoxon配对符号秩检验(Wilcoxon matched-pairs signed rank test); 独立样本的统计采用单因素方差分析(one-way ANOVA) 和Kruskal-Wallis非参数检验(Kruskal-Wallis test)。显著性P < 0.05时表示差异具有统计学意义。
结果 1 有效成分与关键靶点的获取通过检索TCMSP和文献挖掘, 进一步经PubChem和SwissADME的结构解析和体内代谢特性分析, 筛选出胆南星有效成分9个, 包括8, 11, 14-二十二碳三烯酸甲酯(8, 11, 14-docosatrienoic acid, methyl ester)、去氧胆酸、β-谷甾醇和24-肾上腺素(24-epicampesterol) 等。由于CDCA (OB = 27.17%, DL = 0.69) 与胆南星特异性相关程度较高, 且其OB值接近筛选标准, 故特别纳入分析。有效成分信息详见表 1。检索TCMSP和SwissTargetPrediction进行成分靶点预测, 获得82个成分对应的靶点。利用GeneCards和OMIM, 得到6 107个疾病靶点, 整合筛选后得到1 753个疾病靶点。有效成分靶点与癫痫疾病靶点取交集得到22个关键靶点。
| Table 1 General information of active ingredients of Arisaema cum Bile |
利用STRING数据库分析关键靶点PPI关系并构建可视化网络(图 1A), 导出PPI评分数据。网络中共产生22个节点和37条边。圆形节点代表靶蛋白, 节点大小和颜色深浅表示度值大小, 节点越大、橙色越深, 度值越高, 在互作网络中作用越关键。边代表靶蛋白之间相互作用关系, 边的粗细和颜色深浅表示PPI综合评分的高低, 边越粗、橙色越深, 综合评分越高, 连接的两靶蛋白间作用能力越强。利用Cytoscape 3.7.2软件的拓扑分析功能得到各靶蛋白度值, 并将靶蛋白分为5类(图 1B), 计算每个种类聚集的靶蛋白数量(圆形大小) 和总度值(横轴)。结果有8个高度值靶蛋白为调节细胞兴奋性的神经递质受体, 包括5-羟色胺2A受体(5-hydroxytryptamine 2A receptor, HTR2A)、GABAA受体α亚型家族(gamma-aminobutyric acid receptor type A subunit alpha family, GABRA1, GABRA2, GABRA3 and GABRA5)、乙酰胆碱受体α-2和α-7亚型(neuronal acetylcholine receptor subunit alpha-2 and alpha-7, CHRNA2 and CHRNA7) 和μ-1阿片受体(opioid receptor mu 1, OPRM1)。4个神经递质转运体和代谢酶, 包括5-羟色胺转运体(5-hydroxytryptamine transporter, SLC6A4)、多巴胺转运体(dopamine transporter, SLC6A3) 和单胺氧化酶A、B (monoamine oxidase A and B, MAOA and MAOB)。6个与细胞生长和凋亡相关的靶蛋白, 包括半胱天冬酶3 (caspase-3, CASP3)、凋亡调节因子(apoptosis regulator, BAX and BCL2)、转化生长因子β-1 (transforming growth factor beta 1, TGFB1)、微管相关蛋白2 (microtubule associated protein 2, MAP2) 和肝细胞核因子4α (hepatocyte nuclear factor 4 alpha, HNF4A)。2个与胆固醇和脂质代谢相关的靶蛋白, 分别是细胞色素P450 7B1 (cytochrome P450 family 7 subfamily B member 1, CYP7B1) 和HMG-CoA还原酶(3-hydroxy-3-methylglutaryl-CoA reductase, HMGCR)。2个离子通道蛋白分别是电压门控钾离子通道亚型Kv11.1 (potassium voltage-gated channel subfamily H member 2, KCNH2) 和电压门控钠离子通道α亚型Nav1.5 (sodium channel protein type 5 subunit alpha, SCN5A)。这些蛋白中涉及调节细胞兴奋性的受体和转运蛋白拥有较高的度值和较多的互作关系, 推测其为网络的核心靶点, 提示胆南星通过这些靶点可影响中枢神经系统的兴奋性。

|
Figure 1 Protein-protein interaction (PPI) analysis. A: PPI network of key targets of Arisaema cum Bile in the treatment of epilepsy. Circle represents the protein target, circle size and color depth represent degree and the edge width and color represent different interactions between protein and protein; B: Classification of protein. Total degree value and the number of clusters were calculated |
利用DAVID v6.8平台进行KEGG信号通路富集分析, 共获得21条与关键靶点相关的通路, 以P < 0.05为标准筛选, 筛选出16条通路。利用R x64 4.0.2软件绘制气泡图(图 2), 图中横轴代表富集系数; 纵轴代表富集条目名称; 气泡面积越大, 该通路所涉及的基因个数越多; 填充颜色从蓝到红渐进, 显著性越高。结果发现, 神经递质调控的配体-受体相互作用(neuroactive ligand-receptor interaction)、5-羟色胺能突触(serotonergic synapse)、GABA能突触(GABAergic synapse)、内源性大麻素逆向信号(retrograde endocannabinoid signaling) 和多巴胺能突触(dopaminergic synapse) 等与神经元突触传递及兴奋性调节的相关通路可能参与胆南星的抗癫痫作用。

|
Figure 2 Diagram of KEGG enrichment analysis of key targets of Arisaema cum Bile for epilepsy therapy |
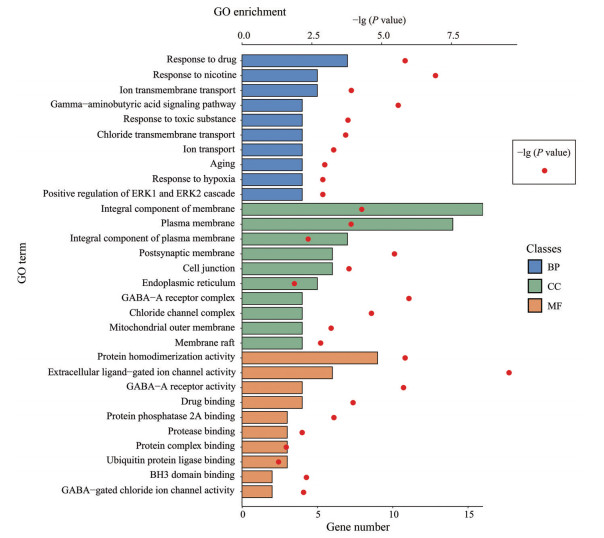
利用R x64 4.0.2软件分别对生物过程、细胞成分和分子功能涉及基因个数排名前10的GO富集分析结果(P < 0.05) 绘制条形图(图 3)。图中蓝色代表生物过程; 绿色代表细胞成分; 橙色代表分子功能; 上标横轴代表显著性-lg (P value); 下标横轴表示基因数目。细胞成分中膜的组成部分(integral component of membrane) 所富集的基因个数最多, 为16个。其次是质膜(plasma membrane), 基因个数为14个。分子功能中蛋白质同源二聚活性(protein homodimerization activity) 涉及9个。生物过程中药物反应(response to drug) 涉及7个。图中红色圆点代表-lg (P value) 的大小, 其中尼古丁成瘾(nicotine addiction, 6.93) 显著性最高, 其他涉及GABA信号通路(gamma-aminobutyric acid signaling pathway, 5.59) 和离子跨膜转运(ion transmembrane transport, 3.92) 等。细胞成分中GABAA受体复合物(GABA_A receptor complex, 5.97) 显著性最高, 其他还有突触后膜(postsynaptic membrane, 5.46) 和氯化物通道复合体(chloride channel complex, 4.63) 等。分子功能中细胞外配体门控离子通道活性(extracellular ligand-gated ion channel activity, 9.38) 显著性最高, 相关功能还包括GABAA受体活性(GABA_A receptor activity, 5.80) 和GABA门控氯离子通道活性(GABA-gated chloride ion channel activity, 2.21) 等。
|
Figure 3 Diagram of GO enrichment analysis key targets of Arisaema cum Bile for epilepsy therapy |
在上述预测的基础上, 利用Cytoscape 3.7.2软件构建“中药-有效成分-关键靶点-信号通路-疾病”网络(图 4)。网络中共有49个节点和130条边, 橙色菱形代表胆南星(1个); 绿色菱形代表癫痫(1个); 粉红色圆形代表关键靶点(22个); 蓝色圆形代表信号通路(21个); 红色V形代表有效成分(4个)。节点大小反映度值大小, 节点越大, 度值越高, 说明该靶点在网络中越具重要性。从网络中发现4个可能通过作用于关键靶点及信号通路来影响癫痫的有效成分, 分别是β-谷甾醇、植物甾醇、CDCA和[(2R)-2-[[[(2R)-2-(benzoylamino)-3-phenylpropanoyl]amino]methyl]-3-phenylpropyl] acetate (2R-B-3-A), 其度值分别为17、9、4和2。网络中度值较高的关键靶点包括CASP3 (10)、MAOA (9)、MAOB (9)、BAX (8)、BCL2 (8)、TGFB1 (7)、GABRA1 (7)、GABRA3 (7)、GABRA2 (6)、GABRA5 (6) 和SLC6A3 (5) 等。网络中胆南星的各成分分别与多个靶点蛋白相互作用, 而同一靶点又参与多个信号通路的功能调节, 抑制癫痫的发作。度值较高的信号通路包括配体-受体相互作用(neuroactive ligand-receptor interaction, 9)、5-羟色胺能突触(serotonergic synapse, 6)、吗啡成瘾(morphine addiction, 6)、尼古丁成瘾(nicotine addiction, 6)、内源性大麻素逆向信号(retrograde endocannabinoid signaling, 5) 和GABA能突触(GABAergic synapse, 5) 等。此网络体现了胆南星通过多成分、多靶点、多通路的方式干预癫痫的特点。

|
Figure 4 Network of Arisaema cum Bile-active ingredient-key target-signal pathway-epilepsy. The orange diamond represents Arisaema cum Bile, the green diamond represents epilepsy, the pink circle represents key target, the blue circle represents signal pathway and the red V-shaped pattern represents active ingredient |
神经元兴奋性增加引起的异常放电是导致癫痫发作的重要原因之一, 为验证网络药理学筛选出的胆南星成分对神经元兴奋性的影响, 在“中药-有效成分-关键靶点-信号通路-疾病”网络中, 选择了分别在天南星中度值最高的β-谷甾醇和胆汁中度值最高的CDCA两种成分, 探究二者对小鼠海马CA1锥体神经元动作电位的影响。
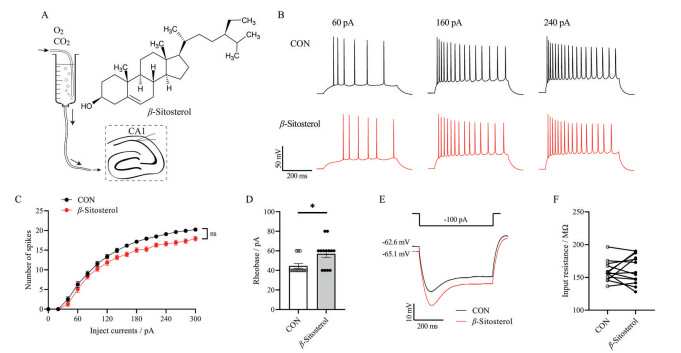
本研究采用脑片膜片钳技术进行验证, 工作模式如图 5A, 使用灌流法给药(25 μmol·L-1 β-谷甾醇), 记录海马CA1锥体神经元在全细胞电流钳模式下的动作电位。结果显示, 动作电位发放个数随着跃阶注入电流的增大而增加, 在给予β-谷甾醇孵育后, 动作电位发放个数整体比较无显著性差异(图 5B、C)。与对照组相比, 基强度在给予β-谷甾醇后显著升高, 由44.6 ± 2.4 pA上升至56.9 ± 3.8 pA (图 5D)。图 5E为初次给予超极化电流(-100 pA) 刺激时, β-谷甾醇使膜电位显著发生超极化, 但细胞的输入阻抗无显著性差异(图 5F)。
|
Figure 5 β-Sitosterol inhibited the excitability of hippocampal CA1 pyramidal neurons. A: Schematic diagram of the experimental procedure of CA1 pyramidal neurons; B: Example of action potentials response to step current injections (60, 160, and 240 pA; 500 ms) in CA1 pyramidal neurons treated without (black) or with (red) β-sitosterol; C: β-Sitosterol affected on the excitability of CA1 pyramidal neurons with increasing current injection. Depolarizing steps in 20 pA increments from 0 to 300 pA for 500 ms; D: Rheobase was increased by 25 μmol·L-1 β-sitosterol; E: Typical trace at injecting -100 pA for 500 ms. Normal control (CON, black) and after perfusing 25 μmol·L-1 β-sitosterol (red); F: There were no significant changes in the input resistance between the control group and 25 μmol·L-1 β-sitosterol treated group. Two-way ANOVA was used in C. Wilcoxon matched-pairs signed rank test was used in D. Paired t test was used in F. n = 13, mean ± SEM. *P < 0.05 |
灌流孵育β-谷甾醇后诱发首个动作电位时间明显延迟(图 6A), 诱导时间由28 ± 4 ms明显延迟至39 ± 3 ms (图 6B)。给予β-谷甾醇后动作电位去极化时程(depolarization duration, DPD) 显著延长, 由0.264 ± 0.009 ms延长到0.296 ± 0.011 ms (图 6E), 但不影响动作电位幅值、半峰宽及复极化时程(repolarization duration, RPD) (图 6C、D和F)。图 6G表示在给予β-谷甾醇后的相同刺激电流诱发的动作电位去极化达峰值所需时间延长。相位图显示, 动作电位去极化的速率在膜电位超过-25 mV后减慢, 但阈电位和后超极化(after-hyperpolarization, AHP) 未见显著性差异(图 6H~J)。结果表明, β-谷甾醇可通过降低膜兴奋, 延迟动作电位发放, 延长去极化达峰值时间, 从而降低海马CA1锥体神经元兴奋性。

|
Figure 6 β-Sitosterol delayed action potential (AP) generation. A: Typical spikes of AP delay; B-F: The AP delay, amplitude, half-width, depolarization duration (DPD) and repolarization duration (RPD) were obtained from control and 25 μmol·L-1 β-sitosterol treatment; G: Example of APs spike without (black) and with (red) β-sitosterol; H, I: Associated phase plane plots of the first single AP (the gray arrow indicates threshold potential occurrence point) and the average spike threshold potential without and with β-sitosterol; J: The change of the after-hyperpolarization (AHP) without and with β-sitosterol. Paired t test was used in B-F and I. Wilcoxon matched-pairs signed rank test was used in J. n = 13, mean ± SEM. *P < 0.05, ***P < 0.001 |
采用和β-谷甾醇相似的方法, 验证25 μmol·L-1 CDCA对海马CA1锥体神经元动作电位的作用(图 7A)。结果显示, 动作电位发放个数随着跃阶注入电流的增大而增加, 给予CDCA孵育后跃阶刺激电流(80、180、280 pA) 诱发的动作电位个数明显受到抑制(图 7B), 与对照组相比, 刺激强度越高, 动作电位个数减少越显著(P < 0.001, 图 7C)。与对照组相比, 基强度在给予CDCA后显著升高, 由40.0 ± 2.3 pA上升至53.8 ± 4.2 pA (图 7D)。图 7E为初次给予超极化电流(-100 pA) 刺激时, CDCA使膜电位显著发生超极化, 但细胞输入阻抗变化无显著性差异(图 7F)。

|
Figure 7 CDCA inhibited the excitability of hippocampal CA1 pyramidal neurons. A: Schematic diagram of the experimental procedure of CA1 pyramidal neurons; B: Example of action potentials response to step current injections (80, 180 and 280 pA; 500 ms) in CA1 pyramidal neurons treated without (black) or with (red) CDCA; C: CDCA significantly inhibited the excitability of CA1 pyramidal neurons with increasing current injection. Depolarizing steps in 20 pA increments from 0 to 300 pA for 500 ms; D: Rheobase was increased by 25 μmol·L-1 CDCA; E: Typical trace at -100 pA for 500 ms. Normal control (black) and after perfusing 25 μmol·L-1 CDCA (red); F: There were no significant changes in the input resistance between control group and 25 μmol·L-1 CDCA treated group. Two-way ANOVA was used in C. Wilcoxon matched-pairs signed rank test was used in D. Paired t test was used in F. n = 13, mean ± SEM. *P < 0.05, ***P < 0.001 |
灌流孵育CDCA后诱发首个动作电位时间明显延迟(图 8A), 诱导时间由24.6 ± 2.4 ms明显延迟至40.7 ± 3.6 ms (图 8B)。去极化时程在给予CDCA后也显著延长, 由0.268 ± 0.007 ms延长至0.312 ± 0.013 ms (图 8E)。与对照组相比, 半峰宽显著延长, 由1.230 ± 0.026 ms延长至1.303 ± 0.026 ms (图 8D), 但动作电位幅值和复极化时程均无显著性差异(图 8C、F)。图 8G表示在给予CDCA后的相同刺激电流诱发的动作电位去极化达峰值所需的时间延长, 动作电位下降支与对照组相比, 未见显著差异。相位图显示, 给予CDCA后去极化的速率在膜电位超过0 mV后减慢, 而阈电位和后超极化无显著性差异(图 8H~J)。结果表明, CDCA可减少动作电位发放数量和降低膜兴奋, 有效延迟动作电位发放, 并能延长去极化达峰值时间, 同时延长动作电位时程, 最终降低海马CA1锥体神经元兴奋性。

|
Figure 8 CDCA delayed AP generation. A: Typical spikes of AP delay; B-F: The AP delay, amplitude, half-width, DPD and RPD were obtained from control and 25 μmol·L-1 CDCA treatment; G: Example of APs spike without (black) and with (red) CDCA; H, I: Associated phase plane plots of the first single AP and the average spike threshold potential without and with CDCA; J: The change of the AHP without and with CDCA. Paired t test was used in B, D, F, I and J. Wilcoxon matched-pairs signed rank test was used in C and E. n = 13, mean ± SEM. *P < 0.05, ***P < 0.001 |
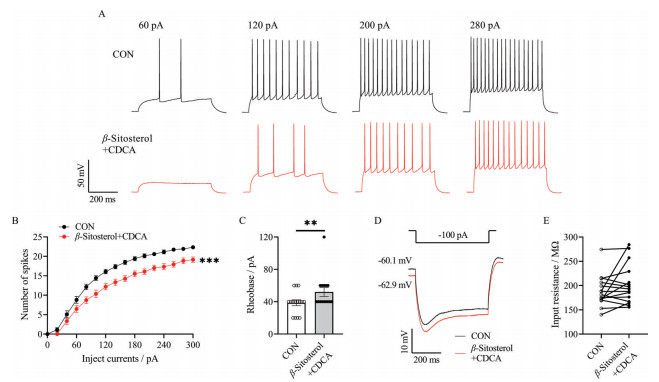
上述结果显示, β-谷甾醇和CDCA分别对海马CA1锥体神经元具有抑制作用, 因此猜测联合应用二者应具有更好的抑制效应。为验证该假设, 本研究采用灌流法探究联合应用25 μmol·L-1 β-谷甾醇和25 μmol·L-1 CDCA对海马CA1锥体神经元动作电位的影响。结果显示, 孵育两种药物混合物后, 相同的跃阶刺激电流(60、120、200、280 pA) 诱发的动作电位个数明显受到抑制(图 9A), 与对照组相比, 刺激强度越高, 动作电位个数减少越显著(P < 0.001, 图 9B)。同时, 诱发动作电位的基强度显著升高, 由39 ± 4 pA上升至52 ± 5 pA (图 9C)。图 9D表示联合应用药物后, 给予超极化电流(-100 pA) 刺激时膜电位发生超极化, 但细胞输入阻抗大小无显著性差异(图 9E)。
|
Figure 9 β-Sitosterol and CDCA inhibited the excitability of hippocampal CA1 pyramidal neurons. A: Example of action potentials response to step current injections (60, 120, 200 and 280 pA; 500 ms) in CA1 pyramidal neurons without (black) or with (red) 25 μmol·L-1 β-sitosterol and 25 μmol·L-1 CDCA; B: 25 μmol·L-1 β-sitosterol and 25 μmol·L-1 CDCA significantly inhibited the excitability of CA1 pyramidal neurons with increasing current injection. Depolarizing steps in 20 pA increments from 0 to 300 pA for 500 ms; C: Rheobase was increased by 25 μmol·L-1 β-sitosterol and 25 μmol·L-1 CDCA; D: Typical trace at injecting -100 pA for 500 ms. Normal control (black) and after perfusing 25 μmol·L-1 β-sitosterol and 25 μmol·L-1 CDCA (red); E: There were no significant changes in the input resistance between the control group and 25 μmol·L-1 β-sitosterol and 25 μmol·L-1 CDCA treated group. Two-way ANOVA was used in B. Wilcoxon matched-pairs signed rank test was used in C and E. n = 15, mean ± SEM. **P < 0.01, ***P < 0.001 |
25 μmol·L-1 β-谷甾醇和25 μmol·L-1 CDCA联合用药灌流孵育后, 诱发首个动作电位时间明显延迟(图 10A), 诱导时间由21.2 ± 2.2 ms明显延迟至36.3 ± 4.2 ms (图 10B)。动作电位幅值显著降低, 由113.2 ± 1.8 mV下降至104.9 ± 2.6 mV (图 10C)。同时, 半峰宽显著延长, 由1.331 ± 0.022 ms延长至1.473 ± 0.039 ms (图 10D)。与对照组相比, 去极化时程显著延长, 由0.310 ± 0.012 ms延长至0.388 ± 0.022 ms, 而复极化时程无显著性差异(图 10E、F)。图 10G表示联合应用两种药物后相同刺激电流诱发的动作电位峰值明显低于对照组, 去极化达峰值所需时间延长。相位图显示, 联合应用两种药物后, 去极化的速率在膜电位超过-20 mV后明显减慢, 但阈电位及后超极化无显著性差异(图 10H~J)。以上结果表明, β-谷甾醇和CDCA联合应用可有效减少动作电位发放数量, 降低膜兴奋, 并可明显延迟动作电位发放, 降低动作电位幅值, 同时降低动作电位去极化的速率、延长去极化达峰值时间, 使动作电位时程延长, 最终有效降低海马CA1锥体神经元兴奋性。

|
Figure 10 β-Sitosterol and CDCA delayed AP generation. A: Typical spikes of AP delay; B-F: The AP delay, amplitude, half-width, DPD and RPD were obtained from control and 25 μmol·L-1 β-sitosterol and 25 μmol·L-1 CDCA treatment; G: Example of APs spike without (black) and with (red) 25 μmol·L-1 β-sitosterol and 25 μmol·L-1 CDCA; H, I: Associated phase plane plots of the first single AP and the average spike threshold potential without and with 25 μmol·L-1 β-sitosterol and 25 μmol·L-1 CDCA; J: The change of the AHP without and with 25 μmol·L-1 β-sitosterol and 25 μmol·L-1 CDCA. Wilcoxon matched-pairs signed rank test was used in B. Paired t test was used in C-F, I and J. n = 15, mean ± SEM. ***P < 0.001 |
根据β-谷甾醇和CDCA对细胞兴奋性的影响, 本研究综合比较了两药单独应用和联合应用的结果。结果显示, 各组药物对动作电位发放的抑制作用(图 11A) 以CDCA组和联合用药组最强, 其抑制程度明显强于β-谷甾醇组与时间对照组(time contrast)。与β-谷甾醇组、CDCA组相比, 联合用药组对诱发动作电位的基强度和动作电位发放无显著性影响(图 11B、C)。但联合用药组显著抑制了动作电位幅值(P < 0.05, 图 11D), 延长了动作电位半峰宽(P < 0.05, 图 11E)。而尽管联合用药组的去极化时程变化与β-谷甾醇组、CDCA组相比有增加的趋势, 但并无显著性差异(图 11F)。综上比较, 联合用药对海马CA1锥体神经元兴奋性抑制作用更加显著。

|
Figure 11 Comparison the separate and combined effects of β-sitosterol and CDCA on action potential. A: Comparison of inhibition degree of AP release in time contrast group, β-sitosterol group, CDCA group and combination group; B-F: Change rate of rheobase, delay, amplitude, half-width and DPD in β-sitosterol group, CDCA group and combination group. One-way ANOVA was used in E. Kruskal-Wallis test was used in B-D and F. n = 7 in time contrast group. n = 13 (β-sitosterol group and CDCA group), n = 15 (combination group), mean ± SEM. *P < 0.05 |
癫痫在祖国医学中属于“痫症”范畴, 俗称“羊角风”或“羊癫风”。祖国医学认为“痫因痰生, 痫为痰蓄, 无痰不作痫”; “痰积日久化热生火”; “诸暴强直, 皆属于风”。因此, 针对此病可从化痰、清热和平肝息风等方面入手治疗[16]。而胆南星入肝、脾两经, 强于清热化痰, 兼有息风定惊之效, 恰是祖国医学理论中治疗癫痫的一味对证良药[5]。研究表明, 海马与颞叶癫痫密切相关, 其中海马CA1锥体神经元在癫痫持续状态下会发生异常去极化, 使神经元兴奋性增加[17]。本研究利用网络药理学方法和电生理膜片钳技术探究了胆南星治疗癫痫的现代药理机制, 获得了胆南星的有效成分, 预测了其作用于癫痫的靶点及相关通路, 并验证了β-谷甾醇和CDCA单独应用及联合应用时在调节海马CA1锥体神经元兴奋性方面的作用。
由于胆南星、天南星的研究相对较少, 本研究获得的天南星已知成分约120个, 然而这些成分均存在于多种植物, 而非天南星所独有。此外, 本研究参照文献, 将筛选方法的标准设定为OB ≥ 30%且DL ≥ 0.18, 按照此标准, 绝大多数成分都与参考标准相距甚远, 部分成分如夏佛塔苷、异夏佛塔苷、芹菜素-6-c-阿拉伯糖基-8-c-半乳糖苷和秋水仙碱等尽管类药性超过了设定标准, 但因其生物利用度太低而未被列入有效成分的研究范围。然而, 胆南星中的胆汁酸类成分尤其是CDCA及其衍生物在胆南星炮制后的成分中含量较高[18], 考虑到目前临床上已有CDCA口服成药, 且其OB值接近筛选标准, 故将其列入研究范围。因而, 根据网络药理学的研究结果, 本研究筛选出了β-谷甾醇、植物甾醇、CDCA和化合物2R-B-3-A为胆南星治疗癫痫的主要有效成分。
本研究发现化合物2R-B-3-A仅与KCNH2靶点相关联, 大量研究表明KCNH2参与调节细胞的钾离子稳态, 因此, 化合物2R-B-3-A可能通过作用于KCNH2, 影响海马星形胶质细胞中hERG钾离子通道的表达和功能, 调节钾离子稳态从而达到改善癫痫的效果[19], 但此推测尚待实验验证。以往的研究发现植物甾醇中的α-菠菜甾醇能提高全身性阵挛性癫痫发作的阈值[20]。研究表明, 植物甾醇类成分可透过体外模拟的血脑屏障(blood brain barrier, BBB)[21], 入脑后, 可在脑中累积[22]。
根据“中药-有效成分-关键靶点-信号通路-疾病”网络的拓扑分析结果, 本研究发现β-谷甾醇和CDCA在网络中处于关键位置, 可通过多个靶点和信号通路作用于癫痫。因此, 本课题组推测β-谷甾醇和CDCA可能是胆南星中潜在的抗癫痫代表性成分。β-谷甾醇广泛存在于各种植物中, 也是胆南星中甾体类成分之一[23], 目前已有证据显示β-谷甾醇可起到保护神经元的作用[24], 用于中枢神经系统疾病的治疗[22]。Ye等[25]的研究显示β-谷甾醇可改善APP/PS1小鼠的认知缺陷, 防止Aβ蛋白沉积, 还可以增加海马神经元微小兴奋性突触后电流(mEPSC) 频率。本研究的电生理实验证明了β-谷甾醇可提高海马CA1锥体神经元基强度、延迟动作电位发放并延长去极化时程。而CDCA既存在于胆汁酸中, 也是胆南星的重要成分[18, 26], 据报道, CDCA不仅可以调节胆固醇水平, 调控脂代谢, 还能够提高神经元活性, 降低脑腱黄瘤病癫痫的发作频率[27, 28]。且CDCA可扩散穿过磷脂双分子层, 并与BBB的紧密连接蛋白相互作用, 影响血脑屏障的通透性[29], 且其在大脑中的浓度与血清中的浓度呈正相关[30]。而本研究电生理实验中, CDCA除具有与β-谷甾醇类似的神经元兴奋性调节作用外, 还可延长动作电位半峰宽并明显减少动作电位发放数量, 提示CDCA比β-谷甾醇具有更强的神经元兴奋性抑制作用。与单独用药相比, 联合用药在延长动作电位去极化时程和半峰宽方面作用更为显著, 且能有效降低动作电位幅值, 结果表明联合用药比单独用药对神经元兴奋性抑制作用更强, 这与中药多种成分共同作用发挥更强疗效的特点一致。
众所周知, 抑制性神经递质γ-氨基丁酸与GABAA受体的相互作用可以降低神经元兴奋性, 从而防止神经元过度兴奋[31]。5-羟色胺转运体SLC6A4和单胺氧化酶MAOA的功能失调可以通过HTR2A直接或间接调控谷氨酸能或GABA能神经元兴奋性, 改善整个神经网络兴奋性[32-34]。而SCN5A虽然被认为与心肌细胞功能密切相关, 但也在大脑中表达, SCN5A突变可致心律失常伴发癫痫发作[35]。本研究网络药理学的研究结果显示, β-谷甾醇和CDCA可以和上述靶蛋白直接或间接相互作用。以往的研究还显示CDCA是GABAA受体以及N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor, NMDAR) 中GluN2D亚型、GluN3B亚型的拮抗剂, 能够抑制神经元网络同步化放电[7, 8]。结合网络药理学预测结果和实验验证结果, 本课题组推测β-谷甾醇和CDCA可能通过影响GABAA受体、SCN5A及5-羟色胺能突触通路的功能共同降低神经元兴奋性。
综上所述, 本研究通过网络药理学方法探究了胆南星治疗癫痫的机制, 发现中药多成分、多靶点、多途径治疗癫痫的特点。网络药理学方法提示胆南星治疗癫痫可能的有效成分包括β-谷甾醇、植物甾醇、CDCA和化合物2R-B-3-A, 与之相关的靶点包括GABRA家族成员、SLC6A4、CASP3和HTR2A等, 涉及的信号通路包括配体-受体相互作用、5-羟色胺能突触和GABA能突触等。除此以外, 本研究还通过与实验验证相结合的方法, 以电生理膜片钳技术对部分结果进行了初步验证, 证实了β-谷甾醇和CDCA可有效降低小鼠海马CA1锥体神经元兴奋性, 联合应用抑制作用更显著。然而由于受目前关于胆南星的成分分析研究限制, 本研究基于网络药理学方法获取的胆南星的有效成分有限, 这也造成了本研究针对有效成分的生物信息学预测和功能验证都具有一定的局限性。尽管如此, 本研究的结果依旧能对今后中药胆南星的机制研究及临床用药提供一定的思路与参考。
作者贡献: 陈思软负责完成网络药理学预测、执行电生理实验、采集数据、分析数据并撰写文章; 赵姣娇协助分析数据; 孔德志提供研究思路; 张炜指导研究思路、设计研究计划、指导研究方法、撰写并修订文章。
利益冲突: 本研究与任何组织和个人均不存在利益冲突。
| [1] |
Ding D, Zhou D, Sander JW, et al. Epilepsy in China: major progress in the past two decades[J]. Lancet Neurol, 2021, 20: 316-326. DOI:10.1016/S1474-4422(21)00023-5 |
| [2] |
Thijs RD, Surges R, O'Brien TJ, et al. Epilepsy in adults[J]. Lancet, 2019, 393: 689-701. DOI:10.1016/S0140-6736(18)32596-0 |
| [3] |
Oyrer J, Maljevic S, Scheffer IE, et al. Ion channels in genetic epilepsy: from genes and mechanisms to disease-targeted therapies[J]. Pharmacol Rev, 2018, 70: 142-173. DOI:10.1124/pr.117.014456 |
| [4] |
Yuan X, Li Z, Wang XT, et al. Roles and mechanisms of traditional Chinese medicine and its active ingredients in treating epilepsy[J]. Chin J Chin Mater Med (中国中药杂志), 2019, 44: 9-18. |
| [5] |
Tang ZQ, Li B, Wang QH, et al. Research progress on chemical constituents, pharmacological effects and clinical application of related compounds of Arisaema cum Bile[J]. Chin Pharm (中国药房), 2020, 31: 1523-1527. |
| [6] |
Ru JL, Li P, Wang J, et al. TCMSP: a database of systems pharmacology for drug discovery from herbal medicines[J]. J Cheminform, 2014, 6: 13. DOI:10.1186/1758-2946-6-13 |
| [7] |
Schubring SR, Fleischer W, Lin JS, et al. The bile steroid chenodeoxycholate is a potent antagonist at NMDA and GABA A receptors[J]. Neurosci Lett, 2012, 506: 322-326. DOI:10.1016/j.neulet.2011.11.036 |
| [8] |
Koch A, Bonus M, Gohlke H, et al. Isoform-specific inhibition of N-methyl-D-aspartate receptors by bile salts[J]. Sci Rep, 2019, 9: 10068. DOI:10.1038/s41598-019-46496-y |
| [9] |
Daina A, Michielin O, Zoete V. SwissTargetPrediction: updated data and new features for efficient prediction of protein targets of small molecules[J]. Nucleic Acids Res, 2019, 47: W357-W364. DOI:10.1093/nar/gkz382 |
| [10] |
The UniProt Consortium. UniProt: the universal protein know-ledgebase in 2021[J]. Nucleic Acids Res, 2021, 49: D480-D489. DOI:10.1093/nar/gkaa1100 |
| [11] |
Kanehisa M, Furumichi M, Tanabe M, et al. KEGG: new perspectives on genomes, pathways, diseases and drugs[J]. Nucleic Acids Res, 2017, 45: D353-D361. DOI:10.1093/nar/gkw1092 |
| [12] |
The Gene Ontology Consortium. Expansion of the Gene Ontology knowledgebase and resources[J]. Nucleic Acids Res, 2017, 45: D331-D338. DOI:10.1093/nar/gkw1108 |
| [13] |
Cedric G. ggplot2: elegant graphics for data analysis[J]. J R Stat Soc Ser A Stat Soc, 2011, 174: 245-246. DOI:10.1111/j.1467-985X.2010.00676_9.x |
| [14] |
Yu YZ, Yang ZX, Jin BH, et al. Cannabidiol inhibits febrile seizure by modulating AMPA receptor kinetics through its interaction with the N-terminal domain of GluA1/GluA2[J]. Pharmacol Res, 2020, 161: 105128. DOI:10.1016/j.phrs.2020.105128 |
| [15] |
Kamalova A, Futai K, Delpire E, et al. AMPA receptor auxiliary subunit GSG1L suppresses short-term facilitation in corticothalamic synapses and determines seizure susceptibility[J]. Cell Rep, 2021, 34: 108732. DOI:10.1016/j.celrep.2021.108732 |
| [16] |
He L, Chen HF, Zhao WJ, et al. Study on the medication law of clinical prescriptions for epilepsy based on the analysis of ancient books and documents[J]. J Gansu Coll Tradit Chin Med (甘肃中医学院学报), 2013, 30: 56-59. |
| [17] |
Minge D, Bähring R. Acute alterations of somatodendritic action potential dynamics in hippocampal CA1 pyramidal cells after kainate-induced status epilepticus in mice[J]. PLoS One, 2011, 6: e26664. DOI:10.1371/journal.pone.0026664 |
| [18] |
Liu XY, Tao X, Pan D, et al. Chemical constituents from Arisaema cum Bile[J]. Chin Tradit Pat Med (中成药), 2018, 40: 1991-1995. |
| [19] |
Emmi A, Wenzel HJ, Schwartzkroin PA, et al. Do glia have heart? Expression and functional role for ether-a-go-go currents in hippocampal astrocytes[J]. J Neurosci, 2000, 20: 3915-3925. DOI:10.1523/JNEUROSCI.20-10-03915.2000 |
| [20] |
Socała K, Nieoczym D, Pieróg M, et al. α-Spinasterol, a TRPV1 receptor antagonist, elevates the seizure threshold in three acute seizure tests in mice[J]. J Neural Transm, 2015, 122: 1239-1247. DOI:10.1007/s00702-015-1391-7 |
| [21] |
Vanmierlo T, Weingärtner O, van der Pol S, et al. Dietary intake of plant sterols stably increases plant sterol levels in the murine brain[J]. Lipid Res, 2012, 53: 726-735. DOI:10.1194/jlr.M017244 |
| [22] |
Vanmierlo T, Bogie JF, Mailleux J, et al. Plant sterols: friend or foe in CNS disorders?[J]. Prog Lipid Res, 2015, 58: 26-39. DOI:10.1016/j.plipres.2015.01.003 |
| [23] |
Sun N, Liu JY, Yu WY, et al. Research progress on chemical constituents and biological activities of Arisaematis Rhizoma[J]. Chin J Chin Mater Med (中国中药杂志), 2021, 46: 5194-5200. |
| [24] |
Dong X, Liu XG, Yang ML, et al. The toxicity of β-sitosterol on the vitality of hippocampal neuron cell in original generation rats[J]. Heilongjiang Med Pharm (黑龙江医药科学), 2013, 36: 1-2. |
| [25] |
Ye JY, Li L, Hao QM, et al. β-Sitosterol treatment attenuates cognitive deficits and prevents amyloid plaque deposition in amyloid protein precursor/presenilin 1 mice[J]. Korean J Physiol Pharmacol, 2020, 24: 39-46. DOI:10.4196/kjpp.2020.24.1.39 |
| [26] |
Cui YC, Shan LQ, Shan GS, et al. Comparative study on pharmacodynamics of bile from pigs, cattle and sheep and their Arisaema cum Bile[J]. Chin Med Mat (中药材), 2021, 44: 586-592. |
| [27] |
Matsumuro K, Takahashi K, Matsumoto H, et al. A case of cerebrotendinous xanthomatosis with convulsive seizures[J]. Rinsho shinkeigaku, 1990, 30: 207-209. |
| [28] |
Salen G, Steiner RD. Epidemiology, diagnosis, and treatment of cerebrotendinous xanthomatosis (CTX)[J]. J Inherit Metab Dis, 2017, 40: 771-781. DOI:10.1007/s10545-017-0093-8 |
| [29] |
Mertens KL, Kalsbeek A, Soeters MR, et al. Bile acid signaling pathways from the enterohepatic circulation to the central nervous system[J]. Front Neurosci, 2017, 11: 617. DOI:10.3389/fnins.2017.00617 |
| [30] |
Higashi T, Watanabe S, Tomaru K, et al. Unconjugated bile acids in rat brain: analytical method based on LC/ESI-MS/MS with chemical derivatization and estimation of their origin by comparison to serum levels[J]. Steroids, 2017, 125: 107-113. DOI:10.1016/j.steroids.2017.07.001 |
| [31] |
Walker JE. Glutamate, GABA, and CNS disease: a review[J]. Neurochem Res, 1983, 8: 521-550. DOI:10.1007/BF00965107 |
| [32] |
Cupello A, Favale E, Audenino D, et al. Decrease of serotonin transporters in blood platelets after epileptic seizures[J]. Neurochem Res, 2005, 30: 425-428. DOI:10.1007/s11064-005-2676-2 |
| [33] |
Guiard BP, Di Giovanni G. Central serotonin-2A (5-HT2A) receptor dysfunction in depression and epilepsy: the missing link?[J]. Front Pharmacol, 2015, 6: 46. |
| [34] |
Mousseau DD, Baker GB. Recent developments in the regulation of monoamine oxidase form and function: is the current model restricting our understanding of the breadth of contribution of monoamine oxidase to brain [dys]function?[J]. Curr Top Med Chem, 2012, 12: 2163-2176. DOI:10.2174/156802612805219969 |
| [35] |
Parisi P, Oliva A, Coll Vidal M, et al. Coexistence of epilepsy and Brugada syndrome in a family with SCN5A mutation[J]. Epilepsy Res, 2013, 105: 415-418. DOI:10.1016/j.eplepsyres.2013.02.024 |
 2022, Vol. 57
2022, Vol. 57


