2. 中国人民解放军空军军医大学药学院, 陕西 西安 710027
2. School of Pharmacy, Fourth Military Medical University, Xi'an 710027, China
近年来, 由于艾滋病、器官移植和恶性肿瘤患者等人数的增加, 以及生物医学材料如静脉插管、心脏支架、气管插管和导尿管等越来越多地应用于人体, 国内外研究报道, 真菌感染尤其是侵袭性真菌感染的发生率和死亡率呈逐渐上升趋势。临床统计分析发现, 大多数医院深部真菌感染是由念珠菌引起的, 其中白念珠菌构成比最高, 其次为光滑念珠菌、近平滑念珠菌、热带念珠菌和克柔念珠菌[1]。目前临床上可供选择的抗深部真菌感染药物种类有限, 主要为多烯类如两性霉素B, 三唑类如氟康唑(fluconazole, FCZ)、伊曲康唑、伏立康唑, 棘白菌素类如卡伯芬净、阿尼芬净、米卡芬净等。并且它们还存在如毒副作用大、不便利的给药途径、易产生耐药性等问题, 进一步增加了深部真菌感染的治疗难度。近几十年来抗真菌新药的开发依旧很缓慢, 再加上耐药现象的出现, 使临床可选择的抗真菌药物变得更加有限。因此, 开发新结构类型、作用于新靶点的抗真菌药物是解决临床真菌感染治疗难题的重要策略之一。
随着蛋白激酶在各类疾病过程中重要作用的发现, 蛋白激酶被认为是继G蛋白偶联受体之后第二大类药物作用靶标。据统计, 目前处在临床研究的候选药物中, 约20%~30%的药物为蛋白激酶类抑制剂[2]。虽然蛋白激酶类抑制剂在肿瘤、糖尿病和风湿病等领域被广泛研究[3], 在抗细菌感染方面近年也有许多研究报道, 但在抗真菌感染领域研究还较少。病原真菌属于真核生物, 它的许多蛋白激酶信号通路在哺乳动物细胞中存在高度保守。因此作用于哺乳动物细胞的蛋白激酶抑制剂很有可能对真菌中同源的蛋白激酶也存在抑制作用。研究报道, 如非特异性的蛋白激酶C抑制剂星形孢菌素、乙酰CoA合成酶抑制剂塞来昔布衍生物AR-12、酪蛋白激酶2抑制剂CX-4945和大黄素、磷脂酰肌醇-3-激酶抑制剂苯并呋喃衍生物、磷酸肌醇依赖性蛋白激酶1抑制剂KP-372-1、糖原合成酶激酶3抑制剂NP031112和TDZD-8等对肿瘤和病原真菌均表现良好的抑制活性[4-9], 这证实了该观点的可行性。此外, 蛋白激酶在真菌与哺乳动物细胞中虽存在相似性, 但彼此也有一定差异。如人源磷酸肌醇依赖性蛋白激酶1 (phosphoinositide dependent protein kinase 1, PDK1) 是一个具有血小板同源结构域、长为556个氨基酸的蛋白, 它在白念珠菌的同源蛋白Pkh1是一个长为944个氨基酸但没有血小板同源结构域的蛋白, 且两者酶活性部位仅存在50%的相似性[10]。因此, 本研究从哺乳动物细胞蛋白激酶抑制剂中寻找具有抗真菌活性的先导化合物, 以期发现作用于新靶点的抗真菌先导化合物或候选药物。
本研究前期通过搜寻蛋白激酶类抑制剂的小分子化合物库, 挑选了100个结构多样的哺乳动物细胞蛋白激酶类小分子抑制剂, 发现有12个化合物表现了不同程度的抗真菌活性, 其中5碘代杀结核菌素(5-iodotubercidin, 5-Itu, 化学结构见图 1) 的抗真菌活性较优。5-Itu为广泛的激酶抑制剂, 尤其对腺苷激酶抑制活性最强。5-Itu具有多种药理活性, 如可通过抑制胰岛瘤细胞相关蛋白1的表达、降低环磷酸腺苷水平而发挥抑制神经母细胞瘤增殖的作用; 以依赖或不依赖抑制组蛋白H3磷酸化激酶Haspin活性的方式影响胚胎干细胞的自我复制和分化; 通过抑制环磷腺苷效应元件结合蛋白的磷酸化、增加蛋白激酶B和细胞外信号调节酶磷酸化而发挥抑制黑色素形成的作用; 通过激活p53, 其代谢物插入DNA引起DNA断裂等发挥体内抗肿瘤活性; 通过抑制乙酰辅酶A羧化酶活性而发挥抑制脂肪酸和胆固醇合成的作用等[11-15]。本研究基于前期发现, 进一步通过微量液基稀释法、时间-杀菌曲线实验、菌丝和生物被膜形成实验等评价了5-Itu的体外抗真菌和抗生物被膜活性。通过气相色谱-质谱联用(GC/MS)、透射电镜(TEM) 和流式细胞技术初步探索了其抗真菌作用机制。

|
Figure 1 Chemical structure of 5-iodotubercidin (5-Itu) |
实验菌种 耐药白念珠菌103、白念珠菌SC5314、光滑念珠菌、近平滑念珠菌、克柔念珠菌、热带念珠菌、新生隐球菌(上海市长海医院检验科)。
实验试剂和培养基 12个化合物(CAS号分别为: 24386-93-4、742112-33-0、950736-05-7、1219168-18-9、1356962-34-9、336113-53-2、307543-71-1、837422-57-8、1229582-33-5、1228013-15-7、110448-33-4和1421227-52-2, Aladdin公司); 氟康唑(Sigma公司); 钙黄绿素乙酰氧基甲酯、细胞凋亡检测试剂盒(上海碧云天生物技术有限公司); 蜗牛酶(生工生物工程股份有限公司); 二甲基亚砜、碳酸氢钠及氢氧化钠(天津市天力化学试剂有限公司); 蛋白胨(北京奥博星生物技术有限责任公司); 葡萄糖(天津市科密欧化学试剂有限公司); 3-(N-吗啡啉) 丙磺酸/MOPS (上海源叶生物科技有限公司); RPMI 1640 (Gibco公司)。
SDA平板(40 g葡萄糖、10 g蛋白胨加三蒸水至1 000 mL搅拌溶解, 加18 g琼脂粉混匀, 121 ℃高温灭菌20 min, 倒平皿4 ℃储存); YPD培养液(酵母提取物10 g、蛋白胨20 g、葡萄糖20 g加三蒸水至1 000 mL, 混匀分装, 121 ℃高压灭菌20 min, 4 ℃保存); RPMI 1640液体培养液(RPMI 1640 10 g、NaHCO3 2.0 g、MOPS 34.5 g加三蒸水溶解, 用NaOH调pH至7.0, 加水至1 000 mL, 除菌, 4 ℃保存)。
实验仪器 SW-CJ-JFD型洁净工作台(苏州安泰空气技术有限公司); THZ-98C型恒温振荡箱、GP-9080型隔水式培养箱(上海一恒科学仪器有限公司); 流式细胞仪(美国Beckman公司); GC/MS (Thermo Fisher公司); 透射电镜(日本日立公司)。
微量液基稀释法 将实验各菌株培养过夜, RPMI 1640培养基调整每毫升菌浓度至约1×103~5×103个, 混匀。取无菌96孔板, 每排1号孔加等量RPMI 1640液体培养基作空白对照, 12号孔不加药物作阳性对照。对2~11号孔进行倍比稀释, 保证各孔的药物终浓度依次为64、32、16、8、4、2、1、0.5、0.25、0.125 μg·mL-1且孔中DMSO的含量均低于1%。35 ℃恒温培养, 于24或72 h进行观察记录, 得对应最小抑菌浓度(minimal inhibit concentration, MIC)。MIC值选用记录方法: 当MIC值高于64 μg·mL-1记为“ > 64 μg·mL-1”; 等于或低于最低浓度时均记为“≤ 0.125 μg·mL-1”。上述实验均平行操作两次, 当观察所得MIC值能准确重复或只差一个浓度时视为有效结果, 并取较高浓度为最终确定值, 否则重新实验直到数据符合要求。
时间-杀菌曲线实验 挑取白念珠菌克隆培养过夜。离心收集菌体, PBS洗涤, RPMI 1640培养基调整每毫升菌浓度至1×105个。将菌液分装, 加不同浓度的化合物, 振摇培养, 不同时间点取出菌液, 用PBS稀释不同的浓度, 取稀释液分别涂铺SDA平板, 35 ℃静置培养48 h后, 数克隆数并计算CFU数目。
生物被膜实验 挑取白念珠菌克隆培养过夜。离心收集菌体, PBS洗涤, RPMI 1640培养基调整每毫升菌浓度至1×106个。菌悬液100 μL加入96孔板, 37 ℃黏附90 min后, PBS洗3次, 再加入新鲜RPMI 1640以及含药的培养基, 37 ℃培养24 h后, 用XTT染色并检测生物被膜的量。成熟生物被膜的检测: 调整每毫升菌浓度至1×106个。菌悬液100 μL加入96孔板, 37 ℃黏附90 min后, PBS洗3次, 再加入新鲜PRMI 1640培养基, 37 ℃培养24 h后, 再用PBS洗3次, 加入新鲜PRMI 1640以及含药的培养基, 用XTT染色并检测成熟生物被膜的量。
菌丝形成实验 挑取白念珠菌克隆培养过夜。离心去上清, PBS洗3次。用培养基RPMI 1640 + 10% FBS重悬, 调整每毫升菌终浓度为1×106个, 取1 mL于6孔板, 加药混匀, 37 ℃静置培养, 于3 h观察并拍照。
细胞膜通透性实验 挑取白念珠菌克隆培养过夜。离心去上清, PBS洗3次。调整每毫升菌浓度为1×107个, 加10 μmol·L-1钙黄绿素乙酰氧基甲酯(calcein AM) 孵育2 h。PBS清洗3次, 调整每毫升菌液浓度为1×106个, 加药5-Itu (4和8 μg·mL-1) 或不加药孵育3 h。PBS清洗3次, 流式细胞仪检测。
细胞凋亡检测 挑取白念珠菌克隆培养过夜。再将菌以1∶100比例转移至新鲜的YPD培养基及含药培养基中, 35 ℃、200 r·min-1培养, 离心收集, PBS清洗, 加入蜗牛酶37 ℃孵育1 h, 离心去上清, PBS清洗, 按照细胞凋亡试剂盒说明书操作, 孵育, 上流式细胞仪检测。
透射电镜实验 挑取白念珠菌克隆于YPD中培养过夜, 再将菌以1∶100比例转移至100 mL新鲜的YPD培养基及含药培养基中, 35 ℃、200 r·min-1培养至菌处于对数生长期, 离心收集, PBS清洗, 收集菌沉淀, 加2.5%戊二醛固定液置于4 ℃冰箱, 漂洗, 再加1%锇酸固定, 漂洗, 梯度脱水, 包埋, 切片, 柠檬酸铅和醋酸铀双染, 透射电镜观察拍照。
GC/MS检测细胞膜甾醇成分 挑取白念珠菌克隆培养过夜。再将菌以1∶100比例转移至新鲜的YPD培养基及含药培养基中, 35 ℃、200 r·min-1培养, 离心收集, PBS清洗, 去上清, 称各菌湿重约0.5 g, 加PBS 2.5 mL和新鲜配制的皂化剂(含15% NaOH的90%乙醇溶液) 6 mL, 混匀, 80 ℃水浴皂化60 min。加石油醚(沸程30~60 ℃) 6 mL提取3次, 合并提取液, 加水6 mL洗涤, 弃去水层, 醚层于60 ℃水浴挥干, 得未皂化脂, 加环己烷使溶液体积为1 mL·g-1湿菌, -20 ℃保存。送样GC/MS检测。检测分析条件为: 氦气, 1 mL·min-1; 质谱, 离子源EI, 250 ℃; 质量范围: m/z 41~500; 进样口温度, 250 ℃; 传输线温度, 250 ℃; 进样体积, 1 μL; 延迟时间, 3 min; 升温程序: 100~300 ℃, 30 ℃·min-1。实验重复两次。
统计学方法 计量资料以均值±标准差(
如表 1所示, 初步筛选到12个化合物对耐药白念珠菌103和敏感白念珠菌SC5314均表现不同程度的抑制活性, 其中5-Itu对这两种真菌的抑制作用最优, MIC值范围为2~4 μg·mL-1。
| Table 1 Minimal inhibitory concentrations (MICs) of 12 compounds against fungi |
如表 2所示, 5-Itu对多种真菌(包括敏感白念珠菌SC5314、耐药白念珠菌103、热带念珠菌、光滑念珠菌、近平滑念珠菌、克柔念珠菌和新生隐球菌) 的MICs范围为2~4 μg·mL-1, 说明5-Itu具有较广谱的抗真菌活性。
| Table 2 MICs of 5-Itu against different fungi |
如图 2所示, 2 μg·mL-1 5-Itu作用真菌24 h后, 与空白组相比, 存活的菌数减少了4.57×102 CFU·mL-1。4 μg·mL-1 5-Itu作用真菌48 h后, 与空白组相比, 存活的菌数减少了2.51×105 CFU·mL-1。8 μg·mL-1 5-Itu作用真菌48 h后, 存活菌数为0。这结果说明5-Itu具有杀真菌作用。
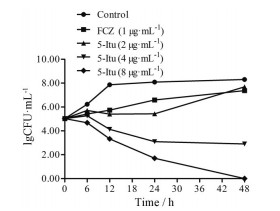
|
Figure 2 Time killing curves of C. albicans SC5314 treated with or without different concentrations of 5-Itu or FCZ. Aliquots were obtained at the indicated time points and serially dilutions were spread on SDA plates. After 48 h of incubation at 35 ℃, the colony was counted |
如图 3所示, 2~16 μg·mL-1 5-Itu均能显著地抑制白念珠菌生物被膜的形成(P < 0.05), 且呈现浓度依赖性。5-Itu在浓度为4、8和16 μg·mL-1时, 还能明显损伤成熟生物被膜(P < 0.05), 损伤率分别为33.4%、60.0%和70.5%。
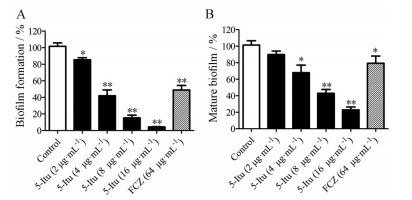
|
Figure 3 Effects of 5-Itu on biofilm formation and mature biofilms of C. albicans in vitro. A: Effects of different concentrations of 5-Itu (2, 4, 8 and 16 μg·mL-1) on biofilm formation of C. albicans; B: Effects of different concentrations of 5-Itu (2, 4, 8 and 16 μg·mL-1) on mature biofilms of C. albicans. Biofilm cells were tested by the XTT reduction assay, and the biofilms were evaluated by the percentage of viable cells treated with different drugs relative to the control. n = 3, |
如图 4所示, 2、4和8 μg·mL-1 5-Itu作用白念珠菌3 h后, 虽然有部分菌出现较短的菌丝, 但部分菌依然为酵母态。结果说明5-Itu能抑制白念珠菌菌丝的形成。

|
Figure 4 Inhibitory activity of different concentrations of 5-Itu on hyphal formation of C. albicans SC5314. Representative photomicrographs of C. albicans SC5314 treated with or without different concentrations of 5-Itu or FCZ for 3 h at 37 ℃. Magnification: 400×. Scale bar = 50 μm |
如图 5所示, 4和8 μg·mL-1 5-Itu作用白念珠菌3 h后, 其菌细胞内的钙黄绿素荧光值与空白组相比, 明显降低(P < 0.05), 说明5-Itu能增加白念珠菌细胞膜的通透性。

|
Figure 5 Effects of 5-Itu on cell membrane permeability of C. albicans was evaluated by the cellular fluorescence intensities of calcein. A: Flow cytometry histograms of C. albicans treated with or without 5-Itu or FCZ; B: The cellular fluorescence intensities of calcein in C. albicans treated with or without 5-Itu or FCZ. n = 3, |
Annexin V是一种钙离子依赖磷脂结合蛋白, 可与细胞凋亡早期细胞膜外翻的磷脂酰丝氨酸结合, 从而检测细胞凋亡。如图 6所示, 4和8 μg·mL-1 5-Itu作用白念珠菌后, Annexin V阳性菌细胞数明显高于空白组(P < 0.05), 提示5-Itu可诱导白念珠菌发生凋亡。
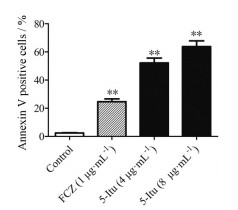
|
Figure 6 The percentage of Annexin V-positive cells of C. albicans treated with 5-Itu (4 and 8 μg·mL-1) was evaluated. n = 3, |
如图 7所示, 4 μg·mL-1 5-Itu作用白念珠菌后, 与空白组相比, 部分菌细胞的细胞质密度明显下降, 并且细胞膜与细胞壁之间出现分离, 中间存在部分内容物, 细胞膜向细胞质方向发生轻微内陷。结果提示, 5-Itu可能损伤白念珠菌细胞膜和细胞内的超微结构。

|
Figure 7 The effect of 5-Itu on the cell ultrastructures of C. albicans by transmission electron microscopy. Magnification: 15 000×, 30 000×, 80 000× |
前期结果显示, 5-Itu能够显著增加细胞膜的通透性, 透射电镜观察发现5-Itu能够损伤白念珠菌的细胞膜。因此, 进一步用GC/MS考察了5-Itu对细胞膜甾醇成分的影响。如表 3所示, 空白组中麦角甾醇(ergosterol) 的百分比含量为87.2%, 是最主要的甾醇成分。阳性对照药氟康唑(通过作用于羊毛甾醇-14α-去甲基化酶抑制麦角甾醇的合成) 组的麦角甾醇百分比含量降为1.7%, 而羊毛甾醇(lanosterol) 和其他含有14α-甲基的甾醇成分如obtusifoliol、eburicol、lanost-8-en-3-ol和14α-methyl-5α-ergosta-8, 24(28)-dien-3α-ol均发生累积。5-Itu组的麦角甾醇百分比含量降为35.6%, 其他甾醇成分如ergosta-3, 5, 7, 22-tetraene、3α, 5-cyclo-5α-ergosta-6, 8(14), 22-triene和羊毛甾醇百分比含量均高于空白组。结果说明, 5-Itu可以改变细胞膜的甾醇成分。
| Table 3 The mean percentage of sterol compositions (%) of C. albicans SC5314 following FCZ or 5-Itu treatment, as analyzed by GC/MS. aND: Not detected |
本研究用不同的方法评价了5-Itu对真菌的活性, 结果发现5-Itu对各种念珠菌属真菌和新生隐球菌均表现较好的抑制作用, 对白念珠菌还表现杀菌活性。并且, 5-Itu能够显著地抑制生物被膜和菌丝的形成, 并明显损伤成熟生物被膜。初步的作用机制研究显示, 5-Itu能够显著地增加细胞膜的通透性, 损伤细胞膜和细胞内的超微结构, 改变细胞膜的甾醇成分, 诱导细胞凋亡。
生物被膜是真菌在植入人体内的生物材料如中心静脉导管、导尿管、起搏器、假牙等表面形成的一种由酵母态、菌丝态、假菌丝态细胞和胞外基质组成的致密结构, 是真菌毒性和耐药性形成的重要因子。白念珠菌生物被膜的形成与酵母和菌丝型细胞的发育存在密切关系, 受环腺苷酸/蛋白激酶A (cyclic adenosine monophosphate/protein kinase A, cAMP/PKA) 信号通路调控[16]。本研究发现5-Itu具有抗白念珠菌生物被膜的活性, 可能与它抑制菌丝形成有关。此外, 文献报道5-Itu能够通过诱导细胞内外的腺苷失衡而降低细胞内cAMP的含量[11]。而降低cAMP与抗生物被膜作用密切相关[17]。因此, 进一步还需研究5-Itu的抗生物被膜作用是否与cAMP信号通路相关。
甾醇是真核细胞膜的重要组成成分。与哺乳动物细胞不同的是, 真菌细胞膜最主要的甾醇成分为麦角甾醇。氟康唑是临床治疗侵袭性真菌感染的一线药物。它会通过抑制麦角甾醇合成通路中的羊毛甾醇-14α-去甲基化酶而阻断羊毛甾醇的14α-去甲基化, 从而造成羊毛甾醇、含甲基的羊毛甾醇类似物的累积和麦角甾醇含量的减少。本研究中, 氟康唑作用白念珠菌后的细胞膜麦角甾醇百分比含量显著减少, 羊毛甾醇和其他含有14α-甲基的甾醇成分如obtusifoliol、eburicol、lanost-8-en-3-ol和14α-methyl-5α-ergosta-8, 24(28)-dien-3α-ol均发生累积, 这与文献报道结果相似[18, 19]。5-Itu作用后的白念珠菌细胞膜麦角甾醇百分比含量虽然与空白组相比也有明显下降, 但高于氟康唑药物组。并且, 与氟康唑不同的是, 5-Itu引起了白念珠菌细胞膜中3α, 5-cyclo-5α-ergosta-6, 8(14), 22-triene和ergosta-3, 5, 7, 22-tetraene两个甾醇成分的累积, 通过将这两个甾醇组分与麦角甾醇的结构进行比较, 发现它们均缺少了3-位羟基。目前对于催化这个反应的酶还未见文献报道。本研究发现5-Itu可以改变细胞膜甾醇的成分, 但与氟康唑作用机制不同, 5-Itu可能是通过作用于麦角甾醇合成通路中的上游靶标影响麦角甾醇成分含量, 或者可能直接作用于麦角甾醇引起其结构的改变, 从而损伤细胞膜的超微结构, 引起细胞膜通透性的改变, 这还有待进一步的研究。
综上所述, 5-Itu对各种真菌表现出良好的抑制甚至是杀菌作用。并且, 5-Itu能够显著地抑制生物被膜和菌丝的形成, 明显损伤成熟生物被膜。其抗真菌作用机制可能与影响细胞膜甾醇有关。相关研究结果为新型抗真菌先导化合物的研究和开发提供有益参考。
作者贡献: 刘伟、王苗苗、韩研春、倪萍、温芝潼、袁林负责完成文中实验部分和数据处理; 刘伟负责撰写文章; 王胜正指导实验设计和数据分析, 并修改文章。
利益冲突: 本文的研究内容无任何利益冲突。
| [1] |
Xiao Z, Wang Q, Zhu F, et al. Epidemiology, species distribution, antifungal susceptibility and mortality risk factors of candidemia among critically ill patients: a retrospective study from 2011 to 2017 in a teaching hospital in China[J]. Antimicrob Resist Infect Control, 2019, 8: 89. DOI:10.1186/s13756-019-0534-2 |
| [2] |
Eglen RM, Reisine T. The current status of drug discovery against the human kinome[J]. Assay Drug Dev Technol, 2009, 7: 22-43. DOI:10.1089/adt.2008.164 |
| [3] |
Roskoski R. A historical overview of protein kinases and their targeted small molecule inhibitors[J]. Pharmacol Res, 2015, 100: 1-23. DOI:10.1016/j.phrs.2015.07.010 |
| [4] |
Maslyk M, Janeczko M, Martyna A, et al. CX-4945: the protein kinase CK2 inhibitor and anti-cancer drug shows anti-fungal activity[J]. Mol Cell Biochem, 2017, 435: 193-196. DOI:10.1007/s11010-017-3068-z |
| [5] |
Baxter BK, DiDone L, Ogu D, et al. Identification, in vitro activity and mode of action of phosphoinositide-dependent-1 kinase inhibitors as antifungal molecules[J]. ACS Chem Biol, 2011, 6: 502-510. DOI:10.1021/cb100399x |
| [6] |
Koselny K, Green J, DiDone L, et al. The celecoxib derivative AR-12 has broad-spectrum antifungal activity in vitro and improves the activity of fluconazole in a murine model of cryptococcosis[J]. Antimicrob Agents Chemother, 2016, 60: 7115-7127. DOI:10.1128/AAC.01061-16 |
| [7] |
Janeczko M, Maslyk M, Kubinski K, et al. Emodin, a natural inhi bitor of protein kinase CK2, suppresses growth, hyphal development, and biofilm formation of Candida albicans[J]. Yeast, 2017, 34: 253-265. DOI:10.1002/yea.3230 |
| [8] |
El-Khouly OA, Henen MA, El-Sayed MA, et al. Synthesis, anticancer and antimicrobial evaluation of new benzofuran based derivatives: PI3K inhibition, quorum sensing and molecular modeling study[J]. Bioorg Med Chem, 2021, 31: 115976. DOI:10.1016/j.bmc.2020.115976 |
| [9] |
Sebastian-Perez V, Manoli MT, Perez DI, et al. New applications for known drugs: human glycogen synthase kinase 3 inhibitors as modulators of Aspergillus fumigatus growth[J]. Eur J Med Chem, 2016, 116: 281-289. DOI:10.1016/j.ejmech.2016.03.035 |
| [10] |
Pastor-Flores D, Schulze JO, Bahi A, et al. PIF-pocket as a target for C. albicans Pkh selective inhibitors[J]. ACS Chem Biol, 2013, 8: 2283-2292. DOI:10.1021/cb400452z |
| [11] |
Chen C, Breslin MB, Guidry JJ, et al. 5'-Iodotubercidin represses insulinoma-associated-1 expression, decreases cAMP levels, and suppresses human neuroblastoma cell growth[J]. J Biol Chem, 2019, 294: 5456-5465. DOI:10.1074/jbc.RA118.006761 |
| [12] |
Karanika E, Soupsana K, Christogianni A, et al. Haspin-dependent and independent effects of the kinase inhibitor 5-iodotubercidin on self-renewal and differentiation[J]. Sci Rep, 2020, 10: 232. DOI:10.1038/s41598-019-54350-4 |
| [13] |
Kim KI, Jeong HB, Ro H, et al. Inhibitory effect of 5-iodotubercidin on pigmentation[J]. Biochem Biophys Res Commun, 2017, 490: 1282-1286. DOI:10.1016/j.bbrc.2017.07.008 |
| [14] |
Zhang X, Jia D, Liu H, et al. Identification of 5-iodotubercidin as a genotoxic drug with anti-cancer potential[J]. PLoS One, 2013, 8: e62527. DOI:10.1371/journal.pone.0062527 |
| [15] |
Garcia-Villafranca J, Castro J. Effects of 5-iodotubercidin on hepatic fatty acid metabolism mediated by the inhibition of acetyl-CoA carboxylase[J]. Biochem Pharmacol, 2002, 63: 1997-2000. DOI:10.1016/S0006-2952(02)01013-4 |
| [16] |
Guo DD, Yue HZ, Wei YJ, et al. Genetic regulatory mechanisms of Candida albicans biofilm formation[J]. Chin J Biotechnol (生物工程学报), 2017, 33: 1567-1581. |
| [17] |
Qian W, Yang M, Li X, et al. Anti-microbial and anti-biofilm activities of combined chelerythrine-sanguinarine and mode of action against Candida albicans and Cryptococcus neoformans in vitro[J]. Colloids Surf B Biointerfaces, 2020, 191: 111003. DOI:10.1016/j.colsurfb.2020.111003 |
| [18] |
Suchodolski J, Muraszko J, Bernat P, et al. A crucial role for ergosterol in plasma membrane composition, localisation, and activity of Cdr1p and H+-ATPase in Candida albicans[J]. Microorganisms, 2019, 7: 378. DOI:10.3390/microorganisms7100378 |
| [19] |
Lv QZ, Qin YL, Yan L, et al. NSG2 (ORF19.273) encoding protein controls sensitivity of Candida albicans to azoles through regulating the synthesis of C14-methylated sterols[J]. Front Microbiol, 2018, 9: 218. |
 2022, Vol. 57
2022, Vol. 57


