丝素蛋白(silk fibroin) 是一种天然可降解高分子聚合物, 具有稳定无毒、价廉易得及无炎症反应等特点, 表现出良好的可降解性和生物相容性, 在生物医药领域常作为生物组织工程与药物递送载体的材料广泛应用,如骨组织修复物[1]、关节腔润滑凝胶[2]、脂质体[3, 4]、纳米粒[5, 6]、微球[7, 8]、膜剂[9]、透皮微针[10, 11]、刺激响应性原位凝胶剂[12]等。本综述基于丝素蛋白的一级结构与不同环境中二级结构的相应变化特点, 对其体内外生物降解特性与生物相容性研究的方法与结果的国内外进展进行了总结, 以期为丝素蛋白的进一步深入研究与应用提供参考。
1 丝素蛋白的来源与结构 1.1 丝素蛋白的来源丝素蛋白是由蚕丝经脱去外层丝胶后所得的内层蛋白。家蚕幼虫经4次蜕皮后会吐出蚕丝, 可直接加工为手术缝合线, 作为具有100多年应用历史的天然来源生物材料, 其早已被美国食品药品管理局(FDA) 批准应用于临床。蚕丝主要由外周包围的丝胶蛋白(20%~30%) 和内芯的丝素蛋白(70%~80%) 组成[13]。医用丝线在早期应用阶段曾引起众多不良反应, 后经研究表明, 其外层丝胶才是引起机体异物反应的主要原因, 在经化学方法脱胶后所得产物的安全性可显著提高[14]。因此, 可靠且稳定的丝素蛋白提取工艺对其后续应用至关重要。
1.2 丝素蛋白的结构与组成丝素蛋白包括轻链(25 kDa)、重链(350 kDa) 和P25糖蛋白链(28 kDa), 三者摩尔比为6∶6∶1。重链与轻链之间由二硫键连接, 其中重链分子质量大约是350 kDa, 是蚕丝蛋白晶体结构的主要构成者[15]。
丝素蛋白主要由甘氨酸(43%)、丙氨酸(30%)、丝氨酸(12%) 等18种氨基酸组成, 其一级结构主要由Gly-Ala-Gly-Ala-Gly-Ser六肽重复序列与非重复序列相间分布而成(图 1)[16, 17]。六肽重复序列反向平行排列分布, 通过氢键相互作用形成β-折叠结构, 从而形成丝素蛋白的主晶区。由于分子间大量氢键、天然的疏水性和高结晶度, 丝素蛋白的环境稳定性远高于普通球蛋白如胶原蛋白。丝素蛋白的构象可分为silk I和silk II。Silk I包括无规线团和α-螺旋; silk II以反平行β-折叠结构为主。由于反平行β-折叠形成的密集晶型使丝素蛋白分子处于空间最适位置, 状态体系能量最低, 因此silk II构型成为丝素蛋白较为稳定的一种构型[18, 19]。Silk I和silk II构象可通过改变温度、应力、溶剂极性、pH值等条件进行转变[18, 20-22]。

|
Figure 1 Amino acid sequence of silk fibroin protein heavy chain, blue represents the repeated sequence that forms the β-folded structure |
物质结构决定性质, 丝素蛋白的特殊结构使其具有以下优点: ①可塑性强。通过化学修饰氨基酸的氨基或侧链来改变丝素蛋白的表面性能, 处理得到不同形态的丝素材料, 如纤维、溶液、粒子、膜及凝胶等[13, 23]。如He等[24, 25]制备出多孔性丝素蛋白凝胶, 通过对蛋白羧基进行酰胺化修饰, 获得pH智能响应性多孔性丝素凝胶, 有利于离子型药物的溶出和释放; ②具有良好的抗拉伸强度和柔韧性、缓释性。该性质与丝素蛋白含有大量疏水域, 可结合并折叠成β-二级结构有关[19]。Xie等[26]创新性地采用溶剂焊接法交联三维结构的丝素纳米纤维制得气凝胶, 与传统气凝胶相比(如通过二氧化硅、黏土等制备), 丝素蛋白气凝胶具有机械强度高、生物安全性好、环境友好和成本低等优点; ③具有环境响应性。基于丝素蛋白的纳米药物递送系统具有特殊的pH/过氧化氢(H2O2)/谷胱甘肽(GSH) 响应能力, 它们对酸性pH和H2O2的响应是由于破坏silk II晶型的β-折叠结构, 而对GSH的响应是由于二硫键的裂解; ④具有可生物降解性。丝素蛋白在体内可部分降解, 其主要成分为细胞黏合相关蛋白, 不仅对组织无不良反应, 还有营养细胞与修复作用, 有益于促进细胞外基质的形成[27]; ⑤具有更优的生物相容性。与其他常见的生物可降解聚合物如胶原蛋白相比, 丝素蛋白不仅机械韧性更好, 且炎症反应更小, 作为药物递送载体或者生物组织材料的安全性与长期稳定性更高[28]。
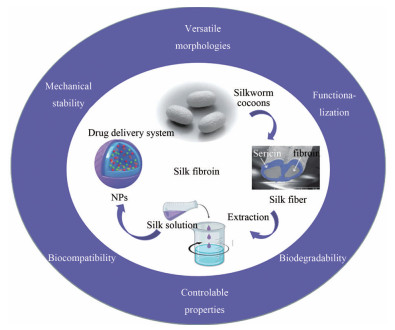
众多优点使丝素蛋白迅速成为新兴生物材料并应用于多学科领域, 如用作人工皮肤[29]等仿生材料、酶固定材料[30]、组织工程生物材料、生物传感器材料[31]、药物递送系统[1, 32, 33]等(图 2)。但目前未见成熟的工业化分离、精制方法与产品作为药用辅料大规模上市, 另外, 尚无发达国家药典标准收载本品种。因此, 在本品广泛应用于临床前仍需开展大量基础与应用研究。
|
Figure 2 Key advantageous properties of silk fibroins for biomedical applications. NPs: Nanoparticles |
丝素蛋白在美国药典被定义为不可降解材料, 这是由于天然丝素特殊的结晶取向和致密的结构难以降解, 蚕丝在体内抗拉强度的损失可忽略不计。研究表明蚕丝可降解, 只是在体内吸收缓慢, 需要时间更长[31]。与合成材料不同, 丝素蛋白的降解行为不会导致免疫原性反应的发生。
2.1.1 丝素蛋白的酶降解特性生物材料的降解通常是将高分子材料分解成更小的化合物。降解过程变化很大, 机制也很复杂, 受到物理、化学和生物因素的影响。根据降解方式的不同, 丝素蛋白可归为酶降解聚合物[27, 34], 酶在丝素蛋白的降解过程中起着重要作用。
丝素蛋白作为一种蛋白质, 易被糜蛋白酶、链酶蛋白酶、羧化酶等水解降解。生物降解行为有两个步骤, 首先丝素蛋白材料被不同的酶吸附, 这要求酶必须在材料表面找到结合域, 而后丝素蛋白被酶消化水解。丝素蛋白的最终降解产物是相应的氨基酸, 在体内易被吸收[35-37]。因而, 可降解吸收的特点也是丝素蛋白生物材料在生物医药领域应用的优势之一。
不同酶对丝素蛋白生物降解行为的影响不同。Li等[36]研究在体外环境下暴露于不同蛋白酶的丝素蛋白的降解行为, 糜蛋白酶可降解丝素蛋白的无定形区域, 得到高结晶性丝素蛋白。当蛋白酶XIV与α-糜蛋白酶孵育1周后, 丝素蛋白的极限抗拉强度和质量显著降低, 而在α-糜蛋白酶中孵育1周后, 丝素蛋白基质的极限抗拉强度和质量保持不变[36, 38]。Li等[36]发现α-糜蛋白酶可降解丝素蛋白, 但不能降解丝素蛋白膜。相比之下, 其他酶特别是蛋白酶XIV可普遍降解丝素蛋白及丝素膜, 揭示不同蛋白酶降解丝素的不同潜力。相反, 在家蚕丝腺中会产生一种蛋白酶抑制剂, 并将其嵌入蚕茧中, 以防止丝素蛋白过早发生降解[39]。
2.1.2 丝素蛋白降解后结构变化及降解产物丝素蛋白经酶生物降解后, 结构和分子质量发生显著变化。Altman等[27, 31]体外研究丝素蛋白的降解行为, 发现蛋白酶将丝素蛋白的少晶区切割成多肽, 能被细胞吞噬以进一步代谢。降解后丝素蛋白的样品质量和聚合度明显下降, 部分丝素材料可分解为氨基酸。丝素蛋白生物材料经不同酶降解后的平均分子质量大小依次为蛋白酶XIV < 胶原酶IA < α-糜蛋白酶。经过胶原酶IA降解, 丝素蛋白膜的重量随降解时间增加而减小, 游离氨基酸占总氨基酸的比例超过50%。然而, 当孵育在蛋白酶XIV中时, 70%的丝素蛋白膜在15天内可降解。蛋白酶XIV不仅能降解丝素蛋白, 而且还直接将丝素膜降解为多肽和氨基酸[36]。由上可得, 丝素蛋白相关材料的生物降解产物为常见的氨基酸, 对人体几乎无危害。
2.1.3 丝素蛋白体内外降解速率一般来说, 丝素蛋白在体内缓慢降解、吸收, 吸收速率可通过改变环境因素如植入部位、机械环境、患者健康和生理状态, 以及改变丝素的二级结构起到控制作用[40-42]。丝素纤维加工过程中可能导致蛋白质的构象变化, 潜在增加或减少对降解酶的敏感性。Greenwald等[43]研究表明, 丝素纤维在人体内1年内失去大部分的抗拉强度, 2年内在植入部位无法被识别。在大鼠的皮下植入模型中, 蚕丝纤维在植入后10天失去29%的抗拉强度, 30天失去73%, 70天失去83%, 不被识别[44]。在兔模型的角膜、巩膜、眼部肌肉中, 90天即可被吸收[41]。
除了蛋白水解酶, 丝素蛋白也可通过其他方式降解, 如γ射线。随辐照强度的增加, 丝素多肽键合能力减弱, 丝素蛋白β-折叠结构减少, 使降解产物中低分子质量蛋白的释放增多, 丝素蛋白的生物降解能力增强[45]。
2.2 丝素蛋白体内外降解研究方法 2.2.1 体外方法丝素蛋白体内外降解的速度都十分缓慢, 体内植入大约1年可降解, 体外降解常规为1个月左右。体外降解速率受丝素蛋白材料形式与蛋白酶的不同种类影响, 降解速率不同, 但与体内降解速率相比, 降解速度更快。降解实验大多模拟体内微环境温度为37 ℃、pH为7.2~7.4, 实验条件多为磷酸盐缓冲液(PBS) 中加入适宜浓度蛋白酶XIV[46]。用于体外降解丝素蛋白的酶类有多种, 如α-糜蛋白酶、胶原酶IA、蛋白酶XIV, 其中蛋白酶XIV作用1周后丝素蛋白的质量和抗拉强度明显下降[36], 因而实验选用蛋白酶XIV较多。蛋白酶XIV作用于蛋白肽链, 将丝素蛋白大分子断裂、分解, 达到降解目的。
丝素蛋白降解的终产物为多肽片段或单个氨基酸, 包括丙氨酸、甘氨酸、丝氨酸、酪氨酸等。降解实验主要通过测量材料的失重率来评价, Baran等[47, 48]测量了丝素蛋白-淀粉结合物在α-淀粉酶、蛋白酶和溶菌酶溶液中的失重率来评价结合物的体外生物降解性, 丝素蛋白及衍生材料的重量随时间增加进一步减少, 表明丝素蛋白发生降解, 也可用通过测降解前后的紫外吸光度、傅里叶红外衍射光谱、SDS-聚丙烯酰胺凝胶电泳、体积排阻色谱柱等方法评估降解程度[49, 50], Zhao[46]构建了重组丝素蛋白可降解导管用于神经生物学研究, 由于降解过程中离子浓度与紫外吸收成线性关系, 故通过紫外可见分光光度计测吸光度来表征材料的降解。由吸光度随时间变化趋势可得: 一定时间内粒子的吸光度增大至最大值, 而后吸光度逐渐减小, 这表明丝素蛋白降解后的粒子浓度逐渐增大, 降解程度逐渐增大, 至降解速率达最大, 而后降解速率逐渐缓慢。由丝素蛋白降解过程的红外图谱对照可得: 红外吸收峰1 610~1 630、1 695~1 703、1 510~1 525 cm-1是丝素silk II结构的特征峰, 峰1 648~1 654和1 535~1 542 cm-1是silk I结构的特征峰。降解后红外峰位移由silk II向silk I轻微转变, 说明降解过程中丝素蛋白的β-折叠构型向α-螺旋构型翻转。聚丙烯酰胺凝胶电泳图表明随着降解时间延长, 所对应时间的电泳条带颜色逐渐变淡, 说明丝素蛋白纤维分子质量整体发生一定程度的降解。综上整体实验, 可能是由于体外实验条件下丝素蛋白不一定完全降解, 降解产物为蛋白和多肽、氨基酸混合物形式, 测定某种单一氨基酸难度较高, 因而采用一系列间接实验来测定降解程度。
2.2.2 体内方法丝素蛋白纤维在植入大鼠体内后, 1年内失去了大部分抗拉强度, 2年内在植入部位无法被识别。丝素蛋白在体内的降解特性可通过大耳白兔皮下植入或小鼠皮下植入方法观察研究。降解实验大多依旧检测植入前后丝素材料的失重率, 也可通过观察材料抗拉强度的减弱趋势、对比植入部位组织切片苏木素-伊红(HE) 染色后观察结果、扫描电镜观察丝素蛋白组织支架或制剂植入皮下组织前后的形貌完整度来评价降解程度。Zhao[46]的实验研究可肉眼观察到丝素蛋白导管材料植入大耳白兔背部的降解情况。手术植入切口无感染、无红肿, 术后1周拆除缝线, 切口初步愈合无裂开。植入4周时导管和纤维均保持原有外形, 周围有纤维组织包裹且血管丰富; 植入8周时, 丝素蛋白导管塌陷; 植入12周时, 导管已失去管状外形, 肉眼可观察到乳白色团块状, 植入部位及周围未见明显炎症反应。扫描电镜观察则可更为直观地观察到, 植入一段时间后, 丝素蛋白导管孔隙增大, 管壁变薄, 表面出现碎屑状颗粒等微观降解表征。在组织切片HE染色实验中, 可观察到刚植入后, 丝素蛋白材料周围有少量中性粒细胞、巨噬细胞出现, 随时间增加丝素蛋白材料体积减小并发生降解, 炎症反应也逐渐减轻, 直至消失, 以上结果均表明丝素蛋白及降解产物在体内环境中安全无毒。如需系统性分析降解后游离氨基酸的种类及含量, 可采用自动氨基酸分析仪测定不同降解时间的丝素材料本身及降解介质中的游离氨基酸[36]。
3 丝素蛋白的生物相容性研究与方法 3.1 丝素蛋白的生物相容性研究生物相容性是指材料与生物体之间相互作用后产生的各种物理、化学、生物等反应。一般状况下, 即材料植入后与人体的相容程度, 对人体组织是否造成毒害作用。早期研究报道使用未脱胶的丝线(virgin silk) 会引起I型变态反应的发生, 严重时引起哮喘[51]和血清IgE水平[52]的升高。这是由于未脱胶丝线中的外围成分丝胶引起T细胞介导的变态反应, 而丝素蛋白本身并不会引起IgE水平的增高[4, 53]。继而临床上出现了脱胶后用蜡或硅树脂作为涂层的黑色编织丝线, 改良后的脱胶丝线不仅有出色的力学性能且不引起免疫反应, 是眼科手术、血管手术等手术中的常用缝线。
高分子纳米材料的生物相容性、生物安全性和作为材料能否应用于生物医药用途的重要因素已被广泛讨论[54]。丝素蛋白作为天然高分子纤维蛋白, 降解产物无不良反应, 植入机体或动物组织中无潜在安全危害, 无炎症现象等免疫应激反应, 与细胞、组织有良好的生物相容性。由于出色的安全性, 丝素蛋白成为了极具研究潜力的生物材料, 现已被制成丝素蛋白纤维、丝素蛋白膜、纳米粒、水凝胶等多种形式材料。这些材料的生物安全性研究均表明了丝素蛋白具有良好生物相容性, 并未引起异物反应(foreign body response)[27]。Panilaitis等[55]实验研究了丝素蛋白纤维在体外并不刺激巨噬细胞释放肿瘤坏死因子, 反而可能存在一定程度的抑菌作用, 呈免疫惰性, 而粒径约20 μm大小的不溶性丝素颗粒在体外却会显著诱导巨噬细胞释放炎性因子, 表明丝素蛋白材料的粒径、形态等理化性质也会影响免疫反应的发生。Meinel等[56]的体内研究实验表明, 小鼠体内植入6周后, 丝素蛋白膜的免疫炎性反应明显小于同类型的丝素蛋白胶原膜与聚乳酸膜; Wang等[57]同样发现丝素蛋白骨架在小鼠体内1年, 仅表现出小范围的宿主免疫反应。以上材料均表明丝素蛋白的生物相容性在目前应用的生物材料中具有很大的优势。
3.2 丝素蛋白的生物相容性研究方法丝素蛋白已被反复证实是安全无毒的生物材料, 但其衍生化材料及药物递送系统为多体系的融合, 体系越多带来更多潜在毒性作用的可能。纳米材料的实验研究如需进一步转化为临床应用, 发展的最大阻碍为材料的生物相容性研究。因而, 研究丝素蛋白材料的毒性反应也即生物相容性便尤为重要。生物相容性实验可分为细胞、组织、血液相容性实验三大类。
细胞相容性即细胞毒性, 一般需进行体外细胞培养, 观察细胞生长形态, 计算细胞存活率。如Zadegan等[58]将丝素蛋白与羟磷灰石(HAP) 结合构建共静电SF-HAP复合材料, 具有良好的机械强度与增强骨细胞相容性的特点。为测定材料的细胞相容性, 首先在SF-HAP材料上接种人成骨样细胞MG-63并培养。继而进行细胞增殖实验, 绝大多数实验采用MTT比色法[58-60], 通过测定吸光度, 求得细胞存活率, 由此证明丝素蛋白无细胞毒性; 也可用激光共聚焦显微镜、扫描电镜进行细胞形态生长观察, 可直观观察细胞有无坏死[61, 62]。Heard等[62]研发出可注射的丝素蛋白-聚乙二醇(PEG) 凝胶生物材料, 将SF-PEG生物材料注射到人宫颈组织中, 利用凝胶的溶胀性与丝素蛋白的机械性能达到避孕效果, 这种机体创伤小且组织相容性好的生物材料有望替代传统的宫颈环扎术。为证实SF-PEG的生物安全性, 在宫颈成纤维细胞上接种SF-PEG材料, 适宜条件下孵育并利用calcein AM和乙啡啶荧光染料对细胞进行染色(calcein AM进入活细胞发绿色荧光, 乙啡啶进入死细胞发红色荧光), 共聚焦显微镜下观察到宫颈成纤维细胞形态良好且发绿色荧光, 表明SF-PEG生物材料有良好的细胞生物相容性; 对于有孔隙的导管类或支架类材料, 也可利用组织切片染色进行细胞在丝素蛋白材料上的渗透性观察[63], 由此不仅验证了细胞相容性, 更得出适宜细胞生长的孔径。
组织相容性研究方面, 相比于细胞相容性研究仅局限于体外环境下, 并未考虑到个体差异性的全面性欠佳研究结果, 组织相容性研究十分必要, 其可体现在丝素材料植入体内并发生降解后, 无法与宿主组织完全分离时的生理状况。对于组织的生物相容性研究十分必要。组织相容性大多在动物体内进行, 便可弥补该方面的不足。Gisbert等[64]将丝素蛋白与透明质酸(HA) 结合构建水凝胶用于神经系统方面治疗, 丝素蛋白可以改善HA的力学性能与生物学性能。HA是广泛存在于大多数组织的细胞外基质中的天然生物材料, 尽管有很高的生物安全性, 但两种材料结合可能会带来潜在的安全毒性, 评价SF-HA水凝胶的生物安全性依旧十分重要。Gisbert团队将丝素蛋白材料注入小鼠皮下, 可初步观察动物的伤口恢复与愈合状况, 生活习性有无改变, 伤口周围有无炎症反应发生, 有无反应性肉芽生成等。进而通过组织切片HE染色观察一定时间后材料的降解状况以及免疫反应如炎症等发生情况, 来评估材料的组织相容性。SF-HA水凝胶植入1周后可观察到中等程度的免疫应答, 周围的纤维囊清晰可见, 这是生物材料植入后的典型反应; 4周后已观察到免疫应答的降低, 粒细胞数减少且存在更多的巨噬细胞, 逐渐生成新的血管外基质; 最终在植入8周后, 免疫应答急剧下降, SF-HA凝胶被完全吸收, 纤维囊消失, 粒细胞和巨噬细胞几乎消失。这与丝素蛋白体内酶降解实验类似[64, 65]; 细胞相容性与组织相容性两者在考察材料安全性实验方面使用非常普遍。
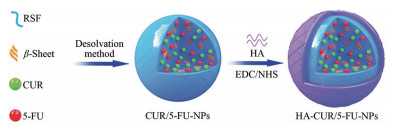
血液相容性实验可代表许多常用的医疗器械如导管、体外循环系统和血管内移植物等与循环血接触时的情况。对此类医疗器械的血液相容性评价研究已非常普遍, 如测定溶血和血栓形成的风险。因此对丝素蛋白材料的血液相容性检测十分重要, 血液相容性可通过体外溶血实验评估材料在血液中的生物安全性评级[66, 67]。溶血实验是通过将测试材料直接与血液相接触, 测定释放的血红蛋白量来检测材料的溶血性能[68-70]。如Huang等[71]将姜黄素(CUR) 和氟尿嘧啶(5-FU) 共装载到基于重组丝素蛋白的NPs中, 后用HA进行表面功能化, 用于乳腺癌的多药联合靶向递送(图 3)。
|
Figure 3 Schematic illustration of the fabrication process of HA-CUR/5-FU-NPs. Adapted from Ref. 71 with permission. Copyright © 2021 Nanoscale. RSF: Regenerated silk fibroin; CUR: Curcumin; 5-FU: 5-Fluorouracil; HA: Hyaluronic acid |
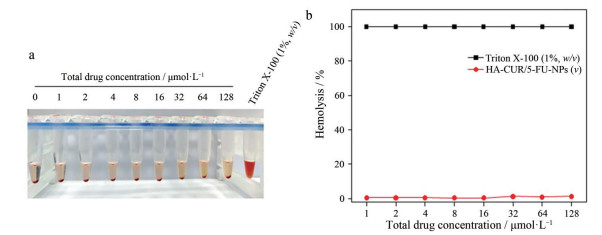
为测定递送系统的血液相容性, 计算梯度浓度的HA-CUR/5-FU-NPs的溶血率。溶血率= (待测样品A均值- 阴性对照A均值)/(阳性对照A均值- 阴性对照A均值)。采用未处理的红细胞悬液作为阴性对照, 以Triton X-100处理的红细胞悬液(1.0%, w/v) 作为阳性对照(图 4), 一般认为, 毒性越大的材料所造成的溶血程度越大, 可提示材料具有细胞毒性。材料溶血率小于5%说明材料符合医用材料的溶血实验要求, 确保材料的生物相容性要求是进一步应用研究与临床转化的基础[72]。
|
Figure 4 In vitro hemocompatibility of NPs. Photograph (a) and hemolytic analysis (b) of erythrocyte suspensions with different treatments at various total drug concentrations. Adapted from Ref. 71 with permission. Copyright © 2021 Nanoscale |
目前丝素蛋白已作为备受关注的新型药物递送载体应用于脂质体、纳米粒、微球、膜剂、透皮微针、刺激响应性原位凝胶剂等方面。随着国内外学者对丝素蛋白材料的深入研究, 发现基于丝素蛋白的纳米药物递送系统具有特殊的pH/H2O2/GSH响应能力, 最终导致特定药物在疾病环境中释放。Huang等[71]利用HA在乳腺癌CD44的靶向性、再生丝素基纳米颗粒的环境响应性, 作为抗肿瘤药物CUR与5-FU的递送系统, 靶向治疗乳腺癌及其转移。合成的HA-CUR/5-FU-NPs不仅具有理想粒径、优异的胶体稳定性, 更具有pH/H2O2/GSH/透明质酸酶响应的药物释放能力, 使药物在特定疾病环境中释放, 极大地减轻传统化疗药物带来的不良反应, 延长患者生存期, 为癌症等疾病治疗提供了新思路。除了小分子药物的传递, 蛋白质、生长因子、多肽和基因等生物分子的传递也是生物医学应用的重要领域。
丝素蛋白除应用于药物递送系统外, 生物组织材料方面的重要应用是骨组织再生支架, 丝素蛋白在体内的生物相容性、机械强度、非免疫原性、可调节降解和多重修饰性是非常有利的特点。Cacciotti[73]研究了丝素蛋白/羟基磷灰石复合材料, 在SF/HAp体系中, HAp是一种脆性成骨生物陶瓷, SF具有理想的弹性和柔韧性, 结合生成陶瓷/聚合物杂化结构, 在结构上与天然骨非常相似, 有望用作骨成分生物材料。SF/HAp系统通过刺激成骨细胞的增殖、黏附和分化, 诱导成骨和血管生成, 从而实现有效的骨再生。SF/HAp系统可制成3D支架、可注射水凝胶、薄膜或纳米粒加固支架。
天然聚合物有不可避免的局限性, 难以控制其结构和分子质量; 目前丝素蛋白的研究局限在实验室的小批量精制生产, 进一步应用需在适当的动物模型和临床上进行大量临床前实验; 丝素蛋白的应用从传统丝线到如今的基础生物医药研究, 乃至扩展到临床实践, 更期待于在产业中大规模应用。相信新的“丝绸之路”可将旧纺织行业与未来生物医药行业连接起来, 带来前所未有的创新机遇。
丝素蛋白具有生物可降解性与良好的生物相容性, 表现出无细胞毒性、抗原性低和非炎症特性等优良特点, 可作为纳米粒、丝素膜、水凝胶、缓释制剂等多种递药系统增加药物递送效率。但成熟的工业化分离、精制方法与产品仍较少见, 且尚无发达国家药典标准收载本品种。因此, 在本品广泛应用于临床前仍需开展大量基础与应用研究。
作者贡献: 程佳玲、叶军、王洪亮、杨艳芳、陈智洋、周航、刘玉玲共同参与文章的撰写及修改。
利益冲突: 所有作者声明没有利益冲突。
| [1] |
Zhang X, Liu Y, Zuo Q, et al. 3D bioprinting of biomimetic bilayered scaffold consisting of decellularized extracellular matrix and silk fibroin for osteochondral repair[J]. Int J Bioprint, 2021, 7: 85-98. |
| [2] |
Parkes M, Myant C, Dini D, et al. Tribology-optimised silk protein hydrogels for articular cartilage repair[J]. Tribol Int, 2015, 89: 9-18. DOI:10.1016/j.triboint.2014.11.024 |
| [3] |
Xu HL, Chen PP, Zhuge DL, et al. Liposomes with silk fibroin hydrogel core to stabilize bFGF and promote the wound healing of mice with deep second-degree scald[J]. Adv Healthc Mater, 2017, 6: 1700344. DOI:10.1002/adhm.201700344 |
| [4] |
Suyamud C, Phetdee C, Jaimalai T, et al. Silk fibroin-coated liposomes as biomimetic nanocarrier for long-term release delivery system in cancer therapy[J]. Molecules, 2021, 26: 4936-4946. DOI:10.3390/molecules26164936 |
| [5] |
Rezaei F, Damoogh S, Reis RL, et al. Dual drug delivery system based on pH-sensitive silk fibroin/alginate nanoparticles entrapped in PNIPAM hydrogel for treating severe infected burn wound[J]. Biofabrication, 2020, 13: 015005. |
| [6] |
Liu YK, Fan JC, Lv MQ, et al. Photocrosslinking silver nanoparticles-aloe vera-silk fibroin composite hydrogel for treatment of full-thickness cutaneous wounds[J]. Regen Biomater, 2021, 8: rbab048. DOI:10.1093/rb/rbab048 |
| [7] |
Huang X, Fu Q, Deng YX, et al. Surface roughness of silk fibroin/alginate microspheres for rapid hemostasis in vitro and in vivo[J]. Carbohyd Polym, 2021, 253: 117256. DOI:10.1016/j.carbpol.2020.117256 |
| [8] |
Han L, Xu NW, Lv SW, et al. Enhanced in vitro and in vivo efficacy of alginate/silk protein/hyaluronic acid with polypeptide microsphere delivery for tissue regeneration of articular cartilage[J]. J Biomed Nanotechnol, 2021, 17: 901-909. DOI:10.1166/jbn.2021.3071 |
| [9] |
Gough CR, Hu X. Air-spun silk-based micro-/nanofibers and thin films for drug delivery[J]. Int J Mol Sci, 2021, 22: 9588-9609. DOI:10.3390/ijms22179588 |
| [10] |
Wu QT, He CH, Wang XC, et al. Sustainable antibacterial surgical suture using a facile scalable silk-fibroin-based berberine loading system[J]. ACS Biomater Sci Eng, 2021, 7: 2845-2857. DOI:10.1021/acsbiomaterials.1c00481 |
| [11] |
Hong H, Zhang D, Lin S, et al. Green electrospun silk fibroin nanofibers loaded with cationic ethosomes for transdermal drug delivery[J]. Chem Res Chin Univ, 2021, 37: 488-495. DOI:10.1007/s40242-021-1084-8 |
| [12] |
Wu H, Liu S, Xiao L, et al. Injectable and pH-responsive silk nanofiber hydrogels for sustained anticancer drug delivery[J]. ACS Appl Mater Interfaces, 2016, 8: 17118-17126. DOI:10.1021/acsami.6b04424 |
| [13] |
Numata K, Kaplan DL. Silk-based delivery systems of bioactive molecules[J]. Adv Drug Deliv Rev, 2010, 62: 1497-1508. DOI:10.1016/j.addr.2010.03.009 |
| [14] |
Liu H, Ge Z, Wang Y, et al. Modification of sericin-free silk fibers for ligament tissue engineering application[J]. J Biomed Mater Res B Appl Biomater, 2007, 82: 129-138. |
| [15] |
Inoue S, Tanaka K, Arisaka F, et al. Silk fibroin of Bombyx mori is secreted, assembling a high molecular mass elementary unit consisting of H-chain, L-chain, and P25, with a 6: 6: 1 molar ratio[J]. J Biol Chem, 2000, 275: 40517-40528. DOI:10.1074/jbc.M006897200 |
| [16] |
Nguyen AT, Huang QL, Yang Z, et al. Crystal networks in silk fibrous materials: from hierarchical structure to ultra performance[J]. Small, 2015, 11: 1039-1054. DOI:10.1002/smll.201402985 |
| [17] |
Lammel AS, Hu X, Park SH, et al. Controlling silk fibroin particle features for drug delivery[J]. Biomaterials, 2010, 31: 4583-4591. DOI:10.1016/j.biomaterials.2010.02.024 |
| [18] |
Johari N, Moroni L, Samadikuchaksaraei A. Tuning the conformation and mechanical properties of silk fibroin hydrogels[J]. Eur Polym J, 2020, 134: 109842-109856. DOI:10.1016/j.eurpolymj.2020.109842 |
| [19] |
Dang TT, Chen AZ, Wang SB. Research progress of silk fibroin microsphere as sustained-release carrier of drug[J]. Chem Ind Eng Prog (化工进展), 2012, 31: 1587-1591, 1596. |
| [20] |
Terry AE, Knight DP, Porter D, et al. pH induced changes in the rheology of silk fibroin solution from the middle division of Bombyx mori silkworm[J]. Biomacromolecules, 2004, 5: 768-772. DOI:10.1021/bm034381v |
| [21] |
Cao Y, Wang BC, Chi SP, et al. Silk fibroin used as a drug delivery material[J]. Chin J Tissue Eng Res (中国组织工程研究), 2009, 13: 1533-1536. |
| [22] |
Tu H. Preparation and Characterization of Wool Keratin/Silk Fibroin Composite Films (基于羊毛角蛋白/丝素蛋白复合膜的制备及其性能表征) [D]. Shanghai: Donghua University, 2017.
|
| [23] |
Yang LQ, Yang D, Meng S, et al. Research progress of silk fibroin as drug sustained-release carrier[J]. Chin Med Biotecbnol (中国医药生物技术), 2009, 4: 449-451. |
| [24] |
He ZQ. Drug sustained-release dissolution and decomposition of silk fibroin porous gel[J]. Mod Silk Sci Techno (现代丝绸科学与技术), 1999, 2: 24-29. |
| [25] |
Min SJ, Hu ZW. Research on drug absorption and releasing function of fibroin and its control[J]. Chin J Biomed Eng (中国生物医学工程学报), 2002, 21: 361-366. |
| [26] |
Xie X, Zheng Z, Wang X, et al. Low-density silk nanofibrous aerogels: fabrication and applications in air filtration and oil/water purification[J]. ACS Nano, 2021, 15: 1048-1058. DOI:10.1021/acsnano.0c07896 |
| [27] |
Altman GH, Diaz F, Jakuba C, et al. Silk-based biomaterials[J]. Biomaterials, 2003, 24: 401-416. DOI:10.1016/S0142-9612(02)00353-8 |
| [28] |
Wang Y, Zheng Z, Cheng Q, et al. Ductility and porosity of silk fibroin films by blending with glycerol/polyethylene glycol and adjusting the drying temperature[J]. ACS Biomater Sci Eng, 2020, 6: 1176-1185. DOI:10.1021/acsbiomaterials.9b01567 |
| [29] |
Wendt H, Hillmer A, Reimers K, et al. Artificial skin-culturing of different skin cell lines for generating an artificial skin substitute on cross-weaved spider silk fibres[J]. PLoS One, 2017, 6: e21833. |
| [30] |
Xu M, Pradhan S, Agostinacchio F, et al. Easy, scalable, robust, micropatterned silk fibroin cell substrates[J]. Adv Mater Interfaces, 2019, 6: 1801822. DOI:10.1002/admi.201801822 |
| [31] |
Arai T, Freddi G, Innocenti R, et al. Biodegradation of Bombyx mori silk fibroin fibers and films[J]. J Appl Polym Sci, 2004, 91: 2383-2390. DOI:10.1002/app.13393 |
| [32] |
Gou S, Chen N, Wu X, et al. Multi-responsive nanotheranostics with enhanced tumor penetration and oxygen self-producing capacities for multimodal synergistic cancer therapy [J]. Acta Pharm Sin B, 2021. DOI: 10.1016/j.apsb.2021.07.001.
|
| [33] |
Gou S, Xie D, Ma Y, et al. Injectable, thixotropic, and multiresponsive silk fibroin hydrogel for localized and synergistic tumor therapy[J]. ACS Biomater Sci Eng, 2020, 6: 1052-1063. DOI:10.1021/acsbiomaterials.9b01676 |
| [34] |
Nair LS, Laurencin CT. Biodegradable polymers as biomaterials[J]. Prog Polym Sci, 2007, 32: 762-798. DOI:10.1016/j.progpolymsci.2007.05.017 |
| [35] |
Joung JA, Park MN, You JY, et al. Application of food-grade proteolytic enzyme for the hydrolysis of regenerated silk fibroin from Bombyx mori[J]. J Chem, 2018, 2018: 1285823. |
| [36] |
Li MZ, Ogiso M, Minoura M. Enzymatic degradation behavior of porous silk fibroin sheets[J]. Biomaterials, 2003, 24: 357-365. DOI:10.1016/S0142-9612(02)00326-5 |
| [37] |
Wang F, Zhang YQ. Bioconjugation of silk fibroin nanoparticles with enzyme and peptide and their characterization[J]. Adv Protein Chem Struct Biol, 2015, 98: 263-291. |
| [38] |
Horan RL, Antle K, Collette AL, et al. In vitro degradation of silk fibroin[J]. Biomaterials, 2005, 26: 3385-3393. DOI:10.1016/j.biomaterials.2004.09.020 |
| [39] |
Kurioka A, Yamazaki M, Hirano H. Primary structure and possible functions of a trypsin inhibitor of Bombyx mori[J]. Eur J Biochem, 1999, 259: 120-126. DOI:10.1046/j.1432-1327.1999.00030.x |
| [40] |
Soong HK, Kenyon KR. Adverse reactions to virgin silk sutures in cataract surgery[J]. Ophthalmology, 1984, 91: 479-483. DOI:10.1016/S0161-6420(84)34273-7 |
| [41] |
Salthouse TN, Matlaga BF, Wykoff MH. Comparative tissue response to six suture materials in rabbit cornea, sclera, and ocular muscle[J]. Am J Ophthalmol, 1977, 84: 224-233. DOI:10.1016/0002-9394(77)90856-X |
| [42] |
Rossitch E, Bullard DE, Oakes WJ. Delayed foreign-body reaction to silk sutures in pediatric neurosurgical patients[J]. Child Nerv Syst, 1987, 3: 375-378. DOI:10.1007/BF00270712 |
| [43] |
Greenwald D, Shumway S, Albear P, et al. Mechanical comparison of 10 suture materials before and after in vivo incubation[J]. J Surg Res, 1994, 56: 372-377. DOI:10.1006/jsre.1994.1058 |
| [44] |
Bucknall TE, Teare L, Ellis H. The choice of a suture to close abdominal incisions[J]. Eur Surg Res, 1983, 15: 59-66. |
| [45] |
Kojthung A, Meesilpa P, Sudatis B, et al. Effects of gamma radiation on biodegradation of Bombyx mori silk fibroin[J]. Int Biodeterior Biodegrad, 2008, 62: 487-490. DOI:10.1016/j.ibiod.2007.12.012 |
| [46] |
Zhao YH. Degradation Behaviors of Nerve Guidance Conduits Made Up of Silk Fibroin In Vitro and In Vivo (丝素蛋白导管体内外降解行为的研究) [D]. Nantong: Nantong University, 2009.
|
| [47] |
Baran ET, Tuzlakoglu K, Mano JF, et al. Enzymatic degradation behavior and cytocompatibility of silk fibroin-starch-chitosan conjugate membranes[J]. Mater Sci Eng C Mater Biol Appl, 2012, 32: 1314-1322. DOI:10.1016/j.msec.2012.02.015 |
| [48] |
Maziz A, Leprette O, Boyer L, et al. Tuning the properties of silk fibroin biomaterial via chemical cross-linking[J]. Eur Polym J, 2018, 4: 65012-65036. |
| [49] |
Panda N, Biswas A, Sukla LB, et al. Degradation mechanism and control of blended eri and tasar silk nanofiber[J]. Appl Biochem Biotechnol, 2014, 174: 2403-2412. DOI:10.1007/s12010-014-1151-4 |
| [50] |
Xu Z, Qiu W, Fan X, et al. Stretchable, stable, and degradable silk fibroin enabled by mesoscopic doping for finger motion triggered color/transmittance adjustment[J]. ACS Nano, 2021, 15: 12429-12437. DOI:10.1021/acsnano.1c05257 |
| [51] |
Wen CM, Ye ST, Zhou LX, et al. Silk-induced asthma in children: a report of 64 cases[J]. Ann Allergy, 1990, 65: 375-378. |
| [52] |
Kurosaki S, Otsuka H, Kunitomo M, et al. Fibroin allergy IgE mediated hypersensitivity to silk suture materials[J]. J Nippon Med Sch, 1999, 66: 41-44. DOI:10.1272/jnms.66.41 |
| [53] |
Wang Y, Yao D, Li L, et al. Effect of electrospun silk fibroin-silk sericin films on macrophage polarization and vascularization[J]. ACS Biomater Sci Eng, 2020, 6: 3502-3512. DOI:10.1021/acsbiomaterials.0c00175 |
| [54] |
Xiang C, Zhang Y, Guo W, et al. Biomimetic carbon nanotubes for neurological disease therapeutics as inherent medication[J]. Acta Pharm Sin B, 2020, 10: 239-248. DOI:10.1016/j.apsb.2019.11.003 |
| [55] |
Panilaitis B, Altman GH, Chen J, et al. Macrophage responses to silk[J]. Biomaterials, 2003, 24: 3079-3085. DOI:10.1016/S0142-9612(03)00158-3 |
| [56] |
Meinel L, Hofmann S, Karageorgiou V, et al. The inflammatory responses to silk films in vitro and in vivo[J]. Biomaterials, 2005, 26: 147-155. DOI:10.1016/j.biomaterials.2004.02.047 |
| [57] |
Wang Y, Rudym DD, Walsh A, et al. In vivo degradation of three-dimensional silk fibroin scaffolds[J]. Biomaterials, 2008, 29: 3415-3428. DOI:10.1016/j.biomaterials.2008.05.002 |
| [58] |
Zadegan S, Vahidi B, Nourmohammadi J, et al. Biocompatibility and bioactivity behaviour of coelectrospun silk fibroin‐hydroxyapatite nanofibres using formic acid[J]. Micro Nano Lett, 2018, 13: 709-713. DOI:10.1049/mnl.2018.0047 |
| [59] |
Wang D, Wang L, Lou Z, et al. Biomimetic, biocompatible and robust silk Fibroin-MXene film with stable 3D cross-link structure for flexible pressure sensors[J]. Nano Energy, 2020, 78: 105252. DOI:10.1016/j.nanoen.2020.105252 |
| [60] |
Shen L, Guo L, Chen S, et al. Self-assembly of silica spheres on silk fibroin spheres for synthesis of porous hollow silica spheres and their in vitro biocompatibility and drug delivery property[J]. J Non Cryst Solids, 2019, 522: 119557. DOI:10.1016/j.jnoncrysol.2019.119557 |
| [61] |
Guo X, Lin N, Lu S, et al. Preparation and biocompatibility characterization of silk fibroin 3D scaffolds[J]. ACS Appl Bio Mater, 2021, 4: 1369-1380. DOI:10.1021/acsabm.0c01239 |
| [62] |
Heard AJ, Socrate S, Burke KA, et al. Silk-based injectable biomaterial as an alternative to cervical cerclage: an in vitro study[J]. Reprod Sci, 2013, 20: 929-936. DOI:10.1177/1933719112468952 |
| [63] |
Huang L. Preparation, Structures and Properties of Silk Fibroin Based Biomimetic Tissue Engineering Scaffolds (丝素蛋白仿生组织工程支架的成型、结构与性能研究) [D]. Shanghai: Donghua University, 2020.
|
| [64] |
Gisbert Roca F, Lozano Picazo P, Pérez-Rigueiro J, et al. Conduits based on the combination of hyaluronic acid and silk fibroin: characterization, in vitro studies and in vivo biocompatibility[J]. Int J Biol Macromol, 2020, 148: 378-390. DOI:10.1016/j.ijbiomac.2020.01.149 |
| [65] |
Xie H, Wang J, He Y, et al. Biocompatibility and safety evaluation of a silk fibroin-doped calcium polyphosphate scaffold copolymer in vitro and in vivo[J]. RSC Adv, 2017, 7: 46036-46044. DOI:10.1039/C7RA04999D |
| [66] |
Moraes ML, Lima LR, Vicentini-Oliveira JC, et al. Immunosensor for the diagnostics of autoimmune hemolytic anemia (AIHA) based on immobilization of a monoclonal antibody on a layer of silk fibroin[J]. J Nanosci Nanotechnol, 2019, 19: 3772-3776. DOI:10.1166/jnn.2019.16305 |
| [67] |
Yin GB, Zhang YZ, Wang SD, et al. Study of the electrospun PLA/silk fibroin-gelatin composite nanofibrous scaffold for tissue engineering[J]. J Biomed Mater Res A, 2010, 93: 158-163. |
| [68] |
Deng AH. Fabrication of the SF/PLLA Compound Tissue Engineering Scaffolds by Supercritical Fluids Technology (超临界流体技术制备丝素/聚乳酸复合组织工程支架的研究) [D]. Quanzhou: Huaqiao University, 2013.
|
| [69] |
Gou SQ. Application of Silk Fibroin-based Multifunctional Nanomedicine in the Treatment of Ulcerative Colitis (基于丝素蛋白的多功能纳米药物在溃疡性结肠炎治疗中的应用) [D]. Chongqing: Southwest University, 2020.
|
| [70] |
Gou S, Huang Y, Wan Y, et al. Multi-bioresponsive silk fibroin-based nanoparticles with on-demand cytoplasmic drug release capacity for CD44-targeted alleviation of ulcerative colitis[J]. Biomaterials, 2019, 212: 39-54. DOI:10.1016/j.biomaterials.2019.05.012 |
| [71] |
Huang Y, Xie D, Gou S, et al. Quadruple-responsive nanoparticle-mediated targeted combination chemotherapy for metastatic breast cancer[J]. Nanoscale, 2021, 13: 5765-5779. DOI:10.1039/D0NR08579K |
| [72] |
Luo Z, Dai Y, Gao H. Development and application of hyaluronic acid in tumor targeting drug delivery[J]. Acta Pharm Sin B, 2019, 9: 1099-1112. DOI:10.1016/j.apsb.2019.06.004 |
| [73] |
Cacciotti I. Multisubstituted hydroxyapatite powders and coatings: the influence of the codoping on the hydroxyapatite performances[J]. Int J Appl Ceram Technol, 2019, 16: 1864-1884. DOI:10.1111/ijac.13229 |
 2022, Vol. 57
2022, Vol. 57


