2. 清华大学化学工程系生物化工研究所, 北京 100084;
3. 工业生物催化教育部重点实验室, 北京 100084;
4. 深圳湾实验室医药健康技术与工程研究所, 广东 深圳 518055;
5. 清华大学合成与系统生物学中心, 北京 100084
2. Institute of Biochemical Engineering, Department of Chemical Engineering, Tsinghua University, Beijing 100084, China;
3. MOE Key Laboratory for Industrial Biocatalysis, Beijing 100084, China;
4. Institute of Biomedical Health Technology and Engineering, Shenzhen Bay Laboratory, Shenzhen 518055, China;
5. Center for Synthetic and Systems Biology, Tsinghua University, Beijing 100084, China
肠道是人体消化系统中最重要的组成部分之一。结肠作为肠道的近末端组织, 其结构、功能和菌群内环境均具有高度复杂性和多样性, 为结肠疾病的研究和治疗带来巨大挑战。炎症性肠病(inflammatory bowel disease)、肠易激综合征(irritable bowel syndrome) 和结直肠癌(colorectal cancer) 等是临床常见的复杂肠道疾病[1-3]。溃疡性结肠炎(ulcerative colitis) 是炎症性肠病的主要疾病类型之一, 由于其诱发因素众多, 发病机制尚不明晰, 临床治疗困难且易复发, 被世界卫生组织认定为现代难治病之一[3-5]。目前临床常用治疗药物如非甾体类抗炎药物和皮质类固醇等具有不良反应大、药物利用率低及适用患者受限等问题。久治不愈的结肠炎易诱发世界第三大常见癌症结直肠癌[1], 据统计, 每年世界范围内有超过185万人被新确诊为结直肠癌患者, 超过85万人因结直肠癌失去生命[6]。目前临床针对结直肠癌的药物包括5-氟尿嘧啶(5-fluorouracil)、亚叶酸钙(leucovorin)、伊立替康(irinotecan)、奥沙利铂(oxaliplatin) 和卡培他滨(capecitabine) 等, 而这些药物大多成本高昂且不良反应大[7]。
近年来, 面向精准给药的药物制剂化研究使上述问题有望得到解决, 在现有治疗药物的基础上研发治疗结肠疾病的新型药剂化策略具有重要的社会意义和经济价值。其中, 靶向药物递送体系具有精准给药、提高生物利用度和降低不良反应等功能, 是开发适用于结肠疾病的新型药物制剂最为可行的方向之一。靶向药物递送分为注射给药型与口服给药型两类。口服给药具有便捷性, 患者接受度高, 可沿消化道抵达肠道患部; 而注射给药操作复杂且要求更高, 会造成二次医疗垃圾, 且易引发全身系统性不良反应, 因此口服是治疗结肠疾病的首选给药方式。在口服靶向给药体系中, 递送材料的选择直接决定了靶向递送效果。常见的聚酯、聚乙烯醇和聚丙烯酸等高分子递送材料由于缺乏靶向性及响应性, 不能完全满足口服药物治疗结肠疾病的需求[8-12]。相比之下, 利用多糖材料构建结肠靶向药物递送体系因其更优异且契合需求的药物递送能力获得了更多关注。
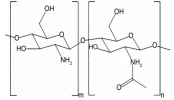
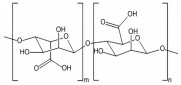
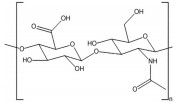
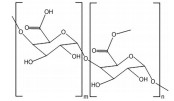
多糖是一类由单糖结构通过糖苷键连接形成的生物大分子, 具有原料来源广泛、生物安全性高、成本低及易于功能化修饰等优点, 在针对结肠疾病的靶向递送体系开发中具有独特的应用优势和潜力。在原料来源上, 多糖可从各类动植物和微生物中广泛获取[13]。比如, 从藻类中可获得海藻酸(alginate)、卡拉胶(carrageenan), 从植物中可获得淀粉(starch)、纤维素(cellulose)、果胶(pectin)、瓜尔胶(guar gum), 从微生物中可提取环糊精(cyclodextrin)、黄原胶(xanthan gum)、右旋糖酐(dextran) 和普鲁兰多糖(pullulan), 以及从动物来源可获得壳聚糖(chitosan)、透明质酸(hyaluronan)、肝素(heparin) 和硫酸软骨素(chondroitin sulfate) 等[13-15]。在生物安全性方面, 大多数多糖都存在于人体摄入食物中, 具备优异的生物相容性, 在医药及食品领域已有成功应用案例[16-19]。例如, 果胶是一种常见的食品增稠剂[20], 壳聚糖可发挥抗菌作用而被美国食品药品监督管理局(Food and Drug Administration, FDA) 批准用作伤口敷料[21], 肝素是临床一线抗凝血药物[22], 透明质酸可用于制备注射用水凝胶和构建可降解支架[23]。在材料功能方面, 多糖具有作为递送材料所需的物理加工性、化学修饰性和丰富的生物学活性。基于多糖可设计出多种不同结构和不同功能的药物递送体系, 有效应对消化道复杂环境[24]。同时, 多种多糖能与人体内蛋白相结合[25], 识别细胞膜和细胞器膜表面多种特异性受体[26], 参与各类信号通路的信号识别传导过程, 对免疫反应[27]、细胞迁移和增殖[28]等生理过程具有调控作用, 能实现结肠特定细胞靶向、病灶部位药物精准递送和协同治疗等功能。因此, 基于多糖特性研发口服靶向药物递送体系是提高结肠疾病治疗效果的有效策略。部分常用于构建结肠靶向药物递送体系的多糖如表 1[13, 21, 23, 29-35]所示。
| Table 1 Polysaccharides mainly explored for colon-targeted drug delivery systems |
近年来, 基于多糖的口服靶向药物递送体系得到广泛研究和报道, 充分展现了多糖作为药物递送材料的广阔应用潜力。本文基于口服多糖靶向药物递送体系的特点, 综述了近年口服多糖靶向药物递送体系在治疗结肠疾病中的应用研究进展, 并重点介绍其结构与功能的对应关系, 探讨其未来发展方向, 为基于多糖的口服靶向型药物递送体系的构建提供参考。
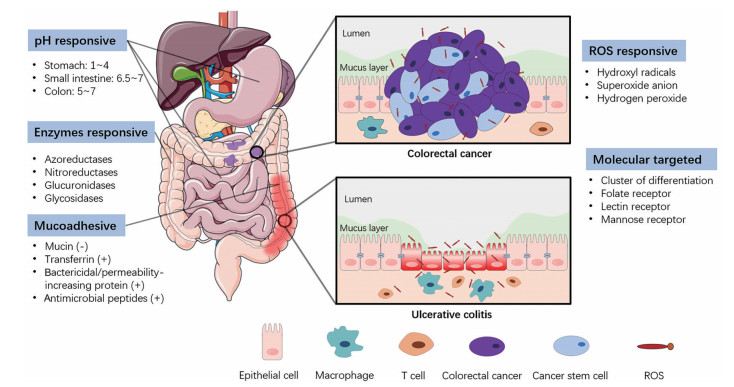
1 结肠靶向递送设计原理人体结肠疾病部位与其他部位的环境差异性是设计结肠靶向递送的主要理论依据[36]。结肠疾病环境的特点主要体现在结肠本身的宏观环境和病灶部位微环境两方面。结肠本身的宏观环境特性包括结肠段pH值、结肠停留时间、肠道内部压力及肠道微生物等[8]; 由结肠疾病产生的微环境特征包括免疫细胞类型及分布、局部氧化应激及肠上皮黏膜屏障的变化等[37]。依据上述环境特点设计的结肠靶向递送策略主要包括pH响应、微生物酶响应、活性氧响应、肠黏膜吸附富集及特定细胞受体分子靶向等(图 1)。
|
Figure 1 Design principles for colon-targeted drug delivery systems. ROS: Reactive oxygen species |
pH响应的实现依赖于人体消化道各部位的pH值差异, 正常状态下食道pH值约为5.0~7.0, 胃部pH值约为1.0~4.0, 小肠pH值约为6.5~7.2, 结肠pH值约为5.0~7.0[24]。经口服进入结肠的停留时间可达20 h, 载药体系有充足时间对结肠pH环境产生响应, 从而实现pH控释。多糖的溶解性及带电荷性均易受到pH值影响, 因此被广泛用于pH响应型肠道药物递送体系的构建。该型响应机制的应用技术较为成熟[38, 39], 但需指出的是, 小肠与结肠pH环境差异较小, 且病患的肠胃pH环境波动幅度较大, 变化趋势因人而异[40]。因此, 单一pH响应型控释的结肠药物递送准确性尚有欠缺。
微生物酶响应的实现依赖于肠道菌群的酶代谢过程。结肠菌群多为厌氧型菌群, 参与机体消化分解食物的过程, 在维持肠道稳态中起重要作用。结肠菌群酶分泌物主要包括偶氮还原酶(azoreductases)、硝基还原酶(nitroreductases)、葡糖醛酸糖苷酶(glucuronidases)、糖苷酶(glycosidases)、酯酶(esterases) 和酰胺酶(amidases) 等[41]。大多数在结肠生存的厌氧菌需通过分解多糖来满足其对能源物质的获取需求[8, 42]。因此, 各类多糖及其衍生物具备结肠特异性降解的特点。
活性氧(reactive oxygen species, ROS) 响应依赖于疾病部位强氧化性物质对递送体系的降解作用。ROS由细胞中氧化酶代谢产生, 是细胞信号传导和体内稳态调控过程中的关键信号分子[43]。正常情况下ROS水平处于动态平衡状态, 结肠病变部位异常活跃的免疫细胞或癌细胞会产生高浓度ROS破坏平衡, 高浓度ROS会进一步对正常细胞造成损伤并加剧病情。基于多糖构建的ROS敏感型载药体系可具备炎症或肿瘤微环境特异性控释及清除过量ROS的双重功能。
肠黏膜吸附富集的实现依赖于递送体系与黏液层(mucus layer) 之间的交互作用。黏液层是由多种生物大分子参与交联形成的水凝胶结构, 是位于肠黏膜表面的第一道生物学屏障, 正常黏液层厚度为50~200 μm, 孔径为10~200 nm[44]。黏液层内含大量黏蛋白, 黏蛋白上连接有寡糖侧链, 其末端唾液酸和硫酸盐残基等使得黏液层呈负电[44]。一些多糖能通过电荷作用[45, 46]及与黏蛋白间的疏水互作[47, 48]获得黏膜黏附性和穿透性, 从而有效提高被载药物的生物利用率。值得一提的是, 结肠炎溃疡部位肠上皮屏障受损严重, 黏液层稀薄[49], 带正电的转铁蛋白、杀菌/通透性增强蛋白及抗菌肽在该区域富集[50], 导致溃疡部位电荷反转, 使带负电多糖更易富集在溃疡区域。
对特定细胞的受体分子靶向依赖于与目标细胞膜表面受体的特异性结合。结肠部位病变会引起病灶部位细胞表面部分受体表达量与正常部位细胞形成显著性差异, 如受损的结肠上皮细胞、被激活的结肠免疫细胞及结肠癌细胞等表面会过表达CD44、CD98、叶酸受体(folate receptor)、凝集素受体(lectin receptor) 和甘露糖受体(mannose receptor) 等[51]。部分多糖对上述受体分子具备特异性靶向功能, 因此被应用于递送载体的表面修饰。相比于单克隆抗体, 多糖具有便捷、稳定及成本低等显著优势。
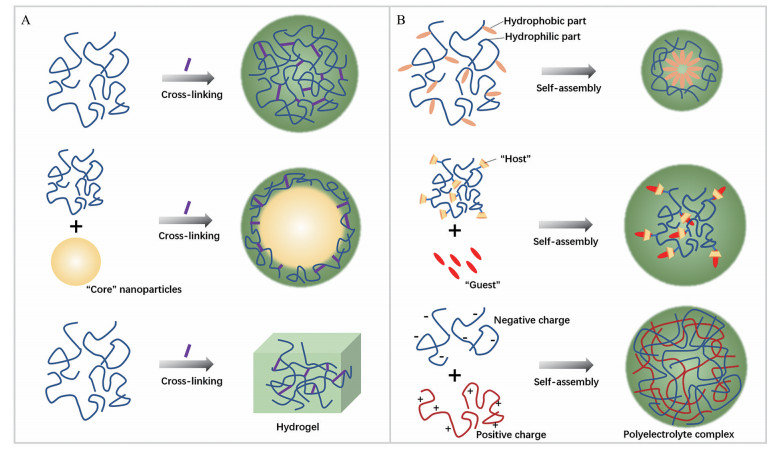
基于以上原理设计的多糖类口服靶向药物递送体系以纳米粒和水凝胶两种形式为主。纳米尺度的粒子具有提高药物分散性、增强药物稳定性、优化药代动力学及促进药物在疾病部位富集[9]等功能。对于结肠靶向递送而言, 纳米粒还具备更好的肠道黏膜屏障穿透性[44]及更高的被巨噬细胞、M细胞等摄取的比率[24, 52]。水凝胶具有高溶胀和高持水三维网状结构, 与生物体组织形态结构类似, 生物相容性优异, 在药物递送、软组织修复及类器官培养等方面已有大量应用[53, 54]。多糖类口服药物递送载体的构建主要依赖于交联和自组装两种方式(图 2), 依据多糖基递送载体的精细结构及功能特点, 本综述将药物递送体系分为交联型纳米粒、自组装型纳米粒及水凝胶3类, 并逐一进行介绍和讨论。
|
Figure 2 Common mechanisms for polysaccharides-based oral drug delivery systems preparation. A: Cross-linking; B: Self-assembly |
交联型纳米粒依赖于共价交联或非共价交联建立大量交联点来获得稳定纳米结构。共价交联是指借助共价键连接形成具备化学稳定性的交联点, 非共价交联一般是借助离子键连接形成一定条件下稳定或动态稳定的离子交联点。部分研究利用多糖大分子骨架上存在的大量反应活性基团, 在交联剂作用下形成交联点, 制备出多种结肠靶向纳米粒[13]。基于多糖分子构建的交联型纳米粒的功能特性与多糖在纳米粒中的组成结构关系密切, 可将其分为以多糖为主体和多糖包覆两大结构类型。
2.1 以多糖为主体型结构用交联剂使多糖大分子之间充分连接可组成以多糖为主体的纳米粒。这类纳米粒主要用于实现纳米递送体系对结肠环境的pH或微生物酶的特异性响应, 优化药代动力学, 实现药物的精准靶向递送与控释。构建主体型交联结构最常用的多糖为壳聚糖和海藻酸钠。
壳聚糖是由几丁质(chitin) 脱乙酰化得到的带正电多糖, 具备对pH环境的敏感性及对黏膜层的穿透性, 因此常被用作结肠靶向药物递送的主体材料。三聚磷酸钠(tripolyphosphate, TPP) 是最常见的壳聚糖交联剂之一, 可用于形成离子交联。在较早的研究中, Dube等[55]在含有(-)-表没食子儿茶素没食子酸酯(epigallocatechin gallate, EGCG) 的壳聚糖水溶液中滴加TPP制备出负载EGCG的壳聚糖纳米粒, 其粒径约为440 nm, zeta电位约为+25 mV。此后, Chuah等[56]同样用TPP离子交联方法制备出负载姜黄素(curcumin) 的壳聚糖纳米粒, 以HT-29细胞系为模型, 验证了其对结肠癌细胞的抑制效果。在此基础上, Alkhader等[57]引入能在胃部环境保持稳定但会被特定结肠菌群降解的果胶多糖, 以TPP交联制备出装载有姜黄素的果胶-壳聚糖复合型纳米粒。借助pH响应性及酶响应性, 有效提高了姜黄素在小鼠结肠部位的释放比率。京尼平(genipin) 是另一种常用的交联剂, 可与壳聚糖形成共价交联点, 相比离子交联更加稳定。Samprasit等[45]采用京尼平作为交联剂, 交联壳聚糖及硫醇化壳聚糖并附加以肠溶材料Eudragit L 100, 形成负载α-倒捻子素(α-mangostin) 的具有pH响应功能及黏膜吸附功能的纳米粒, 该粒子展现出优异的生物安全性及对结肠癌细胞的有效杀伤性。
海藻酸钠是另一种常用的结肠递送主体材料, 这种多糖具备对黏液层的吸附性, 大量羧基使其带负电, 利于其在炎症部位的富集。构建二硫键是一种近年来受到较多关注的用于细胞内给药的交联方式, 硫醇基团能被氧气自然氧化形成二硫键并在胞外环境保持稳定, 进入细胞后, 二硫键在还原反应环境下断裂。Arif等[58]利用1-乙基-(3-二甲基氨基丙基) 碳酰二亚胺(EDC) 和N-羟基琥珀酰亚胺(NHS) 催化的酰胺反应将L-半胱氨酸连接到海藻酸钠羧基上, 通过避光室温氧化24 h形成二硫键交联的海藻酸钠纳米粒。这种纳米粒在体外模拟的胃部环境下能保持低药物释放比例, 而在模拟肠道环境和还原型谷胱甘肽(glutathione) 共同作用下能显著加速释放药物。此外, 二硫键交联的海藻酸钠纳米粒具有比海藻酸钠更高的黏蛋白亲和度, 表明其结肠黏膜附着性得到了提升。Chiu等[59]利用巯基乙酸与海藻酸羧基的酯化反应将海藻酸硫醇化, 通过室温避光氧化方式形成二硫键交联的海藻酸钠纳米粒。该纳米递送体系表面修饰有麦胚凝集素以提供靶向性, 负载药物为多西紫杉醇(docetaxel)。经体外实验验证, 该黏膜吸附性纳米粒具备优异的pH及胞内还原环境响应性。
2.2 多糖包覆型结构表面包覆是指多糖以包覆层的形式存在于载药体系表面, 是常见的将多糖本身的功能特性与其他材料结合的方式, 以期实现对纳米粒本体的功能化, 兼顾主体材料特性和被修饰多糖特性[60]。
表面修饰多糖是可行的实现受体分子靶向递送的方式。众所周知, 聚-(乳酸-羟基乙酸)共聚物[poly(lactic-co-glycolic acid), PLGA] 是最受关注的聚酯类药物递送材料之一, 优异的安全性使其成为了众多靶向递送体系的首选, 但是单一的PLGA材料不具备结肠环境响应性。CD44分子是非激酶单跨膜糖蛋白家族成员, 与细胞的黏附迁移功能相关, 在各类肿瘤细胞[61]及炎症激活状态下的巨噬细胞[31]表面过表达, 研究表明, 透明质酸能特异性靶向CD44分子[23]。因此, Xu等[62]以多重乳化法制备装载BMI-1抑制剂的端氨基PLGA纳米粒, 在EDC/NHS催化下将透明质酸修饰至纳米粒表面来构建功能化PLGA载药纳米粒。这种多糖包覆纳米粒的粒径约为232 nm, 表面带负电荷。结果表明, 透明质酸修饰能使NPs被CT-26摄取的比例提高两个数量级以上, 更有效地抑制了CT26细胞的增殖和迁移(图 3)。在体内实验中, 该纳米粒在结肠部位的滞留时间明显增加并成功富集到肿瘤区域, 显著提升了治疗效果。硫酸软骨素是另外一种具有CD44分子靶向功能的多糖, Gou等[63]以类似思路将硫酸软骨素连接至负载姜黄素的蚕丝蛋白纳米粒表面, 该递送体系具备对pH、谷胱甘肽和ROS的敏感性, 有效靶向活化巨噬细胞, 提升对结肠炎小鼠的治疗效果。
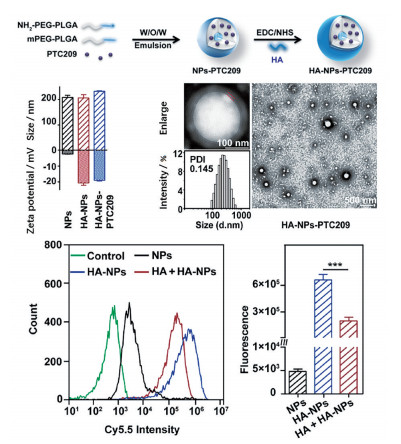
|
Figure 3 Poly(lactic-co-glycolic acid) (PLGA) nanoparticles (NPs) coated with hyaluronic acid (HA) were synthesized by a double emulsion method. The oral drug delivery system with negative charge presented an attractive strategy for colorectal cancer treatment. |
在无机纳米粒表面包覆壳聚糖能赋予递送体系pH响应性及滞留黏液层的功能。Zhang等[64]将亚硒酸溶液和壳聚糖溶液混合, 在抗坏血酸的还原作用下连接形成壳聚糖包覆的硒纳米粒, 显现出在模拟胃液中的稳定性及模拟肠液中的不稳定性。该团队的进一步研究[65]表明这种纳米粒具备良好的生物相容性, 并能降低Caco-2细胞系产生的ROS水平, 展现出对结肠癌的治疗潜力。Narayan等[66]利用EDC和NHS作为偶联剂, 将D-葡萄糖醛酸、壳聚糖、介孔硅纳米粒复合形成多糖包覆无机纳米粒的结构。该纳米粒被HCT116细胞系摄取比率显著提高, 经过进一步复合Eudragit S-100肠溶材料并装载卡培他滨, 该药物递送体系展现出对结肠癌小鼠治疗效果的显著提升。
3 多糖构建的自组装纳米粒自组装行为主要由高分子材料本身的亲疏水性或带电荷性驱动。亲疏水驱动的自组装是由同时具有亲水部分和疏水部分的两亲性分子在水溶液环境中自发形成外部亲水内部疏水的核-壳结构。电荷驱动的自组装是由带电荷的高分子依赖电荷吸引作用结合形成一定条件下稳定的纳米复合体。带电荷多糖均具备电荷驱动自组装的能力, 其稳定性会受到多糖分子质量、糖单元带电荷性强弱、电荷比例、复合顺序及环境pH值等因素的影响[67]。基于多糖的自组装纳米粒主要用于装载疏水或带电荷类药物。
3.1 支链结构自组装大多数多糖材料以亲水性为主, 其两亲性主要通过增加疏水段或疏水基团实现, 通过合理设计亲疏水段的比例及拓扑结构可有效形成自组装纳米粒[16]。与多糖连接的结构主要包括疏水小分子、疏水链高分子及各类脂溶性药物。
长烃链脂肪醇及脂肪酸是常见且安全性较好的疏水侧链选择。Shen等[68]将正十八醇通过N, N-羰基二咪唑(CDI) 偶联反应接枝到右旋糖酐上, 构成以长烷烃链为疏水链的两亲性支链高分子。通过进一步结合脂质体形成有效负载抗癌药物多柔比星的酶响应性纳米粒, 并在载药体系表面修饰具有靶向功能的叶酸分子, 提高了递送体系在结肠及肿瘤部位的富集, 对小鼠结肠癌具有良好的治疗效果。
苯硼酸酯是一类疏水性小分子化合物, 该结构对过氧化物敏感, 可在ROS作用下分解为无明显毒性的水溶性小分子。因此, 被用于构建亲疏水转变控释的ROS响应型递送体系[69]。较早的研究中, Broaders等[70]利用CDI偶联反应将4-(羟甲基)-苯硼酸频哪醇酯连接至亲水的右旋糖酐侧链, 通过亲疏水自组装制备出ROS响应型纳米粒, 该纳米粒在ROS作用下迅速瓦解并溶于水, 从而将药物释放出来。在此基础上, Bertoni等[71]用同样方法制备氧化响应型右旋糖酐纳米粒, 并用其装载抗菌药物利福昔明(rifaximin)。通过微流控技术, 将载药纳米粒封装在壳聚糖及琥珀酸羟丙基甲基纤维素醋酸酯(hydroxypropyl methylcellulose acetate succinate) 微球中, 得到pH和ROS双重响应的炎症性肠病药物递送体系。表征结果显示, 内部的载药纳米粒在高浓度ROS环境下60 min内即发生显著变化。Li等[72]运用类似原理将苯硼酸酯基团接枝至β-环糊精上, 也获得了具备ROS响应功能的递送材料。该团队将多肽Ac2-26作为有效药物进行装载, 并利用葡聚糖硫酸钠(dextran sulfate sodium, DSS) 周期性刺激构建的小鼠急性肠炎和慢性肠炎模型分别进行体内验证。两种模型验证结果表明, 该自组装ROS响应型载药体系的疗效显著优于无响应的PLGA载药体系(图 4), 肠道菌群结构也得到了显著改善。
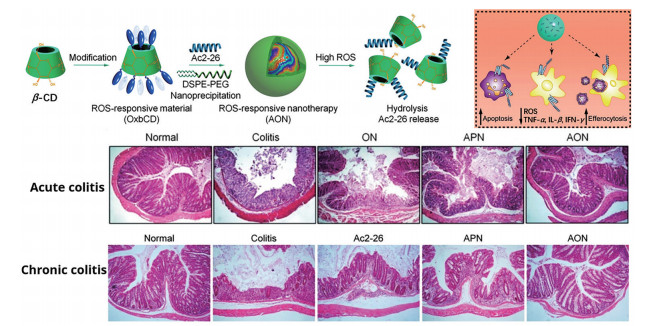
|
Figure 4 ROS-responsive material based on β-cyclodextrin (β-CD) was used to prepare a carrier for Ac2-26. The nano-therapy showed a significant effect on both acute colitis and chronic colitis. ON: Blank ROS-responsive nanoparticles; APN: PLGA-based nanoparticles loaded with Ac2-26; AON: ROS-responsive nanoparticles containing Ac2-26. (Adapted from Ref. 72 with permission. Copyright © 2019 Wiley Open Access CC-BY) |
在不影响药效的情况下, 部分疏水药物可充当疏水段通过化学键连接至多糖链上形成两亲性结构。Lee等[73]以苯硼酸作为连接体, 将抗炎药萘普生(naproxen) 与右旋糖酐相连, 该连接键在10 mmol·L-1过氧化氢作用下即可断裂。相比直接给药, 该结构自组装形成的纳米粒更好地降低了脂多糖(lipopolysaccharide) 刺激下RAW264.7细胞系分泌细胞因子IL-6的水平, 从而有效缓解炎症。Lee等[74]以乙二胺为连接分子, 将疏水的血胆红素和亲水的透明质酸在EDC/NHS作用下通过酰胺键连接形成两亲性结构。血胆红素具有较强的毒性和抗氧化性, 与透明质酸的连接可显著降低血胆红素的毒性并提高对CD44过表达的激活态巨噬细胞的靶向性。这种自组装形成的ROS清除剂可有效治疗DSS诱导的小鼠结肠炎。
3.2 主客体自组装基于多糖的主客体自组装由疏水客体与主体之间的非共价相互作用驱动[35]。在主客体自组装研究中, 环糊精是最重要的主体多糖, 是由6~12个D-吡喃葡萄糖通过α-(1, 4)糖苷键连接形成的环状低聚糖, 能被α-淀粉酶降解, 在人体内具有高生物安全性。环糊精的疏水内环可通过范德华力及氢键与客体形成主客体自组装结构[75], 这种结构的递送优势在于能将疏水客体药物有效装载于环糊精内部。
在不影响环糊精发挥主体装载作用的基础上对环糊精进行功能化修饰可赋予该自组装结构更多的功能性。甘露糖受体是一种与细胞内吞功能相关的受体分子, 能与甘露糖或其残基特异性结合, 在结肠癌细胞及活化的巨噬细胞表面均过表达。基于此, Bai等[76]使用CDI偶联反应将甘露糖与γ-环糊精结合, 并以主客体自组装形式装载了疏水抗癌药物瑞格菲尼(regorafenib)。经甘露糖功能化的环糊精-药物主客体复合物在水相中经历纳米管、纳米砖和纳米球3种形态变化, 最终形成的纳米粒粒径在100~300 nm之间。经过验证, 该纳米粒在HT-29和CT-26两种结肠癌细胞中细胞内化效率显著提升, 并在体内实验验证中有效抑制肿瘤血管生成和细胞增殖, 降低了结肠癌小鼠的疾病活跃指数(disease activity index, DAI)。
将环糊精分子作为装载药物的“框”修饰其他高分子可提高被修饰高分子的载药能力。Xue等[77]通过开环聚合制备了聚乙二醇-聚赖氨酸嵌段共聚物, 并利用赖氨酸残基上的氨基连接环糊精, 该团队以四甲基哌啶(tempol) 作为抗炎药物并将其通过主客体自组装进行装载。结合了客体疏水药物的环糊精残基整体呈疏水性, 使得整体高分子结构展现出两亲性, 从而进一步自组装形成纳米粒。经过验证, 该递送体系具备针对RAW264.7细胞系及小鼠结肠炎模型的优异抗炎效果。菊粉(inulin) 是一种充当部分植物储能物质的多糖, 来源广泛, 可基于酶解作用应用于结肠药物递送。Catenacci等[78]在菊粉糖链上连接β-环糊精, 依赖主客体自组装装载姜黄素, 制备出了适用于结肠炎症及癌症治疗的载药纳米粒。Bai等[79]利用EDC/NHS偶联透明质酸和β-环糊精, 并使用姜黄素-氧铂(curcumin-oxoplatin) 复合物作为被载药物构建纳米载药体系, 其特点在于兼具pH响应、微生物酶响应及CD44靶向功能。
3.3 静电自组装两种带相反电荷的高分子在电荷驱动下静电自组装而成的复合体被称为聚电解质复合物(polyelectrolyte complexes)。大部分纳米粒载体对亲水药物装载效率较低, 静电自组装为亲水且带电荷的药物提供了便捷有效的装载方式。在构建多糖聚电解质复合物的相关研究中, 最重要的正电组分是壳聚糖, 负电组分主要为各类含大量羧基和磺酸基结构的多糖[80, 81]。
当多糖本身即为待递送药物时, 与其他多糖组成聚电解质复合物是一种便捷有效的递送策略。肝素是一种带强负电的高度硫酸化糖胺聚糖, 能抑制多种炎症细胞的活化, 降低炎症因子的表达水平, 具有用于肠道炎症疾病治疗的应用潜力[22]。借助肝素的强负电特性, Maretti等[82]将低分子质量肝素(low molecular weight heparin) 水溶液逐滴加入分子质量为70 kDa、脱乙酰度约为80%的壳聚糖醋酸水溶液, 组合形成了聚电解质复合物。该聚电解质复合物在pH 5.5的环境下能组合成粒径最小约为171 nm的带正电纳米结构。该研究发现低分子质量肝素-壳聚糖聚电解质复合物对pH敏感, 脂质体包覆可提升其在弱碱性环境下的稳定性。Yan等[48]用N位三甲基化壳聚糖和依诺肝素(enoxaparin) 进行静电自组装形成聚电解质复合物, 通过调整两种多糖的比例使其zeta电位呈正值, 再进一步通过静电自组装在其外表面构建海藻酸钠层。结肠炎小鼠体内实验结果表明, 该递送体系能使依诺肝素在炎症部位的分布提高36.46%, 在正常部位的分布减少30.04%。经过复合物体系治疗的2, 4, 6-三硝基苯磺酸(2, 4, 6-trinitro-benzenesulfonic acid, TNBS) 结肠炎小鼠体重下降趋势减缓, 其结肠上皮组织完整性也整体优于直接口服肝素水溶液。
此外, 静电自组装同样适用于非多糖带电荷药物的递送。在一项研究中, Lee等[83]用褐藻糖胶(fucoidan)-壳聚糖聚电解质复合物装载可溶性蛋壳膜蛋白(soluble eggshell membrane protein, SEP)。SEP具有抗氧化及降低肠上皮免疫系统炎症因子分泌量的作用, 由于其不耐受胃酸且易被蛋白酶酶解, 直接口服不能有效发挥SEP对结肠炎的治疗效果。两种多糖组成的聚电解质复合物能高效装载SEP并为其提供保护。细胞实验结果表明, 该载药体系对受损肠上皮组织具有治疗效果。另一项研究中, Boni等[84]以邻苯二甲酸羟丙基纤维素和透明质酸钠作为负电组分与低分子质量壳聚糖形成聚电解质复合物并用于装载甲氨蝶呤(methotrexate)。甲氨蝶呤能通过抑制二氢叶酸还原酶实现抑制癌细胞增殖, 但具有一定毒性和致癌性, 直接口服生物利用率低且不良反应大, 其在弱酸性条件下带正电, 经过聚电解质复合物装载后, 其黏膜黏附性及癌细胞的摄取率均得到了提高。
如果将带电多糖交替添加从而吸附形成相间的多层带电层, 即表现为逐层自组装(layer-by-layer) 行为[85]。逐层自组装技术是近年来受到广泛关注的开发多功能药物控释体系的最通用方法之一[86], Oshi等[87]以姜黄素微晶为核心, 在微晶表面反复交替逐层添加壳聚糖正电层和海藻酸钠负电层, 最后以醋酸纤维素邻苯二甲酸酯(cellulose acetate phthalate, CAP) 作为最外层负电层形成了具有pH响应性的纳米结构。多层带电层使该纳米结构能在模拟胃液及小肠液中保持稳定, 并在模拟结肠液中快速释放姜黄素。结肠炎小鼠模型验证实验表明, 12 h后递送体系明显富集在结肠部位, 且结肠炎症部位的姜黄素浓度比正常部位高3倍以上(图 5)。
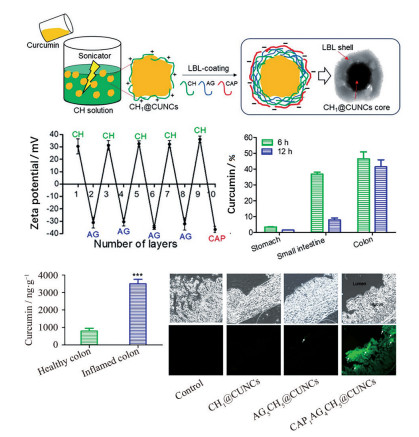
|
Figure 5 Multilayer core-shell nanoparticles, where curcumin served as a core while polysaccharides served as the shell, showed preferential accumulation of nanoparticles in inflamed colonic tissues. LBL: Layer-by-layer; CH: Chitosan; AG: Alginate. |
一些亲水性强的多糖能借助化学键、离子键、氢键和范德华力等形成限制水自由流动、高溶胀、高持水能力的三维交联网状结构, 即水凝胶。相比于纳米粒, 水凝胶具备更优异的生物相容性及更强的载药能力, 其装载的药物可通过凝胶结构的降解或顺浓度梯度扩散等方式释放, 并通过化学键的修饰, 赋予其更多刺激-响应性功能[88, 89]。基于多糖构建的水凝胶分为非共价交联型和共价交联型。
4.1 非共价交联型水凝胶最为常见的非共价交联方式是构建离子交联点, 对于大部分亲水性负电多糖来说, 钙离子是最常用的离子交联剂。以海藻酸和钙离子组合形成的水凝胶能在胃部环境下保持稳定并在结肠部位被菌群分解。在较早的研究中, Laroui等[90]以多重乳化法制备出装载KPV抗炎三肽的聚乳酸(polylactic acid, PLA) 纳米粒。为使其适用于口服给药, 该研究将壳聚糖和海藻酸钠混合, 逐次加入钙离子和硫酸根离子形成双重离子交联的水凝胶, 并将PLA载药纳米粒装载入水凝胶中。这种保护性质的多糖水凝胶有效辅助了结肠靶向给药。Shanmugapriya等[91]将褐藻糖胶、海藻酸及结冷胶(gellan gum) 以3∶3∶1的比例混合, 用钙离子进行室温交联24 h形成水凝胶。作者在水凝胶中加入表皮生长因子受体(epidermal growth factor receptor) 的特异性抗体, 并装载光敏剂二氢卟吩e6, 成功制备出能通过光动力疗法杀死肿瘤细胞的水凝胶递送体系。果胶是另一种适用于构建微生物酶响应离子交联水凝胶的多糖材料。Stealey等[92]将果胶溶液通过电喷雾法喷洒到壳寡糖/氯化钙溶液中, 雾化分散使水相中形成大量粒径在400 μm左右的水凝胶微球, 并以FITC标记的右旋糖酐作为模型药物, 验证了其在模拟结肠液中的特异性释药能力。
构建离子交联水凝胶一般需要在水环境下进行, 多糖溶液混合后的交联行为复杂且较难控制。对此, Xu等[93]采用机械化学方法, 将壳聚糖和海藻酸钠粉末均匀混合, 并用高能球磨机将二者分散至纳米级别共混固体粉末。该尺度下固体状壳聚糖与海藻酸能通过静电力、范德华力及微结构组成交联结构, 溶于水后即可形成凝胶。形成固体分散相的主要优势在于能够提升水凝胶载体的生物相容性、均一性和对环境变化的敏感性。
超分子主客体自组装是另一种非共价交联方式, 主要依赖于宿主分子与两个或以上客体分子间的结合来构成交联点。Ding等[94]将魔芋葡甘露聚糖(konjac glucomannan) 进行羧甲基化, 并通过EDC/NHS偶联反应在羧基上连接苯丙氨酸形成支链化合物KGM-Phe。葫芦脲[8] (cucurbit[8]uril, CB[8]) 是一种环形宿主化合物, 能与苯丙氨酸基团通过主客体自组装形成超分子结构。研究中将CB[8]充当“连接件”, 将两个苯丙氨酸基团连接在一起形成交联点。这种设计使负载小檗碱(berberine, BBR) 的魔芋葡甘露聚糖水凝胶在小鼠体内的停留时间得到了加长, 对DSS诱导的结肠炎小鼠具有优异的治疗效果(图 6)。

|
Figure 6 Non-covalent crosslinked hydrogels based on konjac glucomannan. Dextran sulfate sodium (DSS) induced ulcerative colitis mouse model was used to evaluate the drug delivery system and revealed an improved therapeutic efficacy. DAI: Disease activity index. |
多糖丰富的氨基、羧基和羟基等活性基团提供了大量可用于共价交联的反应位点。相比于非共价交联, 共价交联型多糖水凝胶具有更强的稳定性。Zhang等[95]将透明质酸和明胶混合溶解, 加入EDC后将溶液迅速转移到直径2 cm的球形模具中。在EDC作用下, 透明质酸的羧基能与明胶的氨基结合成酰胺键从而实现共价交联。这种透明质酸/明胶水凝胶能很好地保护负载有姜黄素的羧甲基壳聚糖微米球, 并能使姜黄素在小鼠结肠组织中停留超过24 h。经过该递送体系治疗的结肠炎小鼠血清炎症因子水平明显下降, 苏木精/伊红染色及免疫组织化学的结果表明小鼠结肠组织完整性得到恢复, 髓过氧化物酶水平有效降低。在另一项研究中, Pandey等[96]以果胶为基底材料, 以过硫酸钾为引发剂, 引发丙烯酰胺在果胶羟基上的链式加聚反应。具有聚丙烯酰胺支链结构的果胶衍生物在N, N-亚甲基双丙烯酰胺(N, N-methylene bisacrylamide) 的连接作用下形成共价交联点从而制备出果胶/聚丙烯酰胺水凝胶。这种水凝胶在酸性环境下具有较低肿胀率, 且仅在结肠被酶降解, 负载抗炎药物布地奈德(budesonide) 后可基于pH/微生物酶双响应性实现结肠靶向递送。
除小分子交联剂外, 一些纳米材料也被用于共价交联型水凝胶的构建。Vakili等[97]将纤维素纳米微晶分散在水相中, 以过硫酸钠为引发剂引发丙烯酸链式加聚反应, 棒状结构微晶能够支持多个聚丙烯酸链的聚合, 进而形成以纳米微晶为连接核心的水凝胶。借助纤维素纳米微晶的黏膜吸附性, 该水凝胶同样展现出了对结肠黏膜的黏附效果, 装载抗癌药物顺铂(cisplatin) 后具备高效治疗结肠癌的应用潜力。Rakhshaei等[98]将石墨烯量子点(graphene quantum dot) 和羧甲基纤维素在水相中混合, 在60 ℃条件下反应24 h。借助石墨烯量子点邻位羧基脱水活化后与羧甲基纤维素羟基间的酯化反应, 可形成以石墨烯量子点为交联点的水凝胶。相比于传统的氯化铁交联羧甲基纤维素凝胶, 石墨烯量子点交联具有更优异的安全性和稳定性, 作者将多柔比星负载入该具有pH响应性的水凝胶中, 体外实验结果展现出了其对HT-29细胞活性的有效抑制作用。
5 总结与展望结肠具有复杂和多样的组织结构、生理学及内环境特性, 极大限制了临床化学药物对结肠疾病的治疗效果, 开发新型药物制剂化策略具有重要研究价值。口服靶向型药物递送体系是最有前景的解决途径之一。多糖因其获取来源广泛、应用成本低、生物相容性好及生物学活性丰富等特点受到药物递送领域研究的广泛关注。近年来, 国内外学者已借助pH响应、微生物酶响应、ROS响应、肠黏膜吸附富集及受体分子靶向等机制开发出一系列基于多糖的口服靶向型药物递送体系, 可成功将药物靶向递送至结肠疾病部位, 显著提升药物利用率和优化治疗效果, 并降低不良反应。本文将近年来研发的多糖类结肠靶向递送体系分为交联型纳米粒、自组装型纳米粒及水凝胶3类(表 2[45, 46, 48, 65, 66, 68, 71-73, 78, 82, 93-95, 99, 100]) 分别进行了综述和讨论。通过加入交联剂来将多糖大分子间相互连接可形成交联型多糖纳米粒, 这类纳米粒大多可在复杂消化道环境内保持相对稳定的结构, 而在到达结肠后充分发挥多糖材料本身对肠道疾病环境的响应性实现结肠靶向递送, 因此也是最常用的构建形式之一, 如壳聚糖、海藻酸和果胶等食源性多糖是这类纳米粒常用的构建材料; 利用亲疏水性相互作用等可形成自组装型多糖纳米粒, 大多数多糖材料需经修饰才能具备自组装能力, 或以聚电解质复合物形式实现静电自组装, 合适的结构设计能轻松地在水环境中高效自组装成纳米载药体系。因此, 这类纳米递送体系的构建方式更加便捷且结构及功能的复杂程度上限更高, 引起了大量科研工作者的重视; 借助共价或非共价原理构建交联点形成柔软的高亲水高溶胀三维网状结构可形成多糖水凝胶, 水凝胶具备优异的生物相容性和高载药能力, 较为突出的一类应用方式是利用肠道特异性降解的微米凝胶对药物进行保护, 实用价值很高。以上3种递送体系特点各异功能多样, 突显出多糖材料在结肠疾病治疗中的巨大应用前景。
| Table 2 Polysaccharide-based targeted oral drug delivery systems and their therapeutic model. UC: Ulcerative colitis; NF-κB: Nuclear factor-kappa B |
基于多糖材料构建结肠靶向药物递送体系仍有很大研究发展空间, 但已有的大多数工作着重从多糖作为递送材料的角度进行设计和应用研究, 递送体系中多糖材料本身的生物学活性对结肠疾病的影响或治疗潜力却鲜有报道。研究表明壳聚寡糖、肝素、环糊精、果胶和卡拉胶等多糖具有抗炎、抗氧化、抗肿瘤及调节肠道菌群等功能[22, 26, 29, 33, 101, 102]。因此, 以多糖作为递送材料进行研究时, 其本身对治疗效果的贡献度及与有效药物之间可能存在的协同或拮抗作用是药物递送体系设计及应用的重要组成部分。多糖大分子结构复杂, 目前对于多糖的生物学作用机制解析仍有待更深入的研究, 设计兼顾多糖材料学性能和生物学活性的口服靶向型药物递送体系将是口服递送药物剂型领域最有前景和挑战的研究方向之一。
作者贡献: 黄龙为本文主要撰写者及图表绘制者; 曾文、徐冰和张灿阳负责部分章节内容的撰写和修改; 马少华和张翀负责综述内容审核及修改; 王怡和邢新会负责文章的选题和思路并提出指导修改意见。
利益冲突: 所有作者声明本文不存在利益冲突。
| [1] |
Brenner H, Kloor M, Pox CP. Colorectal cancer[J]. Lancet, 2014, 383: 1490-1502. DOI:10.1016/S0140-6736(13)61649-9 |
| [2] |
Kobayashi T, Siegmund B, Le Berre C, et al. Ulcerative colitis[J]. Nat Rev Dis Primers, 2020, 6: 74. DOI:10.1038/s41572-020-0205-x |
| [3] |
Kaser A, Zeissig S, Blumberg RS. Inflammatory bowel disease[J]. Annu Rev Immunol, 2010, 28: 573-621. DOI:10.1146/annurev-immunol-030409-101225 |
| [4] |
Matsuoka K, Kobayashi T, Ueno F, et al. Evidence-based clinical practice guidelines for inflammatory bowel disease[J]. J Gastroenterol, 2018, 53: 305-353. DOI:10.1007/s00535-018-1439-1 |
| [5] |
Ungaro R, Mehandru S, Allen PB, et al. Ulcerative colitis[J]. Lancet, 2017, 389: 1756-1770. DOI:10.1016/S0140-6736(16)32126-2 |
| [6] |
Keum N, Giovannucci E. Global burden of colorectal cancer: emerging trends, risk factors and prevention strategies[J]. Nat Rev Gastroenterol Hepatol, 2019, 16: 713-732. DOI:10.1038/s41575-019-0189-8 |
| [7] |
Biller L, Schrag D. Diagnosis and treatment of metastatic colorectal cancer: a review[J]. J Am Med Assoc, 2021, 325: 669-685. DOI:10.1001/jama.2021.0106 |
| [8] |
Naeem M, Awan UA, Subhan F, et al. Advances in colon-targeted nano-drug delivery systems: challenges and solutions[J]. Arch Pharm Res, 2020, 43: 153-169. DOI:10.1007/s12272-020-01219-0 |
| [9] |
Zhang X, Song H, Canup BSB, et al. Orally delivered targeted nanotherapeutics for the treatment of colorectal cancer[J]. Expert Opin Drug Deliv, 2020, 17: 781-790. DOI:10.1080/17425247.2020.1748005 |
| [10] |
Lee SH, Bajracharya R, Min JY, et al. Strategic approaches for colon targeted drug delivery: an overview of recent advancements[J]. Pharmaceutics, 2020, 12: 68. DOI:10.3390/pharmaceutics12010068 |
| [11] |
Amidon S, Brown JE, Dave VS. Colon-targeted oral drug delivery systems: design trends and approaches[J]. AAPS PharmSciTech, 2015, 16: 731-741. DOI:10.1208/s12249-015-0350-9 |
| [12] |
Dos Santos AM, Carvalho SG, Meneguin AB, et al. Oral delivery of micro/nanoparticulate systems based on natural polysaccharides for intestinal diseases therapy: challenges, advances and future perspectives[J]. J Control Release, 2021, 334: 353-366. DOI:10.1016/j.jconrel.2021.04.026 |
| [13] |
Mizrahy S, Peer D. Polysaccharides as building blocks for nanotherapeutics[J]. Chem Soc Rev, 2012, 41: 2623-2640. DOI:10.1039/C1CS15239D |
| [14] |
Sinha VR, Kumria R. Polysaccharides in colon-specific drug delivery[J]. Int J Pharm, 2001, 224: 19-38. DOI:10.1016/S0378-5173(01)00720-7 |
| [15] |
Yi Y, Xu W, Wang HX, et al. Natural polysaccharides experience physiochemical and functional changes during preparation: a review[J]. Carbohydr Polym, 2020, 234: 115896. DOI:10.1016/j.carbpol.2020.115896 |
| [16] |
Yang X, Shi X, D'arcy R, et al. Amphiphilic polysaccharides as building blocks for self-assembled nanosystems: molecular design and application in cancer and inflammatory diseases[J]. J Control Release, 2018, 272: 114-144. DOI:10.1016/j.jconrel.2017.12.033 |
| [17] |
Shukla RK, Tiwari A. Carbohydrate polymers: applications and recent advances in delivering drugs to the colon[J]. Carbohydr Polym, 2012, 88: 399-416. DOI:10.1016/j.carbpol.2011.12.021 |
| [18] |
Zhu J, Zhong L, Chen W, et al. Preparation and characterization of pectin/chitosan beads containing porous starch embedded with doxorubicin hydrochloride: a novel and simple colon targeted drug delivery system[J]. Food Hydrocoll, 2019, 95: 562-570. DOI:10.1016/j.foodhyd.2018.04.042 |
| [19] |
Wang LH, Huang GQ, Xu TC, et al. Characterization of carboxymethylated konjac glucomannan for potential application in colon-targeted delivery[J]. Food Hydrocol, 2019, 94: 354-362. DOI:10.1016/j.foodhyd.2019.03.045 |
| [20] |
Perez Espitia PJ, Du WX, Avena-Bustillos RDJ, et al. Edible films from pectin: physical-mechanical and antimicrobial properties-a review[J]. Food Hydrocoll, 2014, 35: 287-296. DOI:10.1016/j.foodhyd.2013.06.005 |
| [21] |
Kean T, Thanou M. Biodegradation, biodistribution and toxicity of chitosan[J]. Adv Drug Deliv Rev, 2010, 62: 3-11. DOI:10.1016/j.addr.2009.09.004 |
| [22] |
Mulloy B, Hogwood J, Gray E, et al. Pharmacology of heparin and related drugs[J]. Pharmacol Rev, 2016, 68: 76-141. DOI:10.1124/pr.115.011247 |
| [23] |
Choi KY, Han HS, Lee ES, et al. Hyaluronic acid-based activatable nanomaterials for stimuli-responsive imaging and therapeutics: beyond CD44-mediated drug delivery[J]. Adv Mater, 2019, 31: 1803549. DOI:10.1002/adma.201803549 |
| [24] |
Duran-Lobato M, Niu ZG, Alonso MJ. Oral delivery of biologics for precision medicine[J]. Adv Mater, 2020, 32: 1901935. DOI:10.1002/adma.201901935 |
| [25] |
Achazi K, Haag R, Ballauff M, et al. Understanding the interaction of polyelectrolyte architectures with proteins and biosystems[J]. Angew Chem Int Ed Engl, 2021, 60: 3882-3904. DOI:10.1002/anie.202006457 |
| [26] |
Yu Y, Shen M, Song Q, et al. Biological activities and pharmaceutical applications of polysaccharide from natural resources: a review[J]. Carbohydr Polym, 2018, 183: 91-101. DOI:10.1016/j.carbpol.2017.12.009 |
| [27] |
Niu W, Chen X, Xu R, et al. Polysaccharides from natural resources exhibit great potential in the treatment of ulcerative colitis: a review[J]. Carbohydr Polym, 2021, 254: 117189. DOI:10.1016/j.carbpol.2020.117189 |
| [28] |
Khan T, Date A, Chawda H, et al. Polysaccharides as potential anticancer agents-a review of their progress[J]. Carbohydr Polym, 2019, 210: 412-428. DOI:10.1016/j.carbpol.2019.01.064 |
| [29] |
Naveed M, Phil L, Sohail M, et al. Chitosan oligosaccharide (COS): an overview[J]. Int J Biol Macromol, 2019, 129: 827-843. DOI:10.1016/j.ijbiomac.2019.01.192 |
| [30] |
Aguero L, Zaldivar-Silva D, Pena L, et al. Alginate microparticles as oral colon drug delivery device: a review[J]. Carbohydr Polym, 2017, 168: 32-43. DOI:10.1016/j.carbpol.2017.03.033 |
| [31] |
Rios de la Rosa JM, Tirella A, Gennari A, et al. The CD44-mediated uptake of hyaluronic acid-based carriers in macrophages[J]. Adv Healthc Mater, 2017, 6: 1601012. DOI:10.1002/adhm.201601012 |
| [32] |
Dos Santos AM, Meneguin AB, Akhter DT, et al. Understanding the role of colon-specific microparticles based on retrograded starch/pectin in the delivery of chitosan nanoparticles along the gastrointestinal tract[J]. Eur J Pharm Biopharm, 2021, 158: 371-378. DOI:10.1016/j.ejpb.2020.12.004 |
| [33] |
Wei Y, Gong J, Zhu W, et al. Pectin enhances the effect of fecal microbiota transplantation in ulcerative colitis by delaying the loss of diversity of gut flora[J]. BMC Microbiol, 2016, 16: 255. DOI:10.1186/s12866-016-0869-2 |
| [34] |
Zhang J, Ma PX. Cyclodextrin-based supramolecular systems for drug delivery: recent progress and future perspective[J]. Adv Drug Deliv Rev, 2013, 65: 1215-1233. DOI:10.1016/j.addr.2013.05.001 |
| [35] |
Rybtchinski B. Adaptive supramolecular nanomaterials based on strong noncovalent interactions[J]. ACS Nano, 2011, 5: 6791-6818. DOI:10.1021/nn2025397 |
| [36] |
Swierczewska M, Han HS, Kim K, et al. Polysaccharide-based nanoparticles for theranostic nanomedicine[J]. Adv Drug Deliv Rev, 2016, 99: 70-84. DOI:10.1016/j.addr.2015.11.015 |
| [37] |
Zhang S, Langer R, Traverso G. Nanoparticulate drug delivery systems targeting inflammation for treatment of inflammatory bowel disease[J]. Nano Today, 2017, 16: 82-96. DOI:10.1016/j.nantod.2017.08.006 |
| [38] |
Qin XS, Luo ZG, Li XL. An enhanced pH-sensitive carrier based on alginate-Ca-EDTA in a set-type W-1/O/W-2 double emulsion model stabilized with WPI-EGCG covalent conjugates for probiotics colon-targeted release[J]. Food Hydrocoll, 2021, 113: 106460. DOI:10.1016/j.foodhyd.2020.106460 |
| [39] |
Tie S, Su W, Zhang X, et al. pH-Responsive core-shell microparticles prepared by a microfluidic chip for the encapsulation and controlled release of procyanidins[J]. J Agric Food Chem, 2021, 69: 1466-1477. DOI:10.1021/acs.jafc.0c04895 |
| [40] |
Nugent S, Kumar D, Rampton D, et al. Intestinal luminal pH in inflammatory bowel disease: possible determinants and implications for therapy with aminosalicylates and other drugs[J]. Gut, 2001, 48: 571-577. DOI:10.1136/gut.48.4.571 |
| [41] |
Kotla NG, Rana S, Sivaraman G, et al. Bioresponsive drug delivery systems in intestinal inflammation: state-of-the-art and future perspectives[J]. Adv Drug Deliv Rev, 2019, 146: 248-266. DOI:10.1016/j.addr.2018.06.021 |
| [42] |
Zeng W, He D, Xing Y, et al. Internal connections between dietary intake and gut microbiota homeostasis in disease progression of ulcerative colitis: a review[J]. Food Sci Hum Well, 2021, 10: 119-130. DOI:10.1016/j.fshw.2021.02.016 |
| [43] |
Canaparo R, Foglietta F, Limongi T, et al. Biomedical applications of reactive oxygen species generation by metal nanoparticles[J]. Materials (Basel), 2020, 14: 53. DOI:10.3390/ma14010053 |
| [44] |
Bao C, Liu B, Li B, et al. Enhanced transport of shape and rigidity-tuned alpha-lactalbumin nanotubes across intestinal mucus and cellular barriers[J]. Nano Lett, 2020, 20: 1352-1361. DOI:10.1021/acs.nanolett.9b04841 |
| [45] |
Samprasit W, Opanasopit P, Chamsai B. Mucoadhesive chitosan and thiolated chitosan nanoparticles containing alpha mangostin for possible colon-targeted delivery[J]. Pharm Dev Technol, 2021, 26: 362-372. DOI:10.1080/10837450.2021.1873370 |
| [46] |
Tahara K, Samura S, Tsuji K, et al. Oral nuclear factor-kappaB decoy oligonucleotides delivery system with chitosan modified poly(D, L-lactide-co-glycolide) nanospheres for inflammatory bowel disease[J]. Biomaterials, 2011, 32: 870-878. DOI:10.1016/j.biomaterials.2010.09.034 |
| [47] |
Bagre AP, Jain K, Jain NK. Alginate coated chitosan core shell nanoparticles for oral delivery of enoxaparin: in vitro and in vivo assessment[J]. Int J Pharm, 2013, 456: 31-40. DOI:10.1016/j.ijpharm.2013.08.037 |
| [48] |
Yan Y, Sun Y, Wang P, et al. Mucoadhesive nanoparticles-based oral drug delivery systems enhance ameliorative effects of low molecular weight heparin on experimental colitis[J]. Carbohydr Polym, 2020, 246: 116660. DOI:10.1016/j.carbpol.2020.116660 |
| [49] |
Neurath MF, Travis SP. Mucosal healing in inflammatory bowel diseases: a systematic review[J]. Gut, 2012, 61: 1619-1635. DOI:10.1136/gutjnl-2012-302830 |
| [50] |
Zhang S, Ermann J, Succi MD, et al. An inflammation-targeting hydrogel for local drug delivery in inflammatory bowel disease[J]. Sci Transl Med, 2015, 7: 300ra128. |
| [51] |
Si XY, Merlin D, Xiao B. Recent advances in orally administered cell-specific nanotherapeutics for inflammatory bowel disease[J]. World J Gastroenterol, 2016, 22: 7718-7726. DOI:10.3748/wjg.v22.i34.7718 |
| [52] |
Zhang L, Sang Y, Feng J, et al. Polysaccharide-based micro/nanocarriers for oral colon-targeted drug delivery[J]. J Drug Target, 2016, 24: 579-589. DOI:10.3109/1061186X.2015.1128941 |
| [53] |
Soni KS, Desale SS, Bronich TK. Nanogels: an overview of properties, biomedical applications and obstacles to clinical translation[J]. J Control Release, 2016, 240: 109-126. DOI:10.1016/j.jconrel.2015.11.009 |
| [54] |
Samadian H, Maleki H, Fathollahi A, et al. Naturally occurring biological macromolecules-based hydrogels: potential biomaterials for peripheral nerve regeneration[J]. Int J Biol Macromol, 2020, 154: 795-817. DOI:10.1016/j.ijbiomac.2020.03.155 |
| [55] |
Dube A, Nicolazzo JA, Larson I. Chitosan nanoparticles enhance the plasma exposure of (-)-epigallocatechin gallate in mice through an enhancement in intestinal stability[J]. Eur J Pharm Sci, 2011, 44: 422-426. DOI:10.1016/j.ejps.2011.09.004 |
| [56] |
Chuah LH, Roberts CJ, Billa N, et al. Cellular uptake and anticancer effects of mucoadhesive curcumin-containing chitosan nanoparticles[J]. Colloids Surf B Biointerfaces, 2014, 116: 228-236. DOI:10.1016/j.colsurfb.2014.01.007 |
| [57] |
Alkhader E, Roberts CJ, Rosli R, et al. Pharmacokinetic and anti-colon cancer properties of curcumin-containing chitosan-pectinate composite nanoparticles[J]. J Biomater Sci Polym Ed, 2018, 29: 2281-2298. DOI:10.1080/09205063.2018.1541500 |
| [58] |
Arif M, Chi Z, Liu YJ, et al. Preparation, characterization, and in vitro drug release behavior of thiolated alginate nanoparticles loaded budesonide as a potential drug delivery system toward inflammatory bowel diseases[J]. J Biomater Sci Polym Ed, 2020, 31: 2299-2317. DOI:10.1080/09205063.2020.1803034 |
| [59] |
Chiu HI, Lim V. Wheat germ agglutinin-conjugated disulfide cross-linked alginate nanoparticles as a docetaxel carrier for colon cancer therapy[J]. Int J Nanomed, 2021, 16: 2995-3020. DOI:10.2147/IJN.S302238 |
| [60] |
Xiao B, Viennois E, Chen Q, et al. Silencing of intestinal glycoprotein CD98 by orally targeted nanoparticles enhances chemosensitization of colon cancer[J]. ACS Nano, 2018, 12: 5253-5265. DOI:10.1021/acsnano.7b08499 |
| [61] |
Chen C, Zhao S, Karnad A, et al. The biology and role of CD44 in cancer progression: therapeutic implications[J]. J Hematol Oncol, 2018, 11: 64. DOI:10.1186/s13045-018-0605-5 |
| [62] |
Xu J, Zhang Y, Xu J, et al. Reversing tumor stemness via orally targeted nanoparticles achieves efficient colon cancer treatment[J]. Biomaterials, 2019, 216: 119247. DOI:10.1016/j.biomaterials.2019.119247 |
| [63] |
Gou S, Huang Y, Wan Y, et al. Multi-bioresponsive silk fibroin-based nanoparticles with on-demand cytoplasmic drug release capacity for CD44-targeted alleviation of ulcerative colitis[J]. Biomaterials, 2019, 212: 39-54. DOI:10.1016/j.biomaterials.2019.05.012 |
| [64] |
Zhang C, Zhai X, Zhao G, et al. Synthesis, characterization, and controlled release of selenium nanoparticles stabilized by chitosan of different molecular weights[J]. Carbohydr Polym, 2015, 134: 158-166. DOI:10.1016/j.carbpol.2015.07.065 |
| [65] |
Zhai X, Zhang C, Zhao G, et al. Antioxidant capacities of the selenium nanoparticles stabilized by chitosan[J]. J Nanobiotechnol, 2017, 15: 4. DOI:10.1186/s12951-016-0243-4 |
| [66] |
Narayan R, Gadag S, Cheruku SP, et al. Chitosan-glucuronic acid conjugate coated mesoporous silica nanoparticles: a smart pH-responsive and receptor-targeted system for colorectal cancer therapy[J]. Carbohydr Polym, 2021, 261: 117893. DOI:10.1016/j.carbpol.2021.117893 |
| [67] |
Zhang YJ, Sun T, Jiang C. Biomacromolecules as carriers in drug delivery and tissue engineering[J]. Acta Pharm Sin B, 2018, 8: 34-50. DOI:10.1016/j.apsb.2017.11.005 |
| [68] |
Shen MY, Liu TI, Yu TW, et al. Hierarchically targetable polysaccharide-coated solid lipid nanoparticles as an oral chemo/thermotherapy delivery system for local treatment of colon cancer[J]. Biomaterials, 2019, 197: 86-100. DOI:10.1016/j.biomaterials.2019.01.019 |
| [69] |
Stubelius A, Lee S, Almutairi A. The chemistry of boronic acids in nanomaterials for drug delivery[J]. Acc Chem Res, 2019, 52: 3108-3119. DOI:10.1021/acs.accounts.9b00292 |
| [70] |
Broaders KE, Grandhe S, Frechet JM. A biocompatible oxidation-triggered carrier polymer with potential in therapeutics[J]. J Am Chem Soc, 2011, 133: 756-758. DOI:10.1021/ja110468v |
| [71] |
Bertoni S, Liu Z, Correia A, et al. pH and reactive oxygen species‐sequential responsive nano‐in‐micro composite for targeted therapy of inflammatory bowel disease[J]. Adv Funct Mater, 2018, 28: 1806175. DOI:10.1002/adfm.201806175 |
| [72] |
Li C, Zhao Y, Cheng J, et al. A proresolving peptide nanotherapy for site-specific treatment of inflammatory bowel disease by regulating proinflammatory microenvironment and gut microbiota[J]. Adv Sci, 2019, 6: 1900610. DOI:10.1002/advs.201900610 |
| [73] |
Lee S, Stubelius A, Hamelmann N, et al. Inflammation-responsive drug-conjugated dextran nanoparticles enhance anti-inflammatory drug efficacy[J]. ACS Appl Mater Interfaces, 2018, 10: 40378-40387. DOI:10.1021/acsami.8b08254 |
| [74] |
Lee Y, Sugihara K, Gillilland MG 3rd, et al. Hyaluronic acid-bilirubin nanomedicine for targeted modulation of dysregulated intestinal barrier, microbiome and immune responses in colitis[J]. Nat Mater, 2020, 19: 118-126. DOI:10.1038/s41563-019-0462-9 |
| [75] |
Hu QD, Tang GP, Chu PK. Cyclodextrin-based host-guest supramolecular nanoparticles for delivery: from design to applications[J]. Acc Chem Res, 2014, 47: 2017-2025. DOI:10.1021/ar500055s |
| [76] |
Bai HZ, Wang JW, Phan CU, et al. Cyclodextrin-based host-guest complexes loaded with regorafenib for colorectal cancer treatment[J]. Nat Commun, 2021, 12: 759. DOI:10.1038/s41467-021-21071-0 |
| [77] |
Xue F, Wang Y, Zhang Q, et al. Self-assembly of affinity-controlled nanoparticles via host-guest interactions for drug delivery[J]. Nanoscale, 2018, 10: 12364-12377. DOI:10.1039/C8NR01518J |
| [78] |
Catenacci L, Sorrenti M, Perteghella S, et al. Combination of inulin and beta-cyclodextrin properties for colon delivery of hydrophobic drugs[J]. Int J Pharm, 2020, 589: 119861. |
| [79] |
Bai Y, Liu CP, Chen D, et al. β-Cyclodextrin-modified hyaluronic acid-based supramolecular self-assemblies for pH- and esterase- dual-responsive drug delivery[J]. Carbohydr Polym, 2020, 246: 116654. |
| [80] |
Luo Y, Wang Q. Recent development of chitosan-based polyelectrolyte complexes with natural polysaccharides for drug delivery[J]. Int J Biol Macromol, 2014, 64: 353-367. |
| [81] |
Pilipenko I, Korzhikov-Vlakh V, Sharoyko V, et al. pH-Sensitive chitosan-heparin nanoparticles for effective delivery of genetic drugs into epithelial cells[J]. Pharmaceutics, 2019, 11: 317. |
| [82] |
Maretti E, Pavan B, Rustichelli C, et al. Chitosan/heparin polyelectrolyte complexes as ion-paring approach to encapsulate heparin in orally administrable SLN: in vitro evaluation[J]. Colloids Surf A, 2021, 608: 125606. |
| [83] |
Lee MC, Huang YC. Soluble eggshell membrane protein-loaded chitosan/fucoidan nanoparticles for treatment of defective intestinal epithelial cells[J]. Int J Biol Macromol, 2019, 131: 949-958. |
| [84] |
Boni FI, Almeida A, Lechanteur A, et al. Mucoadhesive nanostructured polyelectrolytes complexes modulate the intestinal permeability of methotrexate[J]. Eur J Pharm Sci, 2018, 111: 73-82. |
| [85] |
Di JW, Du YM, Gao X, et al. Research progress of layer-by-layer self-assembly technology in drug delivery[J]. Acta Pharm Sin (药学学报), 2020, 55: 2595-2605. |
| [86] |
Alkekhia D, Hammond PT, Shukla A. Layer-by-layer biomaterials for drug delivery[J]. Annu Rev Biomed Eng, 2020, 22: 1-24. |
| [87] |
Oshi MA, Lee J, Naeem M, et al. Curcumin nanocrystal/pH-responsive polyelectrolyte multilayer core-shell nanoparticles for inflammation-targeted alleviation of ulcerative colitis[J]. Biomacromolecules, 2020, 21: 3571-3581. |
| [88] |
Siboro SAP, Anugrah DSB, Ramesh K, et al. Tunable porosity of covalently crosslinked alginate-based hydrogels and its significance in drug release behavior[J]. Carbohydr Polym, 2021, 260: 117779. |
| [89] |
Kono H, Otaka F, Ozaki M. Preparation and characterization of guar gum hydrogels as carrier materials for controlled protein drug delivery[J]. Carbohydr Polym, 2014, 111: 830-840. |
| [90] |
Laroui H, Dalmasso G, Nguyen HT, et al. Drug-loaded nanoparticles targeted to the colon with polysaccharide hydrogel reduce colitis in a mouse model[J]. Gastroenterology, 2010, 138: 843-853. |
| [91] |
Shanmugapriya K, Kim H, Kang HW. Epidermal growth factor receptor conjugated fucoidan/alginates loaded hydrogel for activating EGFR/AKT signaling pathways in colon cancer cells during targeted photodynamic therapy[J]. Int J Biol Macromol, 2020, 158: 1163-1174. |
| [92] |
Stealey S, Guo X, Majewski R, et al. Calcium-oligochitosan-pectin microcarrier for colonic drug delivery[J]. Pharm Dev Technol, 2020, 25: 260-265. |
| [93] |
Xu W, Su W, Xue Z, et al. Research on preparation of 5-ASA colon-specific hydrogel delivery system without crosslinking agent by mechanochemical method[J]. Pharm Res, 2021, 38: 693-706. |
| [94] |
Ding YF, Sun T, Li S, et al. Oral colon-targeted konjac glucomannan hydrogel constructed through noncovalent cross-linking by cucurbit 8 uril for ulcerative colitis therapy[J]. ACS Appl Bio Mater, 2020, 3: 10-19. |
| [95] |
Zhang S, Kang L, Hu S, et al. Carboxymethyl chitosan microspheres loaded hyaluronic acid/gelatin hydrogels for controlled drug delivery and the treatment of inflammatory bowel disease[J]. Int J Biol Macromol, 2021, 167: 1598-1612. |
| [96] |
Pandey M, Choudhury H, D/O Segar Singh SK, et al. Budesonide-loaded pectin/polyacrylamide hydrogel for sustained delivery: fabrication, characterization and in vitro release kinetics[J]. Molecules, 2021, 26: 2704. |
| [97] |
Vakili MR, Mohammed-Saeid W, Aljasser A, et al. Development of mucoadhesive hydrogels based on polyacrylic acid grafted cellulose nanocrystals for local cisplatin delivery[J]. Carbohydr Polym, 2021, 255: 117332. |
| [98] |
Rakhshaei R, Namazi H, Hamishehkar H, et al. Graphene quantum dot cross-linked carboxymethyl cellulose nanocomposite hydrogel for pH-sensitive oral anticancer drug delivery with potential bioimaging properties[J]. Int J Biol Macromol, 2020, 150: 1121-1129. |
| [99] |
Omer AM, Ahmed MS, El-Subruiti GM, et al. pH-Sensitive alginate/carboxymethyl chitosan/aminated chitosan microcapsules for efficient encapsulation and delivery of diclofenac sodium[J]. Pharmaceutics, 2021, 13: 338. |
| [100] |
Park W, Bae BC, Na K. A highly tumor-specific light-triggerable drug carrier responds to hypoxic tumor conditions for effective tumor treatment[J]. Biomaterials, 2016, 77: 227-234. |
| [101] |
Necas J, Bartosikova L. Carrageenan: a review[J]. Vet Med, 2013, 58: 187-205. |
| [102] |
Zimmer S, Grebe A, Bakke SS, et al. Cyclodextrin promotes atherosclerosis regression via macrophage reprogramming[J]. Sci Transl Med, 2016, 8: 333ra350. |
 2022, Vol. 57
2022, Vol. 57