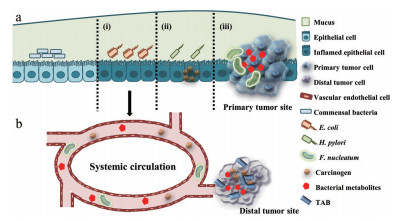
微生物组是指微生物及其遗传物质在特定环境中的集合。人体肠道微生物组参与调节宿主的诸多生理和病理过程, 包括新陈代谢、炎症、免疫和细胞反应等。细菌感染引起的炎症、细菌分泌致癌物质及菌群失调引起的免疫调节等均是形成癌症的诱因(图 1a)。某些致癌性大肠杆菌(Escherichia coli, E. coli) 菌株会引发炎症并在炎症部位特异性扩张, 炎症通过影响局部微生物群的组成促进癌症的发生[1] (图 1a-ⅰ)。幽门螺旋杆菌(Helicobacter pylori, H. pylori) 分泌的IV型细菌衍生致癌物与胃癌的产生、发展密切相关(图 1a-ⅱ)。具核梭杆菌(Fusobacterium nucleatum, F. nucleatum) 通过黏附和侵袭肠道上皮细胞, 随后经β-catenin信号传导诱发炎症反应及结直肠癌症[2] (图 1a-ⅲ)。这些细菌引起的炎症、致癌物质的生成及其他病理改变(如活性氧、DNA损伤及肠道通透性的增加) 是细菌及其他微生物引起癌症的主要原因[3, 4]。此外, 致癌细菌不仅存在于原发肿瘤部位和宿主胃肠道微生物组, 同样在远端肿瘤部位如转移淋巴结和肝脏转移灶中被检出(图 1b)。在远端肿瘤转移中发现的细菌被定义为肿瘤相关细菌(tumor-associated bacteria, TAB)。近年来对于源自肠道的微生物组或细菌代谢物引发和影响非肠道癌症机制的探究[3, 5]已成为研究热点, 同时也有文献探讨了肠道微生物组中的细菌群落如何定植至远端肿瘤部位影响患者生存的过程[6]。
|
Figure 1 The role of bacteria and microbiome in the tumor microenvironment. a: The carcinogenic mechanism of bacteria or microbiome in the gut. (ⅰ) The inflammation caused by E. coli can affect microbiota composition and promote carcinogenesis; (ⅱ) H. pylori secretes type IV carcinogen; (ⅲ) F. nucleatum causes inflammation and carcinogenesis through adhesion and invasion of epithelial cells; b: Tumor-associated bacteria at the distal tumor site. E. coli: Escherichia coli; H. pylori: Helicobacter pylori; F. nucleatum: Fusobacterium nucleatum; TAB: Tumor-associated bacteria |
除致癌作用外, 肠道微生物组还能改变免疫治疗和化学治疗的疗效和毒性。广谱抗生素对微生物群的破坏已证实会对癌症的免疫治疗[7]产生负反馈作用。大量证据表明共生微生物群在调节癌症治疗的免疫反应方面具有重要作用[5], 通过给药和肠道定植共生细菌的方式调节微生物组可使免疫疗法的疗效增强[8-11]。同样地, 在对临床前模型的研究[12]中, 肠道和其他部位的微生物组被证明会影响宿主的化疗效果。开发针对肠道微生物群的治疗策略(如抗生素/益生菌/益生元) 或将减轻化疗对肠道的破坏作用和化疗药物产生的不良反应。
目前的微生物组调节方法(如饮食调整、益生菌、益生元、抗生素和粪便微生物群移植等) 缺乏靶向调节的特异性, 只能通过口服给药途径与微生物组发生相互作用, 不能在胃肠道以外的部位发挥疗效[13-15]。纳米技术作为连接微观小分子与宏观尺度之间的桥梁, 可通过干预小分子代谢物、细菌和肿瘤之间的相互作用来提高癌症治疗的疗效。在癌症防治的微生物组调控领域, 纳米技术的应用虽仍处于起步阶段, 但现有的一些成果已证明了其巨大潜力。本综述讨论了纳米技术用于微生物组干预的优势, 重点介绍了纳米技术通过干预微生物组代谢物或调节微生物组来改善癌症治疗的创新性研究, 并探讨了应用纳米技术调控微生物组治疗癌症的挑战和前景。
1 干预微生物组的纳米技术特性在过去30年里, 纳米技术在癌症治疗中的应用得到了广泛研究。第一代纳米药物能透过血管, 通过增强渗透性和滞留效应[16]在肿瘤处蓄积, 已被批准用于临床。第二代纳米药物目前正在进行临床试验, 能在第一代的基础上增加诸如组织靶向[17]、联合传递[18]和刺激响应[19]等功能。第三代纳米药物具有更强的创新性, 具备免疫调节[20]、生物屏障穿透[21]和“自我识别”等特性[22, 23]。这几代纳米药物的开发与发展得益于表面修饰、封装和缓控释方法等技术的成熟。
肠道微生物组由数万亿种微生物组成, 位于由黏液屏障、管腔及其内容物和肠道内皮细胞组成的界面上, 是一个极其复杂的环境。研究表明, 现有的纳米技术可靶向特定微生物[24]、靶向递送药物至肠道和炎症部位[25], 使其通过黏液渗透或上皮细胞运输进入体循环[26]。因此, 可利用现有纳米技术工具来设计靶向微生物组微环境的纳米粒。本文将重点介绍利用纳米技术干预微生物组-肿瘤微环境或肿瘤转移部位的TAB及其代谢物, 以增强癌症治疗疗效的具体实例。
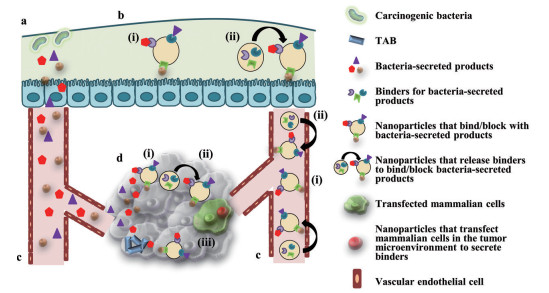
2 调控微生物组代谢物的纳米技术在肠道表面或肿瘤转移灶上, 微生物组、其代谢物和免疫系统之间的相互作用会对癌症的发生和治疗产生深远影响。细菌分泌的毒素(如细胞致死性肿胀毒素、脆弱类杆菌毒素或大肠杆菌素) 可直接诱导DNA损伤反应[3]; 而厌氧菌分泌的短链脂肪酸(如丁酸) 则通过上调p21基因的表达[27]起到抑制肿瘤的作用; 由革兰阴性菌菌体裂解后产生的内毒素会促进炎症, 破坏免疫系统进而影响免疫治疗的疗效[28]。大部分细菌代谢物及其在癌症中的作用尚在探索和研究中[29]。目前来看, 利用纳米技术调控微生物信号/代谢物或干扰有害微生物与宿主细胞之间的相互作用有望成为预防癌症或促进现有疗法疗效的新型治疗方式。纳米技术可用于与肠道、血液系统或原发性/转移性肿瘤中的毒素、致癌物和免疫抑制剂等细菌分泌物产生相互作用, 并通过直接结合或释放阻断剂等其他方式灭活这些细菌代谢物(图 2)。
|
Figure 2 Nanotechnology strategies to interfere with microbiome signals/metabolites. a: Nanotechnology to interfere with bacterial metabolites such as toxins, carcinogens and immunosuppressants; b: Nanotechnology intervention in the gut can (ⅰ) bind or (ⅱ) secrete binders against bacterial metabolites; c: Nanotechnology intervention in the vascular system can (ⅰ) bind or (ⅱ) secrete binders against bacterial metabolites; d: Nanotechnology intervention at tumor site can (ⅰ) bind or (ⅱ) secrete binders against bacterial metabolites or (ⅲ) transfect mammalian cells in the tumor microenvironment to secrete binders |
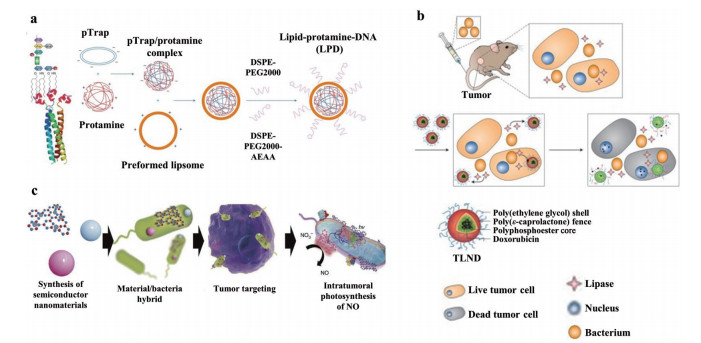
脂多糖(lipopolysaccharide, LPS) 是革兰阴性菌细胞壁的主要成分, 能激活Toll样受体4 (Toll-like receptor 4, TLR4)、核因子-κB (nuclear factor kappa-B, NF-κB) 通路和转录激活因子3 (signal transducer and activator of transcription 3, STAT3)[30]。LPS引发的致癌基因激活与结直肠癌、肝癌和其他癌症的发生密切相关[31, 32]。Song等[33]运用新型纳米技术构建了一种可结合LPS的融合蛋白(LPS-trap protein), 能通过阻断LPS与TLR4的结合进而阻止致癌基因激活, 起到提高免疫治疗疗效的作用。研究者分别在实验小鼠体内建立了原位和皮下结直肠肿瘤两种模型。对原位肿瘤和皮下肿瘤的LPS分析显示, 原位肿瘤中的LPS含量是皮下肿瘤的60倍以上。通过口服抗生素(如多黏菌素B) 清除肠道中的革兰阴性菌可降低LPS含量, 恢复T细胞浸润, 逆转原位肿瘤中免疫抑制的微环境。研究者利用现有的脂质-鱼精蛋白-DNA (lipid-protamine-DNA, LPD) 纳米粒基因递送系统[34]成功得到了LPS-trap蛋白(图 3a)。具体来说, 首先通过静脉注射的方式将LPS-trap纳米粒输送到原位肿瘤, 使其选择性表达并释放LPS-trap蛋白, 以阻断肿瘤微环境中LPS与TLR4受体的结合。与单独的抗PD-L1 (programmed death-ligand 1) 免疫治疗相比, 此治疗方案可增加原位肿瘤中的T细胞浸润, 显著抑制肿瘤生长。与单独使用LPS-trap蛋白相比, 将此纳米粒与抗PD-L1免疫治疗联合使用后, 其抑制肿瘤的有效性提高了5倍以上。该项研究利用纳米技术的现有优势调控微生物组-肿瘤之间的相互作用, 为提高传统免疫疗法的有效性提供了良好借鉴意义。
|
Figure 3 Examples of nanotechnology that manipulate or respond to microbiome signals/metabolites. a: Preparation of lipopolysaccharide Trap plasmid (pTrap) loaded with LPD nanoparticles (Adapted from Ref. 33 with permission. Copyright © 2018 John Wiley and Sons); b: Differential administration of doxorubicin triple-layer nanogels (TLND) on the lipase-secreting bacteria infected tumor (Adapted from Ref. 38 with permission. Copyright © 2013 American Chemical Society); c: Schematic of the preparation and function of a C3N4-bacteria hybrid [Adapted from Ref. 39 with permission. Copyright © The Author(s) 2018]. DSPE: 1, 2-Distearoylphosphatidylethanolamine; AEAA: N-(2-Aminoethyl)-4-methoxybenzamide; NO: Nitric oxide; PEG: Polyethylene glycol; TLND: Triple-layered polyethylene glycol/poly(ε-caprolactone)/polyphosphoester nanogel |
在结肠中定植的原发肿瘤细菌会破坏肠道上皮, 最终以TAB的形式存在于肿瘤转移灶部位, 如结直肠癌中最常见的细菌具核梭杆菌[35]经常出现在远端肝转移瘤中。已知TAB会影响炎症、免疫反应和机体对化疗药物的耐药性[36, 37], 因此TAB及其代谢物可代表一个潜在的干预靶点。之前的一项研究[38]阐述了TAB分泌的代谢物(细菌脂肪酶) 可加速降解多柔比星负载的纳米粒, 从而实现药物在肿瘤部位的刺激响应释放(图 3b)。研究者设计了一种三层的聚乙二醇/聚(ε-己内酯)/聚磷酸酯纳米凝胶(triple-layered polyethylene glycol/poly(ε-caprolactone)/polyphosphoester nanogel, TLND), 其首先在体内细菌脂肪酶的作用下降解, 随后将包裹的多柔比星释放到肿瘤微环境中。体外实验证实, 只有在细菌脂肪酶存在的环境中, TLND才能发生降解并释放多柔比星, 从而诱导对H22肝癌细胞的毒性。然后, 研究者建立了一种肝癌异种移植动物模型, 通过感染一种可分泌脂肪酶的金葡菌SBY1来模拟含有TAB的实体瘤。与标准多柔比星治疗相比, TLND系统给药可使肿瘤重量降低2倍以上; 与无TAB实体瘤的TLND治疗相比, TLND治疗可使肿瘤重量降低4倍以上。上述结果证明了实验者所设计的纳米粒在肿瘤微环境中具备响应细菌脂肪酶的刺激并作出反应的能力。该技术通过细菌代谢物介导刺激响应, 随后控制释放抗癌药物, 有望实现一种新的治疗方式。
用丰富的外源电子给细菌充电可促进其内在代谢活动, 并提高细菌的抗肿瘤能力。一项来自武汉大学的研究[39]展示了一种用纳米光催化剂“充电”细菌以增强其代谢活性的策略。已知一氧化氮(nitric oxide, NO) 浓度较高的环境可引发肿瘤细胞的凋亡。为提升细菌合成NO的能力, 研究人员将碳量子点掺杂的碳化氮(carbon nitride, C3N4)[40]负载到携带NO产生酶的大肠杆菌MG1655上, 用于光控细菌代谢物治疗。在光照下, C3N4产生的光电子转移到大肠杆菌中, 将内源性NO3-转化为具有细胞毒性的NO (图 3c), 最终负载C3N4的细菌会在整个肿瘤中积累并释放NO, 达到抑制肿瘤生长的目的。
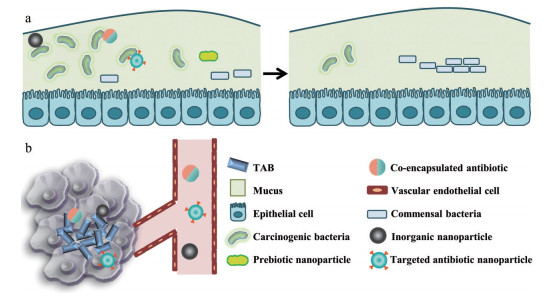
3 调控微生物组的纳米技术改变微生物组组成以预防或治疗癌症的策略包括增加有益菌[41]、减少致癌菌[3]或调节现有共生种群[15]并促进有益抗癌菌的增殖等3种策略(图 4)。下文将对这3类不同的纳米技术策略展开对比和讨论。Pan等[42]通过在多巴胺沉积聚合过程中加入相应的功能性小分子或聚合物, 使其和多巴胺共同涂层到益生菌表面, 成功给益生菌穿上了一层多功能外衣。经过表面修饰的益生菌能够在抵抗胃液、胆汁侵蚀的同时, 借助壳聚糖的靶向能力增加在病灶部位的富集, 从而显著改善肠炎治疗的效果(图 5)。Angsantikul等[24]将胃上皮AGS细胞(gastric epithelial cell) 的细胞膜包被在负载抗生素的聚合物核上, 成功构建了一种仿生纳米粒子。该仿生纳米粒与AGS细胞有相同的表面抗原, 因此对幽门螺杆菌具有固有的黏附性。这种利用分子靶向机制来提高幽门螺杆菌清除效率的方法有望成为预防癌症的新策略(图 6a)。张先正教授团队[43]提出了一种基于噬菌体的生物无机杂交系统, 通过操纵肠道微生物组来抑制结直肠癌的发展, 并进一步重建肿瘤免疫微环境(图 6b)。此外, 该课题组[44]还报道了一种基于噬菌体介导的靶向纳米技术, 该技术能通过递送益生元对微生物组进行调节, 从而上调抗癌共生微生物的表达并有效提升肿瘤化疗的效果(图 7)。
|
Figure 4 Nanotechnology strategies to regulate the microbiome. a: In the gut; b: In the distal tumor microenvironment |
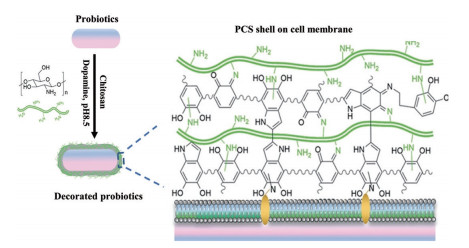
|
Figure 5 Multifunctional strategy on polymerization-mediated dopamine and chitosan co-deposition coating to modify probiotics surface (Adapted from Ref. 42 with permission. Copyright © 2021 John Wiley and Sons). PCS: Chitosan co-deposited polydopamine |

|
Figure 6 Examples of nanotechnology to reduce carcinogens. a: Preparation of gastric epithelial cell membrane-coated nanoparticles for targeted antibiotic delivery to treat Helicobacter pylori infection (Adapted from Ref. 24 with permission. Copyright © 2018 John Wiley and Sons); b: Phage-based biological/non-biological hybrid system (M13@Ag) for anti-tumor specific immunotherapy (Adapted from Ref. 43 with permission. Copyright © 2020 The American Association for the Advancement of Science). AGS: Gastric epithelial cell; PLGA: Poly(lactic-co-glycolic acid); AGS-NP: Nanoparticles coated with AGS; DC: Dendritic cell; MDSC: Myeloid-derived suppressor cell; AgNP: Silver nanoparticles |
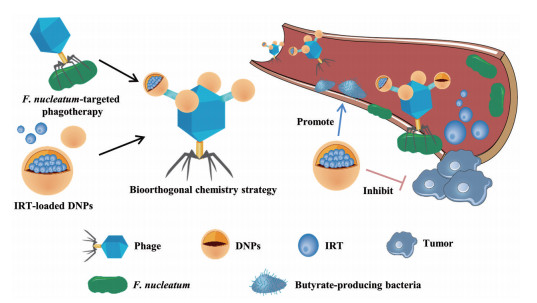
|
Figure 7 Phage targeting mediated biological-non-biological hybrid nanotechnology for the treatment of colorectal cancer. DNPs: Dextran nanoparticles; IRT: Irinotecan |
益生菌是通过定植在人体内, 改变宿主某一部位菌群组成的一类对宿主有益的活性微生物。益生菌及其代谢产物能通过调节细胞新陈代谢、上皮屏障功能和免疫反应[41, 45]有效抑制病原菌的发展和肠道炎症的发生, 保护肠道屏障并维持肠道菌群结构平衡, 发挥一定的抗肿瘤作用[46]。通过口服途径将有益菌递送至肠道是一种简便又行之有效的肠道菌群调节方法, 但面临着由胃酸和胆汁酸破坏导致的口服利用度低、肠道微生物带来的定植抵抗及缺乏靶向性等问题[47]。
对细菌进行改造是解决这些问题的可行方法。刘尽尧教授团队[48]于2019年率先提出了“细菌隐身”策略, 首先通过界面涂层给益生菌穿上一件细胞膜防护外衣, 该防护层能在显著降低体内巨噬细胞吞噬的同时防止细菌毒素的外排, 从而提高细菌药物的体内安全性。在此基础上, 该团队[49]进一步通过界面自组装技术在细菌药物的表面覆盖一层具有较强稳定性的脂质体保护层, 使所包裹的细菌对胃酸和胆汁酸等破坏性因素产生良好的抵抗能力。受自然界生物膜启发, 该团队[50]于2020年又提出了一种更便捷、高效、持续的细菌封装技术, 即经过在体外特殊条件下培养, 诱导细菌在生长过程中分泌细胞外基质, 从而在细菌表面形成一层兼具黏附功能和疏水保护功能的外衣。该方法能确保益生菌在体内分裂增殖的过程中一直保持被包裹状态, 从而实现长效的保护效应。刺激响应性药物递送系统可实现药物的靶向和可控递送[51], 有利于提高药物疗效并降低药物的不良反应。鉴于此, 该团队[52]报道了一种通过抑制可触发纳米涂层内的细菌来按需重新激活的方法。首先通过将细菌单独限制在完整的聚合物涂层中而使细菌暂时失活, 在接收到生物学相关信号刺激时, 涂层可在目标位置进行脱离并智能释放所包裹的细菌。从涂层中释放的益生菌能快速恢复原有活性, 从而发挥其相应的精准诊断作用和保护肠道黏膜的治疗效果。
细胞治疗过程中面临着复杂的细胞相互作用和靶标多样性的问题, 传统的表面修饰过程繁琐复杂, 并且限制了对不同细胞的普适性[53]。大多数已报道的修饰方法仅涉及单一的细胞保护功能, 目前亟需一种能够兼具保护细胞和多功能化细胞作用的策略来工程化改造细胞, 以达到增强细胞疗法的目的。为了实现细菌的靶向递送、提高细菌生物疗法的效果, Pan等[42]发表了一项最新研究进展, 报道了一种聚合介导的细菌表面多功能化修饰新策略(图 5)。
聚多巴胺(polydopamine, PDA) 是一种受贻贝中黏附蛋白启发的合成材料[54], 由于其邻苯二酚基团具有很强的黏附性, 因此被广泛用作各种材料表面的包被层[55, 56]。研究者通过在多巴胺聚合过程中加入少量壳聚糖[57], 可使益生菌Escherichia coli Nissle 1917 (EcN) 表面形成聚多巴胺和壳聚糖的共沉积涂层(chitosan co-deposited PDA, PCS), 实现了益生菌在结肠部位的有效富集。体内成像系统(in vivo imaging system, IVIS) 的成像结果表明, 与聚多巴胺涂层组和未涂层组相比, PCS包裹的EcN (EcN@PCS) 组在小鼠腹部显示出最高的荧光强度, 验证了PCS涂层可以提高口服生物利用度。体外成像结果显示, EcN@PCS组小鼠的结肠炎切片中的荧光信号比未涂层组高5倍以上, 而肠道中的总荧光强度仅高出2倍, 进一步说明与壳聚糖共沉积增加了益生菌在病变结肠中的积聚[58]。在葡聚糖硫酸钠诱导的小鼠动物模型中, 相比未涂层、聚多巴胺涂层及一线临床药物乙酰水杨酸, 共沉积涂层益生菌在炎症缓解方面取得了更优的效果。此外, 作者还验证了该表面修饰方法在改造真菌、真核细胞表面的普适性。聚合介导的活细胞表面多功能化修饰策略为制备细菌介导的智能生物制剂提供了一种重要的手段, 并有望进一步推动益生菌疗法的转化应用。
3.2 减少致癌菌的纳米技术治疗策略抗生素常用于杀灭病原菌和调节微生物组成[59]; 然而, 广谱抗生素的使用会导致抗生素耐药性的产生、共生微生物组的急剧变化及癌症相关的生物失调[60, 61]和炎症[62]发生。目前纳米技术已被用来装载和输送抗生素来杀死致病菌、致癌菌等有害细菌[63, 64]。天然具有抗菌活性的无机纳米粒可通过产生活性氧自由基[65]杀灭致癌细菌, 如银纳米粒单独使用或与常规疗法联合使用时都显示出了较好的抗癌能力[66]。在一个临床病例中, 常规治疗手段对患有侵袭性癌症的患者没有较好的临床改善, 且不能很好地控制肿瘤在肺部和肝脏的转移和扩散, 在使用银纳米粒子溶液3个月后, 患者的临床症状得到显著改善, 不再有任何肺和肝转移[67]。然而这类抗菌的无机纳米粒大多没有选择性, 仅起到非特异性的广谱抗生素作用, 可能会破坏肠道微生物的平衡。
有针对性地将抗生素输送到与肠癌有关的特定细菌(如幽门螺杆菌、具核梭杆菌), 可减轻广谱抗生素对共生微生物群产生的不利影响, 起到更高效的抗菌和抗肿瘤作用(图 4a)。有研究表明[68]包被有4, 6-二氨基-2-嘧啶硫醇(4, 6-diamino-2-pyrimidinethiol, DAPT) 的金纳米粒(DAPT-coated Au nanoparticles, D-Au NPs) 对革兰阴性致病菌有一定抑制作用, 而对以革兰阳性菌属为主的肠道微生物群无效, 可用于治疗肠道中大肠杆菌引发的细菌感染。与传统抗生素(左氧氟沙星) 治疗相比, 口服D-Au NPs可在不破坏肠道菌群的前提下, 更高效地治愈小鼠的大肠杆菌感染。经过28天的长期给药后, 可观察到D-Au NPs不仅对肠道上皮细胞没有损伤作用, 还能增加典型益生菌的相对丰度、维持肠道内菌群的平衡, 可作为传统抗生素的替代品用于治疗细菌感染。
此外, 包载抗生素的纳米技术可通过全身给药方式在肿瘤的远端转移部位杀死TAB (图 4b)。Ren等[69]通过将Fe@Fe3O4纳米粒与人参皂苷Rg3偶联, 制备了一种具有良好偶联效果的纳米药物(Fe@Fe3O4 nanoparticles conjugate with ginsenoside Rg3, NpRg3)。人参皂苷Rg3是一种新的自噬抑制剂, 体内研究显示, 人参皂苷Rg3与多柔比星有协同作用, 能抑制肝癌的生长[70]。在二甲基亚硝胺诱导的肝癌模型中, NpRg3的应用显著抑制了肝癌的发展, 消除了肝癌的肺部转移, 并延长了肝癌小鼠的生存期。在肝癌的进程中, NpRg3的应用一方面增加了拟杆菌和疣微菌的丰度, 另一方面降低了厚壁菌的丰度, 能显著延缓肝癌诱导的回盲部形态和肠道微生物组改变。上述实验结果表明, 特定的肠道细菌与结直肠癌和肝细胞癌的治疗效果密切相关, 人参皂苷Rg3与Fe@Fe3O4纳米粒的偶联药物可通过重塑体内肠道微生物群和改变代谢来抑制肝癌的发展及转移, 为抗肿瘤治疗提供了一种新思路。
纳米技术可通过表面修饰对抗生素进行包裹和靶向传递, 使其功能化地穿越黏膜和上皮屏障, 最终以受控的方式释放抗生素。靶向抗生素可在选择性地杀死特定微生物的同时避免对共生微生物群造成破坏。聚乳酸、聚癸二酸、聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid), PLGA] 和聚丙烯酸等疏水聚合物具有黏附性, 当这些聚合物被包裹在纳米粒表面时, 可通过氢键和疏水相互作用吸附到胃肠道屏障上。由中性和亲水性聚合物组成的纳米粒, 如聚乙二醇化聚乳酸纳米粒, 在模拟胃肠液中可发生聚集和降解[71]。Angsantikul等[24]利用胃上皮细胞膜(AGS细胞) 包裹负载克拉霉素的PLGA制备得到一种仿生纳米粒。由于胃上皮细胞膜上的受体和幽门螺杆菌表面的黏附素之间存在固有的相互作用, 因此该AGS细胞膜包被的仿生纳米粒能优先与幽门螺杆菌相结合(图 6a)。电子显微镜和共聚焦显微镜的扫描结果证实, 该纳米粒会对幽门螺杆菌产生靶向作用。与非靶向纳米粒、游离抗生素和阴性对照组相比, 在活体幽门螺杆菌感染模型中, 该靶向纳米粒改善了胃中幽门螺杆菌的杀灭效果。这项工作报道的仿生纳米治疗策略代表了一个多功能的递送平台, 阐明了利用天然宿主细胞膜功能化药物纳米载体的前景和优势。
噬菌体引导的靶向方法能直接将纳米粒靶向于携带有具核梭杆菌的肿瘤, 同时选择性杀死致癌的具核梭杆菌。在前期研究的基础上, Dong等[43]提出了一种基于肠道微生物群调控的新型免疫治疗策略(图 6b)。首先通过噬菌体展示技术[72]筛选出了一株可特异性识别具核梭杆菌的温和性丝状噬菌体(M13)。随后, 进一步合成并评估了8种不同的纳米粒, 发现对具核梭杆菌杀伤效果最好的是银纳米粒(silver nanoparticles, AgNP)。将AgNP与M13噬菌体的衣壳蛋白通过静电作用自组装, 通过沉淀法即可获得负载银纳米粒的噬菌体(M13@Ag)[73]。动物实验证明, 噬菌体可特异性富集在携带有具核梭杆菌的肿瘤中, 并进一步介导银纳米粒在肿瘤部位对具核梭杆菌的杀伤作用。M13@Ag在肿瘤微环境积累后, 银纳米粒利用噬菌体的精细识别机制选择性杀死原生具核梭杆菌, 阻断髓样来源的免疫抑制细胞(myeloid-derived suppressor cell, MDSC) 募集。此外, M13噬菌体作为一种病毒具有高度的免疫原性[74, 75], 可用其原始外壳蛋白直接刺激宿主免疫系统, 从而诱导树突细胞(dendritic cell, DC) 成熟并促进M1表型肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs) 的活化[76]。体内外实验均表明, M13@Ag治疗可清除肠道内的具核梭杆菌, 并导致肿瘤部位MDSC的扩增减少, 显著增强结直肠癌患者的抗肿瘤免疫应答。当联合结肠癌一线化疗药物或者免疫检查点抑制剂时, 可进一步显著提高结肠肿瘤的治疗效果及患者存活率。该研究综合利用了生物学和材料学方法, 通过调控肠道菌群有效提高了肿瘤免疫治疗的效果。
3.3 调节现有共生种群的纳米技术治疗策略益生元系指一些不被宿主消化吸收却能选择性地促进体内有益菌的代谢和增殖, 从而改善宿主健康的有机物质[77]。在抗癌作用方面, 纳米技术可用来配制和输送益生元, 特异性地调节抗癌共生菌的增殖或代谢[78] (图 4a)。基于纳米技术的益生元系统策略可通过使用刺激响应(如pH、细菌代谢物) 释放机制或针对特定细菌种类的靶向策略, 精准地将益生元输送到肠道中的特定微生物生态位[59]。
在近期工作中, Dong等[43]设计了一种基于噬菌体引导的生物-非生物杂化纳米材料的肠道-微生物群调节疗法, 用来改善结直肠癌的治疗效果(图 7)。首先, 从人类唾液(P2) 中分离出一种能感染、繁殖并溶解细菌[79]的噬菌体, 证明它能清除致癌性具核梭杆菌。随后研究人员合成了一种负载有化疗药物伊立替康的葡聚糖纳米粒(irinotecan-loaded dextran nanoparticles, IDNP), 在生理环境下, 叠氮化的噬菌体(azide-modified phages, A-phage) 可通过生物正交反应[80]与二苯基环辛炔(azodibenzocyclooctyne, DBCO) 修饰的IDNPs (DBCO-modified IDNPs, D-IDNPs) 共价连接形成噬菌体介导的纳米药物(A-phage-D-IDNPs), 靶向于携带具核梭杆菌的结直肠癌部位。噬菌体通常具有高度特异性, 能消灭单一种类的细菌, 而不影响其他细菌, 因此噬菌体的靶向性是治疗结直肠癌多层策略的第一步。短链脂肪酸(short-chain fatty acids, SCFAs) 是膳食纤维微生物发酵的副产品, 被认为是肠道内环境平衡的重要调节因子[81]。本研究中分离的P2噬菌体对具核梭杆菌以外的其他5种细菌表现出较小的抑制作用, 其中包括能分泌短链脂肪酸的丁酸梭菌。丁酸梭菌是肠道内的有益菌, 有促进肠道营养、免疫和调节肠道菌群的作用, 已被证明能抑制结直肠癌的发展[78]。选择合适的纳米技术材料需考虑该材料促进丁酸梭菌生长的能力, 研究者评估了以金、葡聚糖等为基础的8种纳米粒对具核梭杆菌和丁酸梭菌生长的影响, 结果表明, 葡聚糖纳米粒使丁酸梭菌的数量增加了5倍以上。该实验中的葡聚糖起到了益生元[82]的作用, 通过降解纳米粒促进了丁酸杆菌的生长, 增加了结直肠癌部位丁酸梭菌的丰度。这一方法提供了治疗结直肠癌多层策略的第二种机制。众所周知, 伊立替康是一种临床使用的抗结直肠癌化疗药物, 通过选择性抑制拓扑异构酶Ⅰ (topoisomerase Ⅰ, Top Ⅰ) 从而有效地抑制肿瘤细胞的增殖。将伊立替康包裹在葡聚糖纳米粒中, 提供了第三种杀灭结直肠癌细胞的新机制。在结直肠癌的治疗模型中, 与单独的抗生素、伊立替康或非靶向纳米粒组相比, 噬菌体、益生元葡聚糖纳米粒和伊立替康三者联合治疗组的生存优势显著。该项研究综合利用了生物学、化学和材料学方法, 通过噬菌体靶向递送益生元和释放化疗剂的纳米粒, 在促进共生抗癌菌生长的同时抑制了具核梭杆菌和肿瘤细胞的增殖, 从而证明了纳米技术在治疗结直肠癌领域的巨大潜力。
4 总结与展望微生物组学(microbiomics) 是继基因组学以后, 生命科学与生物技术研究领域的重大突破之一, 在医疗健康、农业、生态环境和工业制造方面具有广阔的应用前景。微生物组中的微生物平衡及其相关的反馈回路是一种动态的生态系统。微生物从宿主身上汲取养分, 宿主借助微生物降解一些自身不能分解利用的物质[83]。该平衡一旦被打破, 其中的生物失调、炎症[84]等机制与癌症的产生密切相关, 甚至能改变癌症治疗的疗效[12, 85]。本综述中重点介绍的纳米技术具备高度特异性和靶向性、刺激响应性、生物相容性以及免疫调节功能, 可通过干扰微生物组信号/细菌代谢物(图 2), 或通过调节微生物组/靶向杀死TAB (图 4) 的机制来改善癌症治疗, 具有实际应用转化前景[86]。
微生物组是患者特有的生态系统, 会随着饮食[87]、药物[88]和其他外部因素的变化而发生动态变化, 因此纳米技术必须能够适应微生物组各种变化的条件和状态, 以保证执行其输送、释放和微生物组调节的功能。由于这些因素目前还不能在临床上预测, 纳米技术在微生物组干预中的起始研究集中在靶向特定已知作用的微生物或代谢物。事实上, 准确识别肠道或远端转移组织中的致癌微生物在目前看来仍是一个难题。通过将过去在肿瘤和癌细胞[89]或致病微生物[90]的成像、诊断和检测方面的纳米技术与体内靶向致癌细菌的新纳米技术相结合, 可初步实现对体内致癌微生物及其代谢物的检测。利用纳米技术对致癌细菌进行早期检测, 也许能成为预防癌症或防止致癌细菌繁殖的手段。
用于微生物组干预的纳米技术还将面临与当前癌症纳米技术相同的挑战, 例如如何提高靶向效率和生物利用度、如何降低毒性和不良反应, 以及如何克服患者之间的肿瘤异质性[91]。其中许多因素是由纳米粒设计标准(如材料选择) 及其性质(如尺寸、形状和表面电荷) 决定的。了解这些参数如何影响和控制纳米粒与靶细胞和非靶细胞的相互作用是纳米技术研究的一个热门领域; 然而, 探究纳米粒特性和微生物之间相互作用的有关研究却相当匮乏。随着纳米技术逐渐被用于微生物组的应用领域, 未来将出现一个新的领域, 专注于探究常见纳米粒材料的影响, 以及一种纳米粒的特性如何改变体内共生细菌和致癌细菌的数量和比例。这将带来一项新的、以微生物为核心的新纳米技术, 有朝一日也许能用于特定的微生物组干预。
随着微生物组在癌症和其他疾病(如自身免疫、神经系统和炎症性疾病) 中的作用被不断发现[92-95], 调控微生物组以了解疾病和治疗相关的影响也许会带来新的微生物靶标和治疗其他疾病的机会。总体而言, 将纳米技术用于微生物组干预来治疗癌症仍然是一个新领域, 具有进一步研究的巨大潜力, 很可能成为精准和个性化医学的下一个前沿领域之一。
作者贡献: 龚瑜贝负责全文的撰写及修改; 李少广负责部分章节的撰写和插图绘制; 洪煜璐、谢德晖、郑珊珊负责文献检索和资料收集; 孙漩嵘负责文章的审阅, 提供了重要的指导意见。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Arthur JC, Perez-Chanona E, Muhlbauer M, et al. Intestinal inflammation targets cancer-inducing activity of the microbiota[J]. Science, 2012, 338: 120-123. DOI:10.1126/science.1224820 |
| [2] |
Rubinstein MR, Wang XW, Liu WD, et al. Fusobacterium nucleatum promotes colorectal carcinogenesis by modulating E-cadherin/beta-catenin signaling via its FadA adhesin[J]. Cell Host Microbe, 2013, 14: 195-206. DOI:10.1016/j.chom.2013.07.012 |
| [3] |
Schwabe RF, Jobin C. The microbiome and cancer[J]. Nat Rev Cancer, 2013, 13: 800-812. DOI:10.1038/nrc3610 |
| [4] |
Bhatt AP, Redinbo MR, Bultman SJ. The role of the microbiome in cancer development and therapy[J]. CA Cancer J Clin, 2017, 67: 326-344. DOI:10.3322/caac.21398 |
| [5] |
Helmink BA, Khan MAW, Hermann A, et al. The microbiome, cancer, and cancer therapy[J]. Nat Med, 2019, 25: 377-388. DOI:10.1038/s41591-019-0377-7 |
| [6] |
Riquelme E, Zhang Y, Zhang LL, et al. Tumor microbiome diversity and composition influence pancreatic cancer outcomes[J]. Cell, 2019, 178: 795-806. DOI:10.1016/j.cell.2019.07.008 |
| [7] |
Iida N, Dzutsev A, Stewart CA, et al. Commensal bacteria control cancer response to therapy by modulating the tumor microenvironment[J]. Science, 2013, 342: 967-970. DOI:10.1126/science.1240527 |
| [8] |
Vetizou M, Pitt JM, Daillere R, et al. Anticancer immunotherapy by CTLA-4 blockade relies on the gut microbiota[J]. Science, 2015, 350: 1079-1084. DOI:10.1126/science.aad1329 |
| [9] |
Sivan A, Corrales L, Hubert N, et al. Commensal bifidobacterium promotes antitumor immunity and facilitates anti-PD-L1 efficacy[J]. Science, 2015, 350: 1084-1089. DOI:10.1126/science.aac4255 |
| [10] |
Tanoue T, Morita S, Plichta DR, et al. A defined commensal consortium elicits CD8 T cells and anti-cancer immunity[J]. Nature, 2019, 565: 600-605. DOI:10.1038/s41586-019-0878-z |
| [11] |
Routy B, Le Chatelier E, Derosa L, et al. Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors[J]. Science, 2018, 359: 91-97. DOI:10.1126/science.aan3706 |
| [12] |
Viaud S, Saccheri F, Mignot G, et al. The intestinal microbiota modulates the anticancer immune effects of cyclophosphamide[J]. Science, 2013, 342: 971-976. DOI:10.1126/science.1240537 |
| [13] |
Young VB. Therapeutic manipulation of the microbiota: past, present, and considerations for the future[J]. Clin Microbiol Infect, 2016, 22: 905-909. DOI:10.1016/j.cmi.2016.09.001 |
| [14] |
Vargason AM, Anselmo AC. Clinical translation of microbe-based therapies: current clinical landscape and preclinical outlook[J]. Bioeng Transl Med, 2018, 3: 124-137. DOI:10.1002/btm2.10093 |
| [15] |
Mimee M, Citorik RJ, Lu TK. Microbiome therapeutics-advances and challenges[J]. Adv Drug Deliv Rev, 2016, 105: 44-54. DOI:10.1016/j.addr.2016.04.032 |
| [16] |
Matsumura Y, Maeda H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs[J]. Cancer Res, 1986, 46: 6387-6392. |
| [17] |
Peer D, Karp JM, Hong S, et al. Nanocarriers as an emerging platform for cancer therapy[J]. Nat Nanotechnol, 2007, 2: 751-760. DOI:10.1038/nnano.2007.387 |
| [18] |
Ma L, Kohli M, Smith A. Nanoparticles for combination drug therapy[J]. ACS Nano, 2013, 7: 9518-9525. DOI:10.1021/nn405674m |
| [19] |
Mura S, Nicolas J, Couvreur P. Stimuli-responsive nanocarriers for drug delivery[J]. Nat Mater, 2013, 12: 991-1003. DOI:10.1038/nmat3776 |
| [20] |
Moon JJ, Huang B, Irvine DJ. Engineering nano- and microparticles to tune immunity[J]. Adv Mater, 2012, 24: 3724-3746. DOI:10.1002/adma.201200446 |
| [21] |
Blanco E, Shen H, Ferrari M. Principles of nanoparticle design for overcoming biological barriers to drug delivery[J]. Nat Biotechnol, 2015, 33: 941-951. DOI:10.1038/nbt.3330 |
| [22] |
Hu CMJ, Fang RH, Wang KC, et al. Nanoparticle biointerfacing by platelet membrane cloaking[J]. Nature, 2015, 526: 118-121. DOI:10.1038/nature15373 |
| [23] |
Rodriguez PL, Harada T, Christian DA, et al. Minimal "self" peptides that inhibit phagocytic clearance and enhance delivery of nanoparticles[J]. Science, 2013, 339: 971-975. DOI:10.1126/science.1229568 |
| [24] |
Angsantikul P, Thamphiwatana S, Zhang Q, et al. Coating nanoparticles with gastric epithelial cell membrane for targeted antibiotic delivery against Helicobacter pylori infection[J]. Adv Ther, 2018, 1: 1800016. DOI:10.1002/adtp.201800016 |
| [25] |
Jin K, Luo ZM, Zhang B, et al. Biomimetic nanoparticles for inflammation targeting[J]. Acta Pharm Sin B, 2018, 8: 23-33. DOI:10.1016/j.apsb.2017.12.002 |
| [26] |
Pridgen EM, Alexis F, Kuo TT, et al. Transepithelial transport of Fc-targeted nanoparticles by the neonatal Fc receptor for oral delivery[J]. Sci Transl Med, 2013, 5: 213ra167. |
| [27] |
Hu S, Dong TS, Dalal SR, et al. The microbe-derived short chain fatty acid butyrate targets miRNA-dependent p21 gene expression in human colon cancer[J]. PLoS One, 2011, 6: e16221. DOI:10.1371/journal.pone.0016221 |
| [28] |
Gopalakrishnan V, Helmink BA, Spencer CN, et al. The influence of the gut microbiome on cancer, immunity, and cancer immunotherapy[J]. Cancer Cell, 2018, 33: 570-580. DOI:10.1016/j.ccell.2018.03.015 |
| [29] |
Postler TS, Ghosh S. Understanding the holobiont: how microbial metabolites affect human health and shape the immune system[J]. Cell Metab, 2017, 26: 110-130. DOI:10.1016/j.cmet.2017.05.008 |
| [30] |
Balic JJ, Albargy H, Luu K, et al. STAT3 serine phosphorylation is required for TLR4 metabolic reprogramming and IL-1 beta expression[J]. Nat Commun, 2020, 11: 3816. DOI:10.1038/s41467-020-17669-5 |
| [31] |
Dapito DH, Mencin A, Gwak GY, et al. Promotion of hepatocellular carcinoma by the intestinal microbiota and TLR4[J]. Cancer Cell, 2012, 21: 504-516. DOI:10.1016/j.ccr.2012.02.007 |
| [32] |
Killeen SD, Wang JH, Andrews EJ, et al. Bacterial endotoxin enhances colorectal cancer cell adhesion and invasion through TLR-4 and NF-kappa B-dependent activation of the urokinase plasminogen activator system[J]. Br J Cancer, 2009, 100: 1589-1602. DOI:10.1038/sj.bjc.6604942 |
| [33] |
Song WT, Tiruthani K, Wang Y, et al. Trapping of lipopolysaccharide to promote immunotherapy against colorectal cancer and attenuate liver metastasis[J]. Adv Mater, 2018, 30: e1805007. DOI:10.1002/adma.201805007 |
| [34] |
Goodwin TJ, Zhou YQ, Musetti SN, et al. Local and transient gene expression primes the liver to resist cancer metastasis[J]. Sci Transl Med, 2016, 8: 364ra153. |
| [35] |
Kostic AD, Chun EY, Robertson L, et al. Fusobacterium nucleatum potentiates intestinal tumorigenesis and modulates the tumor-immune microenvironment[J]. Cell Host Microbe, 2013, 14: 207-215. DOI:10.1016/j.chom.2013.07.007 |
| [36] |
Pushalkar S, Hundeyin M, Daley D, et al. The pancreatic cancer microbiome promotes oncogenesis by induction of innate and adaptive immune suppression[J]. Cancer Discov, 2018, 8: 403-416. DOI:10.1158/2159-8290.CD-17-1134 |
| [37] |
Yu TC, Guo FF, Yu YN, et al. Fusobacterium nucleatum promotes chemoresistance to colorectal cancer by modulating autophagy[J]. Cell, 2017, 170: 548-563.e16. DOI:10.1016/j.cell.2017.07.008 |
| [38] |
Xiong MH, Bao Y, Du XJ, et al. Differential anticancer drug delivery with a nanogel sensitive to bacteria-accumulated tumor artificial environment[J]. ACS Nano, 2013, 7: 10636-10645. DOI:10.1021/nn403146t |
| [39] |
Zheng DW, Chen Y, Li ZH, et al. Optically-controlled bacterial metabolite for cancer therapy[J]. Nat Commun, 2018, 9: 1680. DOI:10.1038/s41467-018-03233-9 |
| [40] |
Wang LW, Zhang X, Yu X, et al. An all-organic semiconductor C3N4/PDINH heterostructure with advanced antibacterial photocatalytic therapy activity[J]. Adv Mater, 2019, 31: e1901965. DOI:10.1002/adma.201901965 |
| [41] |
Klaenhammer TR, Kleerebezem M, Kopp MV, et al. The impact of probiotics and prebiotics on the immune system[J]. Nat Rev Immunol, 2012, 12: 728-734. DOI:10.1038/nri3312 |
| [42] |
Pan C, Li JJ, Hou WL, et al. Polymerization-mediated multifunctionalization of living cells for enhanced cell-based therapy[J]. Adv Mater, 2021, 33: e2007379. DOI:10.1002/adma.202007379 |
| [43] |
Dong X, Pan P, Zheng DW, et al. Bioinorganic hybrid bacteriophage for modulation of intestinal microbiota to remodel tumor-immune microenvironment against colorectal cancer[J]. Sci Adv, 2020, 6: eaba1590. DOI:10.1126/sciadv.aba1590 |
| [44] |
Zheng DW, Dong X, Pan P, et al. Phage-guided modulation of the gut microbiota of mouse models of colorectal cancer augments their responses to chemotherapy[J]. Nat Biomed Eng, 2019, 3: 717-728. DOI:10.1038/s41551-019-0423-2 |
| [45] |
O'toole PW, Marchesi JR, Hill C. Next-generation probiotics: the spectrum from probiotics to live biotherapeutics[J]. Nat Microbiol, 2017, 2: 6. |
| [46] |
Raman M, Ambalam P, Kondepudi KK, et al. Potential of probiotics, prebiotics and synbiotics for management of colorectal cancer[J]. Gut Microbes, 2013, 4: 181-192. DOI:10.4161/gmic.23919 |
| [47] |
Jandhyala SM, Talukdar R, Subramanyam C, et al. Role of the normal gut microbiota[J]. World J Gastroenterol, 2015, 21: 8787-8803. DOI:10.3748/wjg.v21.i29.8787 |
| [48] |
Cao ZP, Cheng SS, Wang XY, et al. Camouflaging bacteria by wrapping with cell membranes[J]. Nat Commun, 2019, 10: 3452. DOI:10.1038/s41467-019-11390-8 |
| [49] |
Cao ZP, Wang XY, Pang Y, et al. Biointerfacial self-assembly generates lipid membrane coated bacteria for enhanced oral delivery and treatment[J]. Nat Commun, 2019, 10: 5783. DOI:10.1038/s41467-019-13727-9 |
| [50] |
Wang XY, Cao ZP, Zhang MM, et al. Bioinspired oral delivery of gut microbiota by self-coating with biofilms[J]. Sci Adv, 2020, 6: eabb1952. DOI:10.1126/sciadv.abb1952 |
| [51] |
Liu D, Yang F, Xiong F, et al. The smart drug delivery system and its clinical potential[J]. Theranostics, 2016, 6: 1306-1323. DOI:10.7150/thno.14858 |
| [52] |
Feng PP, Cao ZP, Wang XY, et al. On-demand bacterial reactivation by restraining within a triggerable nanocoating[J]. Adv Mater, 2020, 32: e2002406. DOI:10.1002/adma.202002406 |
| [53] |
Asri RIM, Harun WSW, Samykano M, et al. Corrosion and surface modification on biocompatible metals: a review[J]. Mater Sci Eng C Mater Biol Appl, 2017, 77: 1261-1274. DOI:10.1016/j.msec.2017.04.102 |
| [54] |
Lee H, Dellatore SM, Miller WM, et al. Mussel-inspired surface chemistry for multifunctional coatings[J]. Science, 2007, 318: 426-430. DOI:10.1126/science.1147241 |
| [55] |
Delparastan P, Malollari KG, Lee H, et al. Direct evidence for the polymeric nature of polydopamine[J]. Angew Chem Int Ed Engl, 2019, 58: 1077-1082. DOI:10.1002/anie.201811763 |
| [56] |
Tao W, Zeng XW, Wu J, et al. Polydopamine-based surface modification of novel nanoparticle-aptamer bioconjugates for in vivo breast cancer targeting and enhanced therapeutic effects[J]. Theranostics, 2016, 6: 470-484. DOI:10.7150/thno.14184 |
| [57] |
Hejazi R, Amiji M. Chitosan-based gastrointestinal delivery systems[J]. J Control Release, 2003, 89: 151-165. DOI:10.1016/S0168-3659(03)00126-3 |
| [58] |
Chen S, Cao Y, Ferguson LR, et al. Evaluation of mucoadhesive coatings of chitosan and thiolated chitosan for the colonic delivery of microencapsulated probiotic bacteria[J]. J Microencapsul, 2013, 30: 103-115. DOI:10.3109/02652048.2012.700959 |
| [59] |
Song WT, Anselmo AC, Huang L. Nanotechnology intervention of the microbiome for cancer therapy[J]. Nat Nanotechnol, 2019, 14: 1093-1103. DOI:10.1038/s41565-019-0589-5 |
| [60] |
Wu N, Yang X, Zhang RF, et al. Dysbiosis signature of fecal microbiota in colorectal cancer patients[J]. Microb Ecol, 2013, 66: 462-470. DOI:10.1007/s00248-013-0245-9 |
| [61] |
Zitvogel L, Galluzzi L, Viaud S, et al. Cancer and the gut microbiota: an unexpected link[J]. Sci Transl Med, 2015, 7: 271ps1. |
| [62] |
Vangay P, Ward T, Gerber JS, et al. Antibiotics, pediatric dysbiosis, and disease[J]. Cell Host Microbe, 2015, 17: 553-564. DOI:10.1016/j.chom.2015.04.006 |
| [63] |
Ramteke S, Ganesh N, Bhattacharya S, et al. Amoxicillin, clarithromycin, and omeprazole based targeted nanoparticles for the treatment of H. pylori[J]. J Drug Target, 2009, 17: 225-234. DOI:10.1080/10611860902718649 |
| [64] |
Gao WW, Thamphiwatana S, Angsantikul P, et al. Nanoparticle approaches against bacterial infections[J]. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2014, 6: 532-547. DOI:10.1002/wnan.1282 |
| [65] |
Hajipour MJ, Fromm KM, Ashkarran AA, et al. Antibacterial properties of nanoparticles[J]. Trends Biotechnol, 2012, 30: 499-511. DOI:10.1016/j.tibtech.2012.06.004 |
| [66] |
Foulkes R, Asgari MA, Curtis A, et al. Silver-nanoparticle-mediated therapies in the treatment of pancreatic cancer[J]. ACS Appl Nano Mater, 2019, 2: 1758-1772. DOI:10.1021/acsanm.9b00439 |
| [67] |
Singh J, Moore W, Fattah F, et al. Activity and pharmacology of homemade silver nanoparticles in refractory metastatic head and neck squamous cell cancer[J]. Head Neck, 2019, 41: E11-E16. |
| [68] |
Li JJ, Cha RT, Zhao XH, et al. Gold nanoparticles cure bacterial infection with benefit to intestinal microflora[J]. ACS Nano, 2019, 13: 5002-5014. DOI:10.1021/acsnano.9b01002 |
| [69] |
Ren ZG, Chen XM, Hong LJ, et al. Nanoparticle conjugation of ginsenoside Rg3 inhibits hepatocellular carcinoma development and metastasis[J]. Small, 2020, 16: e1905233. DOI:10.1002/smll.201905233 |
| [70] |
Kim DG, Jung KH, Lee DG, et al. 20(S)-Ginsenoside Rg3 is a novel inhibitor of autophagy and sensitizes hepatocellular carcinoma to doxorubicin[J]. Oncotarget, 2014, 5: 4438-4451. DOI:10.18632/oncotarget.2034 |
| [71] |
Tobio M, Sanchez A, Vila A, et al. The role of PEG on the stability in digestive fluids and in vivo fate of PEG-PLA nanoparticles following oral administration[J]. Colloids Surf B Biointerfaces, 2000, 18: 315-323. DOI:10.1016/S0927-7765(99)00157-5 |
| [72] |
Oh JW, Chung WJ, Heo K, et al. Biomimetic virus-based colourimetric sensors[J]. Nat Commun, 2014, 5: 3043. DOI:10.1038/ncomms4043 |
| [73] |
Souza GR, Molina JR, Raphael RM, et al. Three-dimensional tissue culture based on magnetic cell levitation[J]. Nat Nanotechnol, 2010, 5: 291-296. DOI:10.1038/nnano.2010.23 |
| [74] |
Karimi M, Mirshekari H, Basri SMM, et al. Bacteriophages and phage-inspired nanocarriers for targeted delivery of therapeutic cargos[J]. Adv Drug Deliv Rev, 2016, 106: 45-62. DOI:10.1016/j.addr.2016.03.003 |
| [75] |
Tao P, Zhu JG, Mahalingam M, et al. Bacteriophage T4 nanoparticles for vaccine delivery against infectious diseases[J]. Adv Drug Deliv Rev, 2019, 145: 57-72. DOI:10.1016/j.addr.2018.06.025 |
| [76] |
Eriksson F, Tsagozis P, Lundberg K, et al. Tumor-specific bacteriophages induce tumor destruction through activation of tumor-associated macrophages[J]. J Immunol, 2009, 182: 3105-3111. DOI:10.4049/jimmunol.0800224 |
| [77] |
Gibson GR, Roberfroid MB. Dietary modulation of the human colonic microbiota: introducing the concept of prebiotics[J]. J Nutr, 1995, 125: 1401-1412. DOI:10.1093/jn/125.6.1401 |
| [78] |
Singh N, Gurav A, Sivaprakasam S, et al. Activation of Gpr109a, receptor for niacin and the commensal metabolite butyrate, suppresses colonic inflammation and carcinogenesis[J]. Immunity, 2014, 40: 128-139. DOI:10.1016/j.immuni.2013.12.007 |
| [79] |
Kutter E, De Vos D, Gvasalia G, et al. Phage therapy in clinical practice: treatment of human infections[J]. Curr Pharm Biotechnol, 2010, 11: 69-86. DOI:10.2174/138920110790725401 |
| [80] |
Wang H, Wang RB, Cai KM, et al. Selective in vivo metabolic cell-labeling-mediated cancer targeting[J]. Nat Chem Biol, 2017, 13: 415-424. DOI:10.1038/nchembio.2297 |
| [81] |
Li ZJ, Chen XG, Zhang S. The role of the intestinal microflora dysbiosis in chronic kidney disease[J]. Acta Pharm Sin (药学学报), 2020, 55: 2777-2784. |
| [82] |
Roberfroid M, Gibson GR, Hoyles L, et al. Prebiotic effects: metabolic and health benefits[J]. Br J Nutr, 2010, 104: S1-S63. DOI:10.1017/S0007114510003909 |
| [83] |
Lin Z, Zu XP, Xie HS, et al. Research progress in mechanism of intestinal microorganisms in human diseases[J]. Acta Pharm Sin (药学学报), 2016, 51: 843-852. |
| [84] |
Chen J, Pitmon E, Wang KP. Microbiome, inflammation and colorectal cancer[J]. Semin Immunol, 2017, 32: 43-53. DOI:10.1016/j.smim.2017.09.006 |
| [85] |
Derosa L, Hellmann MD, Spaziano M, et al. Negative association of antibiotics on clinical activity of immune checkpoint inhibitors in patients with advanced renal cell and non-small-cell lung cancer[J]. Ann Oncol, 2018, 29: 1437-1444. DOI:10.1093/annonc/mdy103 |
| [86] |
Qiu KY, Durham PG, Anselmo AC. Inorganic nanoparticles and the microbiome[J]. Nano Res, 2018, 11: 4936-4954. DOI:10.1007/s12274-018-2137-2 |
| [87] |
David LA, Maurice CF, Carmody RN, et al. Diet rapidly and reproducibly alters the human gut microbiome[J]. Nature, 2014, 505: 559-563. DOI:10.1038/nature12820 |
| [88] |
Cho I, Yamanishi S, Cox L, et al. Antibiotics in early life alter the murine colonic microbiome and adiposity[J]. Nature, 2012, 488: 621-626. DOI:10.1038/nature11400 |
| [89] |
Weissleder R, Pittet MJ. Imaging in the era of molecular oncology[J]. Nature, 2008, 452: 580-589. DOI:10.1038/nature06917 |
| [90] |
Sanvicens N, Pastells C, Pascual N, et al. Nanoparticle-based biosensors for detection of pathogenic bacteria[J]. Trac-Trends Anal Chem, 2009, 28: 1243-1252. DOI:10.1016/j.trac.2009.08.002 |
| [91] |
Anselmo AC, Mitragotri S. Nanoparticles in the clinic[J]. Bioeng Transl Med, 2016, 1: 10-29. DOI:10.1002/btm2.10003 |
| [92] |
De Luca F, Shoenfeld Y. The microbiome in autoimmune diseases[J]. Clin Exp Immunol, 2019, 195: 74-85. |
| [93] |
Rogers GB, Keating DJ, Young RL, et al. From gut dysbiosis to altered brain function and mental illness: mechanisms and pathways[J]. Mol Psychiatr, 2016, 21: 738-748. DOI:10.1038/mp.2016.50 |
| [94] |
Griffiths JA, Mazmanian SK. Emerging evidence linking the gut microbiome to neurologic disorders[J]. Genome Med, 2018, 10: 3. DOI:10.1186/s13073-017-0510-5 |
| [95] |
Hansen JJ, Sartor RB. Therapeutic manipulation of the microbiome in IBD: current results and future approaches[J]. Curr Treat Options Gastroenterol, 2015, 13: 105-120. DOI:10.1007/s11938-014-0042-7 |
 2022, Vol. 57
2022, Vol. 57


