2. 中国科学院昆明植物研究所植物化学与西部植物资源持续利用国家重点实验室, 云南 昆明 650201;
3. 中国科学院大学, 北京 100049
2. State Key Laboratory of Phytochemistry and Plant Resources in West China, Kunming Institute of Botany, Chinese Academy of Sciences, Kunming 650201, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
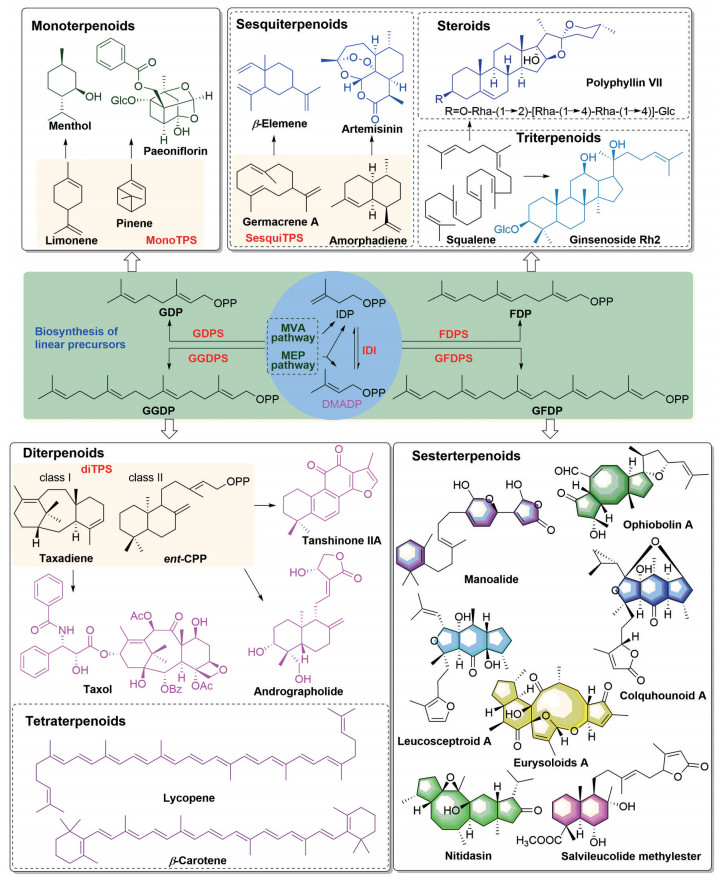
萜类是指由异戊二烯(isoprene, C5) 单元组成的化合物及其衍生物, 其分布广泛、结构丰富多样, 是天然产物中的最大家族, 目前已报道95 000余个(www.dnp.chemnetbase.com)。按异戊二烯单元的数目, 萜类化合物可以分为半萜(C5)、单萜(C10)、倍半萜(C15)、二萜(C20)、二倍半萜(C25)、三萜(C30) 和多萜等[1, 2]。萜类天然产物生物活性显著, 是许多药用植物的活性成分, 如薄荷醇、芍药苷、青蒿素、榄香烯、紫杉醇、穿心莲内酯、丹参酮、人参皂苷等, 并为创新药物研发提供了大量重要源头分子或先导化合物, 其中许多化合物或其衍生物已被开发成药物。萜类化合物往往结构复杂、手性中心较多, 利用化学合成方法工业化生产比较困难, 而从药用植物中直接提取的方法则受含量低、资源匮乏等限制。近年来, 萜类天然产物的生物合成与合成生物学研究引起了国内外广泛关注, 青蒿素、紫杉醇、丹参酮和人参皂苷等化合物的合成途径解析和异源创建取得重要进展, 在解决萜类化合物来源与成本以及相关药用植物资源持续利用等方面展现出巨大优势和应用潜力[3]。
二倍半萜是由五个异戊二烯单元构成、生物合成来源于香叶基法尼基焦磷酸酯(geranylfarnesyl diphosphate, GFDP) 的一类萜类天然产物, 一般含25个碳原子, 少数为少于25碳的降二倍半萜。天然二倍半萜目前仅报道了1 300余个, 为一类珍稀的萜类天然产物[4]。二倍半萜分布广泛, 主要来源于海洋生物(尤其是海绵)。植物二倍半萜仅报道190余个, 主要来源于唇形科(Lamiaceae) 药用植物(占植物二倍半萜总数的75%), 是鼠尾草属(Salvia)、米团花属(Leucosceptrum)、火把花属(Colquhounia)、宽管花属(Eurysolen) 植物的特征性化学成分, 在龙胆科(Gentianaceae) 和蕨类等药用植物中也有发现。另外, 二倍半萜在陆生真菌、细菌、昆虫中也有分布[4, 5]。二倍半萜结构新颖复杂, 具有广泛的药理活性(抗炎、抗菌、抗肿瘤和细胞毒活性等) 和生物功能(化学防御等)[6]。例如, 从海绵Luffariella variabilis中发现的具有α, β-不饱和γ-内酯环的二倍半萜manoalide是磷脂酶A2抑制剂, 具有显著的抗炎等作用, 曾作为银屑病的局部用药进入临床Ⅱ期研究, 后面由于原料来源不足和剂型问题等原因被终止[7]; 真菌来源的蛇孢菌素类(ophiobolins) 二倍半萜具有植物毒、抗菌、杀线虫、细胞毒性等活性[8]; 唇形科药用植物米团花(Leucosceptrum canum) 腺毛中发现的二倍半萜leucosceptroids具有重要防御病虫害的功能以及免疫抑制和减脂等活性[9]; 鼠尾草属植物Salvia dominica中的二倍半萜具有抑制癌细胞微管蛋白酪氨酸连接酶的活性(图 1)[10]。但目前对于二倍半萜的化学多样性、生物活性与生物合成认识较少[4]。本文着重介绍二倍半萜的生物合成研究进展, 包括香叶基法尼基焦磷酸酯合酶(GFDP synthase, GFDPS)、二倍半萜合酶(sesterterpene synthase, sesterTPS) 和氧化酶等, 以期为二倍半萜的生物合成、生物活性、合成生物学等相关研究提供有价值的参考。
|
Figure 1 The biosynthesis pathways of terpenoids and representative compounds. DMADP: Dimethylallyl diphosphate; ent-CPP: ent-Copalyl diphosphate; FDP: Farnesyl diphosphate; FDPS: Farnesyl diphosphate synthase; GDP: Geranyl diphosphate; GDPS: Geranyl diphosphate synthase; GFDP: Geranylfarnesyl diphosphate; GFDPS: Geranylfarnesyl diphosphate synthase; GGDP: Geranylgeranyl diphosphate; GGDPS: Geranylgeranyl diphosphate synthase; IDI: Isopentenyl diphosphate isomerase; IDP: Isopentenyl diphosphate |
萜类天然产物的生物合成主要分为3个步骤: ①异戊二烯单元(C5) 和直链前体的合成; ②萜类核心骨架的构建; ③后修饰(图 1)。所有的萜类天然产物均起源于两个异戊二烯基本单元: 异戊烯基焦磷酸酯(isopentenyl diphosphate, IDP) 及其异构体二甲基烯丙基焦磷酸酯(dimethylallyl diphosphate, DMADP)。生物体中异戊二烯单元的生物合成至少存在两条截然不同的途径, 分别为甲羟戊酸(mevalonate, MVA) 途径和2-C-甲基-D-赤藓糖-4-磷酸酯(2-C-methyl-D-erythritol-4-phosphate, MEP) 途径。IDP和DMADP在IDP异构酶(isoprenyl diphosphate isomerase, IDI) 的作用下能够相互转变。其中, 动物、真菌和古细菌等主要含有MVA途径, 细菌、蓝藻等则主要通过MEP途径合成IDP和DMADP, 而植物中同时包含这两条途径, 分别为定位于细胞质的MVA途径和定位于质体中的MEP途径[11]。IDP与DMADP在不同的异戊烯基焦磷酸酯合酶(isoprenyl diphosphate synthase, IDS) 的作用下生成不同的直链前体, 如香叶基焦磷酸酯(geranyl diphosphate, GDP)、法尼基焦磷酸酯(farnesyl diphosphate, FDP)、香叶基香叶基焦磷酸酯(geranylgeranyl diphosphate, GGDP) 和GFDP。萜类直链前体分别在单萜合酶(monoterpene synthase, monoTPS)、倍半萜合酶(sesquiterpene synthase, sesquiTPS)、二萜合酶(diterpene synthase, diTPS) 和二倍半萜合酶(sesterTPS) 等的作用下经过环化或重排等反应分别生成单萜、倍半萜、二萜、二倍半萜的基本骨架。萜类骨架在氧化酶、还原酶、酰化酶、糖基转移酶等催化下发生氧化、还原、酰化、糖基化等一系列的后修饰反应, 形成化学结构和生物功能千变万化的萜类天然产物[4, 12-14]。
2 二倍半萜的生源途径研究概述1973年, Kawaguchi等[15]采用无细胞体系结合同位素饲喂探讨了植物病原菌Cochliobolus heterostrophus中二倍半萜的生物合成途径, 推测首先经由MVA途径生成FDP, FDP在酶的催化下生成GFDP, GFDP再经过环化反应生成三环二倍半萜ophiobolins。2000年, Renner等[16]用[1-13C] 醋酸钠和[1, 2-13C] 醋酸钠饲喂海洋真菌Fusarium heterosporum, 发现二倍半萜mangicols的直接前体为GFDP。2003年, Neundorf等[17]利用[2-13C, 4-2H]-1-脱氧-D-木酮糖饲喂加纳链霉菌(Streptomyces ghanaensis) 发现抗生素默诺霉素C25脂链的生物合成起源于MEP途径, 其直接前体是C10和C15。2004, Massé等[18]通过同位素标记实验发现硅藻Rhizosolenia setigera (Brightwell) 中Δ7(20)-haslenes二倍半萜的生物合成起始于MVA途径, 而硅藻Haslea ostrearia (Simonsen) 中Δ6(17)-haslenes的生源途径是MEP途径, 推测硅藻二倍半萜生物合成途径与物种相关。
3 GFDPS的功能鉴定及结构研究二倍半萜直链前体GFDP的形成是二倍半萜生物合成途径的一个关键节点, 决定了其产物为二倍半萜而不是其他类型的萜类化合物。GFDPS负责GFDP的生物合成, 其属于异戊烯基转移酶(prenyltransferase, PT) 超家族, 迄今仅报道了10余个GFDPS, 均来源于微生物和植物。1994年, Tachibana等[19]从嗜盐碱古菌Natronobacterium pharaonis中首次分离纯化了GFDPS。2000年, 该课题组从另一种嗜盐碱古菌Aeropyrum pernix中克隆了ApGFDPS基因, 序列分析发现ApGFDPS与古菌GGDPS的相似度最高, 推测其可能是由古菌GGDPS进化而来[20]。2004年, Lee等[21]对ApGFDPS的产物链长调控机制进行了初步研究, 发现首个天冬氨酸富集区(first aspartate-rich motif, FARM) 上游第8个氨基酸残基以及保守区G141Q142上游第7个氨基酸残基是控制ApGFDPS产物链长的关键位点。2010年, Ogawa等[22]从产甲烷古菌Methanosarcina mazei中克隆并鉴定了MmGFDPS, 能够催化IDP与FDP/GGDP缩合生成GFDP, 且以FDP为烯丙基底物时, 能够检测到大量GGDP的生成。MmGFDPS产物的链长受I112残基调控, 其突变酶(MmGFDPSI112A) 可以催化产生C30-C70产物[23]。此外, 在芽孢杆菌属Bacillus clausii和链霉菌属Streptomyces mobaraensis等细菌中也发现了GFDPS[24, 25]。
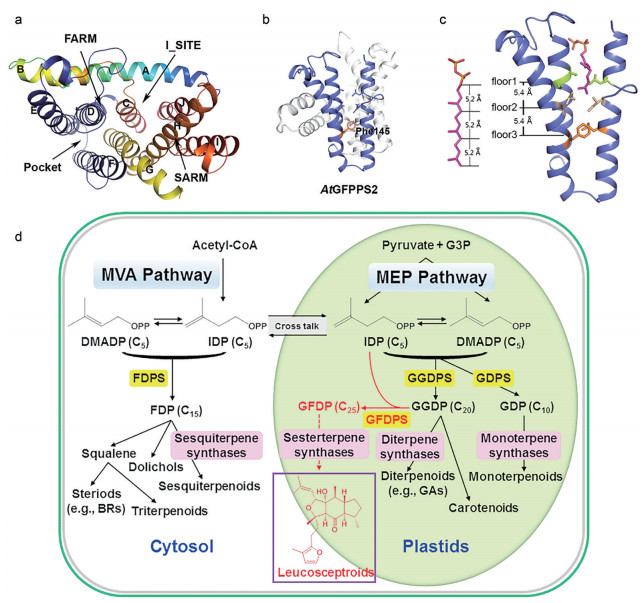
Nagel等[26]和Wang等[27]分别对十字花科(Brassicaceae) 模式植物拟南芥(Arabidopsis thaliana) 中10个GGDPS-like基因的生化功能进行了分析, 发现其中5个具有GFDPS活性(命名为AtGFDPS0-4), 能够合成主产物GFDP和副产物GGDP、GDP。除了AtGFDPS0定位于线粒体外, 其余4个均定位于叶绿体中。氨基酸序列比对结合定点突变实验分析, 发现AtGFDPS的FARM上游第5个氨基酸位点均为侧链较小的氨基酸残基(A或S), 将其突变为M后, 突变酶的主产物则为GGDP。Wang等[27]还对AtGFDPS2 (分辨率为2.3 Å) 的蛋白晶体结构进行了解析, 发现其为同源二聚体, 每个单体由10个α螺旋(A~J) 组成, D、E、F螺旋组成的口袋对于产物的碳链延伸最为重要, 并提出了决定IDS产物链长的“三层楼模型(three floors)” (图 2), 进一步从其他十字花科植物的基因组中发现了数个GFDPS。
|
Figure 2 The crystal structure and "three-floor" model of AtGFDPS2 and the biosynthetic pathway of plant sesterterpenoids. The crystal structure of AtGFDPS2 monomer (a), the elongation pocket of enzymatic product (b), the schematic diagram of the "three-floor" model (c), and GFDP biosynthesis catalyzed by GFDPS using substrates GGDP and IDP derived from the plastidial MEP pathway (d). Photos were reproduced from the literatures with permission[27, 28] |
本课题组从富含二倍半萜的药用植物米团花腺毛中克隆并鉴定了LcGFDPS基因, 其编码的蛋白能够催化IDP与FDP或GGDP反应生成GFDP, 其中对GGDP的亲和力最强。LcGFDPS基因在米团花腺毛中特异性表达, 与二倍半萜的累积模式一致, 表明其可能参与米团花烷二倍半萜的生物合成。LcGFDPS定位于细胞质体中, 且抑制米团花的MEP途径会导致二倍半萜含量显著降低, 首次证明了植物二倍半萜的生源途径为定位于质体的MEP途径(图 2)。LcGFDPS与植物GGDPS同源性较高, 推测植物GFDPS可能起源于选择压力(环境胁迫) 下GGDPS的复制和新功能化[28]。
4 二倍半萜合酶的功能和催化机制二倍半萜合酶负责催化直链前体GFDP生成二倍半萜的基本骨架, 对二倍半萜的结构多样性具有重要贡献。目前已报道了3种类型的二倍半萜合酶, 分别为单结构域、双结构域以及UbiA类。其中植物和细菌二倍半萜合酶均仅含有萜类合酶结构域, 部分与GFDPS成簇存在。而在真菌中发现的二倍半萜合酶主要由C端的异戊烯基转移酶(PT) 结构域和N端的萜类合酶(TS) 结构域组成, PT结构域负责催化IDP和DMADP生成GFDP, TS结构域催化GFDP环化成结构多样的二倍半萜, 因此该类酶也称为PTTS。
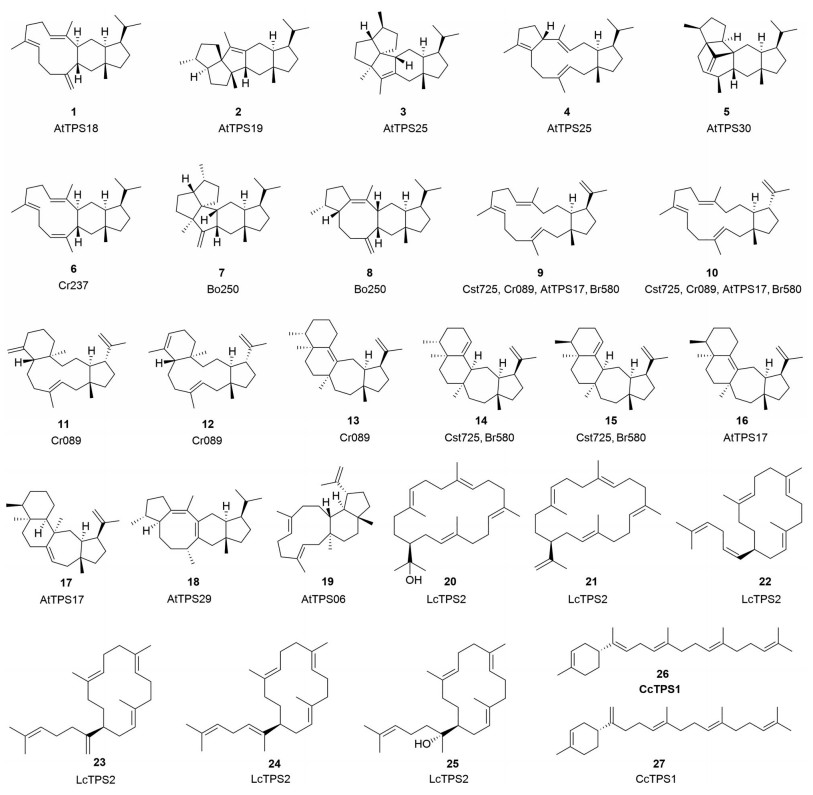
4.1 单结构域的二倍半萜合酶2017年, Shao等[29]从拟南芥基因组中发现AtGFDPS1与AtTPS18、AtGFDPS2与AtTPS19基因成簇存在, 将其分别在大肠杆菌中共表达, 发现AtTPS18能够催化GFDP生成一个11/6/5三环产物(+)-thalianatriene (1), AtTPS19能够合成一个5/5/5/6/5五环产物(-)-retigeranin B (2) (图 3)。同年, Huang等[30]采用plantiSMASH对十字花科植物的基因组进行了系统分析, 另外发现了5个由GFDPS和sesterTPS构成的基因簇。通过本氏烟草瞬时表达体系, 发现拟南芥AtTPS25能够催化GFDP产生两个酶活产物, 分别为具有5/5/5/6/5环系的(-)-ent-quiannulatene (3) 和5/12/5环系的(-)-variculartriene A (4); 拟南芥AtTPS30能够催化产生5/4/7/6/5环系的(+)-astellatene (5); 荠菜(Capsella rubella) 中的Cr237能够催化产生11/6/5环系的(-)-caprutriene (6); 甘蓝(Brassica oleracea) Bo250能够催化生成两个产物, 分别为5/5/5/6/5环系的(+)-boleracene (7) 和5/8/6/5环系的(-)-aleurodiscalene A (8)。另外, Huang等[30]还发现了4个二倍半萜合酶(Cst725、Cr098、AtTPS17和Br580), 能够催化GFDP产生15/5环系的(+)-brassitetraenes A (9) 和B (10), 6/11/5环系的(-)-caprutrienes B (11) 和C (12), 以及6/6/7/5环系的(-)-caprudiene A (13)、(-)-arathanadienes A (14) 和B (15)、(+)-brarapadienes A (16) 和(-)-brarapadiene B (17)。2020年, Chen等[31]在拟南芥中发现3个独立的sesterTPS, 其中AtTPS29催化GFDP形成5/8/6/5环系的二倍半萜18, AtTPS06则催化形成11/6/5环系的(2E)-flocerene (19), 而AtTPS22的产物未被纯化鉴定。另外, 作者获得了AtTPS18和底物类似物FSPP (farnesyl-S-thiolodiphosphate) 的共晶(2.3 Å), 结合定点突变实验, 发现植物sesterTPS相对于常规的mono-/sesqui-/di-TPS具有更大的底物口袋腔, 其中螺旋G的外翻与N493对底物口袋腔大小起关键作用。此外, 作者还发现了一个具有小侧链的关键氨基酸残基(AtTPS18和AtTPS25的G328, AtTPS19的G325, AtTPS30的P328), 将其突变为芳香族色氨酸(W) 后, 突变酶失去了二倍半萜合酶活性, 而获得了单萜、倍半萜或二萜合酶功能[32]。
|
Figure 3 Chemical structures of sesterterpenoids synthesized by plant sesterTPSs |
近期, 本实验室从唇形科药用植物米团花中鉴定了一个双功能的二倍半萜/二萜合酶LcTPS2, 能够催化GFDP和GGDP分别生成6个大环二倍半萜(20~25) 和2个二萜化合物, 其中5个为新的二倍半萜化合物, 包括2个首次发现的具有18元环的二倍半萜(20和21), 也是迄今为止发现的具有最大碳环结构的萜类天然产物。此外, LcTPS2还具有异戊烯基转移酶的功能, 能够催化合成异戊烯基吲哚类化合物。LcTPS2属于TPS-a亚家族, 可能起源于倍半萜合酶的复制和新功能化, 但是区别于十字花科植物的二倍半萜合酶, 具有独立的起源和进化。运用分子对接结合定点突变获得了2个二倍半萜产量显著提高, 同时二萜产量减少的突变酶, 并发现了17个氨基酸残基对酶的催化效率和/或产物特异性具有重要影响。还发现大环二倍半萜产物具有显著免疫抑制活性, 可能通过抑制ERK和JNK的磷酸化影响MAPK信号通路, 从而发挥免疫抑制作用[33]。另外, 从唇形科药用植物火把花(Colquhounia coccinea var. mollis) 中鉴定了1个高度杂泛性的二倍半萜/二萜/倍半萜/单萜合酶CcTPS1, 能够分别催化GFDP/GGDP/FDP/GDP生成8个含有环己烷结构的萜类化合物, 包括2个新二倍半萜(+)-α-geranylbisabolene (26) 和(+)-somaliensene B (27)。CcTPS1是首个从植物中功能鉴定的能够催化形成二倍半萜、二萜、倍半萜和单萜的高度杂泛性萜类合酶。CcTPS1定位于细胞质中且属于TPS-b亚家族, 该家族主要为定位于质体的单萜合酶, 推测CCTPS1可能起源于单萜合酶, 经过亚细胞定位改变和底物耐受性扩展[34]。
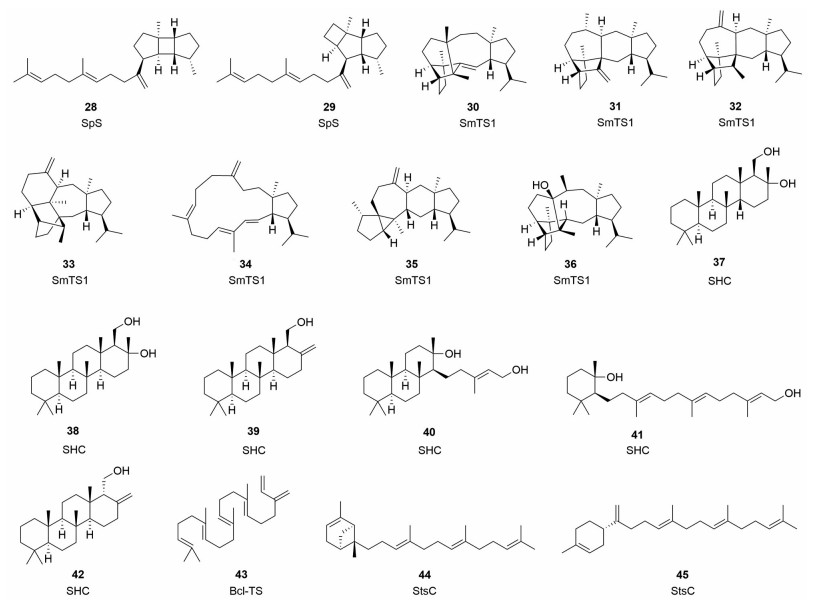
2017年, Rinkel等[35]从海洋微生物Streptomyces xinghaiensis中发现了一个多功能的二倍半萜/二萜/倍半萜合酶SpS, 能够催化GFDP形成prenylspata-13, 17-diene (28) 和geranylkelsoene (29) (图 4)。Hou等[25]从S. mobaraensis的基因组中挖掘得到一个GFDPS-sesterTPS的生物合成基因簇, 能够催化IDP和DMADP最终生成7个二倍半萜化合物sestermobaraenes A~F (30~36)。此外, Shinozaki等[36]发现了1个具有二倍半萜合酶功能的细菌角鲨烯-藿烯环化酶(squalene-hopene cyclase, SHC), 当以all-E-香叶基法尼醇为底物时, 能够合成5个二倍半萜产物(37~41); 当底物为2Z-香叶基法尼醇时, 能够得到化合物42。Sato等[37]从芽孢杆菌中发现了一个二倍半萜/三萜合酶(Bcl-TS), 催化GFDP脱去焦磷酸基团形成直链二倍半萜β-geranylfarnesene (43)。
|
Figure 4 Chemical structures of sesterterpenoids synthesized by bacterial and UbiA sesterTPSs |
2018年, Yang等[38]从Streptomyces somaliensis中鉴定1个属于UbiA超家族的二倍半萜合酶StsC, 该酶在细菌中属于膜结合蛋白家族, 通过大肠杆菌异源表达体系发现StsC能够催化GFDP形成4/6环系的二倍半萜somaliensene A (44) 和含有环己烷结构的somaliensene B (45) (图 4)。
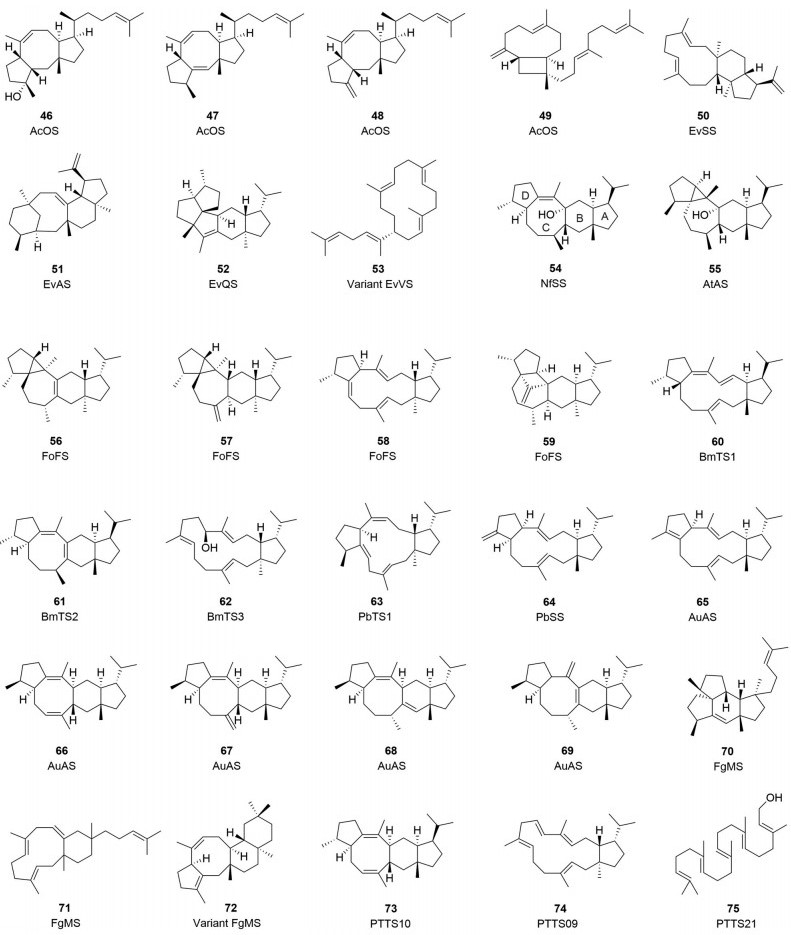
4.3 双结构域的二倍半萜合酶2013年, Chiba等[39]从棒曲霉(Aspergillus clavatus) 首次发现了一个具有双结构域的蛇孢菌素F (ophiobolin F) 合酶AcOS (46) (图 5)。AcOS的PT结构域能够催化IDP与烯丙基底物DMADP、GDP、FDP或GGDP缩合生成GFDP, 其TS结构域再将GFDP环化为蛇孢菌素F, 同时产生3个二倍半萜副产物(47~49)。随后, 科学家运用基因组挖掘结合米曲霉异源表达体系, 从真菌中鉴定了一系列能够合成二倍半萜的PTTS。例如, 从裸壳孢属真菌Emericella variecolor中发现了3个PTTS, 分别合成11/6/5环系的stellata-2, 6, 19-triene (50) (酶命名为EvSS)[40]、6/8/6/5环系的astellifadiene (51) (酶命名为EvAS)[41]和5/6/5/5/5环系的quiannulatene二倍半萜(52) (酶命名为EvQS)[42]。另外, 将EvSS的PT结构域与双功能萜类合酶EvVS (主产物为9/5/5环系的二萜化合物variediene, 副产物为二倍半萜) 的TC结构域进行重组, 进一步鉴定了二倍半萜产物结构, 为14元环的(2E)-α-cericerene (53)[43]。NfSS (来源于Neosartorya fischeri) 合成具有5/8/6/5四环体系的sesterfisherol (54)[44], AtAS (来源于Aspergillus terreus) 和FoFS (来源于Fusarium oxysporum) 分别催化形成5/6/7/3/5五环体系的二倍半萜preaspterpenacid I (55) 和fusoxypenes A-B (56和57), FoFS还能催化形成5/12/5环系的fusoxypene C (58) 和5/6/7/4/5环系的(-)-astellatene (59)[45]。从Bipolaris maydis、Penicillium brasilianum、Phoma betae和Aspergillus ustus等也发现了催化IDP和DMADP形成多环二倍半萜化合物的PTTS (60~69)[46-48]。此外, Bian等[49]运用大肠杆菌体系鉴定了2个二倍半萜合酶FgMS和FgGS (来源于F. graminearum), 其中FgMS催化合成5/5/6/5环系的mangicdiene (70) 及11/6双环的variecoltetraene (71), 而其突变酶FgMSF65L和FgMSF159G能够合成1个5/8/6/6环系的二倍半萜(72)。FgGS在进化的过程中丢失了PT结构域, 其能够催化GFDP形成(2E)-α-cericerene (53)。Chen等[50]运用高产GFDP的酿酒酵母底盘细胞进一步鉴定了约30个真菌来源的具有双结构域的二倍半萜合酶, 除了sesterevisene (73)、sesterorbiculene (74) 和geranylfarnesol (75) 外, 产物大多与以前报道的sesterTPS产物结构相同。
|
Figure 5 Chemical structures of sesterterpenoids synthesized by fungal sesterTPSs containing two catalytically domains |
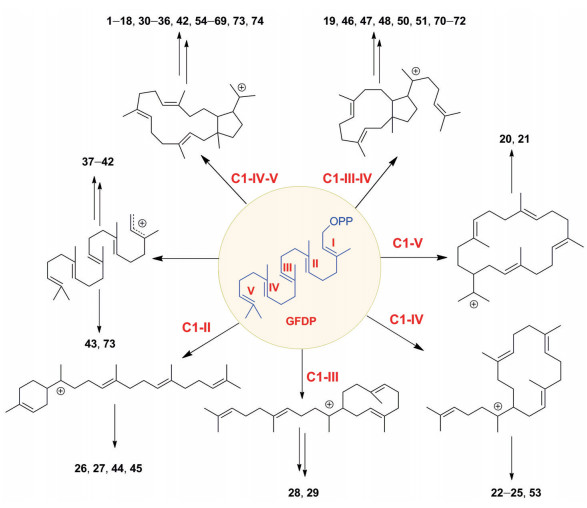
根据二倍半萜合酶环化产物的结构不同, Minami等[12]提出2种主要的环化机制, 即A型和B型环化(图 6)。起始底物GFDP的C-1位焦磷酸基团离去形成碳正离子中间体, C14-C15和C18-C19双键进攻C-1正离子(C1-IV-V), 环化形成具有5/15环系的中间体, 经过此反应的被认为是A型环化。目前报道的催化A型环化反应的二倍半萜合酶较多, 在细菌、真菌和植物中都有发现, 产物骨架类型丰富多样。其中, 较具代表的为从N. fischeri中鉴定的NfSS, Ye等[44]运用同位素标记的底物[1-13C, 2H3] 醋酸盐和[8, 8-2H2]GGDP饲喂实验结合13C NMR、1H NMR、TOCSY分析研究了NfSS催化的可能环合机制, 首先GFDP脱去焦磷酸基团, 经历连续的C1-C15和C14-C18环化反应形成5/15环系的碳正离子中间体, 随后经历1, 5-H迁移、多次1, 2-H迁移以及C6-C10和C2-C12环合形成5/8/6/5稠环的碳正离子中间体, 最终捕获水分子生成sesterfisherol (54)。另外, Sato等[51]利用密度泛函理论(density functional theory, DFT) 计算结合分子对接和定点突变研究, 提出NfSS催化生成sesterfisherol的环合顺序可能是A-D-B/C。B型环化则是C10-C11和C14-C15双键进攻C-1正离子(C1-III-IV)[12, 31, 50], AtTPS06是植物中发现的首个可能催化B型环化反应的二倍半萜合酶[31]。此外, 本实验室发现一些二倍半萜合酶催化的环化反应明显不同于A和B型环化机制, 如S. xinghaiensis来源的SpS, 通过同位素饲喂实验推测了它的环化和重排模式, 即SpS首先催化C1-C10环合和去质子化形成含有环丙烷的中间体, 之后再经过C2-C6环合、环丙烷开环及进一步的环合等, 最终形成化合物28和29[35]; 米团花来源的LcTPS2是由C14-C15双键进攻C-1生成14元环的二倍半萜(22~25), 或者C18-C19双键进攻C-1则生成具有18元碳环的二倍半萜20和21[33]; 火把花来源的CcTPS1和S. somaliensis来源的stsC则是C-1进攻C6-C7双键得到含有6元环的化合物26、27、44和45[34, 38]; 而细菌来源的Bcl-TS和7个真菌的PTTS则催化形成链状β-geranylfarnesene (43) 或geranylfarnesol (75)[37, 50]; 细菌来源的SHC催化二倍半萜环化的机制则与典型的II型萜类合酶相似[36]。
|
Figure 6 Illustration of sesterterpenoid cyclization mechanisms catalyzed by sesterTPSs reported previously |
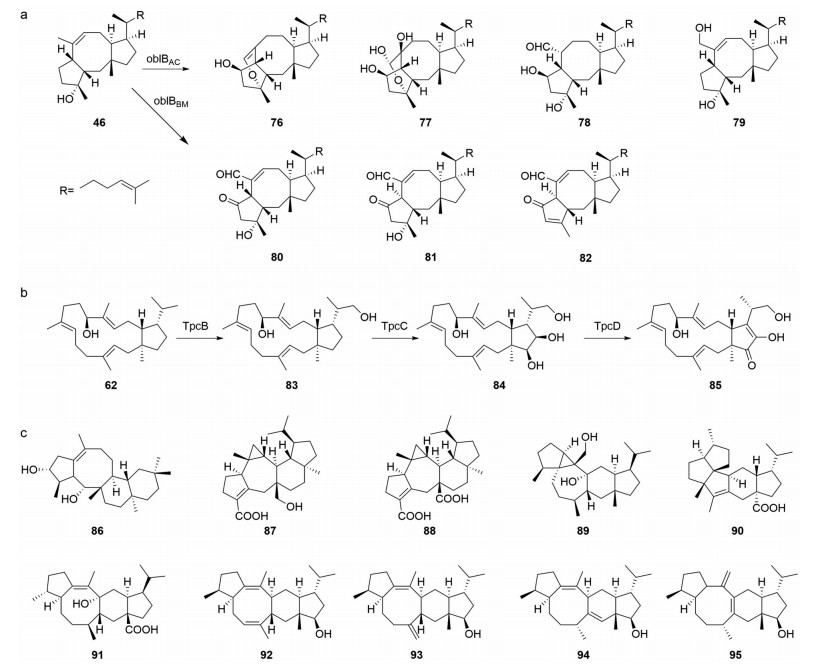
在对真菌二倍半萜合酶的研究中, 科学家发现与萜类合酶基因相毗邻的位置存在氧化酶编码基因, 其翻译的蛋白能够催化二倍半萜骨架发生氧化修饰, 形成更为复杂的化合物(图 7)。Narita等[52]从A. clavatus基因组中发现了一个能够合成蛇孢菌素类化合物的基因簇, 通过米曲霉异源表达体系发现oblBAC能够对ophiobolin F的C-3、C-5和C-21进行氧化, 从而形成4个不同氧化修饰的蛇孢菌素衍生物(76~79)。通过本地Blast, 发现B. maydes中存在1个与oblBAC的氨基酸序列同源性达到68%的氧化酶oblBBM, 同样也能催化ophiobolin F多步氧化形成3个二倍半萜ophiobolin C (80)、6-epiophiobolin C (81) 和6-epiophiobolin N (82)。Narita等[53]从B. maydis基因组中挖掘到一个含有4个基因的基因簇(TpcABCD), 运用米曲霉表达体系解析了可作为抗血管生成剂化合物(-)-terpestacin的生物合成途径, TpcA是负责preterpestacin I (62) 的生物合成, TpcB催化化合物62的C-24位氧化生成preterpestacin II (83), 进一步在TpcC的催化下C-16和C-17位被氧化生成preterpestacin III (84), 最终经FAD型氧化酶TpcD的作用生成terpestacin (85)。另外, 通过基因敲除等技术发现Aspergillus ustus中ophiobolin骨架二倍半萜的生物合成可能涉及5个基因簇[54]。此外, 将PTTS和CYP450基因运用米曲霉异源表达体系进行共表达, 成功鉴定了新的二倍半萜衍生物, 包括乙酰胆碱酯酶(AChE) 抑制剂asperterpenol B (86)[55], 对结核分枝杆菌蛋白酪氨酸磷酸酶B (mPTPB) 表现出强效抑制活性的asperterpenoid A (87) 和B (88)[56]、preasterpenacid II (89)[45]、quiannulatic acid (90)[42]、sesterfisheric acid (91)[44]和aspergilols A~D (92~95)[48]等。
|
Figure 7 The oxidases involved in sesterterpenoid biosynthesis and the chemical structures of their products. The biosynthesis of ophiobolin derivatives catalyzed by the oxidases oblB (a), the biosynthesis of terpestacin (b), and the chemical structures of sesterterpenoids produced by reported oxidases (c) |
二倍半萜类化合物在自然界中分布广泛, 其结构复杂多变, 且具有多样独特的生物活性, 为珍稀天然产物, 引起了众多研究者的关注[4, 5]。二倍半萜类化合物的化学合成研究已经取得了系列重要进展[57-59], 但生物合成研究相对起步较晚。二倍半萜类化合物的生物合成包含了直链前体的合成、核心骨架的形成、后修饰等过程, 其中涉及了多种功能各异的生物合成酶的表达及协同作用, 整个过程复杂而多变。尽管随着多组学技术和异源表达体系的发展, 近年来不同来源的GFDPS、SesterTPS、氧化酶被陆续报道, 但是大量二倍半萜类化合物(尤其是植物二倍半萜) 的生物合成途径仍然未知, 生物合成关键酶及其催化机制和起源进化也有待进一步探索。目前鉴定的植物二倍半萜合酶的产物大多数为新颖结构化合物, 在其宿主中尚未检测或分离到, 比如十字花科和唇形科二倍半萜合酶的产物, 其生物功能及分布规律值得进一步研究。随着合成生物学技术的快速发展, 通过构建高产前体的底盘细胞, 可以促进二倍半萜生物合成途径中关键酶的鉴定以及结构新颖二倍半萜化合物的发现等研究, 为二倍半萜的生物合成、药理活性、生物功能和合成生物学研究奠定重要基础。
作者贡献: 李德森、陈月桂、郭凯和凌伊负责文献调研与文章撰写, 黎胜红和刘燕负责总体构思与文章撰写。
利益冲突: 所有作者声明本文无任何利益冲突。
| [1] |
Christianson DW. Structural and chemical biology of terpenoid cyclases[J]. Chem Rev, 2017, 117: 11570-11648. DOI:10.1021/acs.chemrev.7b00287 |
| [2] |
Quin MB, Flynn CM, Schmidt-Dannert C. Traversing the fungal terpenome[J]. Nat Prod Rep, 2014, 31: 1449-1473. DOI:10.1039/C4NP00075G |
| [3] |
Jiang F, Gong T, Chen J, et al. Synthetic biology of plants-derived medicinal natural products[J]. Chin J Biotech (生物工程学报), 2021, 37: 1931-1951. |
| [4] |
Guo K, Liu Y, Li SH. The untapped potential of plant sesterterpenoids: chemistry, biological activities and biosynthesis[J]. Nat Prod Rep, 2021. DOI:10.1039/D1NP00021G |
| [5] |
Li KK, Gustafson KR. Sesterterpenoids: chemistry, biology, and biosynthesis[J]. Nat Prod Rep, 2021, 38: 1251-1281. DOI:10.1039/D0NP00070A |
| [6] |
Wang L, Yang B, Lin XP, et al. Sesterterpenoids[J]. Nat Prod Rep, 2013, 30: 455-473. DOI:10.1039/c3np20089b |
| [7] |
Newman DJ, Cragg GM. Marine natural products and related compounds in clinical and advanced preclinical trials[J]. J Nat Prod, 2004, 67: 1216-1238. DOI:10.1021/np040031y |
| [8] |
Tian W, Deng ZX, Hong K. The biological activities of sesterterpenoid-type ophiobolins[J]. Mar Drugs, 2017, 15: 229. DOI:10.3390/md15070229 |
| [9] |
Luo SH, Luo Q, Niu XM, et al. Glandular trichomes of Leucosceptrum canum harbor defensive sesterterpenoids[J]. Angew Chem Int Ed, 2010, 49: 4471-4475. DOI:10.1002/anie.201000449 |
| [10] |
Piaz FD, Vassallo A, Lepore L, et al. Sesterterpenes as tubulin tyrosine ligase inhibitors. First insight of structure-activity relationships and discovery of new lead[J]. J Med Chem, 2009, 52: 3814-3828. DOI:10.1021/jm801637f |
| [11] |
Lohr M, Schwender J, Polle JEW. Isoprenoid biosynthesis in eukaryotic phototrophs: a spotlight on algae[J]. Plant Sci, 2012, 185: 9-22. |
| [12] |
Minami A, Ozaki T, Liu C, et al. Cyclopentane-forming di/sesterterpene synthases: widely distributed enzymes in bacteria, fungi, and plants[J]. Nat Prod Rep, 2018, 35: 1330-1346. DOI:10.1039/C8NP00026C |
| [13] |
He YF, Gao W, Liu TS, et al. Research advances of diterpene synthase[J]. Acta Pharm Sin (药学学报), 2011, 46: 1019-1025. |
| [14] |
Gong HY, Zeng Y, Chen XY. Diterpene synthases and their responsible cyclic natural products[J]. Nat Prod Bioprospect, 2014, 4: 59-72. DOI:10.1007/s13659-014-0012-8 |
| [15] |
Kawaguchi A, Nozoe S, Okuda S. Subcellular distribution of sesterterpene- and sterol-biosynthesizing activities in Cochliobolus heterostrophus[J]. Biochim Biophys Acta, 1973, 296: 615-623. DOI:10.1016/0005-2760(73)90122-7 |
| [16] |
Renner MK, Jensen PR, Fenical W. Mangicols: structures and biosynthesis of a new class of sesterterpene polyols from a marine fungus of the genus Fusarium[J]. J Org Chem, 2000, 65: 4843-4852. DOI:10.1021/jo000081h |
| [17] |
Neundorf I, Kohler C, Hennig L, et al. Evidence for the combined participation of a C10 and a C15 precursor in the biosynthesis of moenocinol, the lipid part of the moenomycin antibiotics[J]. ChemBioChem, 2003, 4: 1201-1205. DOI:10.1002/cbic.200300622 |
| [18] |
Massé G, Belt ST, Rowland SJ, et al. Isoprenoid biosynthesis in the diatoms Rhizosolenia setigera (Brightwell) and Haslea ostrearia (Simonsen)[J]. Proc Natl Acad Sci U S A, 2004, 101: 4413-4418. DOI:10.1073/pnas.0400902101 |
| [19] |
Tachibana A. A novel prenyltransferase, farnesylgeranyl diphosphate synthase, from the haloalkaliphilic archaeon, Natronobacterium pharaonis[J]. FEBS Lett, 1994, 341: 291-294. DOI:10.1016/0014-5793(94)80475-3 |
| [20] |
Tachibana A, Yano Y, Otani S, et al. Novel prenyltransferase gene encoding farnesylgeranyl diphosphate synthase from a hyperthermophilic archaeon, Aeropyrum pernix. Molecular evolution with alteration in product specificity[J]. Eur J Biochem, 2000, 267: 321-328. DOI:10.1046/j.1432-1327.2000.00967.x |
| [21] |
Lee PC, Mijts BN, Petri R, et al. Alteration of product specificity of Aeropyrum pernix farnesylgeranyl diphosphate synthase (Fgs) by directed evolution[J]. Protein Eng Des Sel, 2004, 17: 771-777. DOI:10.1093/protein/gzh089 |
| [22] |
Ogawa T, Yoshimura T, Hemmi H. Geranylfarnesyl diphosphate synthase from Methanosarcina mazei: different role, different evolution[J]. Biochem Biophys Res Commun, 2010, 393: 16-20. DOI:10.1016/j.bbrc.2010.01.063 |
| [23] |
Ogawa T, Yoshimura T, Hemmi H. Connected cavity structure enables prenyl elongation across the dimer interface in mutated geranylfarnesyl diphosphate synthase from Methanosarcina mazei[J]. Biochem Biophys Res Commun, 2011, 409: 333-337. DOI:10.1016/j.bbrc.2011.05.018 |
| [24] |
Ueda D, Yamaga H, Murakami M, et al. Biosynthesis of sesterterpenes, head-to-tail triterpenes, and sesquarterpenes in Bacillus clausii: identification of multifunctional enzymes and analysis of isoprenoid metabolites[J]. ChemBioChem, 2015, 16: 1371-1377. DOI:10.1002/cbic.201500138 |
| [25] |
Hou AW, Dickschat JS. The biosynthetic gene cluster for sestermobaraenes-discovery of a geranylfarnesyl diphosphate synthase and a multiproduct sesterterpene synthase from Streptomyces mobaraensis[J]. Angew Chem Int Ed, 2020, 59: 19961-19965. DOI:10.1002/anie.202010084 |
| [26] |
Nagel R, Bernholz C, Vranova E, et al. Arabidopsis thaliana isoprenyl diphosphate synthases produce the C25 intermediate geranylfarnesyl diphosphate[J]. Plant J, 2015, 84: 847-859. DOI:10.1111/tpj.13064 |
| [27] |
Wang C, Chen QW, Fan D, et al. Structural analyses of short-chain prenyltransferases identify an evolutionarily conserved GFPPS clade in Brassicaceae plants[J]. Mol Plant, 2016, 9: 195-204. DOI:10.1016/j.molp.2015.10.010 |
| [28] |
Liu Y, Luo SH, Schmidt A, et al. A geranylfarnesyl diphosphate synthase provides the precursor for sesterterpenoid (C25) formation in the glandular trichomes of the mint species Leucosceptrum canum[J]. Plant Cell, 2016, 28: 804-822. DOI:10.1105/tpc.15.00715 |
| [29] |
Shao J, Chen QW, Lv HJ, et al. (+)-Thalianatriene and (-)-retigeranin B catalyzed by sesterterpene synthases from Arabidopsis thaliana[J]. Org Lett, 2017, 19: 1816-1819. DOI:10.1021/acs.orglett.7b00586 |
| [30] |
Huang AC, Kautsar SA, Hong YJ, et al. Unearthing a sesterterpene biosynthetic repertoire in the Brassicaceae through genome mining reveals convergent evolution[J]. Proc Natl Acad Sci U S A, 2017, 114: E6005-E6014. DOI:10.1073/pnas.1705586114 |
| [31] |
Chen QW, Li J, Liu ZX, et al. Molecular basis for sesterterpene diversity produced by plant terpene synthases[J]. Plant Commun, 2020, 1: 100051. DOI:10.1016/j.xplc.2020.100051 |
| [32] |
Chen QW, Jiang T, Liu YX, et al. Recently duplicated sesterterpene (C25) gene clusters in Arabidopsis thaliana modulate root microbiota[J]. Sci China Life Sci, 2019, 62: 947-958. DOI:10.1007/s11427-019-9521-2 |
| [33] |
Chen YG, Li DS, Ling Y, et al. A cryptic plant terpene cyclase producing unconventional 18- and 14-membered macrocyclic C25 and C20 terpenoids with immunosuppressive activity[J]. Angew Chem Int Ed, 2021, 60: 25468-25476. DOI:10.1002/anie.202110842 |
| [34] |
Li DS, Hua J, Luo SH, et al. An extremely promiscuous terpenoid synthase from the Lamiaceae plant Colquhounia coccinea var. mollis catalyzes the formation of sester-/di-/sesqui-/mono-terpenoids[J]. Plant Commun, 2021, 2: 100233. DOI:10.1016/j.xplc.2021.100233 |
| [35] |
Rinkel J, Lauterbach LJ, Dickschat JS. Spata-13, 17-diene synthase, an enzyme with sesqui-, di- and sesterterpene synthase activity from Streptomyces xinghaiensis[J]. Angew Chem Int Ed, 2017, 56: 16385-16389. DOI:10.1002/anie.201711142 |
| [36] |
Shinozaki J, Shibuya M, Ebizuka Y, et al. Cyclization of all-E- and 2Z-geranylfarnesols by a bacterial triterpene synthase: insight into sesterterpene biosynthesis in Aleuritopteris ferns[J]. Biosci Biotechnol Biochem, 2013, 77: 2278-2282. DOI:10.1271/bbb.130543 |
| [37] |
Sato T, Yamaga H, Kashima S, et al. Identification of novel sesterterpene/triterpene synthase from Bacillus clausii[J]. ChemBioChem, 2013, 14: 822-825. DOI:10.1002/cbic.201300035 |
| [38] |
Yang YL, Zhang YT, Zhang S, et al. Identification and characterization of a membrane-bound sesterterpene cyclase from Streptomyces somaliensis[J]. J Nat Prod, 2018, 81: 1089-1092. DOI:10.1021/acs.jnatprod.7b01033 |
| [39] |
Chiba R, Minami A, Gomi K, et al. Identification of ophiobolin F synthase by a genome mining approach: a sesterterpene synthase from Aspergillus clavatus[J]. Org Lett, 2013, 15: 594-597. DOI:10.1021/ol303408a |
| [40] |
Matsuda Y, Mitsuhashi T, Quan Z, et al. Molecular basis for stellatic acid biosynthesis: a genome mining approach for discovery of sesterterpene synthases[J]. Org Lett, 2015, 17: 4644-4647. DOI:10.1021/acs.orglett.5b02404 |
| [41] |
Matsuda Y, Mitsuhashi T, Lee S, et al. Astellifadiene: structure determination by NMR spectroscopy and crystalline sponge method, and elucidation of its biosynthesis[J]. Angew Chem Int Ed, 2016, 55: 5785-5788. DOI:10.1002/anie.201601448 |
| [42] |
Okada M, Matsuda Y, Mitsuhashi T, et al. Genome-based discovery of an unprecedented cyclization mode in fungal sesterterpenoid biosynthesis[J]. J Am Chem Soc, 2016, 138: 10011-10018. DOI:10.1021/jacs.6b05799 |
| [43] |
Qin B, Matsuda Y, Mori T, et al. An unusual chimeric diterpene synthase from Emericella variecolor and its functional conversion into a sesterterpene synthase by domain swapping[J]. Angew Chem Int Ed, 2016, 55: 1658-1661. DOI:10.1002/anie.201509263 |
| [44] |
Ye Y, Minami A, Mandi A, et al. Genome mining for sesterterpenes using bifunctional terpene synthases reveals a unified intermediate of di/sesterterpenes[J]. J Am Chem Soc, 2015, 137: 11846-11853. DOI:10.1021/jacs.5b08319 |
| [45] |
Jiang L, Zhang X, Sato Y, et al. Genome-based discovery of enantiomeric pentacyclic sesterterpenes catalyzed by fungal bifunctional terpene synthases[J]. Org Lett, 2021, 23: 4645-4650. DOI:10.1021/acs.orglett.1c01361 |
| [46] |
Narita K, Sato H, Minami A, et al. Focused genome mining of structurally related sesterterpenes: enzymatic formation of enantiomeric and diastereomeric products[J]. Org Lett, 2017, 19: 6696-6699. DOI:10.1021/acs.orglett.7b03418 |
| [47] |
Mitsuhashi T, Rinkel J, Okada M, et al. Mechanistic characterization of two chimeric sesterterpene synthases from Penicillium[J]. Chem Eur J, 2017, 23: 10053-10057. DOI:10.1002/chem.201702766 |
| [48] |
Guo J, Cai YS, Cheng F, et al. Genome mining reveals a multiproduct sesterterpenoid biosynthetic gene cluster in Aspergillus ustus[J]. Org Lett, 2021, 23: 1525-1529. DOI:10.1021/acs.orglett.0c03996 |
| [49] |
Bian GK, Han Y, Hou A, et al. Releasing the potential power of terpene synthases by a robust precursor supply platform[J]. Metab Eng, 2017, 42: 1-8. DOI:10.1016/j.ymben.2017.04.006 |
| [50] |
Chen R, Jia Q, Mu X, et al. Systematic mining of fungal chimeric terpene synthases using an efficient precursor-providing yeast chassis[J]. Proc Natl Acad Sci U S A, 2021, 118: E2023247118. DOI:10.1073/pnas.2023247118 |
| [51] |
Sato H, Narita K, Minami A, et al. Theoretical study of sesterfisherol biosynthesis: computational prediction of key amino acid residue in terpene synthase[J]. Sci Rep, 2018, 8: 2473. DOI:10.1038/s41598-018-20916-x |
| [52] |
Narita K, Chiba R, Minami A, et al. Multiple oxidative modifications in the ophiobolin biosynthesis: P450 oxidations found in genome mining[J]. Org Lett, 2016, 18: 1980-1983. DOI:10.1021/acs.orglett.6b00552 |
| [53] |
Narita K, Minami A, Ozaki T, et al. Total biosynthesis of antiangiogenic agent (-)-terpestacin by artificial reconstitution of the biosynthetic machinery in Aspergillus oryzae[J]. J Org Chem, 2018, 83: 7042-7048. DOI:10.1021/acs.joc.7b03220 |
| [54] |
Chai H, Yin R, Liu Y, et al. Sesterterpene ophiobolin biosynthesis involving multiple gene clusters in Aspergillus ustus[J]. Sci Rep, 2016, 6: 27181. DOI:10.1038/srep27181 |
| [55] |
Quan ZY, Dickschat JS. Biosynthetic gene cluster for asperterpenols A and B and the cyclization mechanism of asperterpenol A synthase[J]. Org Lett, 2020, 22: 7552-7555. DOI:10.1021/acs.orglett.0c02748 |
| [56] |
Huang JH, Lv JM, Wang QZ, et al. Biosynthesis of an anti-tuberculosis sesterterpenoid asperterpenoid A[J]. Org Biomol Chem, 2018, 17: 248-251. |
| [57] |
Hog DT, Webster R, Trauner D. Synthetic approaches toward sesterterpenoids[J]. Nat Prod Rep, 2012, 29: 752-779. DOI:10.1039/c2np20005h |
| [58] |
Hugelshofer CL, Magauer T. Total synthesis of the leucosceptroid family of natural products[J]. J Am Chem Soc, 2015, 137: 3807-3810. DOI:10.1021/jacs.5b02021 |
| [59] |
Hugelshofer CL, Magauer T. A general entry to antifeedant sesterterpenoids: total synthesis of (+)-norleucosceptroid A, (-)-norleucosceptroid B, and (-)-leucosceptroid K[J]. Angew Chem Int Ed, 2014, 53: 11351-11355. DOI:10.1002/anie.201407788 |
 2022, Vol. 57
2022, Vol. 57


