2. 贵州医科大学, 省部共建药用植物功效与利用国家重点实验室, 贵州 贵阳 550025
2. State Key Laboratory of Functions and Applications of Medicinal Plants, Guizhou Medicinal University, Guiyang 550025, China
结核病(tuberculosis, TB) 是一种致死性传染性疾病, 自2007年以来结核病死亡人数已超过艾滋病, 成为全球十大死亡病因之一。2020年世界卫生组织(WHO) 全球结核病报告显示, 2019年约有1 000万人(890万至1 110万人) 患结核病, 全球结核病死亡人数约为120万[1]。结核病是由结核分枝杆菌引起的慢性传染疾病, 结核杆菌可通过空气传播侵入人体全身各种器官, 其主要侵犯肺脏, 称为肺结核病, 又称为痨病和“白色瘟疫”。
伴随着抗生素滥用及结核病治疗中的不科学用药等问题, 结核分枝杆菌在全球范围内出现广泛耐药现象, 已经出现耐多药结核病(至少对异烟肼、利福平耐药的结核病), 甚至广泛耐药结核病(extensively drug-resistant tuberculosis, XDR-TB, 同时对任意氟喹诺酮类药物以及至少一种其他的A组药物耐药的结核分枝杆菌菌株引起的结核病)。耐药结核病例数量在全球呈明显上升态势, WHO全球结核报告显示2019年大约有50万例新的利福平耐药结核病(其中78%为耐多药结核病)。全球耐药结核病压力最大的3个国家分别是印度(27%)、中国(14%) 和俄罗斯(9%)[1]。随着诊断技术和鉴定分类方法的进步, 越来越多的耐药结核病例被报道, 临床对于治疗耐药结核病的药物需求越来越迫切。
自2012年至今, 已经有3个抗结核的新化药上市(贝达喹啉、德拉马尼和普托马尼), 并有23个新化学实体药物处于临床试验阶段, 其中有4个新药由中国研发, 分别为TBI-223、吡法齐明(TBI-166)、澳利莫迪(aulimanid) 和WX-081 (表 1)。本文将以上述药物按照临床阶段划分进行分类介绍, 分别从作用机制、体内外药理活性研究、药代动力学及临床研究等角度论述当前研究进展。通过对当前抗结核药物的总结, 希望为后续的抗结核药物研究提供一定的参考(限于澳利莫迪和WX-081披露数据较少, 本综述将不做详细介绍)。
| Table 1 Anti-tubercular drugs in clinical phases. ATP: Adenosine triphosphate; DprE1: Decaprenyl-phosphoryl-ribose 2'-epimerase; LeuRS: Leucyl-tRNA synthetase; PDE4: Phosphodiesterase 4; MmpL3: Mycobacterial membrane protein large 3 |
TBI-223 (图 1) 是由全球结核病药物研发联盟(TB Alliance) 与中国医学科学院药物研究所合作, 通过先导化合物深入优化发现的新型噁唑烷酮类化合物。该药物属于一种蛋白质合成抑制剂, 其作用机制是抑制N-甲酰蛋氨酰-tRNA (N-formylmethionyl-tRNA) 与核糖体结合的早期步骤, Ⅰ期临床试验正在美国进行中[1]。另外, 由中国医学科学院药物研究所进一步深入开发的新型构象限制噁唑烷酮类候选药物(OTB-658, 化合物2) 也于2020年12月获得国家药品监督管理局批准的临床试验资格, 预计于近期开展Ⅰ期临床试验[2]。

|
Figure 1 The structures of TBI-223 (1) and OTB-658 (2) |
TBI-223对野生型结核杆菌和耐药型结核杆菌均具有抑制活性, 在小鼠感染模型中显示较好疗效。同时, 研究结果显示该药物具有良好的药代动力学性质、口服生物利用度和适宜的半衰期(小鼠t1/2 = 3 h, 大鼠t1/2 = 8 h), 另外该化合物显示较好的肝微粒体稳定性并对主要细胞色素P450酶无诱导作用(抑制率 < 20%, 30 μmol·L-1)。相较利奈唑胺, TBI-223在多种动物模型中表现出更好的安全性, 在比格犬体内的14天多次给药毒性实验中最高安全剂量达到了150 mg·kg-1·day-1。在大鼠体内的14天毒性研究中没有观察到血相变化和骨髓毒性, 雄性大鼠的最大无毒性反应剂量(NOAEL) 为200 mg·kg-1·day-1, 雌性大鼠的NOAEL为75 mg·kg-1·day-1 (利奈唑胺的NOAEL为20 mg·kg-1·day-1)。同时, TBI-223对哺乳动物的酪氨酸苏氨酸激酶MPS的半数抑制浓度(IC50) > 74 μmol·L-1 (利奈唑胺IC50 = 8 μmol·L-1)。
1.2 TBAJ-876TBAJ-876 (化合物4, 图 2) 属于贝达喹啉的类似物, 作用机制与贝达喹啉相同, 主要通过抑制ATP合成酶而达到抗菌效果[3]。该化合物报道于2019年, Sutherland等[4]发现在用3, 5二甲氧基-4-吡啶环取代了贝达喹啉的萘环后, 不但可以显著改善贝达喹啉对人心脏钾离子通道蛋白hERG抑制(hERG IC50 = 1.6 μmol·L-1) 导致的心脏毒性, 同时可以降低其亲脂性缩短其半衰期, 同时表现出更强的抗结核活性。该类型化合物目前有两个候选分子TBAJ-876 [H37Rv最小抑菌浓度(minimum inhibitory concentration, MIC) = 0.004 μg·mL-1, hERG IC50 > 30 μmol·L-1] 和TBAJ-587 (化合物5, H37Rv MIC = 0.006 μg·mL-1, hERG IC50 = 13 μmol·L-1), 均处于Ⅰ期临床研究阶段。

|
Figure 2 The structures of bedaquiline (3), TBAJ-876 (4), and TBAJ-587 (5) |
TBAJ-876还对脓肿分枝杆菌M. abscessus在体外模型和动物体内模型均显示有较高活性[5]。另外, TBAJ-876和TBAJ-587失去了贝达喹啉对ATP合成酶解偶联抑制性质[6], 但上述两个化合物保持了对结核杆菌的抗菌活性和对ATP合成酶的抑制, 据此研究者推测贝达喹啉的解偶联机制有可能不是抗结核活性的主要来源。
1.3 GSK-286GSK 2556286 (GSK-286, 图 3) 是由葛兰素史克开发的一种尿嘧啶类化合物, 作用机制尚不明确, 该化合物于2020年11月开始Ⅰ期临床试验。GSK-286对巨噬细胞内的结核分枝杆菌具有高度选择性, 对普通细胞内的结核分枝杆菌H37Rv的MIC > 10 μmol·L-1, 对巨噬细胞内的结核分枝杆菌H37Rv的MIC < 0.1 μmol·L-1。它在不同物种(小鼠、兔、猴) 体内均显示较好药效, 并能够降低结核病感染的复发率。
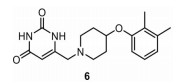
|
Figure 3 The structure of GSK-286 (6) |
BVL-GSK098 (化合物9, 图 4) 是由BioVersys与葛兰素史克GSK合作共同开发的酰基哌啶化合物, 该类化合物可能通过作用于细菌转录调节因子通路, 从而显著降低抗结核药物乙硫异烟胺(ethionamide, ETH)/丙硫异烟胺(protionamide, PTH) 的用药剂量(ETH和PTH属于二线抗结核药物, 因其用药剂量大, 导致胃肠道不适和肝毒性等不良反应较多)。该类型化合物报道于2009年, 研究者首次发现BDM31343抑制EthR (乙硫异烟胺激活酶EthA抑制因子之一), 可显著提高ETH耐药结核杆菌对ETH的敏感性[7]。2017年研究结果发现, 新型螺环类化合物SMARt-420同样可以提高结核杆菌对ETH的敏感性, 然而并未发现其对于EthR蛋白的直接抑制活性, 该现象可能提示新型螺环类化合物具有其他的作用模式[8, 9]。BioVersy与GSK的研究结果显示, BVL-GSK098与ETH配伍在体内外均能快速杀菌, 推测BVL-GSK098可刺激ETH新的生物激活途径, 从而提高ETH的疗效, 同时克服ETH的耐药性。根据动物体内药效数据, 预计BVL-GSK098可能将口服治疗方案中的ETH的有效剂量降低至原来的1/3, 并有可能显著减少剂量依赖性的不良反应, 提高患者依从性。BVL-GSK098于2020年12月在西班牙进入Ⅰ期临床研究, 预计2021年完成。

|
Figure 4 The structures of BDM31343 (7), SMARt-420 (8), and BVL-GSK098 (9) |
Epetraborole (化合物10, 图 5) 是由AN2 Therapeutics原研, 由上海腾盛博药医药技术有限公司进行大中华区商业开发的一种口服抗结核药物。该药物主要用于治疗耐多药和广泛耐药结核病, 于2021年6月开始Ⅰ期临床研究, 预计于2021年11月份完成Ⅰ期临床研究。目前尚未披露更多详细信息, 但其结构与亮氨酸-tRNA合成酶(LeuRS) 抑制剂GSK-052相似(化合物11, GSK-052用于治疗革兰阴性菌感染, 临床Ⅱ期研究已终止)。

|
Figure 5 The structures of epetraborole (10) and GSK-052 (11) |
特雷贝克(Q203, 图 6) 是由Qurient公司开发的一种咪唑并吡啶类药物, 通过与细胞色素bc1复合物QcrB (cytochrome bc1) 亚基结合抑制结核分枝杆菌细胞色素bc1复合物(该复合物是电子传递链的关键组成部分, 抑制该复合物会破坏细菌产生能量的能力)[10]。目前该化合物正在进行Ⅱ期临床试验, 并于2015年Q203获得了美国食品药品监督管理局(Food and Drug Administration, FDA) 批准的用于治疗结核分枝杆菌感染的孤儿药快速通道资格(2021年获得治疗溃疡分枝杆菌感染的孤儿药快速通道资格), 同时该化合物正在进行抗新冠病毒COVID-19感染的Ⅱ期临床试验。
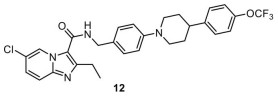
|
Figure 6 The structure of telacebec (12) |
Q203被报道于2013年, 在对苗头化合物进行结构衍生后获得该分子[11, 12]。研究结果显示Q203对结核分枝杆菌H37Rv MIC50为2.7 nmol·L-1, 且在体外活性测试中对MDR和XDR结核分枝杆菌同样保持了极强的抗菌活性。同时, 在小鼠结核分枝杆菌感染模型中, 该化合物在给药剂量低于1 mg·kg-1时即可发挥较好疗效。此外, Q203在10 μmol·L-1浓度下并未观察到对HepG2细胞、HEK293细胞和SH-SY5Y细胞的抑制作用。在小鼠14天单次给药急性毒性实验中, 小鼠在1 000 mg·kg-1剂量情况下, 无明显药物不良反应。在大鼠20天多次给药毒性实验中(给药10 mg·kg-1·day-1), 大鼠并未出现体重下降或其他药物不良反应。
目前, 特雷贝克Ⅱ期临床试验正在系统评价该药物在3种不同剂量(100、200和300 mg) 下治疗成人肺结核的安全性、药效和药代动力学性质。临床试验数据显示, 特雷贝克达到了14天内痰菌阴转率(TTP) 的主要目标, 并且该药物在不同的剂量强度下都表现出较好的安全性和良好的耐受性。
2.2 BTZ-043BTZ-043 (图 7) 由德国汉斯-科勒尔天然产物研究所(Hans-Knoell-Institute for Natural Products Research) 研发, 作用靶点为DprE1 (decaprenyl-phosphoryl-ribose 2'-epimerase), 抑制该靶点可阻断结核分枝杆菌细胞壁必要组成部分阿拉伯聚糖的合成。目前正在德国进行Ⅰ/Ⅱ期临床试验, 用于治疗肺结核。该化合物报道于2009年, Stewart团队[13]研究发现硝基苯并噻唑酮类化合物在对分枝杆菌的抑制活性和选择性方面表现出独特的潜力。BTZ-043对结核分枝杆菌H37Rv和耻垢分枝杆菌的MIC分别为1 ng·mL-1 (2.3 nmol·L-1) 和4 ng·mL-1 (9.2 nmol·L-1), 对从临床分离的MDR和XDR结核分枝杆菌菌株保持高抑制活性, 并优于抗结核药物异烟肼和乙胺丁醇。在慢性小鼠结核分枝杆菌感染模型中, 使用BTZ-043治疗4周后, 肺和脾脏的细菌数量指标分别减少了1个和2个数量级菌落形成单位(colony forming unit)。在未受感染小鼠中进行的急性毒性实验(5 g·kg-1) 和30天慢性毒性实验(25和250 mg·kg-1·day-1) 研究结果表明, 即使在最高剂量的测试中, 一个月后未观察到解剖学和行为学上的不良现象。
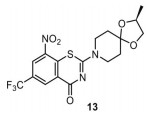
|
Figure 7 The structure of BTZ-043 (13) |
在研究BTZ-043与多种抗结核药物或候选药物(利福平、异烟肼、乙胺丁醇、贝达喹啉、普托马尼、莫西沙星、美罗培南、SQ109) 的联合给药过程中, BTZ-043显示与贝达喹啉的协同作用, 与其余药物联用未发现协同作用或拮抗作用[14]。20 ng·mL-1贝达喹啉与20 ng·mL-1 BTZ-043联合用药体外抗BTZ-043敏感型结核分枝杆菌效果优于80 ng·mL-1贝达喹啉用药效果, 然而在BTZ-043耐药型结核分枝杆菌上并未观察到此种协同作用。
2.3 马考齐酮(macozinone, PBTZ-169)马考齐酮(图 8) 报道于2014年, 是由洛桑联邦理工学院与Nearmedic Plus公司共同开发的一种苯并噻嗪酮类抗结核药物[15]。该化合物为DprE1的共价抑制剂, 于2018年2月终止IIa期临床试验, 其后该公司通过重新设计给药方案并于2018~2020年再次完成了两项临床Ⅰ期试验。

|
Figure 8 The structure of macozinone (14) |
Makarov等[15]研究发现硝基苯并噻唑酮类抗结核药物BTZ-043具有高效的体外抗菌活性MIC, 而其在小鼠结核病模型的药效学实验结果低于预期, 推测可能是由于化合物较高的疏水性所导致体内药效不佳。在深入研究中发现通过结构优化在骨架结构中引入哌嗪基团可以显著改善药代动力学性质, 其中PBTZ-169作为候选药物进入临床研究。体外抗菌活性测试结果显示, PBTZ-169对结核分枝杆菌、耻垢分枝杆菌和白喉棒状杆菌等各种菌的活性优于BTZ-043。在小鼠体内慢性肺结核模型中, PBTZ-169在同等剂量下治疗效果明显优于BTZ-043。在进行棋盘法检测PBTZ-169与其他抗结核药物联合用药情况时发现, PBTZ-169与贝达喹啉有显著的协同作用, 0.125 ng·mL-1 PBTZ-169与25 ng·mL-1贝达喹啉联合用药具有明显的杀菌效果(两种药物在相应浓度下单独使用无杀菌效果)。在小鼠慢性结核病模型中, PBTZ-169、贝达喹啉和吡嗪酰胺组成的新治疗方案显示比一线标准治疗方案(异烟肼、利福平和吡嗪酰胺) 更有效。DprE1-PBTZ-169复合物的晶体结构揭示了该化合物在活性位点与Cys387形成共价结合, 进一步解释了酶的不可逆失活原因。
2.4 TBA-7371TBA-7371 (图 9) 是阿斯利康和全球结核病药物研发联盟研制的一种口服抗结核药物。TBA-7371是DprE1的非共价抑制剂, 该化合物对耐多药结核分枝杆菌有效。当前, 比尔 & 梅琳达⋅盖茨医学研究机构正在开展TBA-7371治疗肺结核的Ⅱ期临床试验。
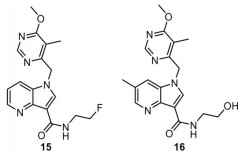
|
Figure 9 The structures of compound 15 and TBA-7371 (16) |
该类型化合物报道于2013年, Shirude等[16]通过对咪唑并吡啶骨架(非DprE1靶点抗结核骨架) 变换策略发现了一种新的1, 4-氮杂吲哚非共价DprE1抑制剂, 其中活性最优的化合物(化合物15, 图 9) 对结核分枝杆菌H37Rv的MIC为0.39 μmol·L-1, 对DprE1的IC50为0.003 μmol·L-1。然而, 在后续研究中发现该类化合物有两个不利于成药的因素: 一是对磷酸二酯酶6 (PDE6) 的潜在抑制, 可能导致眼部毒性; 二是由于在小鼠肝脏微粒体的快速代谢导致体内暴露量较低, 影响体内药效[17]。基于以上主要成药问题, 通过进一步的结构优化和改造得到了TBA-7371, 该分子保持了抗结核活性(对结核分枝杆菌H37Rv的MIC为0.28 μg·mL-1, 对DprE1的IC50为0.019 μmol·L-1)。另外, TBA-7371具有良好的口服生物利用度, 较高的安全性(在浓度100 μmol·L-1时对THP1细胞没有抑制作用, 在浓度33 μmol·L-1时对hERG通道不产生抑制), 半衰期t1/2为2 h。
2.5 OPC-167832OPC-167832 (图 10) 是日本大冢制药(Otsuka Pharmaceutical Co., Ltd., Japan) 开发的一种3, 4二氢喹诺酮衍生物类抗结核药物[18], 作用靶点为DprE1。在2016年, 大冢制药首次于第47届世界肺健康会议公开OPC-167832相关信息, 其对敏感型和MDR等多种结核分枝杆菌的MIC为0.24~2.0 ng·mL-1, 同时OPC-167832对生长型和胞内杆菌均有较强的杀菌作用。在慢性结核病小鼠模型中, OPC-167832在0.625 mg·kg-1时表现出有效的杀菌活性, 优于目前临床使用的抗结核药物(异烟肼、利福平等)。OPC-167832与其他抗结核药物在体外琼脂稀释法和慢性结核小鼠模型中均未显示拮抗作用。在减少细菌活力和防止复发方面表现, 以德拉马尼和OPC-167832为核心的多药联合治疗方案优于一线标准治疗方案。目前, OPC-167832正在进行Ib/IIa期临床试验, 主要评估其对肺结核患者的安全性和有效性, 另外FDA于2016年已经批准该化合物加速评审资格。

|
Figure 10 The structure of OPC-167832 (17) |
GSK3036656 (图 11) 是由葛兰素史克公司开发的一种新型含硼杂环类化合物, 作用靶点为LeuRS, 目前处于Ⅱ期临床试验。GSK3036656通过抑制LeuRS进而影响蛋白质的合成。LeuRS属于氨酰-tRNA合成酶(aaRS), 而aaRS是所有细胞中蛋白质合成所必需的酶家族。

|
Figure 11 The structures of AN2690 (18), compound 19, and GSK3036656 (20) |
该骨架结构(AN2690) 报道于2007年[19], 可与tRNA的末端核苷酸Ade76形成共价复合物, 从而抑制蛋白质合成。2016年Palencia等[20]报道了新型的硼杂环3-氨基甲基衍生物(化合物19, 图 11) 具有较好的抗结核分枝杆菌活性。在小鼠体内结核病感染模型中, 口服该化合物后表现出良好的生物利用度和抗结核疗效, 但是由于该化合物同时能够抑制哺乳动物细胞的LeuRS酶, 从而产生对宿主细胞的潜在毒性。通过进一步结构优化和构效关系探索, 获得了选择性更好的候选化合物GSK3036656[21], 该化合物表现出有效抑制LeuRS (IC50 = 0.20 μmol·L-1) 和体外抗结核的活性(Mtb H37Rv MIC = 0.02 μg·mL-1)。此外, 它对结核杆菌LeuRS具有高度选择性(人线粒体LeuRS的IC50为300 μmol·L-1, 人细胞质LeuRS的IC50为132 μmol·L-1)。在小鼠结核感染模型上, GSK3036656显示出良好的药代动力学性质和体内药效。Ⅰ期临床试验结果显示, GSK3036656单次和多次给药后耐受性良好, 无严重不良事件报告[22]。
2.7 舒特唑利德(sutezolid, PNU-100480)舒特唑利德(图 12) 是由辉瑞开发的一种噁唑烷酮类口服抗结核药物, 其作用靶点为结核分枝杆菌核糖体50S亚基的23S rRNA。在2017年世界结核病日, 全球结核病药物研发联盟加入到该药物的临床研究, 目前该化合物处于Ⅱ期临床试验。PNU-100480报道于1996年[23], 其对野生型结核分枝杆菌的MIC为0.125 μg·mL-1, 该化合物的小鼠体内药效与阳性对照药异烟肼相当。研究显示, PNU-100480的抗结核分枝杆菌活性比上市药物利奈唑胺更强, 在与其他药物联合用药时表现出良好疗效, 且未发现药物相互作用[24, 25]。在气溶胶小鼠慢性感染结核分枝杆菌H37Rv模型中, 舒特唑利德联合一线标准治疗方案可显著缩短治疗时间, 而一线方案加上利奈唑胺会产生拮抗作用[26]。
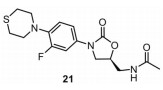
|
Figure 12 The structure of sutezolid (21) |
Delpazolid (图 13) 是由LegoChem BioSciences公司研发的一种新型噁唑烷酮类化合物, 作用靶点同样是50S亚基的23S rRNA, 可抑制蛋白质合成, 于2017年在韩国进入Ⅱ期临床试验。

|
Figure 13 The structure of delpazolid (22) |
该化合物公开报道于2009年的ICAAC会议上[27], 研究结果显示该化合物对多种革兰阳性菌有抑制作用, 在小鼠全身细菌感染模型中显现出比利奈唑胺更好的疗效。在21天内每天两次服用1 200 mg剂量delpazolid的情况下, 健康男性受试者的血液学特征与安慰剂组没有显著性差异[28]。最高单次给药药物耐受剂量为2 400 mg (男性受试者中), 常见的药物相关临床和实验室不良事件是恶心伴或不伴呕吐、中性粒细胞计数减少和总胆红素水平升高。其在临床试验中表现出与利奈唑胺相当的抑菌和杀菌活性, 且在空腹状态下服药与进食后服药动力学参数没有显著性区别[29, 30]。
2.9 SPR720SPR720 (图 14) 是Spero Therapeutics公司研发的一种口服抗生素, 主要用于肺部非结核分枝杆菌感染的治疗, 于2021年3月终止IIa期临床试验, 安全委员会在审查SPR720的灵长类动物模型的数据中发现了原因未知的死亡例, 但目前尚未出现任何人体相关的不良反应现象。现决定再补充开展动物毒性研究, 深入评估SPR720的潜在毒性。SPR720具有氨基苯并咪唑骨架结构, 属于细菌回旋酶B (GyrB) 的抑制剂, 该类化合物具有广谱抗菌活性。SPR720是SPR719 (化合物 23, 图 14) 的前药, 原型化合物SPR719对多种敏感型结核杆菌和耐药型结核杆菌的MIC分别为0.03~0.30 μg·mL-1和0.08~5.48 μg·mL-1, SPR719以及其前药SPR720在小鼠肺部感染模型中均显示出良好的疗效[31]。

|
Figure 14 The structures of SPR719 (23) and SPR720 (24) |
在慢性小鼠结核分枝杆菌感染模型中, SPR720比SPR719具有更好的疗效, 该化合物可以较SPR719进一步缩短结核病的治疗时间, 可能为耐多药结核杆菌感染患者提供新的口服治疗方案。Ⅰ期临床(NCT03796910) 数据显示该化合物具有较好的安全性, 单次给药毒性研究结果显示, 单次给药2 g连续观察14天, SPR720未出现严重不良反应[32]。
2.10 吡法齐明(TBI-166)吡法齐明(图 15) 属于一类新型亚胺吩嗪类抗结核药物, 由全球结核病药物研发联盟与中国医学科学院药物研究所合作研究。氯法齐明(化合物26, 图 15) 是治疗耐药结核病核心药物之一, 然而在豚鼠、兔和非人灵长类动物体内的疗效较差, 并具有皮肤红染等不良反应, 使氯法齐明的应用逐渐减少。通过对氯法齐明的结构优化和改造, 获得候选化合物TBI-166具有良好的理化特性和药代动力学特性(避免皮肤变色), 该化合物于2020年11月在中国开始Ⅱ期临床试验。

|
Figure 15 The structures of TBI-166 (25) and clofazimine (26) |
TBI-166报道于2011年[33], TBI-166的抗结核分枝杆菌H37Rv活性高于氯法齐明(TBI-166和氯法齐明对结核分枝杆菌H37Rv的MIC分别为0.016 μg·mL-1和0.12 μg·mL-1), 半衰期t1/2为41 h (氯法齐明t1/2为29 h)。在对500多个衍生物进行系统研究后[34, 35], TBI-166被选定作为临床候选药物。此外, 在对TBI-166进行复方配伍治疗效果探究中发现: TBI-166 + 贝达喹啉+ 利奈唑胺的治疗方案在小鼠感染模型中疗效较好[36]。与氯法齐明相比, TBI-166对H37Rv和临床分离株的抗菌活性较好, TBI-166对堪萨斯分枝杆菌(M. kansasii) 的MIC为氯法齐明MIC的1/10, 提示TBI-166在M. kansasii感染上具有潜在临床应用[37]。同时, TBI-166显著降低了氯法齐明的红染不良反应, 可改善患者的顺应性。
2.11 AMG-634AMG-634 (图 16) 是由Celgene原研, Amgen公司开发的一种磷酸二酯酶Ⅳ (PDE4) 口服抑制剂。PDE4与多种炎性细胞的cAMP水解有关, PDE4抑制剂能抑制炎症因子肿瘤坏死因子-α (TNF-α) 和白细胞介素-12 (IL-12) 的产生, 并对细菌脂多糖(LPS) 诱导的白细胞介素-1β (IL-1β) 表现出抑制作用[38, 39]。目前其针对结核病、麻风病适应症的临床试验均处于Ⅱ期临床试验。

|
Figure 16 The structure of AMG-634 (27) |
SQ109 (图 17) 是由Sequella公司(美国) 和美国国家卫生研究院(NIH) 共同发现的一种1, 2-二胺类药物, 作用靶点为分枝杆菌膜蛋白3 (MmpL3)[40]。MmpL3是一种重要的膜蛋白, 参与结核分枝杆菌细胞外膜的合成, 其被认为是一种对细菌(包括结核分枝杆菌) 复制和生存至关重要的MmpL, SQ109与MmpL3的蛋白晶体复合物PDB编号为: 6AJG[41]。2021年3月27日, Sequella公司公布针对多药耐药肺结核的IIb/Ⅲ期临床试验阳性结果: 将SQ109添加到一线标准治疗方案中治疗的患者痰菌阴转率(80%) 显著性高于安慰剂组(安慰剂+标准治疗方案) 痰菌阴转率(61%)。

|
Figure 17 The structure of SQ109 (28) |
该化合物报道于2003年, Clif课题组[42, 43]在研究乙胺丁醇类似物的过程中, 利用组合化学技术合成了一个基于乙胺丁醇的1, 2-乙二胺药效团的化合物库, 在对其抗结核分枝杆菌的活性进行了测试后发现了多个苗头化合物, 其中26个化合物体外活性等于或优于乙胺丁醇。其中SQ109是体外最有效的化合物, 相较于乙胺丁醇活性有数十倍的提高(MIC ≤ 0.02 μg·mL-1), 且对于临床上分离的MDR-TB和XDR-TB菌株均有活性。SQ109可显著降低贝达喹啉的MIC, 且不与利福平产生药物相互作用[44]。SQ109和PNU100480联合用药比单独用药可以进一步提高抗结核活性[45]。目前研究显示, 相较于乙胺丁醇, SQ109在安全性、有效性和耐受性方面具有一定的优势[46, 47]。
3.2 德拉马尼(delamanid, OPC-67683)德拉马尼(图 18) 于2014年上市, 是由日本大冢制药开发的硝基咪唑类抗结核药物, 通过抑制结核分枝杆菌细胞壁的重要组成部分——分枝菌酸的合成从而实现抗结核活性。该化合物报道于2006年, 对结核分枝杆菌菌株的体外MIC范围为0.006~0.024 μg·mL-1, 在小鼠体内低剂量即具有高效的治疗效果, 同时该化合物不影响肝药酶活性也不受肝药酶影响, 可与影响细胞色素P450酶诱导或代谢的药物联合使用。

|
Figure 18 The structure of delamanid (29) |
2014年, 根据IIb期试验结果, WHO发布了关于使用德拉马尼治疗成人耐多药结核病的临时政策指南[48]。有条件地建议将德拉马尼作为成人耐多药结核病长期治疗方案的一部分。在2016年发布德拉马尼治疗耐多药结核病的儿童和青少年的结果后, WHO进一步扩大了德拉马尼在儿童和青少年结核患者的使用范围, 包括6~17岁的患者[49]。
2017年11月, 基于德拉马尼针对成人耐多药结核病的安全性和有效性的Ⅲ期临床试验的最终结果, WHO对新数据进行了快速外部专家审查, 肯定了其在成人耐药结核病的治疗效果, 并进一步明确其使用方法——即只能在其他用药方案无效时, 才能将德拉马尼添加到耐多药结核治疗方案中[50]。
3.3 贝达喹啉(bedaquiline, TMC207, R207910)贝达喹啉(化合物3, 图 2) 是美国强生开发的首个二芳基类抗结核药物, 作用靶点为ATP合酶, 该化合物主要通过影响结核分枝杆菌的能量供应而发挥抗菌活性。2012年上市。它是继1963年利福平上市以来, 第一个被FDA批准的抗结核新药。该化合物报道于2005年[51], 在体外对耐药结核分枝杆菌有较强的抑制作用(MIC为0.06 μg·mL -1)。在小鼠体内模型, 贝达喹啉治疗效果超过异烟肼和利福平至少10倍。
2013年, 根据IIb期临床试验结果, WHO于发布了关于使用贝达喹啉治疗成人MDR-TB的临时政策指南[52]: 推荐贝达喹啉加入耐多药结核病长期治疗方案之中, 但应遵循以下条件: 适当的患者选择、遵循WHO建议的方案设计、密切监测治疗、积极的结核病药物安全性监测和管理以及患者的知情同意。2018年, WHO公布的耐药结核病治疗方案, 贝达喹啉被推荐为优先级的药品(A组) 用于设计耐药结核病口服治疗方案。
目前, 贝达喹啉已经在超过50个国家和地区使用, 贝达喹啉耐药病例已有报道, 并且已经观察到贝达喹啉与氯法齐明的交叉耐药现象[53]。目前报道的耐药机制有atpE、Rv0678和pepQ基因的突变[54], 这提示研究者应做好贝达喹啉耐药临床监测工作。
3.4 普托马尼(pretomanid, PA824)普托马尼(图 19) 是由全球结核病药物研发联盟研发的硝基咪唑类药物, 该药物的作用机制是通过抑制分枝菌酸的合成从而起到杀灭复制期菌株的作用, 于2019年已获FDA批准上市。与德拉马尼相同, 普托马尼对结核分枝杆菌的复制期菌株和非复制期菌株均有抑制效果[55]。
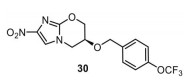
|
Figure 19 The structure of pretomanid (30) |
该化合物报道于2000年, 对不同结核分枝杆菌菌株的MIC为0.015~0.25 μg·mL-1[56]。在2008年, 研究者首次阐明了普托马尼对非复制期结核分枝杆菌杀菌作用的机制: 首先普托马尼需通过硝基还原酶(deazaflavin-dependent nitroreductase, Ddn) 还原激活, 从而形成咪唑杂环的各种还原代谢产物, 其中包括一种去硝基咪唑代谢产物, 它会释放一氧化氮, 破坏细胞内蛋白质、细胞壁脂质和其他大分子物质, 进而对非复制期结核分枝杆菌具有杀菌作用[57, 58]。
4 结语与展望当前临床研究阶段的化合物主要聚焦在作用于结核分枝杆菌的DNA、转录调节因子、蛋白质合成、能量代谢和细胞壁等多个靶点, 同一作用机制下同时有多个药物处于临床的不同研究阶段。其中能量代谢、抑制蛋白质合成和阻断结核分枝杆菌细胞壁合成机制上的临床研究药物较为丰富, 靶向DprE1当前有4个新化学实体进入临床Ⅱ期研究, 并发现了多个不同的骨架结构与全新的非共价结合机制, 这些为该靶点的药物临床应用提供了更加多样的选择。在安全性方面, 上述多个靶点的药物通过直接作用于细菌的特有靶点, 可以较大程度上减少药物对宿主潜在的不良反应。如细菌转录因子与DprE1等细菌或结核杆菌独有的靶点可能会更具有优势。另外, 免疫调节与靶向毒力因子等机制在抗感染领域已有所发展, 并且其在对抗结核耐药方面具有较大的潜在优势, 可以在一定程度上减缓耐药的问题, 可能在后期会成为较为重要的研究方向。如正处于临床Ⅱ期研究的AMG-634, 从目前披露的数据来看, 其可以显著降低由于菌体感染导致的后续人体炎症反应, 虽然不是直接杀死菌体本身, 但同样可以取得较好的临床治疗效果。天然产物一直是药物的重要来源之一, 其结构多样, 并且生物活性广泛。在当前抗结核药物研发方面, 新发现的具有较强抗结核活性的天然药物小分子主要来源于海洋天然产物, 其结构较为复杂, 对其进行系统全面的结构修饰和合成的工作较少。另外, 天然产物抗结核机制研究方面仍存在较大的挑战, 需要科研工作者深入进行系统研究。相信随着基础研究逐步深入, 一定会有更多全新作用机制的抗结核天然产物被应用于临床。
结核病已成为全球公共卫生安全领域的严重威胁之一, 特别是耐药问题给结核病的防治带来了前所未有的挑战。WHO终结结核病战略和联合国可持续发展目标(SDGs) 都对结核病的全球防治提出了阶段性目标和里程碑, 当前距离2035年终结结核病目标仍有距离。至今已经有多个新的药物、联合用药方案和新的诊疗技术正处在临床研究中, 相信通过全球研究机构和制药企业的联合攻关, 后期会有更多药物和诊疗方案进入到临床。同时, 研究者应该加大关注全球的结核分枝杆菌耐药进展, 重视新上市药物的耐药监测, 有效地减少药物滥用及不合理用药造成的耐药问题。当然也必须直面当前新药研发中的挑战和不确定性, 在抗结核药物研究工作稳定持续的投入, 特别在寻找新靶点并开发成为新作用机制的抗结核药物需要进行长期的研究。
作者贡献: 朱子豪、张文轩、李天磊和吴松共同参与了文章的撰写以及修改。
利益冲突: 本文无任何利益冲突。
| [1] |
World Health Organization. Global Tuberculosis Report 2020 [R]. Geneva: WHO, 2020.
|
| [2] |
Zhao H, Wang B, Fu L, et al. Discovery of a conformationally constrained oxazolidinone with improved safety and efficacy profiles for the treatment of multidrug-resistant tuberculosis[J]. J Med Chem, 2020, 63: 9316-9339. DOI:10.1021/acs.jmedchem.0c00500 |
| [3] |
Sarathy JP, Ragunathan P, Shin J, et al. TBAJ-876 retains bedaquiline's activity against subunits c and epsilon of Mycobacterium tuberculosis F-ATP synthase[J]. Antimicrob Agents Chemother, 2019, 63: e01191-19. |
| [4] |
Sutherland HS, Tong AST, Choi PJ, et al. 3, 5-Dialkoxypyridine analogues of bedaquiline are potent antituberculosis agents with minimal inhibition of the hERG channel[J]. Bioorg Med Chem, 2019, 27: 1292-1307. DOI:10.1016/j.bmc.2019.02.026 |
| [5] |
Sarathy JP, Ganapathy US, Zimmerman MD, et al. TBAJ-876, a 3, 5-dialkoxypyridine analogue of bedaquiline, is active against Mycobacterium abscessus[J]. Antimicrob Agents Chemother, 2020, 64: e02404-19. |
| [6] |
Sarathy JP, Ragunathan P, Cooper CB, et al. TBAJ-876 displays bedaquiline-like mycobactericidal potency without retaining the parental drug's uncoupler activity[J]. Antimicrob Agents Chemo-ther, 2020, 64: e01540-19. |
| [7] |
Willand N, Dirie B, Carette X, et al. Synthetic EthR inhibitors boost antituberculous activity of ethionamide[J]. Nat Med, 2009, 15: 537-544. DOI:10.1038/nm.1950 |
| [8] |
Blondiaux N, Moune M, Desroses M, et al. Reversion of antibiotic resistance in Mycobacterium tuberculosis by spiroisoxazoline SMARt-420[J]. Science, 2017, 355: 1206-1211. DOI:10.1126/science.aag1006 |
| [9] |
Rubin EJ. Reviving a drug for tuberculosis?[J]. N Engl J Med, 2017, 376: 2292-2294. DOI:10.1056/NEJMcibr1703502 |
| [10] |
Abrahams KA, Cox JA, Spivey VL, et al. Identification of novel imidazo[1, 2-a]pyridine inhibitors targeting M. tuberculosis QcrB[J]. PLoS One, 2012, 7: e52951. DOI:10.1371/journal.pone.0052951 |
| [11] |
Kang S, Kim RY, Seo MJ, et al. Lead optimization of a novel series of imidazo[1, 2-a]pyridine amides leading to a clinical candidate (Q203) as a multi- and extensively-drug-resistant anti-tuberculosis agent[J]. J Med Chem, 2014, 57: 5293-5305. DOI:10.1021/jm5003606 |
| [12] |
Pethe K, Bifani P, Jang J, et al. Discovery of Q203, a potent clinical candidate for the treatment of tuberculosis[J]. Nat Med, 2013, 19: 1157-1160. DOI:10.1038/nm.3262 |
| [13] |
Makarov V, Manina G, Mikusova K, et al. Benzothiazinones kill Mycobacterium tuberculosis by blocking arabinan synthesis[J]. Science, 2009, 324: 801-804. DOI:10.1126/science.1171583 |
| [14] |
Lechartier B, Hartkoorn RC, Cole ST. In vitro combination studies of benzothiazinone lead compound BTZ043 against Mycobacterium tuberculosis[J]. Antimicrob Agents Chemother, 2012, 56: 5790-5793. DOI:10.1128/AAC.01476-12 |
| [15] |
Makarov V, Lechartier B, Zhang M, et al. Towards a new combination therapy for tuberculosis with next generation benzothiazinones[J]. EMBO Mol Med, 2014, 6: 372-383. DOI:10.1002/emmm.201303575 |
| [16] |
Shirude PS, Shandil R, Sadler C, et al. Azaindoles: noncovalent DprE1 inhibitors from scaffold morphing efforts, kill Mycobacterium tuberculosis and are efficacious in vivo[J]. J Med Chem, 2013, 56: 9701-9708. DOI:10.1021/jm401382v |
| [17] |
Shirude PS, Shandil RK, Manjunatha MR, et al. Lead optimization of 1, 4-azaindoles as antimycobacterial agents[J]. J Med Chem, 2014, 57: 5728-5737. DOI:10.1021/jm500571f |
| [18] |
Hariguchi N, Chen X, Hayashi Y, et al. OPC-167832, a novel carbostyril derivative with potent anti-tuberculosis activity as a DprE1 inhibitor[J]. Antimicrob Agents Chemother, 2020, 64: e02020-19. |
| [19] |
Rock FL, Mao W, Yaremchuk A, et al. An antifungal agent inhibits an aminoacyl-tRNA synthetase by trapping tRNA in the editing site[J]. Science, 2007, 316: 1759-1761. DOI:10.1126/science.1142189 |
| [20] |
Palencia A, Li X, Bu W, et al. Discovery of novel oral protein synthesis inhibitors of Mycobacterium tuberculosis that target leucyl-tRNA synthetase[J]. Antimicrob Agents Chemother, 2016, 60: 6271-6280. DOI:10.1128/AAC.01339-16 |
| [21] |
Li X, Hernandez V, Rock FL, et al. Discovery of a potent and specific M. tuberculosis leucyl-tRNA synthetase inhibitor: (S)-3-(aminomethyl)-4-chloro-7-(2-hydroxyethoxy)benzo[c][1, 2]oxaborol-1(3H)-ol (GSK656)[J]. J Med Chem, 2017, 60: 8011-8026. DOI:10.1021/acs.jmedchem.7b00631 |
| [22] |
Tenero D, Derimanov G, Carlton A, et al. First-time-in-human study and prediction of early bactericidal activity for GSK3036656, a potent leucyl-tRNA synthetase inhibitor for tuberculosis treatment[J]. Antimicrob Agents Chemother, 2019, 63: e00240-19. |
| [23] |
Barbachyn MR, Hutchinson DK, Brickner SJ, et al. Identification of a novel oxazolidinone (U-100480) with potent antimycobacterial activity[J]. J Med Chem, 1996, 39: 680-685. DOI:10.1021/jm950956y |
| [24] |
Cynamon MH, Klemens SP, Sharpe CA, et al. Activities of several novel oxazolidinones against Mycobacterium tuberculosis in a murine model[J]. Antimicrob Agents Chemotherapy, 1999, 43: 1189-1191. DOI:10.1128/AAC.43.5.1189 |
| [25] |
Williams KN, Stover CK, Zhu T, et al. Promising antituberculosis activity of the oxazolidinone PNU-100480 relative to that of linezolid in a murine model[J]. Antimicrob Agents Chemother, 2009, 53: 1314-1319. DOI:10.1128/AAC.01182-08 |
| [26] |
Williams KN, Brickner SJ, Stover CK, et al. Addition of PNU-100480 to first-line drugs shortens the time needed to cure murine tuberculosis[J]. Am J Respir Crit Care Med, 2009, 180: 371-376. DOI:10.1164/rccm.200904-0611OC |
| [27] |
Jeong JW, Jung SJ, Lee HH, et al. In vitro and in vivo activities of LCB01-0371, a new oxazolidinone[J]. Antimicrob Agents Chemother, 2010, 54: 5359-5362. DOI:10.1128/AAC.00723-10 |
| [28] |
Choi Y, Lee SW, Kim A, et al. Safety, tolerability and pharmacokinetics of 21 day multiple oral administration of a new oxazolidinone antibiotic, LCB01-0371, in healthy male subjects[J]. J Antimicrob Chemother, 2018, 73: 183-190. DOI:10.1093/jac/dkx367 |
| [29] |
Cho YS, Lim HS, Lee SH, et al. Pharmacokinetics, pharmacodynamics, and tolerability of single-dose oral LCB01-0371, a novel oxazolidinone with broad-spectrum activity, in healthy volunteers[J]. Antimicrob Agents Chemother, 2018, 62: e00451-18. |
| [30] |
Sunwoo J, Kim YK, Choi Y, et al. Effect of food on the pharmacokinetic characteristics of a single oral dose of LCB01-0371, a novel oxazolidinone antibiotic[J]. Drug Des Devel Ther, 2018, 12: 1707-1714. DOI:10.2147/DDDT.S155657 |
| [31] |
Locher CP, Jones SM, Hanzelka BL, et al. A novel inhibitor of gyrase B is a potent drug candidate for treatment of tuberculosis and nontuberculosis mycobacterial infections[J]. Antimicrob Agents Chemother, 2015, 59: 1455-1465. DOI:10.1128/AAC.04347-14 |
| [32] |
Stokes SS, Vemula R, Pucci MJ. Advancement of GyrB inhibitors for treatment of infections caused by Mycobacterium tuberculosis and non-tuberculous Mycobacteria[J]. ACS Infect Dis, 2020, 6: 1323-1331. DOI:10.1021/acsinfecdis.0c00025 |
| [33] |
Lu Y, Zheng MQ, Wang B, et al. Clofazimine analogs with efficacy against experimental tuberculosis and reduced potential for accumulation[J]. Antimicrob Agents Chemother, 2011, 55: 5185-5193. DOI:10.1128/AAC.00699-11 |
| [34] |
Zhang DF, Lu Y, Liu K, et al. Identification of less lipophilic riminophenazine derivatives for the treatment of drug-resistant tuberculosis[J]. J Med Chem, 2012, 55: 8409-8417. DOI:10.1021/jm300828h |
| [35] |
Zhang DF, Liu Y, Zhang CL, et al. Synthesis and biological evaluation of novel 2-methoxypyridylamino-substituted riminophenazine derivatives as antituberculosis agents[J]. Molecules, 2014, 19: 4380-4394. DOI:10.3390/molecules19044380 |
| [36] |
Zhang Y, Zhu H, Fu L, et al. Identifying regimens containing TBI-166, a new drug candidate against Mycobacterium tuberculosis in vitro and in vivo[J]. Antimicrob Agents Chemother, 2019, 63: e02496-18. |
| [37] |
Xu J, Wang B, Fu L, et al. In vitro and in vivo activities of the riminophenazine TBI-166 against Mycobacterium tuberculosis[J]. Antimicrob Agents Chemother, 2019, 63: e02155-18. |
| [38] |
Houslay MD. Underpinning compartmentalised cAMP signalling through targeted cAMP breakdown[J]. Trends Biochem Sci, 2010, 35: 91-100. DOI:10.1016/j.tibs.2009.09.007 |
| [39] |
Guo J, Lin P, Zhao X, et al. Etazolate abrogates the lipopolysaccharide (LPS)-induced downregulation of the cAMP/pCREB/BDNF signaling, neuroinflammatory response and depressive-like behavior in mice[J]. Neuroscience, 2014, 263: 1-14. DOI:10.1016/j.neuroscience.2014.01.008 |
| [40] |
Tahlan K, Wilson R, Kastrinsky DB, et al. SQ109 targets MmpL3, a membrane transporter of trehalose monomycolate involved in mycolic acid donation to the cell wall core of Mycobacterium tuberculosis[J]. Antimicrob Agents Chemother, 2012, 56: 1797-1809. DOI:10.1128/AAC.05708-11 |
| [41] |
Zhang B, Li J, Yang XL, et al. Crystal structures of membrane transporter MmpL3, an anti-TB drug target[J]. Cell, 2019, 176: 636-648. DOI:10.1016/j.cell.2019.01.003 |
| [42] |
Lee RE, Protopopova M, Crooks E, et al. Combinatorial lead optimization of [1, 2]-diamines based on ethambutol as potential antituberculosis preclinical candidates[J]. J Comb Chem, 2003, 5: 172-187. DOI:10.1021/cc020071p |
| [43] |
Protopopova M, Hanrahan C, Nikonenko B, et al. Identification of a new antitubercular drug candidate, SQ109, from a combinatorial library of 1, 2-ethylenediamines[J]. J Antimicrob Chemother, 2005, 56: 968-974. DOI:10.1093/jac/dki319 |
| [44] |
Reddy VM, Einck L, Andries K, et al. In vitro interactions between new antitubercular drug candidates SQ109 and TMC207[J]. Antimicrob Agents Chemother, 2010, 54: 2840-2846. DOI:10.1128/AAC.01601-09 |
| [45] |
Reddy VM, Dubuisson T, Einck L, et al. SQ109 and PNU-100480 interact to kill Mycobacterium tuberculosis in vitro[J]. J Antimicrob Chemother, 2012, 67: 1163-1166. DOI:10.1093/jac/dkr589 |
| [46] |
Heinrich N, Dawson R, du Bois J, et al. Early phase evaluation of SQ109 alone and in combination with rifampicin in pulmonary TB patients[J]. J Antimicrob Chemother, 2015, 70: 1558-1566. DOI:10.1093/jac/dku553 |
| [47] |
Boeree MJ, Heinrich N, Aarnoutse R, et al. High-dose rifampicin, moxifloxacin, and SQ109 for treating tuberculosis: a multi-arm, multi-stage randomised controlled trial[J]. Lancet Infect Dis, 2017, 17: 39-49. DOI:10.1016/S1473-3099(16)30274-2 |
| [48] |
World Health Organization. The Use of Delamanid in the Treatment of Multidrug-resistant Tuberculosis: Interim Policy Guidance[M]. Geneva: WHO, 2014.
|
| [49] |
World Health Organization. The Use of Delamanid in the Treatment of Multidrug-resistant Tuberculosis in Children and Adolescents: Interim Policy Guidance [M]. Geneva: WHO, 2016.
|
| [50] |
World Health Organization. WHO Position Statement on the Use of Delamanid for Multidrug-resistant Tuberculosis[M]. Geneva: WHO, 2018.
|
| [51] |
Andries K, Verhasselt P, Guillemont J, et al. A diarylquinoline drug active on the ATP synthase of Mycobacterium tuberculosis[J]. Science, 2005, 307: 223-227. DOI:10.1126/science.1106753 |
| [52] |
World Health Organization. The Use of Bedaquiline in the Treatment of Multidrug-resistant Tuberculosis: Interim Policy Guidance[M]. Geneva: WHO, 2013.
|
| [53] |
Hartkoorn RC, Uplekar S, Cole ST. Cross-resistance between clofazimine and bedaquiline through upregulation of MmpL5 in Mycobacterium tuberculosis[J]. Antimicrob Agents Chemother, 2014, 58: 2979-2981. DOI:10.1128/AAC.00037-14 |
| [54] |
Nguyen TVA, Anthony RM, Banuls AL, et al. Bedaquiline resistance: its emergence, mechanism, and prevention[J]. Clin Infect Dis, 2018, 66: 1625-1630. DOI:10.1093/cid/cix992 |
| [55] |
Lenaerts AJ, Gruppo V, Marietta KS, et al. Preclinical testing of the nitroimidazopyran PA-824 for activity against Mycobacterium tuberculosis in a series of in vitro and in vivo models[J]. Antimicrob Agents Chemother, 2005, 49: 2294-2301. DOI:10.1128/AAC.49.6.2294-2301.2005 |
| [56] |
Stover CK, Warrener P, VanDevanter DR, et al. A small-molecule nitroimidazopyran drug candidate for the treatment of tuberculosis[J]. Nature, 2000, 405: 962-966. DOI:10.1038/35016103 |
| [57] |
Singh R, Manjunatha U, Boshoff HI, et al. PA-824 kills nonreplicating Mycobacterium tuberculosis by intracellular NO release[J]. Science, 2008, 322: 1392-1395. DOI:10.1126/science.1164571 |
| [58] |
Manjunatha U, Boshoff HI, Barry CE. The mechanism of action of PA-824: novel insights from transcriptional profiling[J]. Commun Integr Biol, 2009, 2: 215-218. DOI:10.4161/cib.2.3.7926 |
 2022, Vol. 57
2022, Vol. 57


