2. 贵州中医药大学药学院, 纳米药物技术研究中心, 贵州 贵阳 550025;
3. 贵州中药炮制与制剂工程技术研究中心, 贵州 贵阳 550025
2. Nano-drug Technology Research Center, College of Pharmaceutical Sciences, Guizhou University of Traditional Chinese Medicine, Guiyang 550025, China;
3. Guizhou Engineering Technology Research Center for Processing and Preparation of Traditional Chinese Medicine and Ethnic Medicine, Guiyang 550025, China
种植义齿被誉为“人类的第三副牙齿”, 是进行缺失牙种植修复的重要手段, 也是众多患者修复缺失牙的首要选择[1]。然而, 由于很多患者常伴有不同程度的骨缺损和骨质疏松等症状, 导致种植体周围骨质量和骨密度严重不足, 从而影响种植义牙的成功率[2]。
重组人甲状旁腺激素[PTH (1-34)] 是临床上用于治疗甲状旁腺及骨代谢疾病用的药物, 具有刺激正常骨组织更新, 增加骨密度和改善骨结构的作用, 这些功能使其成为临床上治疗骨质疏松症的一种有效药物[3, 4]。2002年, 美国食品药品管理局(FDA) 批准PTH (1-34) 作为促骨素上市, 用于治疗骨质疏松的临床治疗, 商品名为特立帕肽(FORTEOTM)。但PTH (1-34) 也存在很多缺陷, 如半衰期短、生物利用率低, 需少量多次给药等, 因此临床上主要以小剂量皮下注射给药为主, 患者顺应性差, 限制了PTH (1-34) 在口腔种植领域的应用。因此, 研制具有缓控释功能的载体用于递送PTH (1-34) 具有非常重要的意义。
水凝胶是一种介于固体与液体之间的由水溶性的高分子化合物通过物理或化学交联而成的高分子材料, 可吸收大量水分形成高度溶胀的三维网状结构高分子, 特殊的透过性和良好的生物相容性已在医药领域得到广泛的应用, 尤其是在蛋白质类药物的缓控释应用中已取得了很大的成果[5-8]。透明质酸(hyaluronic acid, HA) 又名玻璃酸, 是一种在体内广泛存在的糖胺多糖, 由两个双糖单位D-葡萄糖醛酸及N-乙酰葡糖胺组成, 具有良好的生物相容性和生物可降解性[9-11]。其重要的生物学功能还表现在, 高分子质量的HA在疏松结缔组织中具有维持细胞完整性, 保持细胞外基质水分的作用, 并参与受体介导的细胞内信号转导。此外, HA受体CD44和HA介导能动性的受体(receptor for hyaluronic acid-mediated motility, RHAMM) 在多种正常组织细胞(骨髓间充质干细胞、软骨细胞、破骨细胞等) [12, 13]和肿瘤细胞[14]表面均有高表达, 可特异性地与HA结合, 促进细胞移动并诱导细胞内信号的转导。
N-异丙基丙烯酰胺(NIPAAm) 是丙烯酰胺衍生物单体, 由于分子内同时存在亲水基团(酰胺基) 和疏水基团(异丙基), 使其均聚物具有较低的临界溶解温度等良好特性, 因此以N-异丙基丙烯酰胺为基础生物材料在药物缓控释领域有着非常广泛的应用, 可用于制备具有温度响应特性的聚合物凝胶[15, 16]。基于此, 本研究以己二酰肼为连接臂, HA和NIPAAm为原料, 在碳二亚胺的催化下合成了一种可生物降解的透明质酸/聚N-异丙基丙烯酰胺温度敏感性水凝胶AHA-g-PNIPAAm[17], 并将其作为PTH (1-34) 的药物载体, 以实现持续的药物释放, 延长PTH (1-34) 的作用时间并提高其生物利用度。因此, 该温敏水凝胶有望提高种植义齿的成功率, 为PTH (1-34) 在口腔种植领域的进一步临床应用奠定理论基础。
材料与方法试剂与药品 PTH (1-34) (大连美仑生物技术有限公司); N-异丙基丙烯酰胺、1-乙基-(3-二甲基氨基丙基) 碳二亚胺盐酸盐(EDC)、己二酸二酰肼(己二酰肼, ADH) (阿拉丁公司); 4, 4-偶氮-双(4-氰基戊酸) (ACA, 萨斯化学技术上海有限公司); HA (160 kDa, 华熙福瑞达生物医药有限公司); 盐酸(20151101, 重庆川东化工集团有限公司); 磷酸盐缓冲液(PBS)、a-MEM培养基、DMEM培养基、胰蛋白酶溶液、青链霉素混合液(北京索莱宝生物科技有限公司); 胎牛血清(fetal bovine serum, FBS, 浙江天杭生物科技股份有限公司); 溴化噻唑蓝四氮唑(MTT, 美国Sigma-Aldrich公司); 抗酒石酸酸性磷酸酶StrACP测试盒(南京建成科技有限公司); 其他试剂均为分析纯。
仪器 紫外可见分光光度计(上海元析仪器有限公司); OLYMPUS CKX53倒置显微镜(日本奥林巴斯公司); 扫描电子显微镜(S-3400 I, 日本Hitachi公司); 红外分光光度计(FI/IR-4100, 日本JASCO公司); 核磁共振仪(AC-80, 德国Bruker Biospin公司)。
细胞培养 小鼠单核巨噬细胞RAW264.7和小鼠颅骨前成骨细胞MC3T3-E1细胞(四川大学生物材料工程研究中心提供) 分别在含有10% FBS和双抗青霉素/链霉素的a-MEM培养基或DMEM培养基中培养, 置于含5% CO2、饱和湿度37 ℃的孵箱中连续培养。
透明质酸温敏水凝胶的合成和理化性质研究 参照文献[17]报道的方法, 如合成路线图 1所示。首先, 精密称定HA 0.5 g和ADH 10 g, 超声溶解至100 mL超纯水中(5 mg·mL-1), 得到HA-ADH混合溶液, 备用。分别称量1-羟基苯并三唑0.7 g和碳二亚胺0.8 g, 用5 mL DMSO/H2O (1∶1, v/v) 溶解后加入到上述混合液中。取12 mol·L-1浓盐酸8 mL将混合溶液定容至100 mL, 调pH 5.0, 室温下磁力搅拌24 h, 氯化钠5% (w/v) 溶液透析(MWCO 10 kDa) 3天, 换水的时间间隔分别为1和2 h, 此后, 白天的换水时间间隔为3 h, 夜间为4 h。透析完成后, 将得到的透析产物移至乙醇溶液中使其沉淀30 min, 微孔抽滤, 再次溶解到超纯水中并透析3天后去盐, 所得纯化产品在-40 ℃预冻24 h, 移至冷冻干燥机中冻干, 最后得到的样品经冻干后在4 ℃下保存, 得到ADH修饰的HA (AHA), 备用。
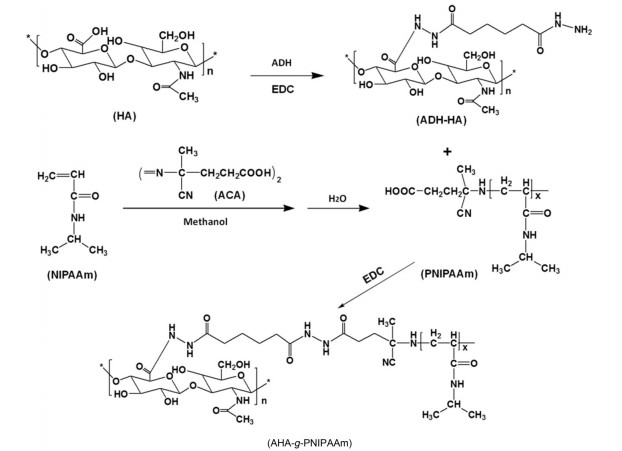
|
Scheme 1 Synthetic route of adipic acid dihydrazide-hyaluronic acid-poly-N-isopropylacrylamide (AHA-g-PNIPAAm). ADH: Adipic acid dihydrazide; EDC: 1-Ethyl-3-(3-dimethylaminopropyl) carbodiimide hydrochloride |
精密称取NIPAAm 5 g和4, 4'ACA 60 mg, 溶解于25 mL甲醇中, 形成20 wt%的单元结构溶液。溶液先用氮气保护10 min, 在68 ℃下温育3 h后滴到60 ℃热水中得到沉淀反应产物; 再用热水洗涤2次, 使沉淀物溶解在≤ 20 ℃的超纯水中, 经冷冻干燥, 得到聚N-异丙基丙烯酰胺-4, 4'-偶氮-(4-氰基戊酸) (PNIPAAm-COOH); 最后, 称取合成好的AHA 0.5 g溶解在200 mL超纯水中; PNIPAAm-COOH溶解在超纯水中与EDC 0.2 g一起在4 ℃下孵育48 h, 然后将PNIPAAm-COOH/EDC溶液在搅拌下加入到AHA溶液中, 调节pH值为5.6, 于室温下继续孵育24 h, 透析2天(MWCO 3.5 K), 得到透明质酸/聚N-异丙基丙烯酰胺温敏水凝胶AHA-g-PNIPAAm。采用核磁共振氢谱检测仪和红外光谱仪对其结构进行确证; 扫描电子显微镜研究其微观形态结构; 紫外分光光度法测定AHA-g-PNIPAAm水凝胶温度敏感性和最低临界转变温度(LCST)。
载PTH (1-34) 温敏水凝胶的制备及性质研究 取PTH (1-34) 溶于PBS中, 配制成1 mg·mL-1的PTH (1-34) PBS, 然后将一定质量冻干的圆柱状水凝胶放入5 mL的PTH (1-34) 溶液中, 在4 ℃下溶胀24 h以使药物的扩散达到平衡, 混合, 静置, 即得到载药温敏水凝胶溶液。取适量载药温敏水凝胶溶液, 等量放入两个5 mL规格的小瓶中, 用封口膜密封后分别置于4 ℃ (低温恒温冰箱) 与37 ℃的恒温水浴锅中孵育1周, 根据溶液的状态评估载药水凝胶的稳定性, 并用扫描电子显微镜观察载药后AHA-g-PNIPAAm水凝胶微观形貌态。
载药透明质酸温敏水凝胶的体外释放行为研究 精密称取适量PTH (1-34) 溶于pH 7.4的PBS中, 以PBS为空白对照, 采用紫外全波长扫描PTH (1-34) PBS, 找到最大吸光度值, 确定PTH (1-34) 的最佳测定波长, 并在最佳波长下制作PTH (1-34) 的标准曲线; 采用紫外吸收法考察AHA-g-PNIPAAm水凝胶的体外药物释放行为, 将实验分为5组: A组为游离药物; B组为水凝胶30 mg + PTH (1-34) 1 mg; C组为水凝胶30 mg +透明质酸酶1 mg + PTH (1-34) 1 mg; D组为水凝胶30 mg + 透明质酸酶2 mg + PTH (1-34) 1 mg; E组为水凝胶30 mg +透明质酸酶3 mg + PTH (1-34) 1 mg。在上述各组中加入PBS 8 mL, 使其溶解, 再将溶液转移至透析袋中(MWCO 10 K), 每组样品平衡3次, 再分别将装有药物的透析袋置于盛有10 mL的PBS (pH 7.4) 的样品瓶中, 放入震荡培养箱(转速为150 r·min-1, 温度为37 ℃), 在预设的时间下(1、3、5、8、20、30、48和72 h) 取样, 在最佳测定波长处测量每组样品溶液的吸光度值, 然后根据公式(1) 计算出重组甲状旁腺激素的释放量, 再根据释放量绘制出药物的累积释放曲线。
| $ 释放量\% =\frac{{C}_{\mathrm{R}}\times \frac{{A}_{\mathrm{x}}}{{A}_{\mathrm{R}}}\times V\times D}{m}\times \mathrm{ }100\mathrm{\%} $ | (1) |
其中, CR: 对照品溶液的浓度(g·mL-1); AX: 供试品溶液的吸光度值; AR: 对照品溶液的吸光度值; V: 供试品初次配制的体积(mL); D: 供试品的稀释倍数; m: 供试品的取样量。
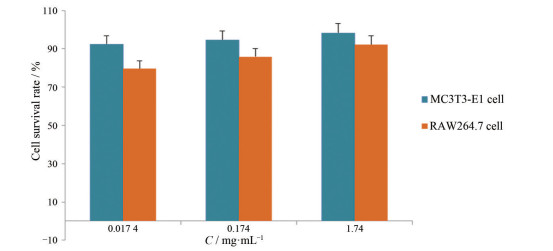
AHA-g-PNIPAAm水凝胶的体外生物安全性评价 取对数期生长状态良好的RAW264.7和MC3T3-E1, 按照细胞数5×105个/mL接种于96孔细胞培养板中, 将其暴露在质量浓度为0.017 4、0.174和1.74 mg·mL-1的空白水凝胶中, 细胞继续孵育24 h, 采用四唑蓝比色法对其安全性进行评价。
载PTH (1-34) 的温敏水凝胶对MC3T3-E1和RAW264.7细胞增殖的影响 采用MTT法检测载PTH (1-34) 温敏水凝胶对小鼠前成骨细胞MC3T3-E1和小鼠单核巨噬细胞RAW264.7增殖的影响。方法如下: 将对数生长期的MC3T3-E1和RAW264.7以5×103个/孔细胞数接种于96孔板, 待细胞贴壁后进行实验分组, 分别为A组(仅培养液)、B组[10-9 mol·L-1的PTH (1-34) + 培养液间歇性给药]、C组[10-8 mol·L-1的PTH (1-34) + 培养液一次性给药]、载药凝胶低、中、高浓度组[浓度分别为10-10、10-9和10-8 mol·L-1 PTH (1-34), 每组平衡5个样本。其中A组仅更换培养液; B组每24 h的前6 h间歇给予含PTH (1-34) 的培养液, 后换成不含药的培养液, 每24 h为1个循环; C组在加入含PTH (1-34) 的培养液后不再更换培养液; 载药凝胶组负载的PTH (1-34) 总浓度以1×10-8、1×10-9、1×10-10 mol·L-1分别加入到培养液中。细胞经不同处理后分别培养48和72 h, 通过MTT法用Bio-Rad酶标仪测定在570 nm的吸光度值, 并通过公式(2) 计算MC3T3-E1和RAW264.7在不同时间点的细胞活性。
| $ 细胞活力 = (A_{样品} - A_{空白})/(A_{对照组} - A_{空白}) × 100%(2) $ | (2) |
其中, A空白: 只含MTT的培养基的吸光度值; A样品: 细胞经不同处理后, 加入MTT孵育后的吸光度值; A对照组: 只用培养液培养的细胞、加入MTT孵育后的吸光度值。
载药水凝胶对RAW264.7细胞破骨分化的影响研究 将RAW264.7以1×104个/孔细胞数接种于24孔板(n = 5), 待细胞贴壁生长后, 按照以上实验分组方法进行给药。培养7天后, 用胰蛋白酶消化细胞, 将细胞转入EP管后在1 000 r·min-1下离心10 min, 弃掉上清液, 加入PBS 1 mL, 轻轻吹打, 再次离心10 min, 弃上清, 在细胞沉淀中加入PBS 200 μL, 直接放入液氮中3~5 s, 立即转入-20 ℃冰箱(20 s左右), 再取出室温解冻, 重复冻融3次; 按抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase, TRAP) StrACP测试盒操作步骤在96孔板中加样, 混匀, 用Bio-Rad酶标仪测定520 nm的A值, 测定RAW264.7细胞中的TRAP的活力(U·L-1), 见公式(3)。
| $ {\mathrm{TRAP}}活力 = \frac{\mathrm{测}\mathrm{定}A\mathrm{值}-\mathrm{对}\mathrm{照}A\mathrm{值}}{\mathrm{呈}\mathrm{色}\mathrm{物}\mathrm{微}\mathrm{摩}\mathrm{尔}\mathrm{消}\mathrm{光}\mathrm{系}\mathrm{数}}\times \\\frac{1}{\mathrm{比}\mathrm{色}\mathrm{光}\mathrm{径}\times \mathrm{反}\mathrm{应}\mathrm{时}\mathrm{间}}\times \frac{\mathrm{反}\mathrm{应}\mathrm{液}\mathrm{总}\mathrm{体}\mathrm{积}}{\mathrm{取}\mathrm{样}\mathrm{量}} $ | (3) |
其中, 测定A值: 不同处理组; 对照A值: 只用培养液培养的细胞吸光度值; 比色光径: 1 cm; 反应时间: 5 min; 反应液总体积: 980 mL; 取样量: 20 μL (蛋白浓度归一)。
结果和讨论 1 AHA-g-PNIPAAm的结构验证AHA-g-PNIPAAm的1H-NMR图谱, 见图 1。在化学位移4.32~4.48的弱而矮的双峰为透明质酸中的D-葡萄糖醛酸和N-乙酰葡糖胺中次甲基(-CH-) 质子峰信号(图 1A), 化学位移0.95~1.08强且宽的单峰信号为PNIPAAm中的-CH3质子吸收信号(图 1B), 化学位移1.8~2.0的强单峰是透明质酸分子中D-葡萄糖醛酸和N-乙酰葡糖胺中羟基(-OH) 的信号峰(图 1C), 表明透明质酸温敏水凝胶AHA-g-PNIPAAm已成功合成。

|
Figure 1 1H-NMR spectra of adipic acid dihydrazide-hyaluronic acid (AHA, A), poly-N-isopropylacrylamide (PNIPAAm, B), AHA-g-PNIPAAm (C) |
AHA-g-PNIPAAm的红外光谱图见图 2, a、b、c图谱依次为NIPAAm、HA和AHA-g-PNIPAAm。HA和AHA-g-PNIPAAm在吸收波长3 318 cm-1处具有相同的吸收峰; NIPAAm和AHA-g-PNIPAAm在2 972和1 376 cm-1处也具有相同的吸收峰, 进一步表明AHA-g-PNIPAAm已成功合成。
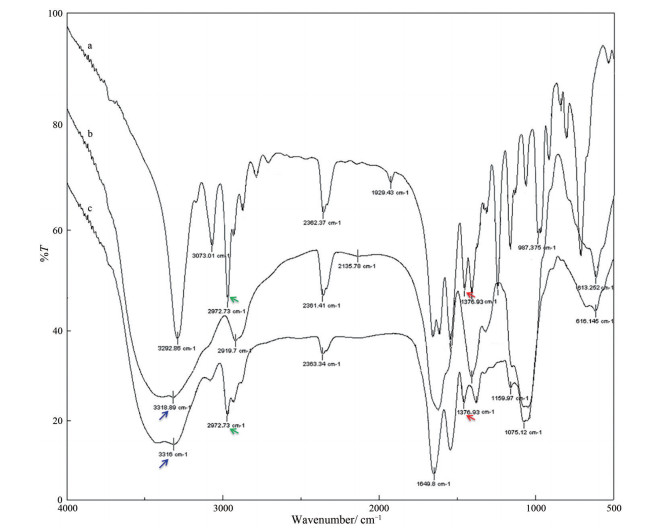
|
Figure 2 FT-IR spectra of PNIPAAm (a), AHA (b), AHA-g-PNIPAAm (c) |
通过溶胀扩散法制备了载PTH (1-34) 的AHA-g-PNIPAAm。载PTH (1-34) 的AHA-g-PNIPAAm在不同条件下的物质形态见图 3A。经冷冻干燥后, 载药水凝胶呈现棉花状形态(图 3A-a); 在4 ℃低温条件下, 载药的水凝胶溶液则呈现无色澄明溶液状(图 3A-b); 在37 ℃下, 载药的水凝胶溶液已明显发生凝胶化, 表明本研究所制备的透明质酸水凝胶具有良好的温度敏感性(图 3A-c)。由于透明质酸温敏水凝胶AHA-g-PNIPAAm在500 nm处有固定的吸收光谱, 因此可通过测定500 nm处AHA-g-PNIPAAm在不同温度下的吸光度(图 3B) 来推算其LCST值, 即曲线的拐点处所对应的温度。经分析, 本研究所合成的透明质酸温敏水凝胶的LCST值在29~30 ℃之间。由于人体温度平均在37 ℃左右, 所制备的温敏水凝胶在37 ℃下具有显著的凝胶转化性能。扫描电子显微镜观察结果显示(图 3C), AHA-g-PNIPAAm和载PTH (1-34) 的AHA-g-PNIPAAm均呈现较规整的三维空间网络类蜂窝状结构。
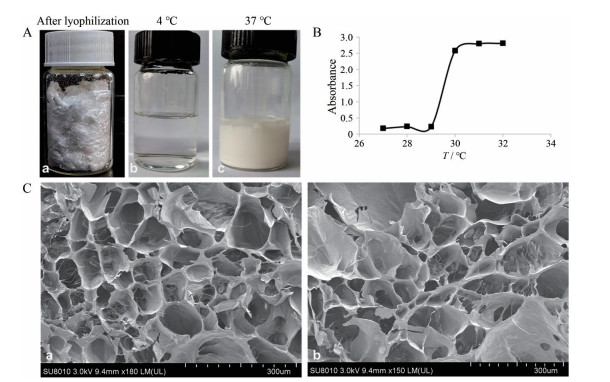
|
Figure 3 Physicochemical characterizations. A: The morphology of recombinant human parathyroid hormone 1-34 [PTH (1-34)] loaded AHA-g-PNIPAAm in different conditions: after lyophilization (a), 4 ℃ (b), 37 ℃ (c); B: UV absorption spectrum of AHA-g-PNIPAAm at different temperatures; C: SEM images of AHA-g-PNIPAAm (a) and PTH (1-34) loaded AHA-g-PNIPAAm (b) |
透明质酸温敏水凝胶的稳定性对于所载药物的释放行为及进一步的临床应用影响较大。因此, 通过观察水凝胶在4 ℃和37 ℃两种温度下的状态, 对透明质酸温敏水凝胶的稳定性进行初步的追踪观察。结果显示, 将透明质酸温敏水凝胶置于4 ℃和37 ℃下7天, 仍保持最初时的溶液或凝胶状态, 说明合成的透明质酸温敏水凝胶体外稳定性良好。进一步将凝胶化的水凝胶进行离心, 经观察发现, 载药的透明质酸温敏水凝胶在离心前呈白色凝胶状, 离心后呈无色透明溶液, 无分层现象发生, 说明载药温敏水凝胶具有较好的离心稳定性。离心前, 该水凝胶处于37 ℃条件下, 此时的温度大于其最低临界温度, 所以呈现白色的凝胶状; 而离心后, 该温敏水凝胶的环境温度在逐渐降低, 直至低于其最低临界温度, 因此呈现无色透明状; 不同温度下透明质酸温敏水凝胶呈现不同的物质状态, 这可归因于水凝胶良好的温度敏感性, 并非离心所致。
4 载药温敏水凝胶的体外释放行为考察为更准确地评价PTH (1-34) 在温敏水凝胶中的体外释放性能, 本研究通过紫外全波长扫描确定了PTH (1-34) 的最佳测定波长。结果显示, PTH (1-34) 在270 nm波长下具有最大的吸光度值, 故选择270 nm作为PTH (1-34) 的最佳测定波长, 且根据其制作重组人甲状旁腺激素PTH (1-34) 的标准曲线, 具有较好的线性关系(R2 = 0.999 3)。
体外的药物释放行为考察结果(图 4) 显示, 在所有的释放组中, 游离药物组PTH (1-34) 释放速度最快, 在20 h内基本释放完毕; 而载PTH (1-34) 的透明质酸温敏水凝胶的释放速度最慢, 其在72 h内的药物的释放量仅为52.36%; 当在透明质酸载PTH (1-34) 水凝胶中分别加入低、中、高质量浓度(0.125、0.25、0.375 mg·mL-1) 的透明质酸酶后, 结果发现其药物释放速度明显快于载药水凝胶, 在72 h内的药物累积释放量分别达到了67%、74%和83%, 表明合成的透明质酸温敏水凝胶对PTH (1-34) 具有较好的缓释作用。
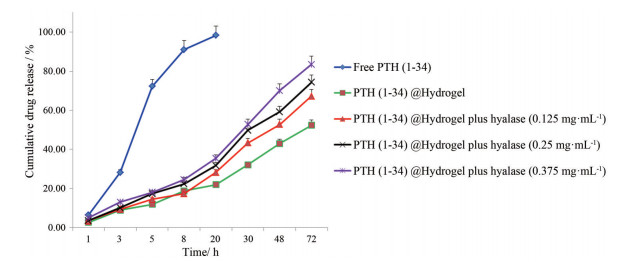
|
Figure 4 In vitro release curves of PTH (1-34)-loaded hydrogels. n = 3, |
将质量浓度为0.017 4、0.174和1.74 mg·mL-1的空白水凝胶与小鼠单核巨噬细胞RAW264.7和小鼠颅骨前成骨细胞MC3T3-E1一起孵育。结果发现, 所有组别的细胞存活率几乎都在80%以上, 说明所制备的温敏水凝胶具有良好的生物安全性(图 5)。
|
Figure 5 In vitro biological safety investigation of AHA-g-PNIPAAm in MC3T3-E1 and RAW264.7 cells. n = 6, |
成骨细胞主要由内外骨膜和骨髓中基质内的间充质始祖细胞分化而来, 能特异性分泌多种生物活性物质, 调节并影响骨的形成和重建过程。因此, 成骨细胞的增殖对骨的生长和再生有重要作用。将小鼠颅骨前成骨细胞MC3T3-E1和RAW264.7暴露在不同浓度的载PTH (1-34) 水凝胶中48 h后, 其对MC3T3-E1的增殖作用均明显强于RAW264.7。研究也显示, 间歇性(10-9 mol·L-1) 和一次性给予PTH (1-34) (10-8 mol·L-1) 对MC3T3-E1的增殖作用也强于RAW264.7, 但这种促增殖作用弱于凝胶给药组(图 6A)。
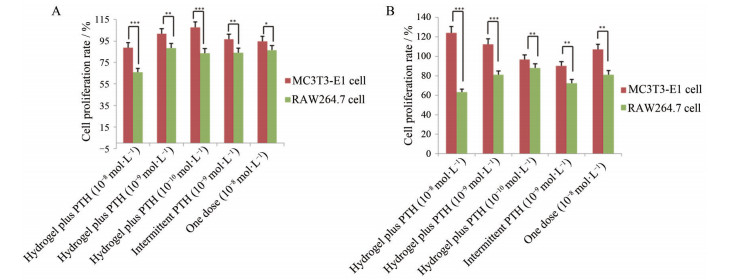
|
Figure 6 Effects of PTH (1-34)-loaded hydrogels on the proliferation and activity of MC3T3-E1 and RAW264.7 cells, the cells were respectively incubated with PTH (1-34)-loaded hydrogels in vitro for 48 h (A) and 72 h (B). n = 6, |
继续孵育72 h后, 载PTH (1-34) 透明质酸温敏水凝胶对MC3T3-E1细胞的增殖作用强于RAW264.7细胞, 其中高剂量载药水凝胶组(10-8 mol·L-1) 表现出最强的促MC3T3-E1细胞增殖的作用(图 6B)。
TRAP活性是骨吸收和破骨细胞活性的良好标志物, 因此通过测定破骨细胞的TRAP活性对于研究生理或病理条件下的骨代谢状况意义重大。如图 7A所示, 给药7天后, 空白对照组中RAW264.7大量分化(见白色箭头), 而一次性给予PTH (1-34) 并未能显著抑制RAW264.7的分化, 而以间歇式给予PTH (1-34) 的抑制分化效果最佳。载不同浓度药物PTH (1-34) 的水凝胶, 由于所载药物实现了缓慢释放, 表现出较好的RAW264.7细胞向破骨细胞分化的抑制效果。RAW264.7细胞的TRAP活性测定结果显示(图 7B), 给药7天后, 与空白对照组和一次性给予PTH (1-34) 组相比, 载药水凝胶组表现出与间歇给予PTH (1-34) 组相似的抑制RAW264.7细胞向破骨分化的效果, 其TRAP活性显著低于空白对照组和一次性给予PTH (1-34) 组。此外, 中(10-9 mol·L-1)、高剂量(10-8 mol·L-1) 载药凝胶组的TRAP抑制活性强于低剂量组(10-10 mol·L-1), 这些结果与倒置显微镜观察到的结果基本一致。
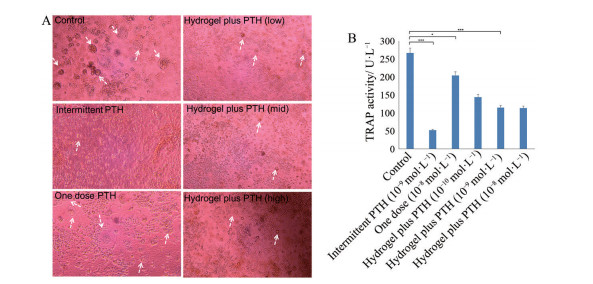
|
Figure 7 Effects of PTH (1-34)-loaded hydrogels on the osteoclast differentiation of RAW264.7 cells, the cells were respectively incubated with different groups in vitro for 7 days (A), then the tartrate-resistant acid phosphatase (TRAP) activity of RAW264.7 cells were measured by StrACP assay kit (B). n = 4, |
综上, 本研究所制备的透明质酸温敏水凝胶可有效装载骨促进剂PTH (1-34), 实现PTH (1-34) 的缓慢释放, 延长PTH (1-34) 的作用时间并提高其生物利用度, 可有效促进MC3T3-E1细胞的增殖, 抑制RAW264.7细胞向破骨的分化, 这归因于透明质酸温敏水凝胶AHA-g-PNIPAAm的良好温度敏感性, 可在人体温度下溶胀形成致密的三维空间网络类蜂窝状结构。本项研究成果有望提高PTH (1-34) 的生物利用度和顺应性, 并为其临床广泛应用提供实验数据和理论依据。
结论本研究构建了一种具有生物降解的透明质酸/聚N-异丙基丙烯酰胺温度敏感性水凝胶AHA-g-PNIPAAm, 该温敏水凝胶具有规整的三维空间网络类蜂窝状结构和良好的温度敏感性, 可实现PTH (1-34) 的缓慢释放, 且能有效促进MC3T3-E1细胞的增殖, 抑制RAW264.7细胞向破骨的分化, 其研究成果有望提高PTH (1-34) 的生物利用度和临床治疗的顺应性, 为PTH (1-34) 在种植牙及骨质疏松症相关领域的临床广泛应用提供实验数据和理论依据。
作者贡献: 宣少燕负责论文的撰写、材料的合成和评价, 并提供经费支持; 朱月、张林和唐志华负责数据的处理、分析; 徐锋和陈滕负责药物释放行为考察及论文的润色等; 汪祖华负责实验设计并提供实验经费支持。
利益冲突: 所有作者声明没有利益冲突。
| [1] |
Okayama S. Fixation of magnet assembly to denture base using alternative resins[J]. Dent Mater J, 2015, 34: 364-370. DOI:10.4012/dmj.2014-348 |
| [2] |
Chow L, Chow TW, Chai J, et al. Bone stability around implants in elderly patients with reduced bone mineral density-a prospective study on mandibular overdentures[J]. Clin Oral Implants Res, 2017, 28: 966-973. DOI:10.1111/clr.12907 |
| [3] |
Alkhiary YM, Gerstenfeld LC, Krall E, et al. Enhancement of experimental fracture-healing by systemic administration of recombinant human parathyroid hormone (PTH 1-34)[J]. J Bone Joint Surg Am, 2005, 87: 731-741. |
| [4] |
Cejka D, Kodras K, Bader T, et al. Treatment of hemodialysis-associated adynamic bone disease with teriparatide (PTH 1-34): a pilot study[J]. Kidney Blood Press Res, 2010, 33: 221-226. DOI:10.1159/000316708 |
| [5] |
Oh JS, Lee EJ. Photodynamic graphene oxide combined alginate hydrogel for controlled drug release[J]. Macromol Res, 2021, 29: 383-390. DOI:10.1007/s13233-021-9048-x |
| [6] |
Bardajee GR, Hosseini SS, Ghavami S. Correction to: embedded of nanogel into multi-responsive hydrogel nanocomposite for anticancer drug delivery[J]. J Inorg Organomet Polym, 2019, 29: 2291. DOI:10.1007/s10904-019-01272-3 |
| [7] |
Mehra S, Nisar S, Chauhan S, et al. Soy protein-based hydrogel under microwave-induced grafting of acrylic acid and 4-(4-hydroxyphenyl) butanoic acid: a potential vehicle for controlled drug delivery in oral cavity bacterial infections[J]. ACS Omega, 2020, 5: 21610-21622. DOI:10.1021/acsomega.0c02287 |
| [8] |
Zhao W, Volkova E, Blatchley MR, et al. Hydrogel vehicles for sequential delivery of protein drugs to promote vascular regeneration[J]. Adv Drug Deliv Rev, 2019, 149-150: 95-106. DOI:10.1016/j.addr.2019.08.005 |
| [9] |
Qiu LM, Long MM, Chen DW. Hyaluronic acid-based carriers for tumor targeted delivery system[J]. Acta Pharm Sin (药学学报), 2013, 9: 1376-1382. |
| [10] |
Bulpitt P, Aeschlimann D. New strategy for chemical modification of hyaluronic acid: preparation of functionalized derivatives and their use in the formation of novel biocompatible hydrogels[J]. J Biomed Mater Res, 2015, 47: 152-169. |
| [11] |
Choi KY, Saravanakumar G, Park JH, et al. Hyaluronic acid-based nanocarriers for intracellular targeting: interfacial interactions with proteins in cancer[J]. Colloids Surf B Biointerfaces, 2012, 99: 82-94. DOI:10.1016/j.colsurfb.2011.10.029 |
| [12] |
Qu C, Rilla K, Tammi R, et al. Extensive CD44-dependent hyaluronan coats on human bone marrow-derived mesenchymal stem cells produced by hyaluronan synthases HAS1, HAS2 and HAS3[J]. Int J Biochem Cell Biol, 2014, 48: 45-54. DOI:10.1016/j.biocel.2013.12.016 |
| [13] |
Suzuki K, Zhu B, Rittling SR, et al. Colocalization of intracellular osteopontin with CD44 is associated with migration, cell fusion, and resorption in osteoclasts[J]. J Bone Miner Res, 2002, 17: 1486-1497. DOI:10.1359/jbmr.2002.17.8.1486 |
| [14] |
Choi KY, Chung H, Min KH, et al. Self-assembled hyaluronic acid nanoparticles for active tumor targeting[J]. Biomaterials, 2010, 31: 106-114. DOI:10.1016/j.biomaterials.2009.09.030 |
| [15] |
Mirkovic I, Nikolic M, Ostojic S, et al. Thermo-responsive hydrogels based on poly (N-isopropyl-acrylamide) and hyaluronic acid cross-linked with nanoclays[J]. J Serb Chem Soc, 2020, 85: 1197-1221. DOI:10.2298/JSC200109023M |
| [16] |
Xia Y, Qiu LY, Jin Y. Preparation and characterization of indom ethacin/poly (N-isopropy lacrylamide)-β-cyclodextrin complex with temperature-sensitivity[J]. Acta Pharm Sin (药学学报), 2005, 2: 91-96. |
| [17] |
Tan H, Ramirez CM, Miljkovic N, et al. Thermosensitive injectable hyaluronic acid hydrogel for adipose tissue engineering[J]. Biomaterials, 2009, 30: 6844-6853. DOI:10.1016/j.biomaterials.2009.08.058 |
 2022, Vol. 57
2022, Vol. 57


