2. 山西大学化学生物学与分子工程教育部重点实验室, 山西 太原 030006;
3. 中国科学院过程工程研究所, 北京 100190;
4. 地产中药功效物质研究与利用山西省重点实验室, 山西 太原 030006
2. Key Laboratory of Chemical Biology and Molecular Engineering of Ministry of Education of Shanxi University, Taiyuan 030006, China;
3. Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China;
4. Key Laboratory of Effective Substances Research and Utilization in TCM of Shanxi Province, Taiyuan 030006, China
中药黄芪是多年生豆科植物蒙古黄芪Astragalus membranaceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao或膜荚黄芪Astragalus membranaceus (Fisch.) Bge.的干燥根[1, 2]。黄芪在《神农本草经》中被列为上品, 临床用量大, 有“十方八芪”之称, 同时黄芪也是典型的一药多效中药。2020版《中国药典》收载的黄芪具有补益驱邪功效, 包括补气升阳、固表止汗、生津养血、行滞通痹、托毒排脓、敛疮生肌等[3]。然而本草考证发现, 记载黄芪临床功效最早应用在痈疽治疗。如《五十二病方》[4] (先秦) 中记载“黄芪治疗疽病, 肉疽则倍用”; 《神农本草经》也言其“味甘微温, 主痈疽久败创, 排脓止痛”, 虽然这些功效主要通过黄芪补中健脾生肌功能实现, 然而其调控机制也与黄芪活性成分的双向免疫调节功能相关。
黄芪主要化学成分为多糖、皂苷类、黄酮类及氨基酸、微量元素、甾醇类物质等[5]。现代研究表明黄芪多糖是黄芪中免疫调节活性最强的一类物质, 具有抗肿瘤、抗病毒、心血管和神经保护等多种作用[6, 7]。然而黄芪多糖(Astragalus polysaccharide, APS) 分子量分布广(5.6×103~4.8×106 Da), 属于大分子混合物, 虽然已有大量报道, 但主要集中在对黄芪总多糖或者某一特定分子量多糖组分的研究[8-13], 缺乏不同分子量组分的系统活性筛选比较。此外, 在药理研究方面, 多集中在黄芪多糖的免疫促进功能上, 虽开发有黄芪多糖粉针剂(国药准字Z20040086), 也主要是用于肿瘤化疗后升高白细胞, 提升患者免疫水平。该药主要选取10 kDa分子量组分[14], 其他分子量黄芪多糖是否具有相同或差异功能, 尚不清楚。
近年来, 越来越多的研究表明, 黄芪多糖在机体中主要起到免疫调节或免疫平衡作用, 尤其是在过度炎症模型中具有明显的免疫抑制作用或抗炎活性[15]。溃疡性结肠炎(ulcerative colitis, UC) 是一种难治性慢性非特异性炎症肠道疾病, 目前尚无根治措施。已有研究报道, 黄芪多糖对于2, 4, 6-三硝基苯磺酸诱导建立的Wistar大鼠UC模型具有很好的治疗作用; 其作用机制与减少结肠组织炎症因子释放、调节机体免疫功能密切相关[16]。临床上发现, 黄芪多糖注射液可显著改善糖尿病肾病患者机体的炎症状态[17]。诸多研究表明, 多糖作为黄芪中主要的免疫调控物质, 可能包含免疫促进功能的组分, 也可能某些特定分子量组分具有较强的免疫抑制或免疫平衡作用, 或者由不同组分多糖共同作用达到双向调节的目的。因此, 明确黄芪多糖中不同分子量组分的结构、免疫调节活性, 是阐明黄芪药效物质基础的关键问题。
根据以上研究, 课题组通过水提醇沉法制备黄芪总多糖, 采用凝胶色谱法对其测定分子量分布, 结合超滤膜截留法分离制备不同分子量黄芪多糖, 并对其单糖组成进行测定, 确定其主要的结构特征。活性筛选方面, 建立LPS诱导小鼠单核巨噬细胞RAW 264.7过度炎症模型, 采用MTT法检测黄芪多糖对巨噬细胞(RAW 264.7) 增殖的影响, 利用ELISA试剂盒测定其对一氧化碳(NO)、白细胞介素-10 (IL-10) 和肿瘤坏死因子(TNF-α) 释放量的影响, 筛选出黄芪多糖中主要的抗炎活性组分。同时采用的高分辨Thermo Scientific Q Exactive质谱仪对细胞内代谢物进行数据采集, 结合多元统计分析和代谢通路分析, 探索其抗炎作用机制, 以期为进一步阐明黄芪多糖药效物质基础指明方向。
材料与方法仪器 依利特液相色谱仪(大连依利特分析仪器有限公司); 示差折光检测器(Shodex RI-201H); Waters2695型高效液相色谱仪(2489紫外检测器, 美国Waters公司); CPA225D万分之一电子天平(德国Sartorius公司); Neofuge13R高速冷冻离心机(上海力申科学仪器有限公司); SC-3610低速离心机(安徽中科中佳科学仪器有限公司); RE-52型旋转蒸发器(上海亚荣生化仪器厂); 细胞培养箱(力康生物医疗科技控股有限公司); Infinite M200 Pro多功能酶标仪(瑞士Tecan公司); SCIENTZ-12N真空冷冻干燥机和UP-250超声波细胞粉碎机(宁波新芝生物科技股份有限公司); 高分辨液质联用仪(Thermo Scientific Q Exactive); Xcalibur数据处理软件(Thermo Fisher Scientific公司)。
材料与试剂 山西浑源黄芪(仿野生蒙古黄芪), 山西大学秦雪梅教授鉴定为蒙古黄芪Astragalus membranaceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao的干燥根(2017年采收, 生长年限5年)。药材样品留存于山西大学中医药现代研究中心样品库。系列相对分子质量(Mr) 右旋糖酐对照品(Mr: 180、2 500、7 100、10 000、21 400、41 100、84 400、133 800及2 000 000, 中国食品药品检定研究院); 葡萄糖(Glu)、半乳糖(Gal)、半乳糖醛酸(Gal A)、鼠李糖(Rha)、甘露糖(Man)、阿拉伯糖(Ara) 和N-乙酰葡糖胺(N-acetylglucosamine, GlcNAc), 纯度大于98%, 山西玖玖商贸有限公司; 木瓜蛋白酶购自Solarbio (美国); 分析级甲醇、无水乙醇、氯仿均购自天津市大茂化学试剂厂; 乙腈(质谱级)、甲酸(质谱级) 购自Fisher Scientific公司。所有其他试剂均为分析级。RAW 264.7小鼠巨噬细胞从ATCC获得, MTT、胎牛血清(FBS)、DMEM培养基、0.25%胰蛋白酶、PBS磷酸盐缓冲液、LPS均购自北京索莱宝科技有限公司。一氧化氮(NO) 检测试剂盒购自上海碧云天生物技术有限公司, 肿瘤坏死因子-α (TNF-α) 和白细胞介素-10 (IL-10) 的酶联免疫吸附测定(ELISA) 试剂盒均购自武汉博士德生物工程有限公司。
HPLC-RID检测条件 色谱柱为TSK gel GMPWXL凝胶柱(300 mm × 7.8 mm, 13 μm) (日本Tosoh Corporation公司); 示差折光检测器(RID); 流动相为纯水; 等度洗脱; 流速1.0 mL·min-1; 柱温为35 ℃; 进样量10 μL。
HPLC-UV检测条件 色谱柱为Venusil XBP C18 (250 mm × 4.6 mm, 5 μm; 中国天津博纳艾杰尔科技有限公司); 流动相A相为磷酸二氢钠缓冲液(pH 6.7, 50 mmol·L-1); B相为乙腈(A∶B = 82∶18), 等度洗脱; 流速1.0 mL·min-1; 柱温35 ℃; 检测波长250 nm; 进样量20 μL。
LC-MS条件
色谱条件 流动相为0.1%甲酸水(A) 和乙腈(B)。梯度为: 0~2 min, 1% B; 2~8 min, 1%~35% B; 8~11 min, 35%~40% B; 11~14 min, 40%~60% B; 14~17 min, 60%~99% B; 17~19 min, 99%~1% B; 19~20 min, 1% B。体积流量0.2 mL·min-1, 进样量为5 μL, 柱温40 ℃, Waters ACQUITYUPLC HSS T3色谱柱(100 mm × 2.1 mm, 1.7 μm)。
质谱条件 采用HESI离子化方式, 正极电压为3.5 kV, 负极2.5 kV。扫描模式为Full Scan/dd-MS2, 采集范围为m/z 100~1 500, 正负离子切换采集模式, 毛细管温度320 ℃, 加热器温度300 ℃, 鞘气体积流量35 arb, 辅助气体积流量10 arb。分辨率采用MS Full Scan 35000 FWHM, MS/MS 17500 FWHM, 碰撞能量为12.5、25.0和37.5 eV。
黄芪多糖的提取 参考文献[18]方法, 黄芪粉末过100目筛后取黄芪细粉15 g, 以1∶20比例加入去离子水, 90 ℃下磁力搅拌器搅拌提取4 h, 离心取上清液浓缩至150 mL, 酶解法结合三氯乙酸法除蛋白(加入200 U木瓜蛋白酶, 45 ℃下水浴6 h, 随后加10%三氯乙酸至总体积200 mL, 冰浴中搅拌15 min后静置30 min, 离心弃沉淀)。离心后上清液中缓缓加入无水乙醇至最终醇浓度为80%, 静置过夜, 沉淀冷冻干燥得APS, 计算得率。
黄芪多糖的分离 参考文献[8]方法, 根据黄芪多糖的分子量分布色谱图, 采用超滤膜截留法分离纯化黄芪多糖, 可将黄芪多糖分为2个部分。第一部分的分子质量大于2 000 kDa (超出线性范围), 第二部分的分子质量约为10 kDa。将APS配制成5 mg·mL-1的溶液, 并通过分子截留量为100 kDa的超滤膜将APS分为APS-Ⅰ (Astragalus polysaccharide-Ⅰ, APS-Ⅰ) 和APS-Ⅱ (Astragalus polysaccharide-Ⅱ, APS-Ⅱ) 两个组分。截流后, 将这2个部分分别冷冻干燥。
黄芪多糖及其组分相对分子质量测定 取9个已知相对分子质量的右旋糖酐对照品, 分别加纯水稀释成5 mg·mL-1的对照品溶液, 分别进样。以保留时间tR为横坐标, lg Mw为纵坐标, 作标准曲线, 得到右旋糖酐对照品线性回归方程lg Mw = -0.782 tR + 12.451, R2 = 0.999 8。
供试品溶液的配置: 取APS、APS-Ⅰ和APS-Ⅱ多糖粉末, 加纯水分别配置成5 mg·mL-1的供试品溶液, 备用。根据线性回归方程计算样品相对分子质量。
黄芪多糖及其组分单糖组成分析 参照文献[19]方法, 将甘露糖、半乳糖醛酸、葡萄糖、半乳糖、阿拉伯糖、N-乙酰葡糖胺和鼠李糖混合对照品衍生化, 取上层水液, 经0.45 μm微孔滤膜滤过, 备用。
供试品溶液的配置: 精密吸取APS及其APS-Ⅰ和APS-Ⅱ两个组分水解液0.2 mL, 按上述方法处理, 即得。
细胞培养 将RAW 264.7细胞在含有10% FBS、100 μg·L-1青霉素和100 μg·L-1链霉素的DMEM培养基中, 于37 ℃、5% CO2饱和湿度下培养, 直至细胞生长至对数期。
MTT法检测药物毒性 参考文献[20]方法并做适当修改, 用含10% FBS的完全培养液将RAW 264.7细胞配成单个细胞悬液, 以每孔1×104个细胞的浓度接种到96孔板, 每孔体积100 μL。在5% CO2、37 ℃条件下孵育24 h, 届时细胞单层铺满孔底。24 h后给药, 实验分组为: 空白组, APS、APS-Ⅰ和APS-Ⅱ给药组, 浓度梯度分别为10、25、50、100、250和500 μg·mL-1。每个浓度的药物设置6个复孔。给药完成后, 于培养箱培养24 h。次日取出96孔板, 向含细胞的96孔板中每孔加入5 mg·mL-1 MTT试剂10 μL, 再于培养箱中培养4 h。4 h后小心吸弃MTT试剂, 向每孔中加入DMSO试剂100 μL。室温下用摇床振荡10 min, 再于酶标仪490 nm下检测每孔吸光度。
ELISA法检测IL-10、NO和TNF-α的水平 用含10% FBS的完全培养液将RAW 264.7细胞配成单个细胞悬液, 以每孔1×104个细胞的浓度接种到96孔板, 每孔体积100 μL。在5% CO2、37 ℃条件下孵育24 h, 届时细胞单层铺满孔底。设置空白组、模型组, APS、APS-Ⅰ和APS-Ⅱ给药组, 每组均设置6个复孔, 药物预干预2 h后, 模型组与给药组加入适量LPS, 使得LPS终浓度为1 μg·mL-1, 空白组加入等量的PBS后继续培养24 h; 24 h后取细胞培养基上清液, 1 000 × g, 4 ℃, 离心15 min, 取上清液, 按照NO、TNF-α和IL-10试剂盒说明书操作, 测定上述炎症因子的生成量。
代谢组学样品制备 实验分组: 空白组、模型组、APS-Ⅰ给药组。将相同数量的RAW 264.7细胞(每孔1×105个) 于直径为10 cm的培养皿中培养, 每组设置6个重复。当细胞生长至90%时, 空白组加入10 mL DMEM培养基; 模型组加入适量LPS使其终质量浓度为1 μg·mL-1; 给药组分别先加入100 μg·mL-1 APS-Ⅰ预保护2 h, 然后加入适量LPS使其终质量浓度为1 μg·mL-1。培养24 h后, PBS洗涤细胞3次, 用细胞刮刀刮下培养皿中的细胞, 4 ℃、1 200 r·min-1离心10 min, 收集各组细胞沉淀, 于液氮中速冻, 并储存在-80 ℃下, 用于进一步细胞内代谢组学分析。
细胞内代谢物提取方法 参考文献[21, 22]方法, 并稍做修改, 将细胞4 ℃融化, 反复冻融5次后, 加入MeOH-CHCl3-H2O (8∶1∶1) 1 mL, 于冰上超声破碎15 min (超5 s, 停9 s), 4 ℃、13 000 r·min-1离心10 min, 收集上清。收集沉淀加入MeOH-CHCl3-H2O (8∶1∶1) 1 mL, 再次超声破碎15 min, 合并2次上清液冻干。于冻干后的细胞裂解物中加入50%乙腈60 μL复溶, 4 ℃、13 000 r·min-1离心10 min, 上清液置于液相小瓶中。另通过混合各自的等分试样作为QC样本。空白为提取溶剂。
数据处理 将采集到的原始LC-MS/MS数据文件导入Compound Discoverer 2.0软件(美国Thermo Fisher公司), 设置参数, 获取匹配和对齐的峰值数据, 将得到的峰面积等进行归一化, 再将归一化后的数据导入SIMCA-P 13.0软件进行主成分分析(PCA)、偏最小二乘判别分析(PLS-DA) 和正交偏最小二乘判别分析(OPLS-DA)。结合OPLS-DA的S-plot图中VIP > 1以及独立样本t检验筛选差异代谢物(以P < 0.05为标准筛选)。通过使用HMDB数据库并结合二级碎片离子对筛选出的差异代谢物进行指认、通过Metboanalyst平台进行通路富集分析, 并对差异代谢物进行相关性分析。采用SPSS 16.0软件对数据进行单因素方差分析, 各结果以
采用水提醇沉法获得APS, 得率为8.5%。采用高效液相色谱法对提取所得到的黄芪多糖进行分子量测定, 图 1中色谱峰上的数据为各切割部分的最高点的相对分子质量。通过80%醇沉得到APS包含两个不同分子量多糖APS-Ⅰ (大于2 000 kDa) 和APS-Ⅱ (10 kDa) (图 1A), 采用超滤膜截留法将APS截取得到APS-Ⅰ (图 1B) 和APS-Ⅱ (图 1C)。

|
Figure 1 HPLC chromatogram of refined polysaccharide from APS (A), APS-Ⅰ (B), APS-Ⅱ (C). APS: Astragalus polysaccharide; APS-Ⅰ: Astragalus polysaccharide-Ⅰ; APS-Ⅱ: Astragalus polysaccharide-Ⅱ |
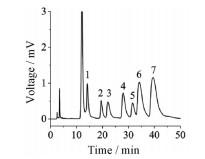
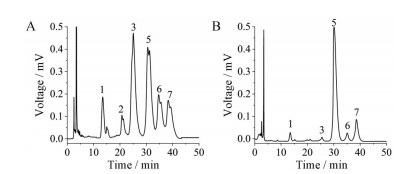
采用PMP柱前衍生化-高效液相色谱法测定了7种标准单糖混合物色谱图和样品黄芪单糖特征图谱(图 2和3)。根据样品黄芪单糖的HPLC-UV特征图谱的保留时间, 将单糖混合对照品图谱与样品黄芪单糖特征图谱进行对比, 可以确定APS-Ⅰ由Man、Rha、Gal A、Glu、Gal和Ara 6种单糖组成, 以阿拉伯糖的物质的量为1, 各单糖组成比例约为0.54∶0.26∶12.24∶17.24∶8.46∶1; APS-Ⅱ由Rha、Gal A、Glu、Gal和Ara 5种单糖组成, 各单糖组成比例约为0.26∶0.14∶24.04∶0.62∶1。
|
Figure 2 Monosaccharide chromatograms of reference substances by HPLC. 1: Mannose; 2: Rhamnose; 3: Galacturonic acid; 4: N-acetylglucosamine; 5: Glucose; 6: Galactose; 7: Arabinose |
|
Figure 3 Monosaccharide chromatograms of APS-Ⅰ (A), APS-Ⅱ (B) by HPLC |
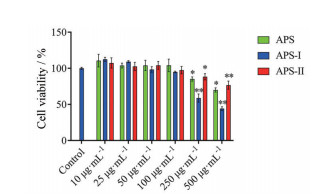
本实验采用MTT法考察了APS、APS-Ⅰ和APS-Ⅱ不同浓度下对RAW 264.7细胞存活率的影响, 如图 4所示, 3个组分在0~100 μg·mL-1内与细胞共培养24 h无明显毒性, 因此可在0~100 μg·mL-1选取合适浓度进行后续炎症因子的测定。
|
Figure 4 MTT assay results with various concentrations of APS, APS-Ⅰ and APS-Ⅱ. n = 6, |
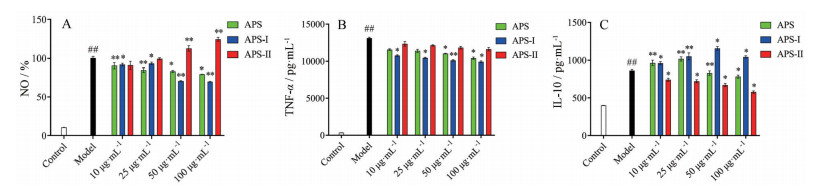
由图 5可知, 与空白组相比, 模型组能显著增加NO、TNF-α和IL-10的产生, 说明LPS诱导的小鼠单核巨噬细胞RAW 264.7细胞炎症模型可以成功构建。由图 5A可知, APS和APS-Ⅰ均可抑制模型组产生NO。APS为100 μg·mL-1时, 抑制NO产生的作用最强; APS-Ⅰ为100 μg·mL-1时, 抑制NO产生的作用最强。APS和APS-Ⅰ最佳剂量与模型组比较差异有统计学意义(P < 0.05), 均能显著抑制NO的产生。APS-Ⅱ可促进模型组产生NO, APS-Ⅱ为100 μg·mL-1时, 促进NO产生的作用最强, 与模型组比较差异有统计学意义(P < 0.05)。不同分子量组分抑制NO产生的活性顺序为APS-Ⅰ > APS > APS-Ⅱ。
|
Figure 5 Effects of APS, APS-Ⅰ and APS-Ⅱ on NO (A), TNF-α (B), and IL-10 (C) of RAW 264.7 cells. n = 6, |
由图 5B可知, APS、APS-Ⅰ和APS-Ⅱ均可抑制模型组产生TNF-α。APS为100 μg·mL-1时, 抑制TNF-α产生的作用最强; APS-Ⅰ为100 μg·mL-1时, 抑制TNF-α产生的作用最强; APS-Ⅱ为50 μg·mL-1时, 抑制TNF-α产生的作用最强。APS和APS-Ⅰ最佳剂量与模型组比较差异有统计学意义(P < 0.05), 均能显著抑制TNF-α的产生。不同分子量组分抑制TNF-α产生的活性顺序为APS-Ⅰ > APS > APS-Ⅱ。
由图 5C可知, APS在0~50 μg·mL-1时可以促进IL-10的产生。APS为25 μg·mL-1时, 促进IL-10产生的作用最强; 与模型组比较差异有统计学意义(P < 0.05)。APS在50~100 μg·mL-1时可以抑制IL-10的产生。APS为100 μg·mL-1时, 抑制IL-10产生的作用最强; 与模型组比较差异有统计学意义(P < 0.05)。APS-Ⅰ可促进模型组产生IL-10。APS-Ⅰ为50 μg·mL-1时, 促进IL-10产生的作用最强; 与模型组比较差异有统计学意义(P < 0.05)。APS-Ⅱ可抑制模型组产生IL-10。APS为100 μg·mL-1时, 抑制IL-10产生的作用最强; 与模型组比较差异有统计学意义(P < 0.05)。不同分子量组分促进IL-10产生的活性顺序为APS-Ⅰ > APS > APS-Ⅱ。
综上所述, APS-Ⅰ的体外抗炎活性优于APS-Ⅱ。
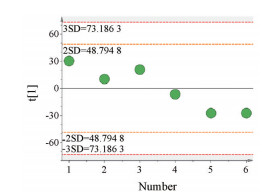
5 细胞代谢组学分析方法可靠性检测为检测细胞代谢组学分析方法的重复性和稳定性, 对细胞内QC样本进行了聚类分析, PCA结果表明所有QC样本都在标准偏差(SD) 的2倍范围之内, 见图 6。同时, 细胞内QC样本RSD < 30%的变量占85.4%。以上结果表明该分析方法具有很高的稳定性和重复性, 适合大批量进样。
|
Figure 6 The reliability investigation of the analytical method using QC samples. PCA score map of QC samples in cells |
通过超高效液相色谱-串联orbitrap质谱(UHPLC-Q exactive orbitrap) 方法对空白组、模型组和给药组RAW 264.7细胞的裂解物进行数据采集和处理后, 正负离子模式下共采集到1 688个峰。为了解造模和给药后细胞代谢物变化, 对空白组、模型组和给药组进行多元统计分析。从PCA和PLS-DA得分图中可以看出细胞内代谢物在空白组、模型组和给药组之间能明显分开(图 7A、B), 表明LPS诱导的小鼠单核巨噬细胞RAW 264.7细胞炎症模型构建成功, APS-Ⅰ对RAW 264.7细胞炎症模型有一定的调控作用。模型评价指标(图 7C) 显示左侧所有Q2 (R2) 低于右边原始值, Q2所在蓝色回归线与左侧纵坐标相交于零以下, 表明模型验证有效。OPLS-DA有助于筛选出造模后的差异代谢物(图 7D)。通过S-plot图结合VIP > 1 (图 7E) 以及独立样本t检验P < 0.05筛选出细胞中的差异代谢物。

|
Figure 7 PCA (A) and PLS-DA scores (B) plots of cell lysate of RAW 264.7 in all of groups; model validation results (C), OPLS-DA scatter plots (D) and corresponding S-plot (E) of cell lysate of RAW 264.7 in control group and model group |
对空白组和模型组通过VIP > 1结合独立样本t检验P < 0.05, 以及通过HMDB数据库和代谢物二级碎片离子进行指认, 共鉴定出32个与小鼠单核巨噬细胞RAW 264.7过度炎症模型相关的差异代谢物, 见表 1。结果表明, 与空白组相比, 模型组中S-腺苷甲硫氨酸、瓜氨酸、3-吲哚丁酸、尿嘧啶、α-酮戊二酸等17个代谢物水平显著升高, 经APS-Ⅰ给药后尿嘧啶、α-酮戊二酸、S-腺苷甲硫氨酸等11个代谢物水平显著回调。与空白组相比, 模型组中尿苷、脱氧尿嘧啶核苷酸、精氨酸、亮氨酰脯氨酸、尿酸、左旋肉碱、异琥珀酸、延胡索酸等15个代谢物水平显著降低, 经APS-Ⅰ给药后鸟苷酸、精氨酸、左旋肉碱、尿酸等7个代谢物水平显著回调。上述结果表明, 黄芪多糖APS-Ⅰ通过回调精氨酸等18个差异代谢物从而发挥一定程度的抗炎作用。
| Table 1 The differential metabolites in RAW 264.7 cell lysates detected by LC-MS/MS. ↑ and ↓ represent higher and lower level; Model vs control: Model group compared with control group; APS-Ⅰ vs model: APS-Ⅰ group compared with model group |
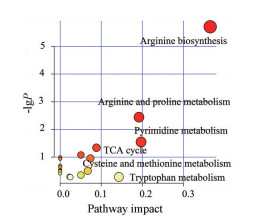
将细胞裂解物中的差异代谢物代入Metaboanalyst中进行通路富集分析, 选择影响值大于0.1的代谢途径作为APS-Ⅰ发挥抗炎作用的主要途径, 图中圆点颜色越深表示参与该通路代谢物越多, 圆点越大表示该通路作用越明显[23], 结果见图 8。差异代谢物相关通路共有19条, 综合Holm P值、错误发现率(false discovery rate, FDR) 和Impact值共发现6条主要代谢通路, 分别为精氨酸生物合成、精氨酸和脯氨酸代谢、三羧酸循环、半胱氨酸和甲硫氨酸代谢、色氨酸代谢和嘧啶代谢。
|
Figure 8 Analysis of MetPA pathway in cell lysate |
黄芪多糖是黄芪中含量最多、免疫调节活性最强的一类物质。然而黄芪多糖分子量分布广, 属于大分子混合物, 虽然已有大量报道, 但主要集中在对黄芪总多糖或者某一特定分子量多糖组分的研究, 缺乏不同分子量组分的系统活性筛选比较。课题组前期根据黄芪多糖主要由两组不同分子量多糖部位组成的特点, 通过超滤膜分离手段将两个组分分离制备, 得到APS-Ⅰ和APS-Ⅱ两个组分, 并从细胞水平和动物水平筛选出了APS-Ⅱ是发挥免疫促进作用的主要组分; 而两个组分在免疫抑制过程中的药理作用与作用机制尚不清楚。
因此, 本文从抗炎活性与作用机制两个方面对分离得到的两种多糖进行了研究。从抗炎活性上看, NO是炎症反应中生成的重要炎症因子, 介导炎症等疾病的发生, 其含量可以作为炎症反应程度的指标[24], APS-Ⅰ在质量浓度为0~100 μg·mL-1时显著抑制NO的产生, 抑制效果优于APS-Ⅱ。TNF-α是炎症反应中主要促炎细胞因子, 可调节细胞的生长分化、调节免疫应答, 具有重要的生物功能[25], APS-Ⅰ在质量浓度为0~100 μg·mL-1时显著抑制TNF-α的产生, 抑制效果优于APS-Ⅱ。IL-10是一种多细胞源性的细胞因子, 其中单核细胞、巨噬细胞是其主要来源细胞。在控制病原体和微生物造成的炎症反应中, IL-10具有抗炎、免疫抑制、负反馈调节的生物学功能[26], APS-Ⅰ在质量浓度为0~100 μg·mL-1时显著促进IL-10的产生, 促进效果优于APS-Ⅱ。综上所述, APS-Ⅰ的体外抗炎活性优于APS-Ⅱ。
黄芪多糖具有免疫双向调节作用, 已被大量研究证明[9]。课题组前期通过LC-MS/MS代谢组学方法研究了APS-Ⅱ发挥免疫促进作用的作用机制[21, 27]。结果发现, APS-Ⅱ主要通过影响三羧酸循环途径、酪氨酸和色氨酸的生物合成途径、精氨酸和脯氨酸代谢途径与半胱氨酸和甲硫氨酸等代谢途径发挥免疫促进作用。本研究采用LC-MS/MS代谢组学技术研究APS-Ⅰ发挥免疫抑制作用的作用机制。结果发现, APS-Ⅰ主要通过调控精氨酸生物合成、精氨酸和脯氨酸代谢、三羧酸循环、半胱氨酸和甲硫氨酸代谢、色氨酸代谢和嘧啶代谢发挥免疫抑制作用。因此, 作者推测黄芪多糖的不同组分具有不同功效, 且主要通过调控三羧酸循环途径、精氨酸和脯氨酸代谢途径、半胱氨酸和甲硫氨酸代谢途径发挥免疫双向调节作用。
精氨酸及其代谢产物是生物体内各种代谢途径的中心。精氨酸在体内和甘氨酸、甲硫氨酸内源性合成肌酸, 肌酸是能量代谢最重要物质之一; 精氨酸在精氨酸酶作用下水解为鸟氨酸和尿素, 鸟氨酸可在鸟氨酸转氨酶作用下生成脯氨酸, 脯氨酸在抗氧化反应和免疫反应中发挥着重要作用。已有研究表明, 炎症反应可能会影响精氨酸的代谢, 精氨酸和脯氨酸代谢异常可以从两个方面影响炎症效应: 其一, 在精氨酸和脯氨酸向NO的转化过程中, TNF-α可以增加iNOS的表达并在细胞中产生大量的NO, 加剧炎症效应; 其二, 精氨酸能够转化为尿素和鸟氨酸并进入尿素循环, 导致尿素循环出现异常, 而尿素循环与三羧酸循环有关, 由此出现一定程度的线粒体功能障碍, 线粒体功能障碍也可增强细胞炎性因子诱导的炎症反应[28, 29]。本研究中巨噬细胞RAW 264.7造模后细胞内精氨酸水平显著低于空白组, APS-Ⅰ给药后回调至正常水平, 提示APS-Ⅰ通过调节精氨酸生物合成和精氨酸代谢途径发挥抗炎作用。
半胱氨酸是人体的条件必需氨基酸, 是由人体内必需氨基酸甲硫氨酸转化而来的, 它在体内参与蛋白质合成与代谢, 发挥免疫调节等重要的生物学功能。甲硫氨酸进入机体后, 在甲硫氨酸腺苷转移酶催化下与ATP发生反应, 生成S-腺苷甲硫氨酸, 参与多种激素的合成与降解, 发挥抗炎、抗氧化功能。近年来, 大量研究表明炎症反应与半胱氨酸代谢异常关系密切, 炎症性肠病(inflammatory bowel disease, IBD) 是一组非特异性肠道慢性炎症性疾病, 临床资料显示IBD患者的血浆半胱氨酸水平明显升高, 提示半胱氨酸含量增加可以诱发炎症[30-32]。本研究中巨噬细胞RAW 264.7造模后细胞内S-腺苷甲硫氨酸水平显著高于空白组, APS-Ⅰ给药后回调至正常水平, 提示APS-Ⅰ通过调节半胱氨酸和甲硫氨酸的代谢途径发挥抗炎作用。
炎症是由外来条件引起的损伤与抗损伤的双重应激过程, 强烈的炎性反应会对组织产生损伤, 导致多种疾病的发生, 线粒体在能量代谢中起着重要的作用。三羧酸循环通路是线粒体产能的关键通路。大量研究表明, 炎症与三羧酸循环的关联性十分密切。LPS刺激巨噬细胞使得细胞线粒体氧化磷酸化水平降低, 三羧酸循环产物累积, α-酮戊二酸含量升高; LPS激活的RAW 264.7细胞在琥珀酸处发生了代谢中止, 琥珀酸不再继续代谢成延胡索酸, 延胡索酸含量降低[33-35]。本研究中巨噬细胞RAW 264.7造模后细胞内α-酮戊二酸水平显著高于空白组, APS-Ⅰ给药后二者回调至正常水平, 提示APS-Ⅰ通过调节三羧酸循环代谢途径发挥抗炎作用。
在课题组前期研究基础上, 本文采用LPS诱导巨噬细胞RAW 264.7建立细胞炎症模型, 筛选出APS中的抗炎活性组分APS-Ⅰ; 并通过LC-MS/MS代谢组学技术对APS-Ⅰ发挥抗炎作用的机制进行了研究, 研究结果为进一步阐明黄芪多糖药效物质基础指明方向。然而本文也存在一些不足之处, 从抗炎活性上看, 仅从细胞水平上筛选出抗炎组分, 后续应在炎症动物模型上验证该结论, 从作用机制上看, 仅从代谢组学的角度上研究作用机制深入性不足, 后续可采用转录组学和蛋白质组学等技术全面解释其作用机制。
作者贡献: 范信晖和李科负责文中实验方案设计; 范信晖负责实验实施、数据收集、结果分析和文章撰写等工作; 李科负责提供文章思路, 在文章写作方面进行指导和修改; 秦雪梅和李震宇对整个实验内容给予监督; 杨一丹、李雪琴负责对文章内容的修改完善。
利益冲突: 本文研究内容无任何利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Part 1. 2015 Ed. Beijing: China Medical Science Press, 2015: 302-303.
|
| [2] |
Tian Y, Ding YP, Shao BP, et al. Interaction between homologous functional food Astragali Radix and intestinal flora[J]. China J Chin Mater Med (中国中药杂志), 2020, 45: 2486-2492. |
| [3] |
Wang CN, Chen DY, Wang J, et al. Research progress on bidirectional immunoregulation of Huangqi (Astragali Radix) and its compound preparations[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2021, 39: 126-129. |
| [4] |
Gu ZR, Ge B, Xu AX, et al. Study on the efficacy and taboo of Astragalus based on herbal research[J]. Chin Tradit Pat Med (中成药), 2018, 40: 2524-2530. |
| [5] |
Chen GH, Huang WF. Research progress on chemical constituents and pharmacological effects of Astragalus membranaceus[J]. Chin J New Drugs (中国新药与临床), 2008, 17: 1482-1485. |
| [6] |
Zheng Y, Ren W, Zhang L, et al. A review of the pharmacological action of Astragalus polysaccharide[J]. Front Pharmacol, 2020, 11: 349. DOI:10.3389/fphar.2020.00349 |
| [7] |
Jiang CL, Tang C, Qian Y, et al. Immunoregulation effect of Astragalus polysaccharides[J]. Food Sci (食品科学), 2013, 94: 90-99. |
| [8] |
Liu Q, Yao Y, Yu Y, et al. Astragalus polysaccharides attenuate postburn sepsis via inhibiting negative immunoregulation of CD4+ CD25high T cells[J]. PLoS One, 2011, 6: e19811. DOI:10.1371/journal.pone.0019811 |
| [9] |
Liu A, Yu J, Ji H, et al. Extraction of a novel cold-water-soluble polysaccharide from Astragalus membranaceus and its antitumor and immunological activities[J]. Molecules, 2018, 23: 62. |
| [10] |
Yu J, Ji H, Yang Z, et al. Relationship between structural properties and antitumor activity of Astragalus polysaccharides extracted with different temperatures[J]. Int J Biol Macromol, 2019, 124: 469-477. DOI:10.1016/j.ijbiomac.2018.11.156 |
| [11] |
Zhu Z, Liu R, Si C, et al. Structural analysis and anti-tumor activity comparison of polysaccharides from Astragalus[J]. Carbohydr Polym, 2011, 85: 895-902. DOI:10.1016/j.carbpol.2011.04.020 |
| [12] |
Wu X, Yang W, Zhang L, et al. Effect of Astragalus polysaccharide segments with different molecular weight on systematic/mucosal immunization in immunodepressive mice[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2011, 17: 169-172. |
| [13] |
Yan J K, Wang W Q, Li L, et al. Physiochemical properties and antitumor activities of two α-glucans isolated from hot water and alkaline extracts of cordyceps (Cs-HK1) fungal mycelia[J]. Carbohydr Polym, 2011, 85: 753-758. DOI:10.1016/j.carbpol.2011.03.043 |
| [14] |
Cao YX. Quality Comparison of Astragali Radix from Different Sources Based on Polysaccharide Molecular Weight Distribution and Immune Activity (基于多糖分子量分布和免疫活性比较的黄芪质量研究)[D]. Taiyuan: Shanxi University, 2020.
|
| [15] |
Zhang C, Bin XU. Research on framework of etiology and pathogenesis theory of gangrene[J]. J Zhejiang Chin Med Univ (浙江中医药大学学报), 2017, 41: 800-802, 805.. |
| [16] |
Zhang QL, Shu YM, Pan XL, et al. Research progress on pharmacological effects and mechanisms of plant polysaccharides with medicine and food homology in treatment of ulcerative colitis[J]. Drug Eval Res (药物评价研究), 2021, 44: 644-651. |
| [17] |
Zhou GJ, Li YZ, Peng YM, et al. Effects of Astragalus polysaccharide injection on the levels of urine CXCL10, E-cadherin and MMP-9 in patients with diabetic nephropathy[J]. Med Pharm J Chin PLA (解放军医药杂志), 2021, 33: 94-97, 107. |
| [18] |
Cao YX, Li K, Qin XM. Quality evaluation of different areas of Astragali Radix based on carbohydrate specific chromatograms and immune cell activities[J]. Acta Pharm Sin (药学学报), 2019, 54: 1277-1287. |
| [19] |
Shi LX, Li K, Qin XM, et al. Identification of different Bupleurum varieties based on carbohydrate-specific chromatograms[J]. Acta Pharm Sin (药学学报), 2020, 55: 2968-2975. |
| [20] |
Liao JZ. Separation of the Effective Parts of Honey-Processed Austragli and Their Anti-inflammation Activities (蜜炙黄芪有效部位的分离及其抗炎活性研究)[D]. Guangzhou: Guangdong Pharmaceutical University, 2017: 28-36.
|
| [21] |
Li SY, Li K, Qin XM, et al. Study on active constituents of Astragalus polysaccharides for injection to regulate metabolism of macrophages based on LC-MS metabolomics[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 1575-1585. |
| [22] |
Gao SS, Guo HQ, Zhang ZK, et al. Metabolic fingerprint analysis of RAW264.7 inflammatory cell model by using UPLC-Q-TOF/MS[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 2373-2379. |
| [23] |
Xia J, Wishart DS. MetPA: a web-based metabolomics tool for pathway analysis and visualization[J]. Bioinformatics, 2010, 26: 2342-2344. DOI:10.1093/bioinformatics/btq418 |
| [24] |
Huang XN, Wan P, Zhao RZ, et al. Study on the structure and anti-inflammatory effect of vinegar Bupleurum Chinese polysaccharide VBCP-3[J]. Prog Vet Med (动物医学进展), 2021, 42: 59-63. |
| [25] |
Li FF, Huang DF, Jiang LM, et al. Immunoregulatory effect of polysaccharide from the seeds of Plantago asiatica L. on RAW264.7 cells stimulated with lipopolysaccharide[J]. Food Sci (食品科学), 2014, 35: 249-252. |
| [26] |
Bai XP, Sun P, Shen CX, et al. Effects of Lycium barbarum polysaccharides on seral IL-6, IL-10 and IL-12/IL-23 p40 levels in sera of immunosuppressive mice[J]. Prog Vet Med (动物医学进展), 2019, 40: 49-51. |
| [27] |
Li K, Cui LJ, Cao YX, et al. UHPLC Q-exactive ms-based serum metabolomics to explore the effect mechanisms of immunological activity of Astragalus polysaccharides with different molecular weights[J]. Front Pharmacol, 2020, 11: 1871. |
| [28] |
Wu G, Bazer FW, Burghardt RC, et al. Proline and hydroxyproline metabolism: implications for animal and human nutrition[J]. Amino Acids, 2011, 40: 1053-1063. DOI:10.1007/s00726-010-0715-z |
| [29] |
Sun XY. Study on Toxic Mechanism of Atmospheric Submicron Particles Based on Metabolomics (基于代谢组学的大气亚微米颗粒物毒性机制研究)[D]. Hangzhou: Zhenjiang University of Technology, 2020.
|
| [30] |
Peng B, Ruilin H, Xihong Z. Oxidation resistance of the sulfur amino acids: methionine and cysteine[J]. BioMed Res Int, 2017, 1-6. |
| [31] |
Shen JX, Wang CD. Correlation of homocysteine with inflammatory bowel disease and colitis-associated colon cancer[J]. Chin J Gastroenterol (胃肠病学), 2017, 22: 370-373. |
| [32] |
Li JJ. Study of Effects of Cystathionine/Hydrogen Sulfide on Inflammatory Responses Induced by Homocysteine in Macrophages and Related Mechanisms (胱硫醚γ裂解酶/硫化氢通路在同型半胱氨酸诱导的巨噬细胞炎症中的作用及机制研究)[D]. Suzhou: Soochow University, 2016.
|
| [33] |
Williams NC, Oneill L. A role for the krebs cycle intermediate citrate in metabolic reprogramming in innate immunity and inflammation[J]. Front Immunol, 2018, 9: 141. DOI:10.3389/fimmu.2018.00141 |
| [34] |
Arts RJW, Joosten LAB, Netea MG. Immunometabolic circuits in trained immunity[J]. Semin Immunol, 2016, 28: 425-430. DOI:10.1016/j.smim.2016.09.002 |
| [35] |
Ji D. Effect of Tricarboxylic Acid Cycle on Mitochondrial Function in Inflammatory and Anti-inflammatory Environments (炎症和抗炎环境下三羧酸循环对线粒体功能的影响)[D]. Shanghai: Shanghai Ocean University, 2020.
|
 2022, Vol. 57
2022, Vol. 57


