玄参为玄参科玄参属草本植物玄参(Scrophularia ningpoensis Hemsl.) 的干燥根, 始载于《神农本草经》, 味甘、苦、咸, 性微寒, 归肺、胃、肾经, 具有清热凉血, 滋阴降火, 解毒散结的功效, 为我国常用大宗中药, 广泛用于治疗热病伤阴、津伤便秘、骨蒸劳热、夜寐不安、目赤、咽痛、瘰疬等疾病[1], 且在中药方剂中经常配伍入药, 如咽炎片、清喉咽合剂、玄麦甘桔颗粒、四妙勇安汤等。因玄参应用广泛, 故对其化学成分及其药理活性研究一直备受关注。目前从玄参中发现的化学成分主要包括环烯醚萜类和苯丙素类[2], 其具有抗炎、抗菌、抗氧化、降血压、降血糖等作用[3]。玄参中尚有生物碱类、黄酮类、香豆素类、糖类、三萜类、挥发油类等成分, 这些成分报道相对较少。
由上可知, 玄参化学成分和药理活性研究虽取得了一定的成果, 但仍有巨大研究开发潜力, 相对于玄参的广泛应用, 对其化学成分研究的相对滞后制约了对玄参及其配伍方剂进行更为深入的开发。本课题组前期对玄参中的环烯醚萜及苯丙素类化学成分进行了研究, 发现一些结构新颖的化合物[4], 为进一步寻找结构新颖、活性良好的化学成分, 丰富玄参的化学成分库, 本课题组继续对其化学成分进行深入、系统的研究。本实验采用多种分离手段和结构鉴定技术从玄参中分离并鉴定了13个化合物, 包括6个生物碱类化合物(1~6)、4个黄酮类化合物(7~10) 和3个香豆素类化合物(11~13), 其中化合物1和2为两个新化合物, 8个化合物为首次从玄参中分离得到, 结构见图 1, 以上研究进一步丰富了玄参的物质基础研究。
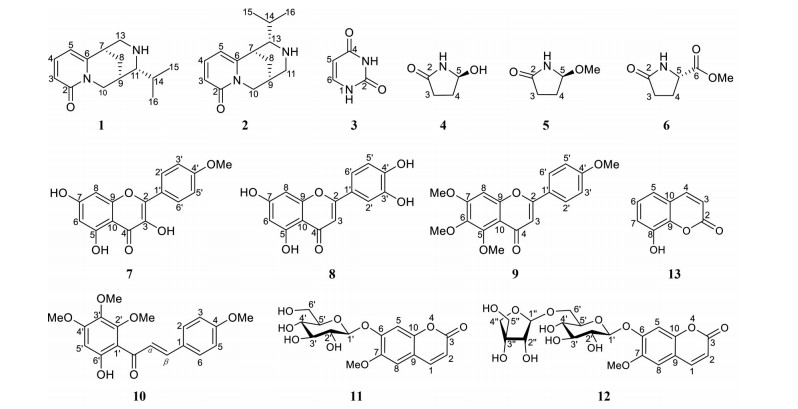
|
Figure 1 Chemical structures of compounds 1-13 |
化合物1 白色无定形粉末, [α]D25 = -95.2 (c 0.21, MeOH)。碘化铋钾反应(TLC) 显橘红色, 提示该化合物可能为生物碱。HR-ESI-MS显示准分子离子峰m/z 233.164 6 [M+H]+ (C14H21N2O+, 计算值233.164 8), 推断其分子式为C14H20N2O, 不饱和度为6。UV光谱显示在203、235、311 nm处有最大吸收, IR光谱显示存在氨基(3 431 cm-1)、羰基(1 655 cm-1) 和苯环(1 574、1 547 cm-1) 的特征吸收峰。
1H NMR谱显示存在α-吡啶酮环的3个特征性双键质子信号δH 7.46 (1H, dd, J = 9.0, 7.0 Hz)、6.42 (1H, dd, J = 9.0, 1.4 Hz) 和6.26 (1H, dd, J = 7.0, 1.4 Hz), 2组含氮亚甲基质子信号δH 3.98 (2H, d, J = 4.0 Hz) 和3.22 (1H, dd, J = 12.0, 2.7 Hz)、2.69 (1H, dt, J = 12.0, 2.4 Hz)。以上信息提示化合物1可能为吡啶酮类喹诺里西啶生物碱[5]。此外, 在高场区还可观察到一组异丙基质子信号δH 2.24 (1H, m)、0.96 (3H, d, J = 6.6 Hz)、0.99 (3H, d, J = 6.6 Hz)。13C NMR谱显示存在14个碳信号, 包括α-吡啶酮环的5个碳信号δC 165.8, 116.7, 141.3, 107.9, 153.8; 2个含氮亚甲基碳信号δC 52.9, 48.6; 1个含氮次甲基碳信号δC 67.1。此外, 在高场区还可观察到6个碳信号δC 36.1, 21.7, 29.1, 26.5, 20.4, 20.4。这些特征信息构建了吡啶酮类喹诺里西啶生物碱基本母核和取代情况。
结合1H-1H COSY、HSQC、HMBC谱所提供的信息, 完成对化合物1碳氢信号的准确归属(表 1)。将化合物1的NMR信号与已知化合物clathrotropine进行对比[5], 发现二者十分相似, 区别仅在于clathrotropine中的原D环信号缺失以及化合物1中多出的一组异丙基信号。同时结合化合物1存在6个不饱和度, 可推断化合物1为具有三环骨架的吡啶酮类喹诺里西啶型生物碱。在1H-1H COSY谱中可观察到如图 2所示的质子自旋偶合体系, 在HMBC谱中可观察到H-15 (δH 0.99)、H-16 (δH 0.96) 与C-11 (δC 67.1) 存在相关, 可确定异丙基连接于C-11位(图 2)。在NOESY谱中可观察到H-7 (δH 2.98) 和H-5 (δH 6.26), H-9 (δH 2.54) 和H-16 (δH 0.96), H-10β (δH 3.98) 和H-11 (δH 2.37), H-14 (δH 2.24) 和H-13α (δH 3.22)/H-15 (δH 0.99), H-10α (δH 3.98) 和H-8α (δH 1.76) 存在相关, 可确定该化合物的相对构型如图 3所示。运用ORCA 4.2.1软件, 采用TDDFT方法[6, 7]分别计算了两种可能的绝对构型的理论CD谱, 并分别与实测的CD谱进行比较(图 4), 确定化合物1的绝对构型为7R, 9R, 11R。综上所述, 确定了化合物1的结构, 为一个新的生物碱类化合物, 命名为11α-isopropylcytisine。
| Table 1 NMR data of compounds 1 and 2 in CD3OD (400 MHz for 1H NMR, 100 MHz for 13C NMR, J in Hz). aOverlapped signals are reported without designating multiplicity |
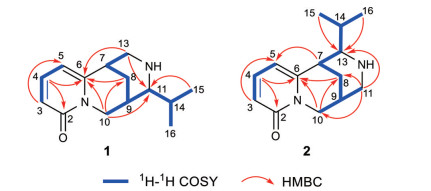
|
Figure 2 Key 1H-1H COSY and HMBC correlations of compounds 1 and 2 |
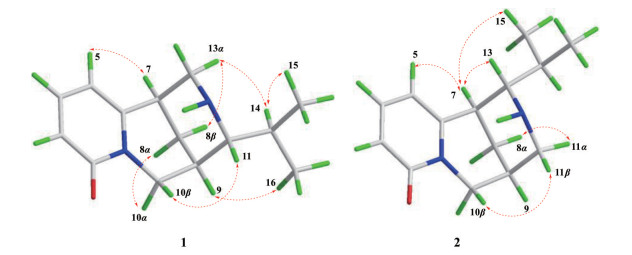
|
Figure 3 Key NOE correlations of compounds 1 and 2 |
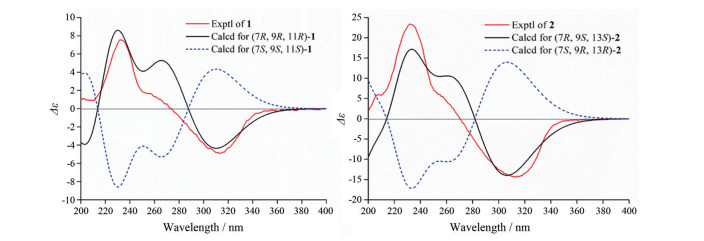
|
Figure 4 Calculated and experimental CD spectra of 1 and 2 |
化合物2白色无定形粉末, [α]D25 = -220.1 (c 0.71, MeOH)。碘化铋钾反应呈阳性, 提示其可能为生物碱类化合物。HR-ESI-MS显示准分子离子峰m/z 233.164 6 [M+H]+ (C14H21N2O+, 计算值233.164 8), 推断其分子式为C14H20N2O, 不饱和度为6, 是化合物1的同分异构体。UV光谱显示在203、234、310 nm处有最大吸收。IR光谱同样显示存在氨基(3 430 cm-1)、羰基(1 655 cm-1) 和苯环(1 573、1 547 cm-1) 的特征吸收峰。1H NMR谱显示存在α-吡啶酮环的3个特征性双键质子信号δH 7.46 (1H, dd, J = 9.0, 7.0 Hz)、6.41 (1H, dd, J = 9.0, 1.3 Hz) 和6.24 (1H, dd, J = 7.0, 1.3 Hz)。2组可能与氮相连的亚甲基质子信号δH 3.90 (1H, dd, J = 15.5, 6.5 Hz)、4.03 (1H, d, J = 15.5 Hz) 和δH 3.14 (1H, br d, J = 12.3 Hz)、2.75 (1H, dt, J = 12.3, 2.2 Hz)。以上信息提示化合物2为吡啶酮类喹诺里西啶生物碱[5]。此外, 与化合物1类似, 化合物2中也同样存在一组异丙基信号δH 2.28 (1H, m)、1.02 (3H, d, J = 6.1 Hz)、0.99 (3H, d, J = 6.1 Hz), δC 26.3, 20.4, 20.4。
结合1H-1H COSY、HSQC、HMBC谱提供的信息, 可对化合物2的碳氢信号进行全归属(表 1)。将化合物2的NMR信号与化合物1对比, 发现二者十分相似, 仅在11-CH和13-CH存在差异, 提示二者中异丙基取代位置可能不同。在化合物2的HMBC谱中可观察到H-15 (δH 1.02) 和H-16 (δH 0.99) 与C-13 (δC 68.0) 存在相关, 说明异丙基连接在C-13位。在NOESY谱中可观察到H-10β (δH 4.03) 与H-11β (δH 2.75), H-5 (δH 6.24) 和H-7 (δH 3.13), H-7 (δH 3.13) 与H-13 (δH 2.31)/H-15 (δH 1.02) 存在相关, 还可观察到H-8α (δH 1.74) 与H-11α (δH 3.14) 存在相关, 可确定化合物2的相对构型如图 3所示。此外, 基于TDDFT理论进行了计算CD, 7R, 9S, 11S-2的计算ECD曲线与化合物2的实验ECD曲线基本一致(图 4), 因此确定化合物2的绝对构型为7R, 9S, 13S。综上所述, 确定了化合物2的结构, 为一个新的生物碱类化合物, 命名为13α-isopropylcytisine。
2 细胞毒活性采用MTT法, 测试了分离所得的化合物对小鼠乳腺癌细胞4T1和人非小细胞肺癌细胞系A549的细胞毒活性。结果显示化合物8和9在浓度为50 μmol·L-1时对4T1具有微弱的细胞毒活性, 抑制率分别为64.46%和54.35%。
实验部分RE-52 A旋转蒸发仪(上海亚荣生化仪器厂); SHB-ⅢA循环水式多用真空泵(郑州长城科工贸有限公司); KQ-500 DE型数控超声波清洗器(昆山市超声仪器有限公司); HH-S2二孔智能水浴(郑州长城科工贸有限公司); Sartorious BT 25 S型十万分之一电子分析天平(北京赛多利斯仪器有限公司)。Agilent-1260型高效液相色谱仪(G1311C四元泵系统和G1315D二极管阵列检测器)配备一根Waters Sunfire C18色谱柱(5 μm, 4.6 mm × 150 mm); 岛津半制备型高效液相色谱仪(LC-20AR二元泵系统和SPD-20A检测器) 配备一根制备型高效液相色谱柱COMOSIL C18 (5 μm, 10 mm × 250 mm)。柱色谱用ODS (50 μm, YMC产品); 柱色谱用Sephadex LH-20 (Pharmacia产品); MCI GEL CHP 20P (日本三菱公司); 柱色谱用硅胶(200~300目)、薄层色谱用硅胶G、硅胶G预制薄层板(20 cm × 20 cm) (青岛海洋化工厂)。CO2细胞培养箱(美国Thermo公司); 荧光倒置显微镜(日本Nikon公司); 酶标仪(德国BMG Labtech公司); 超纯净水仪(美国Millipore公司); 人肺癌细胞A549及小鼠乳腺癌细胞4T1 (北京协和细胞资源中心); 胰蛋白酶(美国Gibco公司); 培养皿(美国Corning公司); 96孔板(美国Corning公司); DMEM培养基(美国Gibco公司); 胎牛血清(以色列Biological Industries公司); DMSO (美国Sigma-Aldrich公司); PBS缓冲液(美国Corning公司); 甲基噻唑蓝(MTT) (北京拜尔迪生物科技有限公司); 阿霉素(麦克林生化科技有限公司)。主要显色剂包括: 10%硫酸乙醇溶液, 5%香草醛浓硫酸溶液等。甲醇、乙腈(色谱级, Fisher公司), 水为超纯水, 其他试剂均为分析纯。
玄参药材(产地: 湖北恩施), 批号: 20180314, 经北京中医药大学中药资源与鉴定系赵婷老师鉴定为玄参科玄参属植物玄参(Scrophularia ningpoensis Hemsl.) 的干燥根, 药材存放于北京中医药大学中药学院B419实验室。
1 提取分离干燥的玄参根(40 kg) 经粉碎, 加10倍量70%乙醇回流提取3次, 每次2 h, 趁热过滤, 合并提取液, 减压浓缩后, 得总浸膏12.7 kg。将总浸膏加水分散, 依次用石油醚、乙酸乙酯、水饱和的正丁醇分别萃取3次, 合并萃取液后减压浓缩, 得到乙酸乙酯部位310 g。乙酸乙酯部位经硅胶柱色谱分离, 以二氯甲烷-甲醇(100∶0, 99∶1, 98∶2, 97∶3, 96∶4, 95∶5, 90∶10, 80∶20, 70∶30, 60∶40, 50∶50, 0∶100) 为洗脱剂进行梯度洗脱, 以薄层色谱进行检识, 合并得到27个不同极性的流分(Fractions 1~27)。Fraction 25 (34.0 g) 经乙酸乙酯-甲醇系统(100∶0, 99∶1, 98∶2, 97∶3, 96∶4, 95∶5, 90∶10, 0∶100) 梯度洗脱, 得到8个流分(Fr. A~H)。Fr. E (1.60 g) 经Sephadex LH-20柱色谱(甲醇为洗脱剂) 分离, 得到5个流分(Fr. E1~E5)。Fr. E3 (723.6 mg) 经ODS柱色谱, 以甲醇-水(25∶75, 40∶60, 80∶20, 100∶0) 梯度洗脱, 得到4个流分(Fr. E3.1~E3.4)。Fr. E3.1 (225.2 mg) 经半制备高效液相色谱(甲醇∶水= 5∶95) 得到化合物3 (5.4 mg, tR = 12.5 min)、化合物6 (6.5 mg, tR = 18.4 min) 和化合物4 (3.1 mg, tR = 32.5 min)。Fr. E3.3 (72.8 mg)经半制备高效液相色谱(甲醇-水= 43∶57) 得到化合物13 (3.3 mg, tR = 8.2 min)。Fraction 27 (30.0 g) 经乙酸乙酯-甲醇梯度洗脱(100∶0, 99∶1, 98∶2, 97∶3, 96∶4, 95∶5, 9∶1, 8∶2, 7∶3, 6∶4, 1∶1) 得到9个组分(Fr. 1~9)。Fr. 2 (6.23 g) 经硅胶柱色谱分离, 石油醚-乙酸乙酯(9∶1, 7∶1, 5∶1, 3∶1, 1∶1) 梯度洗脱得到4个组分(Fr. 2.1~2.4)。Fr. 2.1 (1.21 g) 经Sephadex LH-20柱色谱(二氯甲烷-甲醇= 1∶1), 再经ODS柱色谱分离, 甲醇-水梯度洗脱(20∶80, 40∶60, 60∶40), 得到化合物7 (4.5 mg)、化合物10 (3.8 mg) 和化合物8 (3.5 mg)。Fr. 2.2 (1.50 g) 经Sephadex LH-20柱色谱(二氯甲烷-甲醇= 1∶1) 除去色素后, 经半制备高效液相色谱(乙腈-水= 45∶55) 得到化合物1 (6.5 mg, tR = 23.5 min)、化合物2 (4.5 mg, tR = 42.2 min)。Fr. 2.3 (1.15 g) 经Sephadex LH-20柱色谱(二氯甲烷-甲醇= 1∶1) 除色素, 经ODS柱色谱分离, 甲醇-水梯度洗脱(10∶90, 30∶70, 50∶50, 70∶30), 得到化合物9 (3.8 mg) 和化合物5 (4.6 mg)。Fr. 2.4 (1.02 g) 经ODS柱色谱分离, 甲醇-水梯度洗脱(10∶90, 30∶70, 50∶50, 70∶30, 90∶10, 100∶0), 得到5个流分(Fr. 2.4.1~2.4.5)。Fr. 2.4.4 (0.12 g) 经半制备高效液相色谱(乙腈-水= 15∶85) 得到化合物12 (4.5 mg, tR = 10.8 min) 和化合物11 (6.0 mg, tR = 23.1 min)。
2 结构鉴定化合物1 白色无定形粉末(甲醇); [α]D25= -95.2 (c 0.21, MeOH); UV (MeOH) λmax: (log ε) 203.0 (2.71)、235.0 (2.43)、311.0 (2.53) nm; IR (KBr) νmax: 3 431、1 655、1 574、1 546 cm-1; HR-ESI-MS m/z 233.164 6 [M+H]+ (C14H21N2O+, 计算值233.164 8); 1H NMR (CD3OD, 400 MHz) 和13C NMR (CD3OD, 100 MHz) 数据见表 1。
化合物2 白色无定型粉末(甲醇); [α]D25 = -220.1 (c 0.71, MeOH); UV (MeOH) λmax: (log ε) 203.0 (2.92)、234.0 (2.69)、310.0 (2.76) nm; IR (KBr) νmax: 3 430、1 655、1 573、1 547 cm-1; HR-ESI-MS m/z 233.164 6 [M+H]+ (C14H21N2O+, 计算值233.164 8); 1H NMR (CD3OD, 400 MHz) 和13C NMR (CD3OD, 100 MHz) 数据见表 1。
化合物3 白色无定形粉末(甲醇), 5%香草醛-浓硫酸反应显棕黑色。ESI-MS m/z: 113 [M+H]+, 相对分子质量112, 分子式C4H4N2O2。1H NMR (CD3OD, 400 MHz): δH 7.38 (1H, d, J = 7.7 Hz, H-6), 5.60 (1H, d, J = 7.7 Hz, H-5)。13C NMR (CD3OD, 100 MHz): δC 153.6 (C-2), 167.4 (C-4), 101.7 (C-5), 143.7(C-6)。以上数据与文献[8]对比, 确定化合物3为尿嘧啶(uracil)。
化合物4 白色无定形粉末(甲醇), [α]D25 = -2.38 (c 0.042, MeOH); 5%香草醛-浓硫酸反应显棕色。ESI-MS m/z: 102 [M+H]+, 相对分子质量101, 分子式C4H7NO2。1H NMR (CD3OD, 400 MHz): δH 5.25 (1H, dd, J = 6.3, 1.7 Hz, H-5), 2.49 (1H, overlapped, H-3a)/2.19 (1H, ddd, J = 16.8, 9.8, 3.6 Hz, H-3b), 2.37 (1H, overlapped, H-4a)/1.90 (1H, m, H-4b)。13C NMR (CD3OD, 100 MHz): δC 180.8 (C-2), 29.5 (C-3), 31.3 (C-4), 80.9 (C-5)。以上数据与文献[9, 10]对比, 确定化合物4为(S)-5-羟基吡咯烷-2-酮((S)-5-hydroxypyrrolidin-2-one)。
化合物5 白色无定形粉末(甲醇), [α]D25 = + 1.12 (c 0.27, MeOH); 5%香草醛-浓硫酸反应显棕黑色。ESI-MS m/z: 116 [M+H]+, 相对分子质量115, 分子式C5H9NO2。1H NMR (CD3OD, 400 MHz): δH 4.88 (1H, dd, J = 6.0, 0.8 Hz, H-5), 3.30 (3H, s, 5-OCH3), 2.43 (1H, H-3a)/2.18 (1H, H-3b), 2.29 (1H, s, H-4a)/2.00 (1H, s, H-4b)。13C NMR (CD3OD, 100 MHz): δC 181.6 (C-2), 29.3 (C-3), 28.8 (C-4), 88.8 (C-5), 54.8 (5-OCH3)。以上数据与文献[11, 12]对比, 确定化合物5为pterolactam。
化合物6 白色无定形粉末(甲醇), 5%香草醛-浓硫酸反应显灰色。ESI-MS m/z: 144 [M+H]+, 相对分子质量143, 分子式C6H9NO3。1H NMR (CD3OD, 400 MHz): δH 4.29 (1H, dd, J = 9.0, 4.5 Hz, H-5), 3.75 (3H, s, 6-OCH3), 2.47 (1H, overlapped, H-4a)/2.15 (1H, overlapped, H-4b), 2.24~2.39 (2H, overlapped, H-3)。13C NMR (CD3OD, 100 MHz): δC 178.9 (C-2), 174.5 (C-6), 57.0 (C-5), 52.9 (6-OCH3), 30.3 (C-3), 25.8 (C-4)。以上数据与文献[13]对比, 确定化合物6为methyl-L-pyroglutamate。
化合物7 黄色无定形粉末(甲醇)。254 nm下有暗斑, 5%香草醛-浓硫酸显浅黄色。ESI-MS m/z: 301 [M+H]+, 相对分子质量300, 分子式C16H12O6。1H NMR (DMSO-d6, 400 MHz): δH 12.44 (1H, s, 5-OH), 10.82 (1H, br s, 7-OH), 9.52 (1H, br s, 3-OH), 8.13 (2H, d, J = 9.0 Hz, H-2′, 6′), 7.11 (2H, d, J = 9.0 Hz, H-3′, 5′), 6.46 (1H, d, J = 2.0 Hz, H-8), 6.20 (1H, d, J = 2.0 Hz, H-6), 3.84 (3H, s, 4′-OCH3)。13C NMR (DMSO-d6, 100 MHz): δC 146.2 (C-2), 136.1 (C-3), 176.0 (C-4), 160.7 (C-5), 98.2 (C-6), 164.0 (C-7), 93.5 (C-8), 156.2 (C-9), 103.1 (C-10), 123.3 (C-1′), 129.3 (C-2′), 129.3 (C-6′), 160.5 (C-4′), 114.0 (C-3′), 114.0 (C-5′), 55.4 (4′-OCH3)。以上数据与文献[14]对比, 确定化合物7为山柰素(kaempferide)。
化合物8 黄色无定形粉末(甲醇), 254 nm下有暗斑, 5%香草醛-浓硫酸显浅黄色。ESI-MS m/z: 287 [M+H]+, 相对分子质量286, 分子式C15H10O6。1H NMR (DMSO-d6, 400 MHz): δH 12.98 (1H, s, 5-OH), 7.41 (1H, dd, J = 8.1, 2.2 Hz, H-6′), 7.40 (1H, d, J = 2.2 Hz, H-2′), 6.89 (1H, d, J = 8.1 Hz, H-5′), 6.67 (1H, s, H-3), 6.44 (1H, d, J = 2.0 Hz, H-8), 6.19 (1H, d, J = 2.0 Hz, H-6)。13C NMR (DMSO-d6, 100 MHz): δC 163.9 (C-2), 102.9 (C-3), 181.7 (C-4), 161.5 (C-5), 98.9 (C-6), 164.2 (C-7), 93.9 (C-8), 157.3 (C-9), 103.7 (C-10), 121.5 (C-1′), 113.4 (C-2′), 145.8 (C-3′), 149.7 (C-4′), 116.0 (C-5′), 119.0 (C-6′)。以上数据与文献[15]对比, 确定化合物8为木犀草素(luteolin)。
化合物9 黄色无定形粉末(甲醇), 5%香草醛-浓硫酸显浅黄色。ESI-MS m/z: 343 [M+H]+, 相对分子质量342, 分子式C19H18O6。1H NMR (DMSO-d6, 400 MHz): δH 8.00 (2H, d, J = 8.9 Hz, H-2′, 6′), 7.18 (1H, s, H-8), 7.08 (2H, d, J = 8.9 Hz, H-3′, 5′), 6.69 (1H, s, H-3), 3.94 (3H, s, 5-OCH3), 3.84 (3H, s, 6-OCH3), 3.80 (3H, s, 7-OCH3), 3.76 (3H, s, 4′-OCH3)。13C NMR (DMSO-d6, 100 MHz): δC 161.9 (C-2), 106.1 (C-3), 175.6 (C-4), 153.9 (C-5), 139.7 (C-6), 157.4 (C-7), 97.3 (C-8), 151.6 (C-9), 112.0 (C-10), 123.0 (C-1′), 127.8 (C-2′), 127.8 (C-6′), 114.4 (C-3′), 114.4 (C-5′), 160.2 (C-4′), 61.8 (5-OCH3), 61.0 (6-OCH3), 56.4 (7-OCH3), 55.5 (4′-OCH3)。以上数据与文献[16]对比, 确定化合物9为5, 6, 7, 4′-四甲氧基黄酮(5, 6, 7, 4′-tetramethoxyflavone)。
化合物10 浅黄色无定形粉末(甲醇), 254 nm下有暗斑, 5%香草醛-浓硫酸显浅黄色。ESI-MS m/z: 345 [M+H]+, 相对分子质量344, 分子式为C19H20O6。1H NMR (DMSO-d6, 400 MHz): δH 12.40 (1H, s, 2′-OH), 7.69 (2H, d, J = 8.4 Hz, H-2, 6), 7.61 (1H, d, J = 15.7 Hz, H-β), 7.48 (1H, d, J = 15.7 Hz, H-α), 7.01 (2H, d, J = 8.4 Hz, H-3, 5), 6.38 (1H, s, H-3′), 3.84 (3H, s, 5′-OCH3), 3.84 (3H, s, 6′-OCH3), 3.81 (3H, s, 4′-OCH3), 3.70 (3H, s, 4-OCH3)。13C NMR (DMSO-d6, 100 MHz): δC 127.2 (C-1), 130.4 (C-2), 130.4 (C-6), 114.6 (C-3), 114.6 (C-5), 158.2 (C-4), 110.1 (C-1′), 158.3 (C-2′-OH), 96.5 (C-3′), 161.4 (C-4′), 134.7 (C-5′), 153.3 (C-6′), 124.5 (C-α), 143.4 (C-β), 55.4 (4-OCH3), 56.0 (4′-OCH3), 60.6 (5′-OCH3), 61.5 (6′-OCH3)。以上数据与文献[17]对比, 确定化合物10为6′-羟基-2′, 3′, 4, 4′-四甲氧基查尔酮(6′-hydroxy-2′, 3′, 4, 4′-tetramethoxychalcone)。
化合物11 白色无定形粉末(甲醇), 5%香草醛-浓硫酸反应显浅红色, Molish反应呈阳性。ESI-MS m/z: 377 [M+Na]+, 相对分子质量354, 分子式C16H18O9。1H NMR (CD3OD, 400 MHz): δH 7.90 (1H, d, J = 9.5 Hz, H-4), 7.20 (1H, s, H-5), 7.17 (1H, s, H-8), 6.30 (1H, d, J = 9.5 Hz, H-3), 5.06 (1H, d, J = 7.3 Hz, H-1′), 3.90 (3H, s, 7-OCH3), 3.90 (1H, br d, J = 12.0 Hz, H-6′a), 3.70 (1H, dd, J = 12.0, 5.6 Hz, H-6′b), 3.37~3.57 (4H, H-2′, 3′, 4′, 5′)。13C NMR (CD3OD, 100 MHz): δC 163.6 (C-2), 114.5 (C-3), 145.7 (C-4), 110.8 (C-5), 148.3 (C-6), 151.7 (C-7), 102.1 (C-8), 150.7 (C-9), 114.6 (C-10), 105.3 (C-1′), 74.7 (C-2′), 78.4 (C-3′), 71.2 (C-4′), 77.8 (C-5′), 62.4 (C-6′), 57.1 (7-OCH3)。以上数据与文献[18]对比, 确定化合物11为东莨菪苷(scopolin)。
化合物12 白色无定形粉末(甲醇), 5%香草醛-浓硫酸反应显浅红色, Molish反应呈阳性。ESI-MS m/z: 509 [M+Na]+, 相对分子质量486, 分子式C21H26O13。1H NMR (CD3OD, 400 MHz): δH 7.90 (1H, d, J = 9.5 Hz, H-4), 7.22 (1H, s, H-5), 7.20 (1H, s, H-8), 6.31 (1H, d, J = 9.5 Hz, H-3), 4.99 (1H, d, J = 7.5 Hz, H-1′), 4.95 (1H, d, J = 2.7 Hz, H-1′′), 4.06 (1H, d, J = 9.7 Hz, H-4′′a), 4.05 (1H, dd, J = 11.0, 1.8 Hz, H-6′a), 3.98 (1H, d, J = 2.7 Hz, H-2′′), 3.91 (3H, s, 7-OCH3), 3.77 (1H, d, J = 9.7 Hz, H-4′′b), 3.70 (1H, H-5′), 3.64 (1H, d, J = 11.7 Hz, H-5′′a), 3.61 (1H, d, J = 11.7 Hz, H-5′′b), 3.60 (1H, dd, J = 11.0, 7.3 Hz, H-6′b), 3.46~3.55 (2H, H-3′, 4′), 3.34 (1H, dd, J = 9.8, 7.5 Hz, H-2′)。13C NMR (CD3OD, 100 MHz): δC 163.9 (C-2), 114.5 (C-3), 145.8 (C-4), 110.8 (C-5), 148.2 (C-6), 151.7 (C-7), 102.2 (C-8), 150.7 (C-9), 114.6 (C-10), 105.5 (C-1′), 74.7 (C-2′), 78.3 (C-3′), 71.7 (C-4′), 77.2 (C-5′), 69.1 (C-6′), 111.2 (C-1′′), 77.9 (C-2′′), 80.5 (C-3′′), 75.0 (C-4′′), 65.6 (C-5′′), 57.1 (OCH3)。以上数据与文献[19]对比, 确定化合物12为hymexelsin。
化合物13 白色无定形粉末(甲醇), 10%硫酸-乙醇显红色, 5%香草醛-浓硫酸反应显红色。ESI-MS m/z: 161 [M-H]+, 相对分子质量162, 分子式C9H6O3。1H NMR (DMSO-d6, 400 MHz): δH 10.34 (1H, s, 8-OH), 8.00 (1H, d, J = 9.6 Hz, H-4), 7.12 (3H, m, H-5, 6, 7), 6.45 (1H, d, J = 9.6 Hz, H-3)。13C NMR (DMSO-d6, 100 MHz): δC 160.0 (C-2), 118.1 (C-3), 142.2 (C-4), 116.0 (C-5), 144.7 (C-6), 144.7 (C-7), 124.4 (C-8), 144.9 (C-9), 118.4 (C-10)。以上数据与文献[20]对比, 确定化合物13为8-羟基香豆素(8-hydroxycoumarin)。
3 细胞毒活性测试通过MTT法测试化合物1~13的细胞毒活性, 测试细胞株为小鼠乳腺癌细胞4T1和人非小细胞肺癌细胞系A549。实验过程将培养的4T1、A549肿瘤细胞铺96孔板, 培养24 h。给药(浓度为50 μmol·L-1, 6复孔, 5 μmol·L-1阿霉素为阳性对照), 孵育48 h后, 基于MTT法用酶标仪在570 nm波长下检测吸光值, 根据如下公式计算细胞生长抑制率。
细胞生长抑制率(%) = [1-(实验组吸光度值-调零孔吸光度值)/(对照组吸光度值-调零孔吸光度值)] × 100%。
致谢: 深圳大学药学院刘颖博士在ECD计算方面给予指导和帮助。
作者贡献: 刘鹏主要负责对中药玄参进行提取、分离和结构鉴定; 祝琳琳协助对化学成分进行活性筛选和文章整理; 靖淑瑾对化学成分进行活性筛选; 李想协助进行提取和萃取工作; 苏成园协助完成化合物分离和结构鉴定工作; 张薇为通讯作者, 全程指导实验设计、结构解析和论文撰写和修改; 刘斌为通讯作者, 负责实验的整体设计把关和文章审阅。
利益冲突: 本文的研究无任何利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典, 一部)[S]. Vol I. Beijing: China Medical Science Press, 2020, 1: 121-122.
|
| [2] |
Huo YF, Zhan ZL, Wang HL, et al. Chemical constituents from the roots of Scrophularia ningpoensis Hemsl. and their anti-inflammatory activities[J]. Chin Pharm J (中国药学杂志), 2020, 55: 1207-1214. |
| [3] |
Pasdaran A, Hamedi A. The genus Scrophularia: a source of iridoids and terpenoids with a diverse biological activity[J]. Pharm Biol, 2017, 55: 2211-2233. DOI:10.1080/13880209.2017.1397178 |
| [4] |
Liu P, Zhou MN, Zhu LL, et al. New iridoid and phenylethanoid glycosides from the roots of Scrophularia ningpoensis[J]. Tetrahedron, 2021, 94: 132325. DOI:10.1016/j.tet.2021.132325 |
| [5] |
Sagen AL, Gertsch J, Becker R, et al. Quinolizidine alkaloids from the curare adjuvant Clathrotropis glaucophylla[J]. Phytochemistry, 2002, 61: 975-978. DOI:10.1016/S0031-9422(02)00394-1 |
| [6] |
Neese F. The ORCA program system[J]. WIREs, 2012, 2: 73-78. |
| [7] |
Neese F. Software update: the ORCA program system, version 4.0[J]. WIREs, 2018, 8: e1327. |
| [8] |
Hu YM, Wang H, Ye WC, et al. Aqueous constituents from Stellaria Media (L.) Cyr.[J]. J China Pharm Univ (中国药科大学学报), 2005, 36: 523-525. |
| [9] |
Dai YH, Cui Z, Li JL, et al. A new thiaziedione from the fruits of Xanthium sibiricum[J]. J Asian Nat Prod Res, 2008, 10: 303-305. DOI:10.1080/10286020701833495 |
| [10] |
Kim KH, Lee IK, Park KM, et al. Isolation of γ-lactam alkaloids from the Macrolepiota neomastoidea[J]. Bull Korean Chem Soc, 2008, 29: 1591-1593. DOI:10.5012/bkcs.2008.29.8.1591 |
| [11] |
Feng WS, Li M, Zheng XK, et al. Study on chemical constituents of immunosuppressive parts from the roots of Rehmannia glutinosa[J]. Chin Pharm J (中国药学杂志), 2014, 49: 1496-1502. |
| [12] |
Chen Y, Li SW, Yin FZ, et al. Lagerindicine, a new pyrrole alkaloid isolated from the flowers of Lagerstroemia indica Linnaeus[J]. Nat Prod Bioprospect, 2020, 11: 73-79. |
| [13] |
Aggarwal VK, Astle CJ, Iding H, et al. Separation of pyrrolidine allylation products by diastereoselective enzymatic ester hydrolysis[J]. Tetrahedron Lett, 2005, 46: 945-947. DOI:10.1016/j.tetlet.2004.12.062 |
| [14] |
Maruyama H, Sumitou Y, Sakamoto T, et al. Antihypertensive effects of flavonoids isolated from Brazilian green propolis in spontaneously hypertensive rats[J]. Biol Pharm Bull, 2009, 32: 1244-1250. DOI:10.1248/bpb.32.1244 |
| [15] |
Xu XH, Qian SH, Bian MG, et al. Chemical constituents from the leaves of Broussonetia papyrifera.[J]. Chin J Nat Med (中国天然药物), 2007, 5: 190-192. |
| [16] |
Iinuma M, Matsuura S, Kusuda K. 13C-Nuclear magnetic resonance (NMR) spectral studies on polysubstituted flavonoids. I. 13C-NMR spectra of flavones[J]. Chem Pharm Bull, 1980, 28: 708-716. DOI:10.1248/cpb.28.708 |
| [17] |
Yang JN, Yang JY, Cao J, et al. Flavonoids and other compounds from two species of the genus Eupatorium.[J]. Chem Nat Compd, 2020, 56: 539-541. DOI:10.1007/s10600-020-03084-1 |
| [18] |
Chen FY, Chu Y, Chen J, et al. Studies on chemical constituents of Chloranthus fortunei[J]. Chin Tradit Herb Med (中草药), 2020, 51: 1485-1490. |
| [19] |
Sibanda S, Ndengu B, Multari G, et al. A coumarin glucoside from Xeromphis obovata.[J]. Phytochemistry, 1989, 28: 1550-1552. DOI:10.1016/S0031-9422(00)97791-4 |
| [20] |
Sadavongvivad C, Supavilai P. Three monohydroxycoumarins from Alyxia lucida.[J]. Phytochemistry, 1977, 16: 1451. DOI:10.1016/S0031-9422(00)88808-1 |
 2022, Vol. 57
2022, Vol. 57


