2. 中国科学院上海药物研究所新药研究国家重点实验室, 上海 201203;
3. 中国热带农业科学院热带生物技术研究所海南省海洋生物资源功能性成分研究与利用重点实验室, 海南 海口 571101;
4. 中科环渤海 (烟台) 药物高等研究院, 山东 烟台 264000
2. State Key Laboratory of Drug Research, Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China;
3. Hainan Provincial Key Laboratory for Functional Components Research and Utilization of Marine Bio-resources, Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Sciences, Haikou 571101, China;
4. Bohai rim Advanced Research Institute for Drug Discovery, Yantai 264000, China
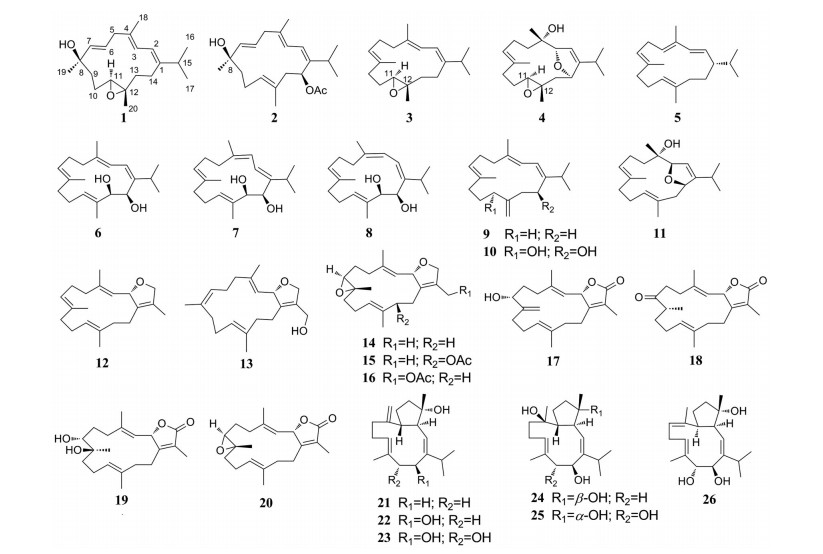
肉芝软珊瑚(Sarcophyton) 隶属于腔肠动物门(Coelenterata) 珊瑚虫纲(Anthozoa) 八放珊瑚亚纲(Octocorallia) 软珊瑚目(Alcyonacea) 软珊瑚科(Alcyoniidae)[1]。肉芝软珊瑚属中珊瑚种类多达40种, 分布广泛, 主要栖息于印度洋-太平洋地区、红海、地中海等[2]。肉芝软珊瑚次级代谢产物丰富, 主要包括倍半萜、二萜、甾体、三萜、四萜、脂肪酸等, 其中的二萜主要是西松烷型, 数量占二萜化合物的90%以上, 双键的位移、环氧化、烯丙位和异丙基的氧化及碳环化等导致其结构的千变万化, 主要有异丙(烯) 基西松烷二萜、呋喃环型西松烷二萜、五元内酯型西松烷二萜、七元内酯型西松烷二萜等, 同时还形成了罕见的二聚西松烷二萜[2, 3]。它们显示出广泛的有效生物活性, 例如抗肿瘤、神经保护、抗菌、抗病毒、抗糖尿病、防污和抗炎活性等[2]。
本课题组长期致力于从中国海洋生物中寻找具有生物活性的新型次级代谢产物[3-8], 尤其是刺胞动物(腔肠动物)[9-11]。近十年来, 在不断努力从海南软珊瑚寻找生物活性次代谢产物的过程中, 本课题组对10种肉芝软珊瑚进行了化学成分研究, 发现了许多结构有趣的新型萜类化合物, 其中一些具有前所未有的骨架结构[12-16]。2009年, 课题组对采自海南省陵水湾沿岸的乳白肉芝软珊瑚Sarcophyton glaucum进行了研究, 并分离得到了一系列具有罕见五元内酯环的新型西松烷型二萜[17]。2021年, 在海南省西瑁岛附近采集到了同种物种, 从中分离得到了21个西松烷型二萜, 其中有6个是新的西松烷型二萜, (+)-sarcophytol A、sarcophytol B在体外生物活性测试中对脂多糖(LPS) 诱导的小鼠小胶质细胞(BV2) 炎症反应表现出有效的抑制作用[16]。最近, 随着研究对象从大陆沿岸向深远海推进[10, 18-21], 在南海西沙首次采到了相同的物种, 进一步对该样品的乙醚相浸膏进行化学研究得到了26个二萜(20个西松烷型和6个Capnosane型), 其中化合物1为新的化合物(图 1)。化合物4对LPS诱导的BV2细胞炎症反应具有抑制作用。
|
Figure 1 The structures of compounds 1-26 |
化合物1, 无色油状, HR-ESI-MS显示其准分子离子峰[M+H]+ m/z 305.248 1 (计算值305.247 5), 确定其分子式为C20H32O2, 不饱和度为5。IR吸收峰提示其含有羟基(3 440 cm-1)。1H NMR谱数据(表 1) 显示存在着5个甲基信号: 2个偕甲基信号[δH 1.02 (6H, d, J = 6.9 Hz), H3-16, 17], 1个烯甲基信号[δH 1.76 (3H, s, H3-18)] 和2个连在季碳上的甲基信号[δH 1.40 (3H, s, H3-19) 和δH 1.23 (3H, s, H3-20)]。13C NMR谱和DEPT谱(表 1) 显示20个碳信号, 包括5个伯碳[δC 16.1 (q), 18.4 (q), 21.9 (q), 22.0 (q), 28.8 (q)]、5个仲碳[δC 24.2 (t), 25.9 (t), 40.4 (t), 41.3 (t), 41.4 (t)]、6个叔碳[4个sp2杂化的叔碳δC 118.4 (d), 120.4 (d), 125.6 (d), 140.3 (d); 1个连氧的叔碳δC 64.2 (d); 1个异丙基上的叔碳δC 36.7 (d)] 和4个季碳[2个连氧的季碳δC 62.4 (s), 72.8 (s); 2个sp2杂化的季碳δC 135.8 (s), 148.5 (s)], 为典型的西松烷型二萜的信号。5个不饱和度包括3个双键、1个环氧环和1个14元大环。通过对比sarcophytrol D[22]的数据发现, 它们的核磁数据非常相似, 其区别主要在C-15位及其邻位碳、氢原子的化学位移。化合物1的C-15、C-16和C-17的化学位移明显移向高场[δC 36.7, 21.9, 22.0 (1), δC 73.8, 29.2, 29.2 (sarcophytrol D)], 而且与sarcophytrol D相对比, 化合物1明显地少了一个连氧的季碳, 多了一个异丙基上的叔碳信号[δH 2.32 (sept, 6.9), δC 36.7 (d)], 推断化合物1为sarcophytrol D的15位去羟基衍生物, 其1H-1H COSY和重要的HMBC相关信号如图 2所示。因此, 化合物1的平面结构如图 1所示。
| Table 1 The 1H (500 MHz) and 13C NMR (125 MHz) data of 1 in CDCl3 |

|
Figure 2 The 1H-1H COSY, key HMBC and NOESY correlations of 1 |
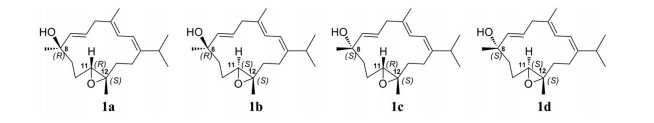
NOESY谱中(图 2), H-11 [δH 3.08 (t, 6.2)] 与H3-20之间未见NOE相关, H-9b [δH 1.69 (m)] 与H-11/H3-19相关, 表明H-11和H3-19在同一平面, 而H-11、H3-19可能与H3-20位于不同的平面。值得指出的是, 核磁共振计算已成为解决传统结构解析方法(1D, 2D NMR、MS、ECD等) 难以解决的天然或合成有机分子立体结构解析的有力工具。特别是, 规范不变的原子轨道(GIAO) NMR计算是用于构建分子结构、确定相对构型、验证或修正错误结构的最普遍方法[22-29]。因此, 本文采用QM-NMR计算方法来进一步确定其相对构型。化合物1有3个手性中心, 对应着4种相对构型1a (8R*, 11R*, 12S*)、1b (8R*, 11S*, 12S*)、1c (8S*, 11R*, 12S*) 和1d (8S*, 11S*, 12S*), 如图 3所示。首先, 采用蒙特卡洛多样优化法(MMCC)、MM2*力场来对这4种相对构型进行构象搜索, 能量窗口设置为21.0 kJ·mol-1 (5.02 kcal·mol-1)。然后对得到的构象进行结构优化, 选择的方法为B3LYP, 基组为6-311G(d, p)。接着, 在PCM/mPW1PW91/6-31G*水平上, 运用GIAO方法进行屏蔽常数的计算。最后, 计算每个立体异构体的Boltzmann平均后的屏蔽常数, 并与实验数据进行比较。概率计算采用DP4+方法[21, 30]。结果如图 4所示, 构型1b (8R*, 11S*, 12S*) 的DP4+概率为99.99%, 其计算得到的NMR数据与化合物1的实验数据相似度最高。实验与计算的13C NMR化学位移值之间的线性回归分析如图 5所示, 1a~1d的拟合优度(R2) 分别为0.997 1、0.999 2、0.997 5和0.998 4, 构型1b的化学位移值与实验值拟合程度最高, 其计算得到的化学位移值最接近实验值。因此, 化合物1的相对构型为8R*, 11S*, 12S*。进一步从生源途径方面进行考虑, 化合物1和化合物2的C5~C10片段化学位移相似, C-8位应同为R; 化合物1的环氧环的立体构型应与化合物3、4的一样, 同为11S, 12S。因此, 化合物1的结构如图 1所示, 命名为15-dehydroxy-sarcophytrol D。
|
Figure 3 Four relative configurations of isomers of 1 |

|
Figure 4 DP4+ results obtained using experimental data of 1 versus isomers 1a-1d |

|
Figure 5 Correlation plots of compound 1 between 13C chemical shifts computed at the PCM/mPW1PW91/6-31G* level of theory and experimental ones for 1a-1d |
根据理化性质和波谱数据分析, 已知化合物分别鉴定为ximaoglaucumin C (2)[16]、(11S, 12S, 1E, 3E, 7E)-11, 12-epoxycembra-1, 3, 7-triene (3)[31, 32]、sarcophytol W (4)[33]、cembrene (5)[30]、sarcophytol B (6)[34, 35]、sarcophytol K (7)[35]、sarcophytol J (8)[36]、pentaene-cembrene (9)[36]、sarcophytol E (10)[36]、(+)-marasol (11)[37]、(2S)-sarcophytoninsarcophytoxide (12)[38]、(-)-17-hydroxydeepoxysarcophytoxide (13)[39]、(+)-sarcophytoxide (14)[38]、13-acetoxysarcophytoxide (15)[40]、bophynin B (16)[41]、16-oxosarcophytoxide E (17)[42, 43]、sarcophinone (18)[44]、7α-8β-dihydroxydeepoxysarcophine (19)[42]、(+)-sarcophine (20)[45]、14-dehydroxy-sarcophytol L (21)[46]、sarcophytol L (22)[47]、13α-hydroxy-sarcophytol L (23)[47]、trocheliophol C (24)[48]、trocheliophol E (25)[48]和trocheliophol L (26)[48]。
对化合物1~26分别进行了抗炎、肿瘤细胞毒(人原髓细胞白血病细胞HL60)、抗菌(铜绿假单胞菌、金葡菌、鲍曼不动杆菌、大肠杆菌) 和抗糖尿病的活性测试。结果表明: 在终浓度为20 μmol·L-1时, 化合物4对LPS诱导的BV2细胞炎症反应具有抑制作用, 一氧化氮(NO) 的产生与脂多糖组相比抑制到(45.04 ± 2.52)%, NO抑制率大于50%, 而且在该浓度下未表现出明显的细胞毒作用, 而其他化合物对LPS诱导BV2细胞炎症没有明显的抑制活性。所有化合物均未显示出相应的肿瘤细胞毒、抗菌、抗糖尿病活性。
小结文献显示, 对乳白肉芝软珊瑚S. glaucum进行的化学成分的研究较多, 其采集的水域涵盖了中国海南的陵水湾、亚龙湾、西瑁岛以及徐闻的珊瑚礁, 日本冲绳的石垣岛, 红海的沙特阿拉伯吉达北部以及赫尔格达海域等[2]。但是, 对采自于远离中国大陆海域(如西沙) 的S. glaucum没有相关的关于化学成分研究的报道, 本文是首次对西沙采集到的S. glaucum进行化学成分研究, 从其乙醚相浸膏中分离得到了26个化合物, 包括20个西松烷型二萜, 6个Capnosane型二萜, 其中化合物1是一个新西松烷型二萜。对所分离到的化合物进行广谱的生物活性筛选, 结果表明化合物4对脂多糖(LPS) 诱导的BV2细胞炎症反应具有抑制作用。该研究有助于了解乳白肉芝软珊瑚S. glaucum在不同环境条件下产生的次级代谢产物的差异性, 丰富了中国南海乳白肉芝软珊瑚S. glaucum的化学多样性, 为深远海生物资源的开发和利用提供一定的参考。
实验部分Bruker AVANCE III 400 MHz、500 MHz和600 MHz核磁共振仪(Bruker Biospin AG, Fällanden德国), 以TMS信号作为参照; Perkin-Elmer 241MC旋光测定仪(PerkinElmer, Fremont, 美国); Agilent G6520 Q-TOF高分辨质谱仪(Agilent, 美国); Nicolet iS5红外光谱仪(Thermo Scientific, Waltham, 美国); 薄板硅胶板GF254和柱色谱用硅胶(200~300目, 300~400目, 青岛海洋化工有限公司, 中国); Agilent 1260高效液相色谱仪(Agilent, 美国), Agilent Eclipse XDB-C18半制备色谱柱(5 μm, 9.4 mm × 250 mm); Thermo恒温培养箱(美国赛默飞公司); 摇板机(IKA MS3 digital); Sephadex LH-20凝胶(Amersham Pharmacia Biotech, 瑞典); 色谱纯试剂(DiKMA, 美国), 其他有机溶剂均为分析纯, 购自国药集团化学试剂有限公司; DMEM (高糖)培养液、胎牛血清(FBS)、胰蛋白酶(Trypsin) (美国Gibco公司); 噻唑蓝(MTT)、脂多糖(LPS)、Griess reagent (格里斯试剂, 美国Sigma公司)、白藜芦醇(Sigma-Aldrich)。
样品乳白肉芝软珊瑚S. glaucum采集于中国南海西沙海域(2019年5月), 种属由海南大学李秀保教授鉴定, 标本保存于中国科学院上海药物研究所新药研究国家重点实验室(编号为19-XS-3)。
1 提取与分离将冷冻的乳白肉芝软珊瑚(干重量212.7 g) 切碎, 丙酮超声提取3次, 过滤后的提取液经减压浓缩后得到丙酮提取物, 将丙酮提取物分散于水中用乙醚萃取3次, 得到乙醚相浸膏32.0 g。
乙醚相浸膏(32.0 g) 经硅胶柱色谱(200~300目, 石油醚-乙醚= 10∶1→9∶1→8∶2→7∶3→5∶5, 二氯甲烷-甲醇= 9∶1→8∶2) 梯度洗脱, 得到14个组分(GA~GM)。
组分GC (6.5 g) 先后经Sephadex HL-20柱色谱(二氯甲烷)、硅胶柱色谱(300~400目, 石油醚-乙醚= 20∶1) 和半制备HPLC (乙腈-水= 8∶2), 得到化合物21 (2.6 mg, tR = 28.8 min)。
组分GD (3.2 g) 经Sephadex HL-20柱色谱(石油醚-二氯甲烷-甲醇= 2∶1∶1) 和硅胶柱色谱(300~400目, 石油醚-乙醚= 70∶1), 得到化合物3 (71.1 mg) 和化合物12 (33.6 mg)。
组分GE (1.1 g) 经Sephadex HL-20柱色谱(石油醚-二氯甲烷-甲醇= 2∶1∶1)、硅胶柱色谱(300~400目, 石油醚-二氯甲烷= 9∶1→8∶2) 和半制备HPLC (甲醇-水= 9∶1), 得到化合物5 (3.2 mg, tR = 20.1 min)。
组分GF (870 mg) 经Sephadex HL-20柱色谱(石油醚-二氯甲烷-甲醇= 2∶1∶1) 得到流分GF1~GF6, GF4经半制备HPLC (乙腈-水= 7∶3), 得到化合物9 (5.1 mg, tR = 11.1 min)。GF5经硅胶柱色谱(300~400目, 石油醚-丙酮= 100∶1→15∶1), 得流分GF5A~GF5D, GF5B经硅胶柱色谱(300~400目, 石油醚-丙酮= 40∶1) 和半制备HPLC (乙腈-水= 9∶1), 得到化合物24 (4.9 mg, tR = 7.5 min)。GF5C经半制备HPLC (乙腈-水= 6∶4), 得到化合物11 (3.0 mg, tR = 29.6 min)。
组分GH (365.5 mg) 经硅胶柱色谱(300~400目, 石油醚-丙酮= 13∶1, 石油醚-丙酮= 8∶2) 和半制备HPLC (乙腈-水= 5∶5), 得到化合物14 (2.0 mg, tR = 42.2 min)。
组分GI (3.3 g) 经Sephadex HL-20柱色谱(石油醚-二氯甲烷-甲醇= 2∶1∶1)、硅胶柱色谱(300~400目, 石油醚-丙酮= 40∶1→7∶3) 和半制备HPLC (乙腈-水= 6∶4), 得化合物2 (2.7 mg, tR = 50.3 min) 和化合物4 (3.7 mg, tR = 23.1 min)。
组分GJ (2.0 g) 经Sephadex HL-20柱色谱(石油醚-二氯甲烷-甲醇= 2∶1∶1) 得到流分GJ1~GJ7, GJ4经硅胶柱色谱(300~400目, 石油醚-二氯甲烷= 5∶5→3∶7→2∶8) 得到GJ4A~GJ4O。GJ4I经硅胶柱色谱(300~400目, 石油醚-丙酮= 13∶1) 得到化合物6 (10.0 mg)。GJ4L经Sephadex HL-20柱色谱(二氯甲烷) 和硅胶柱色谱(300~400目, 石油醚-丙酮= 12∶1→9∶1→6∶4) 得到GJ4L1A~GJ4L1J。GJ4L1D经硅胶柱色谱(300~400目, 石油醚-丙酮= 12∶1→11∶1) 和半制备HPLC (甲醇-水= 7∶3), 得到化合物18 (1.2 mg, tR = 19.4 min) 和化合物20 (4.3 mg, tR = 16.5 min)。GJ4L1H经半制备HPLC (甲醇-水= 3∶1), 得到化合物19 (5.6 mg, tR = 6.5 min)。GJ4N经硅胶柱色谱(300~400目, 石油醚-丙酮= 12∶1) 和半制备HPLC (甲醇-水= 8∶2), 得到化合物15 (1.6 mg, tR = 8.4 min) 和化合物16 (0.7 mg, tR = 11.0 min)。GJ6经硅胶柱色谱(300~400目, 石油醚-丙酮= 12∶1→9∶1) 得到GJ6E和GJ6F。GJ6E经硅胶柱色谱(300~400目, 石油醚-丙酮= 7∶1, 石油醚-丙酮= 8∶1) 和半制备HPLC (乙腈-水= 11∶9), 得到化合物17 (1.7 mg, tR = 14.7 min)。GJ6F经硅胶柱色谱(300~400目, 石油醚-丙酮= 7∶1→4∶1) 得到GJ6F4B和GJ6F4D。GJ6F4B经半制备HPLC (甲醇-水= 8∶2), 得到化合物23 (3.7 mg, tR = 16.0 min) 和化合物26 (1.8 mg, tR = 14.3 min)。GJ6F4D经半制备HPLC (甲醇-水= 7∶3→9∶1), 得到化合物25 (4.7 mg, tR = 11.4 min)。
组分GL (920 mg) 经硅胶柱色谱(300~400目) 得到流分GL1~GL7。GL2经硅胶柱色谱(300~400目, 二氯甲烷) 和半制备HPLC (乙腈-水= 6∶4), 得到化合物7 (3.5 mg, tR = 37.9 min)。GL5经硅胶柱色谱(300~400目, 石油醚-乙醚= 8∶2→7∶3, 石油醚-乙醚= 8∶2) 得到GL5B1~GL5B6。GL5B1经半制备HPLC (甲醇-水= 22∶3), 得到化合物8 (1.0 mg, tR = 12.4 min)。GL5B4经硅胶柱色谱(300~400目, 石油醚-乙醚= 7∶3) 和半制备HPLC (乙腈-水= 13∶7), 得到化合物1 (2.0 mg, tR = 21.1 min)。
组分GM (971.3 mg) 经Sephadex HL-20柱色谱(石油醚-二氯甲烷-甲醇= 2∶1∶1) 和硅胶柱色谱(300~400目, 石油醚-乙醚= 8∶2→7∶3) 得到GM5A~GM5G。GM5E经半制备HPLC (甲醇-水= 8∶2), 得到化合物13 (3.1 mg, tR = 24.0 min)。GM5F经Sephadex HL-20柱色谱(二氯甲烷)、硅胶柱色谱(300~400目, 石油醚-丙酮= 40∶1) 和半制备HPLC (甲醇-水= 8∶2), 得到化合物22 (0.8 mg, tR = 14.2 min) 和10 (1.6 mg, tR = 22.7 min)。
2 结构鉴定化合物1 无色油状物, [α]D20 -72.5 (c 0.20, CHCl3); UV (MeOH) λmax (log ε) 250.0 (2.93) nm; IR (νmax) 3 440、2 959、2 925、2 871、1 727、1 465、1 383、1 260、1 075、1 028、979 cm-1。1H NMR和13C NMR数据见表 1。HR-ESI-MS [M+H]+ m/z: 305.248 1 (计算值305.247 5), 分子式C20H32O2。
已知化合物的旋光值分别为[α][α]D20 +80.3 (c 0.20, CHCl3) (2), [α]D +104.1 (c 0.10, CHCl3) (3), [α]D +67.4 (c 0.35, CHCl3) (4), [α]D +39.7 (c 0.30, CHCl3) (5), [α]D +162.3 (c 0.99, CHCl3) (6), [α]D -27.3 (c 0.35, CHCl3) (7), [α]D -18.7 (c 0.50, CHCl3) (9), [α]D +235.4 (c 0.12, CHCl3) (10), [α]D +54.6 (c 0.30, CHCl3) (11), [α]D +231.2 (c 1.12, CHCl3) (12), [α]D +68.7 (c 0.30, CHCl3) (13), [α]D +238.4 (c 0.18, CHCl3) (14), [α]D +138.5 (c 0.16, CHCl3) (15), [α]D +85.0 (c 0.05, CHCl3) (16), [α]D +112.6 (c 0.15, CHCl3) (17), [α]D +107.8 (c 0.12, CHCl3) (18), [α]D +71.0 (c 0.54, CHCl3) (19), [α]D +148.1 (c 0.43, CHCl3) (20), [α]D +3.0 (c 0.05, CHCl3) (21), [α]D -117.6 (c 0.07, CHCl3) (22), [α]D -130.2 (c 0.36, CHCl3) (23), [α]D -151.8 (c 0.20, CHCl3) (24), [α]D -66.6 (c 0.45, CHCl3) (25), [α]D -293.6 (c 0.17, CHCl3) (26)。
3 计算部分计算遵循DP4+的通用方法[21, 30], 采用Macromodel软件、蒙特卡洛多样优化法(MMCC)、MM2*力场进行构象搜索, 得到的在最低能量为21.0 kJ·mol-1 (5.02 kcal·mol-1) 范围内的所有构象将用于进一步的计算。结构优化选用B3LYP/6-311G(d, p), 然后采用GIAO方法在PCM/mPW1PW91/6-31G*水平上进行屏蔽常数的计算(σ)。计算所采用的软件为Gaussian 09。13C化学位移的计算值如表 2所示。
| Table 2 13C NMR calculations for compound 1 |
用二甲基亚砜(100%) 溶解化合物至浓度为20 mmol·L-1于冰箱冻存备用, 实验时用DMEM高糖培养液稀释至200 μmol·L-1。BV-2细胞经0.25%胰蛋白酶消化后, 重悬于含10% FBS的DMEM高糖培养液中, 以每毫升1.25×104个细胞(每孔100 μL) 接种于96孔板, 置于含5% CO2的37 ℃恒温培养箱内培养24 h后, 将各组的培养液均换成新鲜含10% FBS的DMEM高糖培养液。化合物测试组分别加入相应化合物(每孔10 μL), 正常对照组加入含10%胎牛血清DMEM高糖培养液(每孔10 μL) 继续培养24 h后, 加入5 mg·mL-1 MTT (每孔10 μL), 进行活细胞染色, 采用白藜芦醇作为对照。孵育3 h后, 弃去培养液, 加入DMSO (每孔100 μL) 溶解, 并在摇板机上振摇使之充分溶解, 随后在490 nm的波长下测定OD值。空白组每孔加入100 μL DMSO, 用以下公式计算各组的细胞存活率:
细胞存活率(%) = (OD值化合物测试组 - OD值空白组)/(OD值正常对照组 - OD值空白组) × 100%。
4.2 化合物抗炎活性测试BV-2细胞以每毫升2×105个的密度接种于96孔培养板上(每孔100 μL), 置于含5% CO2的37 ℃恒温培养箱内培养24 h后将各组的培养液均换成新鲜含10%胎牛血清的DMEM高糖培养液。在给药组中加入相应浓度的待测化合物(每孔10 μL), 正常对照组和脂多糖模型组加入含10%胎牛血清DMEM高糖培养液(每孔10 μL)。随后在化合物测试组与脂多糖模型组中分别加入0.001 mg·mL-1的脂多糖(每孔10 μL), 正常对照组加入10 μL含10% FBS的DMEM高糖培养液。继续培养24 h后, 每孔取50 μL上清与50 μL Greiss试剂, 室温反应15 min。在540 nm的波长下测定OD值, 运用一氧化氮的标准曲线计算出各组一氧化氮(NO) 摩尔质量分数, 并进一步计算各加药组的抑制率。计算公式如下:
NO生成抑制率(%) = 1 - w1 ÷ w2 × 100%
w1代表化合物测试组的NO摩尔质量分数, w2代表脂多糖组的NO摩尔质量分数。
致谢: 本文在此感谢海南省重点研发计划项目(ZDYF2021SHFZ107), 国家自然科学基金项目(81991521), 新药研究国家重点实验室项目(SIMM2103ZZ-06) 和农业农村部财政专项项目(NFZX2021) 提供的资金支持。感谢中国科学院上海药物研究所章海燕课题组提供的抗炎生物活性筛选, 特别是其课题组的研究生李旺盛, 进行了抗炎生物活性测试相关实验及其数据整理, 为本文活性部分提供了实验数据支持。
作者贡献: 李金凤负责化合物的分离提取、结构鉴定及初稿的撰写; 姚励功负责实验动物样品的采集; 曾艳波是本文的共同通讯作者, 参与样品的提取、负责核磁谱图分析、稿件修改等工作; 郭跃伟是本文的通讯作者, 负责实验设计及把关, 提供本文思路, 参与稿件修改等工作。
利益冲突: 本文不存在任何利益冲突。
| [1] |
Huang ZG. Species and Distribution of Marine Life in China (中国海洋生物种类与分布)[M]. Beijing: Ocean Press, 2008.
|
| [2] |
Elkhawas YA, Elissawy AM, Elnaggar MS, et al. Chemical diversity in species belonging to soft coral genus Sacrophyton and its impact on biological activity: a review[J]. Mar Drugs, 2020, 18: 41. DOI:10.3390/md18010041 |
| [3] |
Liang LF, Guo YW. Terpenes from the soft corals of the genus Sarcophyton: chemistry and biological activities[J]. Chem Biodivers, 2013, 10: 2161-2196. DOI:10.1002/cbdv.201200122 |
| [4] |
Zhang W, Guo YW, Gu YC. Secondary metabolites from the South China Sea invertebrates: chemistry and biological activity[J]. Curr Med Chem, 2006, 13: 2041-2090. DOI:10.2174/092986706777584960 |
| [5] |
Zhou ZF, Menna M, Cai YS, et al. Polyacetylenes of marine origin: chemistry and bioactivity[J]. Chem Rev, 2015, 115: 1543-1596. DOI:10.1021/cr4006507 |
| [6] |
Jiang CS, Muller Werner EG, Schroder HC, et al. Disulfide- and multisulfide-containing metabolites from marine organisms[J]. Chem Rev, 2012, 112: 2179-2207. DOI:10.1021/cr200173z |
| [7] |
Shen SM, Guo YW, Li XW. A new briarane-type diterpenoid from the South China Sea gorgonian Junceella fragilis[J]. Acta Pharm Sin (药学学报), 2020, 55: 1661-1665. |
| [8] |
Liang LF, Liu HL, Li YF, et al. Review on the secondary metabolites from Xestospongia sponges and their bioactivities[J]. Acta Pharm Sin (药学学报), 2014, 49: 1218-1237. |
| [9] |
Li G, Li H, Tang W, et al. Klyflaccilides A and B, diterpenoids with 6/5/8/3 fused tetracyclic carbon skeleton from the Hainan soft coral Klyxum flaccidum[J]. Org Lett, 2019, 21: 5660-5664. DOI:10.1021/acs.orglett.9b01998 |
| [10] |
Ye F, Zhu ZD, Chen JS, et al. Xishacorenes A-C, diterpenes with bicyclo[3.3.1]nonane nucleus from the Xisha soft coral Sinularia polydactyla[J]. Org Lett, 2017, 19: 4183-4186. DOI:10.1021/acs.orglett.7b01716 |
| [11] |
Li SW, Ye F, Zhu ZD, et al. Cembrane-type diterpenoids from the South China Sea soft coral Sarcophyton mililatensis[J]. Acta Pharm Sin (药学学报), 2018, 53: 944-955. |
| [12] |
Ye F, Li J, Wu Y, et al. Sarinfacetamides A and B, nitrogenous diterpenoids with tricyclo[6.3.1.01, 5]dodecane scaffold from the South China Sea soft coral Sarcophyton infundibuliforme[J]. Org Lett, 2018, 20: 2637-2640. DOI:10.1021/acs.orglett.8b00842 |
| [13] |
Liang LF, Kurtan T, Mandi A, et al. Unprecedented diterpenoids as a PTP1B inhibitor from the Hainan soft coral Sarcophyton trocheliophorum Marenzeller[J]. Org Lett, 2013, 15: 274-277. DOI:10.1021/ol303110d |
| [14] |
Yang M, Li XL, Wang JR, et al. Sarcomililate A, an unusual diterpenoid with tricyclo[11.3.0.02, 16] hexadecane carbon skeleton, and its potential biogenetic precursors from the Hainan soft coral Sarcophyton mililatensis[J]. J Org Chem, 2019, 84: 2568-2576. DOI:10.1021/acs.joc.8b03020 |
| [15] |
Jia R, Kurtan T, Mandi A, et al. Biscembranoids formed from an α, β-unsaturated γ-lactone ring as a dienophile: structure revision and establishment of their absolute configurations using theoretical calculations of electronic circular dichroism spectra[J]. J Org Chem, 2013, 78: 3113-3119. DOI:10.1021/jo400069n |
| [16] |
Shen SM, Li SW, Ding X, et al. Ximaoglaucumins A-F, new cembranoids with anti-inflammatory activities from the South China Sea soft coral Sarcophyton glaucum[J]. Bioorg Med Chem, 2021, 38: 116-139. |
| [17] |
Yao LG, Liu HL, Guo YW, et al. New cembranoids from the Hainan soft coral Sarcophyton glaucum[J]. Helv Chim Acta, 2009, 92: 1085-1091. DOI:10.1002/hlca.200800417 |
| [18] |
Li SW, Cuadrado C, Huan XJ, et al. Rare new bicyclic cembranoid ethers and a novel trihydroxy prenylated guaiane from the Xisha soft coral Lobophytum sp[J]. Bioorg Chem, 2020, 103: 104223. DOI:10.1016/j.bioorg.2020.104223 |
| [19] |
Wu QH, Li H, Yang M, et al. Two new cembrane-type diterpenoids from the Xisha soft coral Lemnalia flava[J]. Fitoterapia, 2019, 134: 481-484. DOI:10.1016/j.fitote.2019.03.018 |
| [20] |
Ye F, Zhu ZD, Gu YC, et al. Further new diterpenoids as PTP1B inhibitors from the Xisha soft coral Sinularia polydactyla[J]. Mar Drugs, 2018, 16: 103. DOI:10.3390/md16040103 |
| [21] |
Li SW, Cuadrado C, Yao LG, et al. Quantum mechanical-NMR-aided configuration and conformation of two unreported macrocycles isolated from the soft coral Lobophytum sp.: energy calculations versus coupling constants[J]. Org Lett, 2020, 22: 4093-4096. DOI:10.1021/acs.orglett.0c01155 |
| [22] |
Chen WT, Liang LF, Li XW, et al. Further new highly oxidative cembranoids from the Hainan soft coral Sarcophyton trocheliophorum[J]. Nat Prod Bioprospect, 2016, 6: 97-102. DOI:10.1007/s13659-016-0088-4 |
| [23] |
Barone G, Gomez-Paloma L, Duca D, et al. Structure validation of natural products by quantum-mechanical GIAO calculations of 13C NMR chemical shifts GIAO=gauge including atomic orbitals[J]. Chen Eur J, 2002, 8: 3233-3239. DOI:10.1002/1521-3765(20020715)8:14<3233::AID-CHEM3233>3.0.CO;2-0 |
| [24] |
Barone G, Duca D, Silvestri A, et al. Determination of the relative stereochemistry of flexible organic compounds by ab initio methods: conformational analysis and Boltzmann-averaged GIAO 13C NMR chemical shifts GIAO=gauge including atomic orbitals[J]. Chem Eur J, 2002, 8: 3240-3245. DOI:10.1002/1521-3765(20020715)8:14<3240::AID-CHEM3240>3.0.CO;2-G |
| [25] |
Smith SG, Goodman JM. Assigning stereochemistry to single diastereoisomers by GIAO NMR calculation: the DP4 probability[J]. J Am Chem Soc, 2010, 132: 12946-12959. DOI:10.1021/ja105035r |
| [26] |
Kutateladeze AG, Reddy DS. High-throughput in silico structure validation and revision of halogenated natural products is enabled by parametric corrections to DFT-computed 13C NMR chemical shifts and spin-spin coupling constants[J]. J Org Chem, 2017, 82: 3368-3381. DOI:10.1021/acs.joc.7b00188 |
| [27] |
Bifulco G, Dambruoso P, Gomez-Paloma L, et al. Determination of relative configuration in organic compounds by NMR spectroscopy and computational methods[J]. Chem Rev, 2007, 107: 3744-3779. DOI:10.1021/cr030733c |
| [28] |
Lodewyk MW, Siebert MR, Tantillo DJ. Computational prediction of 1H and 13C chemical shifts: a useful tool for natural product, mechanistic, and synthetic organic chemistry[J]. Chem Rev, 2012, 112: 1839-1862. DOI:10.1021/cr200106v |
| [29] |
Shepherd ED, Dyson BS, Hak WE, et al. Structure determination of a chloroenyne from Laurencia majuscula using computational methods and total synthesis[J]. J Org Chem, 2019, 84: 4971-4991. DOI:10.1021/acs.joc.8b02975 |
| [30] |
Sun LL, Li SW, Li J, et al. Uncommon diterpenoids from the South China Sea soft coral Sinularia humilis and their stereochemistry[J]. J Org Chem, 2021, 86: 3367-3376. DOI:10.1021/acs.joc.0c02742 |
| [31] |
Bowden BF, Coll J, Hicks W, et al. Studies of australian soft corals. X*: The isolation of epoxyisoneocembrene-A from Sinularia grayi and isoneocembrene-A from Sarcophyton ehrenbergi[J]. Aust J Chem, 1978, 31: 2707-2712. DOI:10.1071/CH9782707 |
| [32] |
Bowden BF, Coll J, Tapiolas D. Studies of Australian soft corals. XXXⅢ: New cembranoid diterpenes from a Lobophytum species[J]. Aust J Chem, 1983, 36: 2289-2295. DOI:10.1071/CH9832289 |
| [33] |
Cao F, Zhou J, Xu KX, et al. New cembranoid diterpene from the South China Sea soft coral Sarcophyton sp.[J]. Nat Prod Commun, 2013, 8: 1675-1678. |
| [34] |
Kobayashi M, Nakagawa T, Mitsuhashi H. Marine terpenes and terpenoids. I. Structures of four cembrane-type diterpenes: sarcophytol-A, sarcophytol-A acetate sarcophytol-B, and sarcophytonin-A, from the soft coral Sarcophyton glaucum[J]. Chem Pharm Bull, 1979, 27: 2382-2387. DOI:10.1248/cpb.27.2382 |
| [35] |
Kobayashi M, Iesaka T, Nakano E. Marine terpenes and terpeoids. IX.: Structures of six new cembranoids, sarcophytols F, K, P, Q, R and S, from the soft coral Sarcophyton glaucum[J]. Chem Pharm Bull, 1989, 37: 2053-2057. DOI:10.1248/cpb.37.2053 |
| [36] |
Kobayashi M, Osabe K. Marine terpenes and terpenoids. VⅡ.: Minor cembranoid derivatives, structurally related to the potent anti-tumor-promoter sarcophytol A, from the soft coral Sarcophyton glaucum[J]. Chem Pharm Bull, 1989, 37: 631-636. DOI:10.1248/cpb.37.631 |
| [37] |
Peniston M, Rodriguez AD. The isolation of (-)-sarcophytol A and (+)-marasol from the Caribbean gorgonian Plexaura flexuosa[J]. J Nat Prod, 1991, 54: 1009-1016. DOI:10.1021/np50076a014 |
| [38] |
Bowden BF, Coll JC, Heaton A, et al. The structures of four isomeric dihydrofuran-containing cembranoid diterpenes from several species of soft coral[J]. J Nat Prod, 1987, 50: 650-659. DOI:10.1021/np50052a013 |
| [39] |
Cuong NX, Tuan TA, Kiem PV, et al. New cembranoid diterpenes from the Vietnamese soft coral Sarcophyton mililatensis stimulate osteoblastic differentiation in MC3T3-E1 cells[J]. Chem Pharm Bull, 2008, 56: 988-992. DOI:10.1248/cpb.56.988 |
| [40] |
Lin ST, Wang SK, Duh CY. Cembranoids from the dongsha atoll soft coral Lobophytum crassum[J]. Mar Drugs, 2011, 9: 2705-2716. DOI:10.3390/md9122705 |
| [41] |
Yamada K, Ryu K, Miyamoto T, et al. Bioactive terpenoids from octocorallia. 4. Three new cembrane-type diterpenoids from the soft coral Lobophytum schoedei[J]. J Nat Prod, 1997, 60: 798-801. DOI:10.1021/np960728m |
| [42] |
El-Sayed KA, Hamann MT, Waddling CA, et al. Structurally novel bioconversion products of the marine natural product sarcophine effectively inhibit JB6 cell transformation[J]. J Org Chem, 1998, 63: 7449-7455. DOI:10.1021/jo9813134 |
| [43] |
Hegazy MEF, Mohamed TA, Abdel-Latif FF, et al. Trochelioid A and B, new cembranoid diterpenes from the Red Sea soft coral Sarcophyton trocheliophorum[J]. Phytochem Lett, 2013, 6: 383-386. DOI:10.1016/j.phytol.2013.05.005 |
| [44] |
Shaaban M, El-Hagrassi AM, Abdelghani MA, et al. Diverse bioactive compounds from Sarcophtyton glaucom: structure elucidation and cytotoxic activity studies[J]. Zeitschrift fur Naturforschung C, 2018, 73: 325-334. DOI:10.1515/znc-2017-0106 |
| [45] |
Grote D, Soliman HSM, Shaker KH, et al. Cembranoid diterpenes and a briarane diterpene from corals[J]. Nat Prod Res, 2006, 20: 285-291. DOI:10.1080/14786410500087657 |
| [46] |
Kobayashi M, Nakano E. Stereochemical course of the transannular cyclization, in chloroform, of epoxycembranoids derived from the geometrical isomers of (14S)-14-hydroxy-1, 3, 7, 11-cembratetraenes[J]. J Org Chem, 1990, 55: 1947-1951. DOI:10.1021/jo00293a049 |
| [47] |
Kobayashi M, Osabe K. Marine terpenes and terpenoids. VⅢ.: Transannular cyclization of 3, 4-epoxy-1, 7, 11-cembratriene systems[J]. Chem Pharm Bull, 1989, 37: 1192-1196. DOI:10.1248/cpb.37.1192 |
| [48] |
Liu Z, Cheng W, Liu D, et al. Capnosane-type cembranoids from the soft coral Sarcophyton trocheliophorum with antibacterial effects[J]. Tetrahedron, 2014, 70: 8703-8713. DOI:10.1016/j.tet.2014.09.034 |
 2022, Vol. 57
2022, Vol. 57


