目前, 人脑胶质瘤已成为最具致病性、最常见的成人脑恶性肿瘤之一, 是最常见的原发性中枢神经系统肿瘤, 多数患者预后较差, 放化疗联合只能使患者生存时间延长2~4个月[1-3]。最有效的治疗方法是最大限度切除、化疗和放疗, 但存活时间仍只有15个月。人脑胶质瘤具有发病率高、复发率高和局部侵袭等特点, 并受到多种因素的调控[4-6]。替莫唑胺(TMZ) 是治疗人脑胶质瘤的一线化疗药物, 其口服的生物利用度接近100%, 并且容易通过血脑屏障。TMZ主要通过DNA甲基化和干扰错配修复机制发挥抗肿瘤作用, 但随着治疗时间的延长容易产生耐药性与其他不良反应, 疗效逐渐降低[7]。
免疫治疗作为一种新的肿瘤治疗方法, 可以通过激活和恢复癌症患者天然的免疫系统来识别和清除肿瘤细胞, 具有广阔的发展前景。肿瘤的免疫治疗主要包括逆转肿瘤免疫逃逸和靶向杀伤肿瘤细胞。最新研究表明, 色氨酸(Trp) 分解代谢产生犬尿氨酸(Kyn) 这一途径在脑胶质瘤的发病机制中具有重要作用[8-12], 在肿瘤细胞中Kyn的积累以及Trp的不断消耗会造成效应T细胞(Teff) 以及自然杀伤细胞(NK) 的抑制, 激活了调节性T细胞(Treg), 导致肿瘤微环境产生免疫抑制作用, 促进肿瘤免疫逃逸[13]。研究表明, 吲哚胺2, 3-双加氧酶1 (IDO1)、吲哚胺2, 3-双加氧酶2 (IDO2) 和色氨酸2, 3-双加氧酶(TDO) 启动犬尿氨酸途径是一种肿瘤免疫逃逸的新机制, 其抑制剂已经成为癌症免疫治疗的新策略[14-16]。
IDO在多种人类癌症中表达, 如恶性黑色素瘤、卵巢癌和结直肠癌, 并且IDO表达水平在临床上与不良临床结果及肿瘤进展相关[17-19]。IDO的表达导致Trp的局部消耗和具有毒性的Trp分解代谢物的积累, 会使Teff或NK细胞凋亡和生长停滞[20-22]。已有报道认为, 人类胶质母细胞组织中IDO高表达, 并且在继发性胶质母细胞瘤中IDO的表达增加[23]。在一些其他癌症中, 研究报告也同样指出IDO抑制具有抗肿瘤作用[24-26]。NLG-919是一种咪唑异吲哚, 被证明是有效的IDO1抑制剂, 可阻断IDO1介导的免疫抑制途径并导致免疫激活, 显示出Teff的剂量依赖性激活和增殖, 使已建立的肿瘤显著消退[27]。目前, NLG-919对晚期实体瘤的治疗研究进展已进入临床I期[28]。本研究通过将IDO1抑制剂NLG-919与替莫唑胺联合使用探究其对人脑胶质瘤的治疗效果, 旨在为脑胶质瘤患者治疗提供新的治疗思路。
材料与方法细胞 人脑胶质瘤细胞株U251、U87, 购买于上海ATCC细胞库。
药物 IDO1抑制剂NLG-919 (成都海品信医药有限公司), 替莫唑胺(上海迈瑞尔化学技术有限公司, 批号: 85622-9391)。
试剂与仪器 DMEM培养基、RPMI-1640培养基、胰酶、PBS缓冲液、多聚甲醛溶液、细胞通透液Triton-100、细胞凋亡检测试剂盒(Annexin V-FITC/PI)、细胞周期检测试剂盒(RNase A/PI)、活性氧荧光探针(DCFH-DA)、线粒体膜电位检测试剂盒(JC-1)、4', 6-二脒基-2-苯基吲哚(DAPI) 以及溴化四氮唑蓝(MTT) 购自江苏凯基生物技术有限公司; 胎牛血清购自杭州四季青生物技术有限公司; 二甲基亚砜(DMSO) 购自阿拉丁试剂公司。
给药方法 将对数生长期的U251和U87细胞收集起来, 离心后用DMEM完全培养基(DMEM不完全培养基∶胎牛血清= 10∶1) 重悬并将其接种于6孔板中且每孔细胞数约为2×105个, 等细胞完全贴壁后, 移除培养基并用PBS洗涤3次后加入新的含药培养基。阴性对照组不加入任何药物, 将30 μmol·L-1 NLG-919和30 μmol·L-1 TMZ分别加入U251和U87细胞中, 联合给药组分别加入两种药物各30 μmol·L-1, 后进行细胞凋亡、细胞周期阻滞、活性氧产生、线粒体膜电位下降检测和免疫荧光实验; 将15 μmol·L-1 NLG-919和15 μmol·L-1 TMZ分别加入U251和U87细胞中, 联合给药组分别加入两种药物各15 μmol·L-1后进行集落形成实验、迁移和侵袭实验。
MTT法测定药物对肿瘤细胞的增殖抑制作用 将处于对数生长期的细胞收集起来并加入一定量的完全培养基稀释成为每毫升含4×104个的细胞悬液, 后接种在96孔板内并在37 ℃的条件下培养24 h, 等细胞完全贴壁后吸出培养基并加入新的培养基。将药物稀释成5个不同浓度依次加入孔内, 每组浓度药物设置3个平行对照实验组, 每孔体积均为100 μL, 培养72 h后每孔加入5 mg·mL-1的MTT溶液10 μL, 作用4 h后吸出培养基和药物并在每个孔内加入DMSO 130 μL。放在摇床上孵育10 min后在吸光度为490 nm的条件下用酶标仪测出每个孔的A值, 利用SPSS18软件计算出半数抑制浓度(IC50) 值, 其抑制率的计算方法: 抑制率= (A对照组 - A给药组)/A空白组。以上实验重复3次。
采用联合作用指数(combined index, CI) 判断两种药物的协同性, CI计算方法: CI = DA/ICX, A + DB/ICX, B (A和B代表两种不同药物, ICX, A和ICX, B是两种药物单独使用使生长抑制率达X时的药物浓度, DA和DB是两药联合使用使生长抑制率达X时两种药物的浓度), 0.9 ≤ CI ≤ 1.1为叠加作用, 0.8 ≤ CI < 0.9为低度协同作用, 0.6 ≤ CI < 0.8为中度协同作用, 0.4 ≤ CI < 0.6为高度协同作用, 0.2 ≤ CI < 0.4为强协同作用。
脑胶质瘤细胞集落形成实验 将对数生长期的U251和U87细胞消化后收集并稀释为每毫升1×104个的细胞悬液接种于6孔板中, 待贴壁后给药, 在37 ℃和5% CO2的条件下培养2周。当大多数的克隆细胞数多于50个时停止, 吸去培养基, PBS洗涤3次, 加入4%的多聚甲醛固定20 min。洗去固定液, 每孔加入2 mL结晶紫溶液染色15 min, 吸去并洗涤3次, 在空气中干燥24 h后可进行拍照并计算细胞克隆形成率。
脑胶质瘤细胞迁移和侵袭实验 接种后的细胞长满整个孔后吸出培养基, 然后用统一规格的10 μL枪头在孔内划出3道平行的直线凹槽, 并且保证宽度相同, 用PBS洗去脱落的细胞, 加入新的培养基和药物培养24 h后拍照并计算细胞的迁移抑制率, 迁移抑制率= (1 - 实验组迁移细胞数/对照组迁移细胞数) × 100%。
将对数生长期的U251和U87细胞消化后收集并用不含胎牛血清的DMEM不完全培养基稀释为每毫升1×104个的细胞悬液, 均匀分散于侵袭小室内, 分别加入15 μmol·L-1 NLG-919、TMZ以及两种药物联合给药, 同时在侵袭小室下层加入完全培养基诱导侵袭。等待细胞侵袭完成后, 取出侵袭小室并用棉球擦去侵袭小室上表皮细胞, 用0.1%结晶紫对侵袭小室染色20 min, 在白光显微镜下拍照获取侵袭图像, 侵袭抑制率= (1 - 实验组侵袭细胞数/对照组侵袭细胞数) × 100%。
细胞凋亡实验 给药处理后的细胞重悬于500 μL的缓冲液, 并加入Annexin V-FITC和PI各5 μL染色20 min, 通过流式细胞仪检测两种细胞的凋亡率。
细胞周期阻滞实验 给药处理后的细胞重悬于500 μL的75%冰乙醇中, 放置于-20 ℃条件下固定12 h。以1 500 r·min-1的转速离心5 min后倒掉上清液, 按照体积比为1∶9加入RNase A与PI染液共500 μL, 避光染色20 min, 流式细胞仪检测细胞周期。
活性氧 (ROS) 产生检测实验 给药处理后的细胞重悬于缓冲液中并加入DCFH-DA染色20 min后用流式细胞仪检测ROS产生的水平。
线粒体膜电位 (JC-1) 检测实验 给药处理后的细胞重悬于缓冲液中, 并加入JC-1探针染色20 min, 流式细胞仪对线粒体膜电位下降程度进行测定。
免疫荧光实验 接种于培养皿的细胞经过给药处理后加入4%多聚甲醛溶液对细胞进行固定, 20 min后移去固定液并加入浓度为0.5%的细胞通透液Triton-100对细胞进行透化, 20 min后移去通透液并用PBS清洗3次, 加入质量分数为5%的脱脂牛奶封闭1 h, 在4 ℃下与相应的一抗孵育过夜, 随后与相应的二抗在37 ℃下孵育2 h, DAPI染色10 min后通过荧光共聚焦显微镜进行成像。
高效液相 (HPLC) 测定Kyn表达 给药处理后的细胞加入20%的三氯乙酸孵育30 min, 进行蛋白质沉淀。孵育结束后再次以13 000 r·min-1的转速离心30 min, 收集上清液用于Trp和Kyn的检测。HPLC的检测条件: 流动相为乙腈和水(乙腈∶水= 60∶40), 流速为1.0 mL·min-1, 检测的波长为254 nm。
统计学方法 本研究通过SPSS16.0软件进行统计学分析, 不同的数据资料表达方式如: 剂量数据为(x±s), 两组间比较用独立样本t检验, 多组间比较采用单因素方差分析, 当P < 0.05时, 组间的差异显著, 数据差异有意义。
结果 1 NLG-919与TMZ联用对人脑胶质瘤U251和U87细胞生长抑制的影响采用MTT法测定NLG-919和替莫唑胺单独及联合使用对人肿瘤细胞U251和U87的体外作用。图 1显示应用5、10、20、30和40 μmol·L-1 TMZ处理U87细胞和U251细胞72 h后, 细胞增殖抑制率增加, 从中可以发现TMZ浓度超过30 μmol·L-1后再升高其浓度, 两种胶质瘤细胞的抑制率升高不明显, 故联合用药浓度选择30 μmol·L-1。应用同种浓度梯度的NLG-919处理U87和U251细胞72 h后, 细胞增殖抑制率增加, 结果提示, NLG-919浓度超过30 μmol·L-1后再升高其浓度, 两种胶质瘤细胞的抑制率升高不明显, 故联合用药浓度同样选择30 μmol·L-1。

|
Figure 1 Effects of different concentrations of temozolomide (TMZ, 5, 10, 20, 30 and 40 μmol·L-1) and NLG-919 (5, 10, 20, 30 and 40 μmol·L-1) for 72 h on the inhibitory rate of proliferation of U87 and U251 cells. n = 3, x±s |
表 1结果显示, 在药物作用72 h后, 两种药物均能抑制U251和U87细胞的增殖, 替莫唑胺对两种细胞系的细胞毒性均优于NLG-919, 且两种药物联合使用较TMZ单独使用对U87细胞和U251细胞的半数抑制浓度(IC50) 值分别由(10.9 ± 0.98) μmol·L-1和(6.192 ± 0.52) μmol·L-1降低至(3.798 ± 0.26) μmol·L-1和(3.111 ± 0.18) μmol·L-1, 说明NLG-919与替莫唑胺联合使用具有较好的协同作用。
| Table 1 The in vitro cytotoxicity evaluation of the selected drugs to human glioma cells for 72 h. n = 3, x±s |
通过联合作用指数(combined index, CI) 判断两种药物的协同性。在U87细胞中, NLG-919与TMZ的CI指数为0.617 ± 0.023, 为中度协同作用; 在U251细胞, NLG-919与TMZ的CI指数为0.471 ± 0.016, 为高度协同作用, 表明NLG-919与TMZ对人脑胶质瘤的抑制作用并非叠加作用, 而呈现协同效应。
2 NLG-919与TMZ联用对人脑胶质瘤U251和U87细胞增殖能力的影响以平板克隆形成法观察NLG-919与替莫唑胺单独或联合使用对体外细胞增殖的作用来判断药物的体外抗肿瘤活性。结果显示, 集落形成实验结果与细胞生长抑制结果一致, 这两种药物均可以有效抑制U251和U87细胞的增殖, 与单独使用TMZ相比, 联合用药显示出更有效的抑制作用, 表明NLG-919与TMZ具有协同抑制胶质瘤增殖的作用(图 2)。
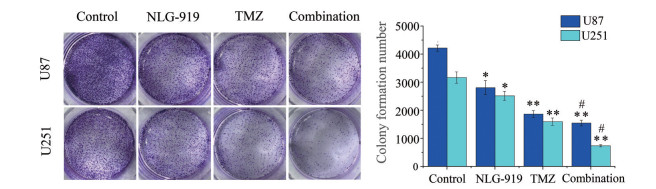
|
Figure 2 Effects of NLG-919 and TMZ on proliferation of human glioma U251 and U87 cells. Colony formations of U251 and U87 cells were analyzed in comparison with NLG-919, TMZ and the combinational treatment after incubation for 14 days (NLG-919 eq·dose 15 μmol·L-1, TMZ eq·dose 15 μmol·L-1). n = 3, x±s. *P < 0.05, **P < 0.01 vs control; #P < 0.05 vs TMZ-treated groups |
实验结果显示, 与单独使用TMZ相比, NLG-919与TMZ联用组对U251细胞和U87细胞的迁移能力具有更明显的抑制作用(图 3A)。此外, 两种胶质瘤细胞侵袭到Transwell小室另一侧的数量明显降低(图 3B), 表明两种药物联用对胶质瘤细胞的迁移和侵袭能力的抑制作用最强(P < 0.05), 实验表明NLG-919协同TMZ抑制U87和U251细胞的侵袭和转移能力(P < 0.05)。

|
Figure 3 Inhibition of migration and invasion of human glioma U251 and U87 cells by NLG-919 and TMZ. A: Migration abilities of U251 and U87 cells were analyzed in comparison with NLG-919, TMZ and the combinational treatment after incubation for 24 h (NLG-919 eq·dose 15 μmol·L-1, TMZ eq·dose 15 μmol·L-1); B: Invasion abilities of U251 and U87 cells were analyzed in comparison with NLG-919, TMZ and the combinational treatment after incubation for 24 h (NLG-919 eq·dose 15 μmol·L-1, TMZ eq·dose 15 μmol·L-1). n = 3, x±s. #P < 0.05, ##P < 0.01 vs TMZ-treated groups |
为了更好地探究MTT实验中观察到的联合抗增殖活性的潜在机制, 将TMZ和NLG-919两种药物单独或联合作用于U87细胞和U251细胞, 并通过流式细胞术进行FITC/PI染色来量化凋亡细胞的百分比, 如图 4所示, 在U87细胞中联合给药处理24 h后诱导凋亡细胞百分比增加: 对照组为2.932% ± 0.04%, TMZ实验组为29.86% ± 1.02%, NLG-919实验组为14.19% ± 1.15%, TMZ和NLG-919联用为44.42% ± 2.28%; 在U251细胞中联合给药处理24 h后诱导凋亡细胞百分比增加: 对照组为2.221% ± 0.02%, TMZ实验组为35.7% ± 1.79%, NLG-919实验组为20.53% ± 1.59%, TMZ和NLG-919联用为42.4% ± 1.98%。值得注意的是, 在两种胶质瘤细胞中, 与单独使用TMZ作用相比, 联合治疗显著诱导胶质瘤细胞凋亡(P < 0.05)。实验表明NLG-919与TMZ联用相较于单独用药, 具有更有效的诱导人脑胶质瘤凋亡作用。
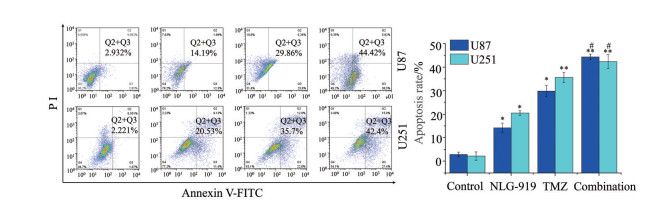
|
Figure 4 Effects of NLG-919 and TMZ on apoptosis of human glioma U251 and U87 cells. U251 and U87 cells were analyzed in comparison with NLG-919, TMZ and the combinational treatment after incubation for 24 h (NLG-919 eq·dose 30 μmol·L-1, TMZ eq·dose 30 μmol·L-1). U251 and U87 cells were resuspended in a 500 μL 1 × buffer and stained with Annexin V-FITC and PI 5 μL each for 20 min. The cells were detected by flow cytometry. n = 3, x±s. *P < 0.05, **P < 0.01 vs control; #P < 0.05 vs TMZ-treated groups |
为了研究联合用药在胶质瘤细胞中的抗增殖机制, 本研究检测了不同给药组对胶质瘤细胞周期的影响。如图 5所示, 在U87细胞中, 对照组的G2-M期细胞百分比为30.58% ± 2.23%, 在NLG-919给药过后, G2-M期细胞百分比为70.48% ± 1.08%, 明显提高(P < 0.01), 表明NLG-919可以在U87细胞中将细胞周期阻滞在G2-M期, 且效果要优于单独使用TMZ, 然而当NLG-919与TMZ联用后对于细胞的周期阻滞并未有明显提高。在U251细胞中, 对照组的G0-G1期细胞百分比为8.23% ± 0.14%, NLG-919与TMZ联用组的G0-G1期细胞百分比明显增加, 达到71.29% ± 2.89%, 且优于单独使用TMZ (P < 0.05), 表明在U251细胞中, 二者联用通过将细胞周期阻滞于G0-G1期, 从而抑制细胞生长。

|
Figure 5 Effects of NLG-919 and TMZ on cell cycle distribution in human glioma U251 and U87. U251 and U87 cells were analyzed in comparison with NLG-919, TMZ and the combinational treatment after incubation for 24 h (NLG-919 eq·dose 30 μmol·L-1, TMZ eq·dose 30 μmol·L-1). U251 and U87 cells were resuspend in a 500 μL mixed solution (RNaseA∶PI = 1∶9), and the cell cycle was detected by flow cytometer; data were analyzed using ModFit LT 3.3 software. n = 3, x±s. *P < 0.05, **P < 0.01 vs control; #P < 0.05 vs TMZ-treated groups |
ROS与许多人类疾病有关(包括肿瘤在内), 是化疗药物起作用的前提条件[29-31], 当药物进入细胞发生作用时, 细胞内的谷胱甘肽(GSH) 会与药物结合, 导致细胞内氧化还原失去平衡, 诱导ROS的产生, 造成氧化应激, 过量的ROS会造成细胞的损伤。如图 6所示, 与对照组和单独用药组相比, 联用NLG-919与TMZ可以诱导大量的ROS累积, 展现出更强的抗肿瘤作用。

|
Figure 6 Effects of NLG-919 and TMZ on ROS in human glioma U251 and U87 cells. U251 and U87 cells were analyzed in comparison with NLG-919, TMZ and the combinational treatment after incubation for 24 h (NLG-919 eq·dose 30 μmol·L-1, TMZ eq·dose 30 μmol·L-1). U251 and U87 cells were resuspended in buffer and stained with H2DCFDA (DCFH-DA). The level of ROS production was detected by flow cytometry. n = 3, x±s. *P < 0.05, **P < 0.01 vs control; #P < 0.05, ##P < 0.01 vs TMZ-treated groups |
ROS的提高通常伴随着线粒体膜电位损伤, 线粒体也是ROS产生的主要场所。ROS的累积会对线粒体的主要蛋白造成严重的氧化损伤, 进而诱导细胞凋亡, 因此线粒体膜电位的下降是药物作用导致肿瘤细胞早期凋亡的重要标志[32]。如图 7所示, 本研究通过对线粒体膜电位检测发现, 在U251和U87细胞中, 联合使用后可以显著降低线粒体膜电位。与单一使用TMZ相比, 联合用药可以使线粒体膜电位下降程度分别提升到7.0% (P < 0.01)和10.2% (P < 0.01)。

|
Figure 7 Effects of NLG-919 and TMZ on mitochondrial membrane potential in human glioma U251 and U87 cells. U251 and U87 cells were analyzed in comparison with NLG-919, TMZ and the combinational treatment after incubation for 24 h (NLG-919 eq·dose 30 μmol·L-1, TMZ eq·dose 30 μmol·L-1). U251 and U87 cells were resuspended in 1 × buffer and stained by adding JC-1 probe. The decrease degree of mitochondrial membrane potential was measured by flow cytometry. n = 3, x±s. *P < 0.05, **P < 0.01 vs control; ##P < 0.01 vs TMZ-treated groups |
研究表明, IDO1在人脑胶质瘤组织中高表达, 并且在恶性转化的继发性胶质母细胞瘤组织中表达增加。由于NLG-919是IDO1抑制剂, 因此通过免疫荧光实验进一步检测两种胶质瘤细胞中IDO1的表达, 如图 8所示, NLG-919抑制了U251细胞和U87细胞中IDO1的表达, TMZ的影响弱于NLG-919, 当两种药物联合使用后, 可以抑制IDO1的表达。
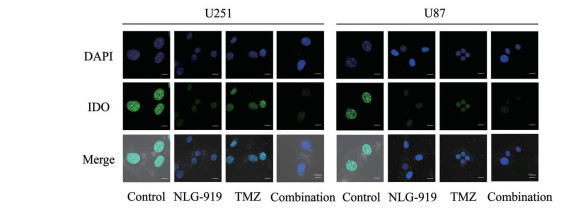
|
Figure 8 Representative results showing the IDO1 expression in human glioma cells after treatment with NLG-919 (30 μmol·L-1) and TMZ (30 μmol·L-1) for 24 h. The scale bar represents 50 μm. Immunofluorescence images were captured by magnification in a 40-fold confocal microscope |
IDO1的高表达会导致具有毒性的Trp分解代谢物Kyn的不断增多, 该产物的积累会使同种反应性T细胞或自然杀伤细胞的凋亡和生长停滞。当IDO1的表达和活性被抑制后, Kyn的产生也将得到抑制。本研究通过高效液相色谱仪检测人脑胶质瘤细胞中Kyn和Trp的表达水平。实验结果如图 9所示, 在U87细胞和U251细胞中, 与空白组相比, NLG-919能够有效地抑制Kyn的产生, 导致Trp的水平明显提高, 这一结果与IDO1的表达水平有关, 表明通过抑制IDO1的表达和活性可以更好地阻断Trp代谢产生Kyn, 进一步验证NLG-919可以有效地抑制IDO1的表达和活性。

|
Figure 9 High performance liquid chromatography (HPLC) determination. NLG-919 could effectively down-regulate the expression level of L-kynurenine (Kyn) in glioma cells. The mobile phase consisted of acetonitrile and water (acetonitrile∶water = 60∶40), the flow rate was 1.0 mL·min-1, and the detection wavelength was 254 nm |
目前, 恶性胶质瘤作为原发性的脑肿瘤是最致命的癌症形式之一, 主要治疗方式为手术切除、放疗和化疗, 但新确诊患者的死亡率仍旧很高。随着病情的加重, 患者可能出现颅内压力升高以及神经功能障碍, 癌细胞的生长具有浸润性和侵袭性, 影响周边组织的正常功能。TMZ作为治疗脑胶质瘤的一线化疗药物, 具有较高的细胞杀伤力, 但对TMZ敏感的肿瘤细胞也会随着化疗的进行逐渐产生获得性耐药, 这严重地影响术后的化疗效果。新的研究表明, 犬尿氨酸途径是产生Kyn的L-Trp分解代谢的主要途径, 在胶质瘤的发病机制中发挥着重要的作用。NLG-919是一种咪唑异吲哚, 它可阻断IDO1介导的免疫抑制途径并导致免疫激活, 并可以使效应T细胞的剂量依赖性激活和增殖, 从而达到抑制肿瘤的效果, NLG-919作为新型的IDO1抑制剂与TMZ联用具有较好的协同作用, 其机制可能涉及: ① NLG-919能通过诱导ROS的产生对线粒体进行氧化损伤, 从而诱导细胞凋亡, 增强化疗药物TMZ的疗效比率; ② Kyn/Trp与胶质瘤的病理分级呈正相关[33]。NLG-919作为新型IDO1抑制剂, 通过阻断犬尿氨酸途径, 减少L-Trp的消耗及Kyn的积累, 逆转肿瘤免疫逃逸, 延长了人脑胶质瘤患者的存活时间。
本研究初步表明, NLG-919与TMZ联用后具有更高的人脑胶质瘤细胞抑制作用, 能够协同抑制肿瘤细胞的增殖、迁移和侵袭。NLG-919与TMZ联用可以诱导人脑胶质瘤细胞的周期阻滞, 同时诱导ROS的产生以及线粒体膜电位的降低来共同促进肿瘤细胞的凋亡, 此外, 两者联用对IDO1具有较好的抑制作用。IDO1可能是一种较可靠的人脑胶质瘤患者预后指标, 并且是恶性胶质瘤的重要治疗靶点之一。关于两者联合用药来逆转TMZ耐药及其机制作用, 将成为本课题组日后研究的重点。
综上所述, NLG-919能够提高替莫唑胺的抗肿瘤作用, 两者能够更好地发挥协同抗肿瘤治疗效果, 两种药物联用为人脑胶质瘤的治疗提供了较好的临床治疗和研究基础。
作者贡献: 田文源负责实验研究、论文撰写和论文修改; 陈飞虹负责实验设计、论文撰写和论文修改。
利益冲突: 本文作者声明无利益冲突。
| [1] |
Herbert S, Walter S. 5‐ALA in the management of malignant glioma[J]. Laser Surg Med, 2018, 50: 399-419. DOI:10.1002/lsm.22933 |
| [2] |
Gaelle T, Konstantin M, Pierre R, et al. Prognostic significance of MEOX2 in gliomas[J]. Modern Pathol, 2019, 32: 774-786. DOI:10.1038/s41379-018-0192-6 |
| [3] |
Xu B, Li AQ, Jiang GF. Research progress of glioma cell origin[J]. Chin J Pathophysiol (中国病理生理杂志), 2018, 34: 566-571. |
| [4] |
Tanja E, Barbara C, Jens S, et al. An advanced glioma cell invasion assay based on organotypic brain slice cultures[J]. BMC Cancer, 2018, 18: 103. DOI:10.1186/s12885-018-4007-4 |
| [5] |
Mehta S, Lo CC. Developmentally regulated signaling pathways in glioma invasion[J]. Cell Mol Life Sci, 2018, 75: 385-402. DOI:10.1007/s00018-017-2608-8 |
| [6] |
Ostrom QT, Bauchet L, Davis F, et al. The epidemiology of glioma in adults: a "state of the science" review[J]. Neuro Oncol, 2014, 16: 896-913. DOI:10.1093/neuonc/nou087 |
| [7] |
Pu B, Gao JJ. Influences of temozolomide combined with radiation therapy in VEGF and IL-8 expressions of glioma patients[J]. Genomics Applied Biol (基因组学与应用生物学), 2016, 35: 3285-3291. |
| [8] |
Adams S, Braidy N, Bessede A, et al. The kynurenine pathway in brain tumor pathogenesis[J]. Cancer Res, 2012, 72: 5649-5657. DOI:10.1158/0008-5472.CAN-12-0549 |
| [9] |
Adams S, Charles T, Kerrie L, et al. Involvement of the kynurenine pathway in human glioma pathophysiology[J]. PLoS One, 2014, 9: e112945. DOI:10.1371/journal.pone.0112945 |
| [10] |
Batista CE, Csaba J, Otto M, et al. Imaging correlates of differential expression of indoleamine 2, 3-dioxygenase in human brain tumors[J]. Mol Imaging Biol, 2009, 11: 460-466. DOI:10.1007/s11307-009-0225-0 |
| [11] |
Guastella AR, Michelhaugh SK, Klinger NV, et al. Tryptophan PET imaging of the kynurenine pathway in patient-derived xenograft models of glioblastoma[J]. Mol Imaging, 2016, 15: 1536012116644881. |
| [12] |
Zhai LJ, Lauing KL, Chang AL, et al. The role of IDO in brain tumor immunotherapy[J]. Neurooncol, 2015, 123: 395-403. DOI:10.1007/s11060-014-1687-8 |
| [13] |
Qian S, Zhang M, Chen QL, et al. IDO as a drug target for cancer immunotherapy: recent developments in IDO inhibitors discovery[J]. RSC Adv, 2016, 6: 7575-7581. DOI:10.1039/C5RA25046C |
| [14] |
Holmgaard RB, Dmitrity Z, Yanyun L, et al. Tumor-expressed IDO recruits and activates MDSCs in a Treg-dependent manner[J]. Cell Rep, 2015, 13: 412-424. DOI:10.1016/j.celrep.2015.08.077 |
| [15] |
Opitz CA, Litzenburger UM, Sahm F, et al. An endogenous tumour-promoting ligand of the human aryl hydrocarbon receptor[J]. Nature, 2011, 478: 197-203. DOI:10.1038/nature10491 |
| [16] |
Pilotte L, Pierre L, Vincent S, et al. Reversal of tumoral immune resistance by inhibition of tryptophan 2, 3-dioxygenase[J]. Proc Natl Acad Sci U S A, 2012, 109: 2497-2502. DOI:10.1073/pnas.1113873109 |
| [17] |
Riesenberg R, Weiler C, Spring O, et al. Expression of indoleamine 2, 3-dioxygenase in tumor endothelial cells correlates with long-term survival of patients with renal cell carcinoma[J]. Clin Cancer Res, 2007, 13: 6993-7002. DOI:10.1158/1078-0432.CCR-07-0942 |
| [18] |
Takao M, Okamoto A, Nikaido T, et al. Increased synthesis of indoleamine-2, 3-dioxygenase protein is positively associated with impaired survival in patients with serous-type, but not with other types of ovarian cancer[J]. Oncol Rep, 2007, 17: 1333-1339. |
| [19] |
Urakawa H, Nishida Y, Nakashima H, et al. Prognostic value of indoleamine 2, 3-dioxygenase expression in high grade osteosarcoma[J]. Clin Exp Metastasis, 2009, 26: 1005-1012. DOI:10.1007/s10585-009-9290-7 |
| [20] |
Della Chiesa M, Carlomagno S, Frumento G, et al. The tryptophan catabolite L-kynurenine inhibits the surface expression of NKp46- and NKG2D- activating receptors and regulates NK-cell function[J]. Blood, 2006, 108: 4118-4125. |
| [21] |
Lee GK, Park HJ, Macleod M, et al. Tryptophan deprivation sensitizes activated T cells to apoptosis prior to cell division[J]. Immunology, 2002, 107: 452-460. DOI:10.1046/j.1365-2567.2002.01526.x |
| [22] |
Munn DH, Shafizadeh E, Attwood JT, et al. Inhibition of T cell proliferation by macrophage tryptophan catabolism[J]. J Exp Med, 1999, 189: 1363-1372. DOI:10.1084/jem.189.9.1363 |
| [23] |
Mitsuka K, Kawataki T, Satoh E, et al. Expression of indoleamine 2, 3-dioxygenase and correlation with pathological malignancy in gliomas[J]. Neurosurgery, 2013, 72: 1031-1038. DOI:10.1227/NEU.0b013e31828cf945 |
| [24] |
Hou DY, Muller AJ, Sharma MD, et al. Inhibition of indoleamine 2, 3-dioxygenase in dendritic cells by stereoisomers of L-methyl-tryptophan correlates with antitumor responses[J]. Cancer Res, 2007, 67: 792-801. DOI:10.1158/0008-5472.CAN-06-2925 |
| [25] |
Muller AJ, DuHadaway JB, Donover PS, et al. Inhibition of indoleamine 2, 3-dioxygenase, an immunoregulatory target of the cancer suppression gene Bin1, potentiates cancer chemotherapy[J]. Nat Med, 2005, 11: 312-319. DOI:10.1038/nm1196 |
| [26] |
Uyttenhove C, Pilotte L, Théate I, et al. Evidence for a tumoral immune resistance mechanism based on tryptophan degradation by indoleamine 2, 3-dioxygenase[J]. Nat Med, 2003, 9: 1269-1274. DOI:10.1038/nm934 |
| [27] |
Zhai QY, Chen YC, Xu JN, et al. Lymphoma immunochemotherapy: targeted delivery of doxorubicin via a dual functional nanocarrier[J]. Mol Pharm, 2017, 14: 3888-3895. DOI:10.1021/acs.molpharmaceut.7b00606 |
| [28] |
Asha N, Hao ZL, Ramses S, et al. A phase I study of NLG919 for adult patients with recurrent advanced solid tumors[J]. J Immuno Ther Cancer, 2014, 2: P250. DOI:10.1186/2051-1426-2-S3-P250 |
| [29] |
Makiya N. Reactive oxygen species in tumor metastasis[J]. Cancer Lett, 2008, 266: 53-59. DOI:10.1016/j.canlet.2008.02.031 |
| [30] |
Calatrava-Pérez E, Bright SA, Achermann S, et al. Glycosidase activated release of fluorescent 1, 8-naphthalimide probes for tumor cell imaging from glycosylated 'pro-probes'[J]. Chem Commun, 2016, 52: 13086-13089. DOI:10.1039/C6CC06451E |
| [31] |
Marian V, Dieter L, Jan M, et al. Free radicals and antioxidants in normal physiological functions and human disease[J]. Int J Biochem Cell Biol, 2007, 39: 44-84. DOI:10.1016/j.biocel.2006.07.001 |
| [32] |
Chua EYD, Davey GE, Chin CF, et al. Stereochemical control of nucleosome targeting by platinum-intercalator antitumor agents[J]. Nucleic Acids Res, 2015, 43: 5284-5296. DOI:10.1093/nar/gkv356 |
| [33] |
Badawy AA. Kynurenine pathway of tryptophan metabolism: regulatory and functional aspects[J]. Int J Tryptophan Res, 2017, 10: 1178646917691938. |
 2022, Vol. 57
2022, Vol. 57


