速效救心丸是由川芎和冰片两味中药组成的复方制剂, 方中川芎活血化瘀止痛, 冰片芳香行气止痛。近年来, 该方在临床上除用于治疗冠心病心绞痛[1]外, 还可用于治疗急性腹痛、血管神经性头痛、尿路结石、痛经和肾绞痛等症[2]。
冰片是中药常用的引经药物[3], 已有研究表明, 冰片可以通过多种生理屏障, 如血脑屏障[4]、黏膜和皮肤等[5, 6], 认为这与P糖蛋白(P-gp) 等转运蛋白的外泵功能抑制[7]、人体生物化学物质水平的变化[8]、细胞紧密连接结构疏松[9]以及皮肤角质层结构改变[10]等有关。鉴于口服给药是含冰片制剂最常用的用药途径, 且冰片发挥引经作用增强疗效的第一环节可能在于影响胃肠道吸收[11], 增加血药浓度, 进而增加药物的靶器官分布, 故从胃肠吸收层面研究可初步阐明冰片发挥引经作用的生物学基础。
瞬时受体阳离子通道蛋白M8 (TrpM8) 被认为是低于28 ℃和薄荷醇等冷刺激的外周神经感受器, 高表达于前列腺和三叉神经中, 广泛参与疼痛、炎症和血管张力的调节[12]。薄荷醇与冰片特性相仿, 结构相似, 故而TrpM8可能也是冰片发挥引经作用的靶点之一。
因此, 本课题通过建立外翻肠囊体外肠道吸收和小鼠在体药物代谢等模型分析冰片对药物的肠道吸收和组织分布的影响, 利用Caco-2细胞体外吸收模型、靶点捕获和质谱成像等手段探究冰片的作用靶点, 并对“引经”效果进行评价, 以期明确冰片促进速效救心丸中川芎药效成分吸收的“引经”作用机制。
材料与方法药品与试剂 Hank's平衡盐溶液、1640培养基、特级胎牛血清、氨苄青霉素和链霉素(美国Gibco公司); 速效救心丸、冰片(borneol, Bor)、无冰片速效救心丸(天津中新药业集团股份有限公司第六中药厂); 藁本内酯(ligustilide, Lig, 纯度≥ 98%, 81944-09-4)、阿魏酸(ferulic acid, FA, 纯度≥ 99%, 1135-24-6)、薄荷醇(menthol, Men, 纯度≥ 99%, 89-78-1) 均购自中国麦克林Mackin; 高效RIPA组织裂解液(美国索莱宝公司); 去甲肾上腺素(norepinephrine, NE)、硝苯地平(nifedipine, NF)、N-(4-叔丁苯基)-4-(3-氯吡啶-2-基)哌嗪-1-甲酰胺(BCTC) 和乙酰胆碱(acetylcholine, ACh) 均购自意大利MCE公司。三(2-羧乙基) 膦(TCEP) 和三[(1-苄基-1H-1, 2, 3-三唑-4-基) 甲基] 胺(TBTA) 购自上海萨恩科学技术有限公司; 二硫苏糖醇(dithiothreitol, DTT, 北京华夏远洋科技有限公司); 磺基琥珀酰亚胺(4-叠氮苯基二硫代) 丙酸酯(Sulfo-SADP, 美国Bioworld研究中心); Fe3O4磁性纳米微球(上海麦克林生化科技有限公司; 脂质体2000 (美国Invitrogen公司); 辣根过氧化物酶标记二抗(HRP-linked antibody, 美国Cell Signaling Technology公司); TrpM8抗体(英国Abcam公司); 双荧光素酶报告试剂盒、Renila质粒、pGL4.30质粒、TrpM8高通量表达质粒(美国Promega公司); 色谱纯甲醇、色谱纯乙腈(美国Fisher公司); 色谱纯甲酸(德国Merck公司); 其他化学试剂均为分析纯。
仪器 Millcell-ER2电阻仪(Millipore公司); HW200S恒温平滑肌实验系统(四川成都泰盟软件有限公司); 离体组织水浴系统(美国Radnoti公司); 高效液相色谱系统(LC-20A, 日本岛津公司)。
动物 SPF级雄性SD大鼠42只, 体重200~250 g, SPF级雄性昆明小鼠63只, 体重20~25 g, 均购于北京维通利华实验动物技术有限公司, 许可证编号: SCXK (北京) 2016-0006。所有动物实验均符合南开大学伦理委员会的规定。
细胞 Caco-2和HEK293购自上海中国科学院细胞库。分别生长在含有10%特级胎牛血清、100 μg·mL-1青霉素和100 μg·mL-1链霉素的1640培养基和DMEM培养基中, 在CO2含量为5%的37 ℃恒温培养箱中培养。
色谱条件 采用Kinetex-C18 (250 mm × 4.6 mm, 5 μm) 色谱柱, 流动相为0.1%甲酸水溶液(A)-乙腈(B), 梯度洗脱(0~15 min, 5%~52% B; 15~35 min, 52%~90% B; 35~40 min, 90% B; 40~45 min, 90%~100% B; 45~50 min, 100%~5% B; 50~60 min, 5% B), 检测波长280 nm, 流速设定1.2 mL·min-1, 柱温为35 ℃, 进样量为10 μL。
外翻肠囊法给药模型的建立 取12只SD雄性大鼠, 禁食24 h后随机分组, 分别为: 速效救心丸组(SX, 200 mg·mL-1) 和等生药量的不含冰片的速效救心丸组(P-SX)。取大鼠十二指肠12 cm, 利用外翻肠囊法[13]借助恒温恒氧仪建立给药模型。分别于0、10、20、30、40、50、60 min向肠管中取样200 μL, 在取样完成后, 立即向肠管中补加空白台式液200 μL, 以维持液面相平。所有样品经离心取上清后, 向其中加入色谱甲醇稀释, 待充分涡旋混匀, 离心取上清过微孔滤膜(0.22 μm) 即可进行HPLC[14]分析, 统计并分析肠囊液样品中Lig和FA的累计吸收量(Q) 和吸收渗透率(Kapp)。
药物成分入血和药物组织分布的检测 取60只雄性昆明小鼠, 禁食24 h后, 随机分成4组给药。分别为Lig (50 mg·kg-1)、FA (50 mg·kg-1), Bor + FA (100 mg·kg-1 + 50 mg·kg-1), Bor + Lig (100 mg·kg-1 + 50 mg·kg-1)。于给药后5、15、30、60、120 min采集血样并取小鼠心、肝、肺组织, 血样离心后取上层血浆, 组织样本裂解匀浆, 再经过样品前处理后进行HPLC分析。记录并分析各样本中Lig和FA的含量。
Caco-2细胞体外吸收模型的建立 将Caco-2细胞接种于24孔板的Transwell细胞小室中, 接种密度为1×105个/孔, 小室内加培养液200 μL, 小室外加培养液1 mL, 保持液面持平。待细胞完全分化形成紧密连接且电阻值稳定并大于2 000 Ω时, 该小室的Caco-2细胞单层模型建立成功[15], 可用于后续实验。
Caco-2细胞跨上皮电阻值(TEER) 测定 以不含细胞的Transwell细胞小室作为对照, 对紧密连接模型建立成功的细胞小室分组给药, 实验设置空白组、薄荷醇给药组(100 μmol·L-1) 和冰片给药组(1、10、100 μmol·L-1)。在细胞给药后0、10、20、30、40、50、60 min进行TEER测定[16]。
Caco-2细胞辣根过氧化物酶(HRP) 含量测定 实验分组和给药与“Caco-2细胞跨上皮电阻值(TEER) 测定”相同, 在细胞给药10、20、30、40、50、60 min时, 分别从细胞外室取样50 μL并补加50 μL无酚红的HBSS以维持液面相平。样品经TMB显色, HCl (1 mol·L-1) 终止后, 在波长为450 nm处测定A值。根据HRP标准曲线计算出样本中HRP的含量[17]。
冰片靶点蛋白捕获和Western blot验证 对冰片进行修饰合成冰片的光敏探针, 进行冰片靶蛋白的捕获。培养Caco-2细胞, 分别给药完全培养基, 冰片探针(100 μmol·L-1) 和冰片(100 μmol·L-1), 共孵育30 min。经PBS清洗后, 紫外照射30 min。然后加RIPA蛋白裂解液裂解, 经离心取上清得到蛋白样品。分别将其添加到磁性微球与桥连剂共孵育6 h得到的叠氮化磁性微球中, 同时向该溶液中加入CuSO4 (1 mmol·L-1) 和TCEP (1 mmol·L-1), 孵育12 h后用磁铁吸附小球, 弃取反应液。向磁球中加300 μL DTT (1 mmol·L-1), 4 ℃振荡反应30 min后用磁铁吸附磁球, 转移上清液至EP管中并冻干。冻干的蛋白样品均用30 μL蛋白上样缓冲液重新溶解, 金属浴100 ℃煮5 min后进行SDS-PAGE电泳(10%)、考马斯亮蓝染色和Western blot验证。
基于双荧光素酶报告系统的冰片Ca2+激动检测 将HEK293接种于96孔板中, 待其密度达到60%~70%时, 以脂质体2000为载体, 分别设置TrpM8质粒不共转染组和共转染组。其中, TrpM8质粒共转染组要求将Ca2+敏感的pGL4.30、荧光素酶内参质粒Renilla和TrpM8质粒瞬时共转染24 h。实验设置空白组、薄荷醇给药组(100 μmol·L-1) 和冰片给药组(1、10、100 μmol·L-1)。在转染结束后分别给药6 h, 按照双荧光素酶报告试剂盒说明, 对各组的Ca2+表达水平进行检测。
BCTC作用下的肠吸收测定 取15只SD雄性大鼠, 禁食24 h后随机分组给药, 分别为FA (1 mg·mL-1)、FA + Bor (1 mg·mL-1 + 2 mg·mL-1)、FA + Bor + BCTC (1 mg·mL-1 + 2 mg·mL-1 + 0.12 μg·mL-1、1 mg·mL-1 + 2 mg·mL-1 + 0.6 μg·mL-1、1 mg·mL-1 + 2 mg·mL-1 + 3 μg·mL-1), 利用前文所述的外翻肠囊给药模型和样品处理方法, 在给药40 min后收集肠囊液, 样品经前处理后进行HPLC分析, 统计并分析该时刻肠囊液样品中FA的累计吸收量(Q)。
质谱成像 共取3只雄性昆明小鼠, 禁食24 h后, 分别给予FA (50 mg·kg-1)、Bor + FA (100 mg·kg-1 + 50 mg·kg-1) 及等量生理盐水。给药15 min后取小鼠心脏, 经羧甲基纤维素(5%) 包埋后制成冷冻切片(片厚15 μm), 进行质谱成像检测。设置检测的质荷比范围(m/z) 为80~1 000、检测面积为切片大小, 空间分辨率为100 μm, 在此条件下获取DESI质谱成像数据并对成像结果进行离子可视化分析与数据统计。
阿魏酸胸主动脉舒张测定 取15只SD雄性大鼠, 禁食24 h后取去除周围结缔组织和内皮组织的大鼠胸主动脉, 剪成长约3 mm的动脉环, 固定在离体组织水浴系统。经KCl (60 mmol·L-1) 预刺激, 待血管环的等张收缩力平衡且稳定到2.0 g后, 向浴槽中加入NE (1 mmol·L-1) 10 μL, 刺激血管收缩约8 min后, 分别加入终浓度为10 μmol·L-1 NF、1 mmol·L-1 FA以及1.5 mmol·L-1 FA, 持续记录血管张力数据10 min。观察给药前后动脉血管的张力变化情况并统计给药后的血管舒张率。
统计学分析 采用GraphPad 5.0软件进行数据统计分析, 结果用
本研究构建外翻肠囊药物体外吸收模型, 以Lig和FA为检测指标, 探究冰片对其肠道吸收的影响。结果如图 1A和B所示, SX组中Lig和FA的Q和Kapp明显高于P-SX组。这表明冰片具有促进药物肠道吸收的作用。同时, 血浆药物浓度的检测结果如图 1C和D所示, 合用冰片后Lig和FA的血浆浓度显著增加。这说明冰片可以增加肠道通透性, 促进药物肠道吸收, 进而促进药物成分入血, 提高生物利用度。

|
Figure 1 Borneol (Bor) promoted the intestinal absorption and the increase of blood concentration of ligustilide (Lig) and ferulic acid (FA). The model of in vitro intestinal absorption and in vivo drug metabolism of mice were established to explore the effects of Bor on intestinal absorption and blood concentration of Lig and FA. A and B show the effects of Bor on intestinal absorption and expresses in quantity (Q) and permeability (Kapp). C and D show the effects of Bor on blood concentration and expresses in Lig concentration and FA concentration. A: Q and Kapp of Lig in intestinal juice; B: Q and Kapp of FA in intestinal juice. SX: Suxiaojiuxin pills group; P-SX: The fake Suxiaojiuxin pills group, which do not contain Bor. n = 3, |
靶器官富集是“佐引”功效的评价指标之一, 本研究利用小鼠在体药物代谢模型, 测定了冰片对心脏等组织中Lig和FA分布的影响。结果如图 2所示, 在120 min内, 与单独给药Lig和FA组相比, 合用冰片后Lig的组织分布也有一定增加, 但不具有显著性。另一方面, 合用冰片后FA在心脏、肝脏以及肺组织中的含量显著增加, 其中药物在心脏的增加最为明显。这说明冰片可以促进FA的组织分布和靶器官富集, 且冰片对于不同类型化合物的促进作用敏感度不同, 其具体机制还需进一步研究。鉴于冰片对FA吸收影响更为明显, 本研究将采用FA作为指示化合物。

|
Figure 2 Bor promoted the tissue distribution of Lig and FA. The model of in vivo drug metabolism of mice was established to explore the effects of Bor on tissue distribution of Lig and FA. A-C: The concentration of Lig in the heart, lung and liver; D-F: The concentration of FA in the heart, lungs and liver. A-F (left) means drug-time curve and A-F (right) means area under the concentration-time curve. n = 3, |
为了探究冰片促肠道吸收发挥“引经”作用的机制, 本研究进行了Caco-2细胞通透性测定。如图 3所示, 与空白组相比, 冰片给药组和薄荷醇给药组均能显著降低Caco-2细胞TEER值, 增加HRP含量。同时, Lig和FA给药组对Caco-2细胞的TEER值和HRP含量无显著影响。结果表明: 冰片可以扩大Caco-2细胞的细胞间隙, 增加其通透性, 进而促进药物肠道吸收。

|
Figure 3 Bor increased permeability by widening the intercellular space. The model of in vitro absorption of Caco-2 was established to explore the effects of Bor on intestinal intercellular space and permeability, which express in transepithelial resistance (TEER) and horseradish peroxidase (HRP) quantity. A, B: The effect of Bor on TEER and HRP quantity; C, D: The effect of Lig and FA on TEER and HRP quantity. n = 3, |
为了进一步探究冰片促吸收的“引经”机制, 明确其作用靶点, 本研究合成了冰片炔基光敏探针(图 4A), 对冰片靶蛋白进行了捕获及验证。结果如图 4B所示, 冰片直接作用靶点为TrpM8。由于TrpM8是一种与Ca2+相关的离子通道蛋白, 进一步探究了冰片对细胞内Ca2+含量的影响, 结果表明: 与空白组相比, 冰片在共转染TrpM8质粒后钙激动效果更显著(图 4C), 且呈现浓度依赖性(图 4D)。提示冰片可以通过激活TrpM8, 使细胞内Ca2+浓度升高, 从而可能通过该方式使细胞间隙增大, 通透性增强, 发挥促吸收的“引经”作用。
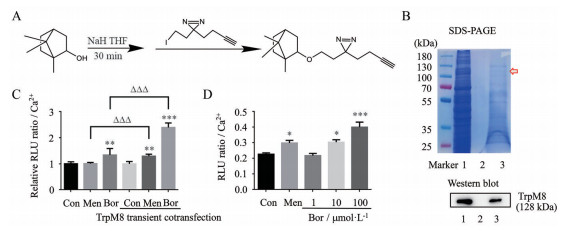
|
Figure 4 Bor induced calcium overload and increased intercellular space by acting on transient receptor potential cation channel, subfamily M, member 8 (TrpM8). A: Synthesis of Bor photosensitive probe; B: Target protein capture and Western blot verification. Lane 1 was total intestines proteins of rat; lane 2 was proteins captured by Bor with no Borphotosensitive probe; lane 3 was proteins captured by Bor photosensitive probe. The "1", "2" and "3" of SDS-PAGE and Western blot were same; C: The effect of TrpM8 transient cotransfection on intracellular calcium with Bor. All the concentrations were 100 μmol·L-1. n = 5, |
为了验证冰片促吸收作用与TrpM8的关联, 本研究基于外翻肠囊给药模型, 利用TrpM8的特异性拮抗剂BCTC与冰片联合使用, 观测BCTC对冰片促吸收作用的影响。以FA作为检测指标, 在40 min时收集肠囊液, 进行检测分析。实验结果如图 5A所示, 与单独给药FA组相比, FA + Bor组的Q值显著增加。与FA + Bor组相比, FA + Bor + BCTC组Q值显著降低。这表明BCTC作为TrpM8的特异性抑制剂可以有效抑制由冰片引起的肠道吸收量的增加, 证明了冰片促吸收作用与TrpM8激活相关。

|
Figure 5 Bor can promote efficacy by acting on TrpM8 and increasing the concentration of medicinal efficacious components in the heart. A: Q of FA in intestinal juice. All groups of FA+Bor are at the same concentration. n = 3, |
为了验证机制猜想, 本研究进行了质谱成像和大鼠胸主动脉舒张测定。质谱成像技术是利用高电压, 在氮气的辅助下让溶剂通过DESI喷雾器, 轰击组织样本以使药效成分发生解析和电离, 从而采集质谱信息, 以可视化的形式直观地表征出组织中的药物分布和富集程度。由Lig和FA的解离特性以及冰片对FA的组织分布敏感度所决定, 本实验只对小鼠心脏中不同给药组FA的分布进行了DESI成像分析。通过对质谱成像心脏染色切片(图 5B) 荧光强度的统计分析可知(图 5C), 合用冰片后FA在心脏中的含量增加了约1.5倍。而与FA组相比, 1.5倍FA给药组的血管舒张作用显著增强, 血管张力减弱(图 5D), 血管舒张率从50%增加到70% (图 5E), 这表明冰片通过增加心脏中FA的含量达到了增强其血管舒张的“引经”药效。
讨论在中医理论中, 冰片归心、脾、肺经, 是常用引经药之一。研究表明, 冰片经小鼠灌胃后可迅速经胃肠黏膜吸收, 透过血脑屏障[18], 在中枢神经有较高浓度。冰片可以通过作用于MAPK途径、PI3K-AKT途径[19]等影响紧密连接蛋白的表达, 如occludin、accludin、ZO-1等[20], 进而开放血脑屏障, 增加脑卒中或脑胶质瘤等治疗药物的脑部浓度。冰片多为口服给药, 且有研究表明冰片可促进多种药物的肠胃吸收, 这提示冰片引经作用还可能与促进药物的肠胃吸收, 增加药效成分的血药浓度, 进而实现靶器官富集有关。经过对肠囊液、血浆和心脏等脏器的药物含量测定, 发现合用冰片后, 肠囊液、血浆和心脏等脏器的药物含量显著增加, 证明了本课题组最初的猜想。
有研究报道, 冰片可以激活TrpM8, 发挥镇痛功效[21]。TrpM8是TRP家族中温和性凉刺激的钙离子通路瞬时感受器[22, 23]。TrpM8是薄荷醇的靶蛋白, 其激活是通过细胞外钙的少量流入, 引起内质网或肌浆网上钙库钙离子的释放, 从而产生胞内钙紊乱, 可能与磷脂酰肌醇4, 5-二磷酸的相互作用相关[24]。由于冰片与薄荷醇的相似性, 推测冰片可能通过作用于TrpM8, 引起Ca2+内流, 进而扩大细胞间隙发挥引经作用。为了探索冰片的引经机制并阐明其作用靶点, 本研究合成冰片光敏探针, 利用点击化学方法捕获其靶蛋白。经Western blot验证表明, TrpM8为冰片直接靶点之一。而进一步的钙激动实验结果也显示冰片具有升钙效果。
综上所述, 本研究发现速效救心丸中的冰片可以激活TrpM8使细胞内Ca2+浓度增加, 扩大细胞间隙, 增加肠道细胞间通透性, 通过促进药物的肠道吸收, 增加血药浓度, 进而起到促进药效成分的组织分布和靶器官富集的“佐引”功效, 更好地发挥药效, 加深了对冰片“佐引”机制的了解, 有利于冰片的进一步开发和利用。
作者贡献: 王洁负责实验操作及论文初稿撰写; 闫孟琳负责实验数据处理; 张曼协助完成实验; 白钢负责课题设计及指导; 姜民负责课题指导及终稿审查。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Wu ZG, Wang XL, Zhang MZ, et al. Chinese expert consensus on Suxiao Jiuxin Pills in the treatment of coronary heart disease[J]. Chin J Integr Med Cardio/Cerebrovasc Dis (中西医结合心脑血管病杂志), 2019, 17: 3265-3267. |
| [2] |
Li ZW. The new clinical use of Suxiao Jiuxin Pills[J]. World Chin Med (世界中医药), 2011, 6: 270-271. |
| [3] |
Wu J, Xie J, Zhang QL, et al. Research progress on meridian-guiding theory of traditional Chinese medicine[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 2428-2434. |
| [4] |
Zheng Q, Chen ZX, Xu MB, et al. Borneol, a messenger agent, improves central nervous system drug delivery through enhancing blood-brain barrier permeability: a preclinical systematic review and meta-analysis[J]. Drug Deliv, 2018, 25: 1617-1633. DOI:10.1080/10717544.2018.1486471 |
| [5] |
Kulkarni M, Sawant N, Kolapkar A, et al. Borneol: a promising monoterpenoid in enhancing drug delivery across various physiological barriers[J]. AAPS PharmSciTech, 2021, 22: 145-149. DOI:10.1208/s12249-021-01999-8 |
| [6] |
Liu S, Long Y, Yu S, et al. Borneol in cardio-cerebrovascular diseases: pharmacological actions, mechanisms, and therapeutics[J]. Pharmacol Res, 2021, 169: 105627. DOI:10.1016/j.phrs.2021.105627 |
| [7] |
Wang S, Tan N, Ma C, et al. Inhibitory effects of benzaldehyde, vanillin, muscone and borneol on P-glycoprotein in Caco-2 cells and everted gut sac[J]. Pharmacology, 2018, 101: 269-277. DOI:10.1159/000487144 |
| [8] |
Bansod S, Chilvery S, Saifi MA, et al. Borneol protects against cerulein-induced oxidative stress and inflammation in acute pancreatitis mice model[J]. Environ Toxicol, 2021, 36: 530-539. DOI:10.1002/tox.23058 |
| [9] |
Shao L, Sun C, Lu W, et al. Effects of borneol on the release of compound Danshen colon-specific osmotic pump capsule in vitro and pharmacokinetics study in beagle dogs[J]. AAPS PharmSciTech, 2020, 21: 316-322. DOI:10.1208/s12249-020-01840-8 |
| [10] |
Yi QF, Yan J, Tang SY, et al. Effect of borneol on the transdermal permeation of drugs with differing lipophilicity and molecular organization of stratum corneum lipids[J]. Drug Dev Ind Pharm, 2016, 42: 1086-1093. DOI:10.3109/03639045.2015.1107095 |
| [11] |
Xi LL, Miao MS, Li Y. Contemporary understanding and reflection on the medicine be responsible for "meridian guiding" in treating diseases[J]. Tradit Chin Drug Res Clin Pharmacol (中药新药与临床药理), 2019, 30: 1269-1272. |
| [12] |
Chen C, Liu ZG, Wang SL, et al. Research progress on the relationship between tumor and menthol and its receptor TRPM8[J]. Chin Pharmacol Bull (中国药理学通报), 2015, 31: 312-314. |
| [13] |
Wu RN, Tang M, Xing LY, et al. Evaluation permeability of different drug by in vitro everted gut sac model[J]. West China J Pharm Sci (华西药学杂志), 2021, 36: 15-18. |
| [14] |
Yan T, Jiang W, Wang QH, et al. Analysis of intestinal absorption characteristics of ferulic acid and ligustilide in Chuanxiong Rhizoma[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2017, 23: 24-29. |
| [15] |
Olivier S, Leclerc J, Grenier A, et al. AMPK activation promotes tight junction assembly in intestinal epithelial Caco-2 cells[J]. Int J Mol Sci, 2019, 20: 5171. DOI:10.3390/ijms20205171 |
| [16] |
Abdayem R, Callejon S, Portes P, et al. Modulation of transepithelial electric resistance (TEER) in reconstructed human epidermis by excipients known to permeate intestinal tight junctions[J]. Exp Dermatol, 2015, 24: 686-691. DOI:10.1111/exd.12750 |
| [17] |
Liu Q, Mittal R, Emami CN, et al. Human isolates of Cronobacter sakazakii bind efficiently to intestinal epithelial cells in vitro to induce monolayer permeability and apoptosis[J]. J Surg Res, 2012, 176: 437-447. DOI:10.1016/j.jss.2011.10.030 |
| [18] |
Wu T, Zhang A, Lu H, et al. The role and mechanism of borneol to open the blood-brain barrier[J]. Integr Cancer Ther, 2018, 17: 806-812. |
| [19] |
Cao WQ, Zhai XQ, Ma JW, et al. Natural borneol sensitizes human glioma cells to cisplatin-induced apoptosis by triggering ROS-mediated oxidative damage and regulation of MAPKs and PI3K/AKT pathway[J]. Pharm Biol, 2020, 58: 72-79. DOI:10.1080/13880209.2019.1703756 |
| [20] |
Duan M, Xing Y, Guo J, et al. Borneol increases blood-tumour barrier permeability by regulating the expression levels of tight junction-associated proteins[J]. Pharm Biol, 2016, 54: 3009-3018. DOI:10.1080/13880209.2016.1199044 |
| [21] |
Wang S, Zhang D, Hu J, et al. A clinical and mechanistic study of topical borneol-induced analgesia[J]. EMBO Mol Med, 2017, 9: 802-815. DOI:10.15252/emmm.201607300 |
| [22] |
Moran MM. TRP channels as potential drug targets[J]. Annu Rev Pharmacol Toxicol, 2018, 58: 309-330. DOI:10.1146/annurev-pharmtox-010617-052832 |
| [23] |
Liu Y, Mikrani R, He Y, et al. TRPM8 channels: a review of distribution and clinical role[J]. Eur J Pharmacol, 2020, 882: 173312. DOI:10.1016/j.ejphar.2020.173312 |
| [24] |
Yin Y, Le SC, Hsu AL, et al. Structural basis of cooling agent and lipid sensing by the cold-activated TRPM8 channel[J]. Science, 2019, 363: eaav9334. DOI:10.1126/science.aav9334 |
 2022, Vol. 57
2022, Vol. 57


