2. 江苏省中医药研究院, 中药组分与微生态研究中心, 江苏 南京 210028
2. Multi-component of Traditional Chinese Medicine and Microecology Research Center, Jiangsu Provincial Academy of Chinese Medicine, Nanjing 210028, China
血管栓塞是指在影像学技术的引导下, 将栓塞剂通过导管选择性地注入到某一病变器官的血管内, 使之发生闭塞, 中断血供, 以达到预定治疗目的的一项技术, 临床主要用于出血性病变、动脉瘤和假性动脉瘤、动静脉畸形(arteriovenous malformation, AVM) 和实体瘤如肝癌、子宫肌瘤等[1, 2]。
目前临床常用的栓塞剂主要有以金属线圈为代表的机械栓塞剂; 以校准微球、载药微球为代表的颗粒栓塞剂和以Onyx、PHIL、氰丙烯酸正丁酯(N-butyl-2-cyanoacrylate, NBCA) 为代表的液体栓塞剂3类。线圈常存在迁移和不完全栓塞的缺陷[3]。而校准微球/载药微球等尽管可能具有更优的可控性和局部缓释效果, 但也面临着血管穿透能力有限、易于聚集、生物降解性差及载药类型有限(仅可负载正电荷药物) 的挑战[4]。相比之下, Onyx[2]、PHIL[1]、NBCA[5]、硬化剂[2]和碘油[6]等液体栓塞剂表现出更为优异的血管填充能力和可递送性, 可沿不同形状和大小的血管深入和广泛地渗透, 并具有一定的载药性能[1, 7], 但仍存在黏附导管和血管、需使用毒性有机溶剂[二甲基亚砜(dimethyl sulfoxide, DMSO) 等]、操作过程复杂、生物相容性或机械性能不佳等问题。
近年来, 原位凝胶在生物医学领域引起了巨大的关注, 其在体外为黏度较低的水溶液, 注射到靶向部位后通过物理交联和/或化学交联等发生溶胶-凝胶转变, 形成固体/半固体水凝胶[8], 具有良好的可注射性、栓塞可控性、血管填充性能、生物相容性和药物缓控释作用, 已成为研发治疗动脉瘤和AVM等多种疾病的新型栓塞剂的新型材料。根据凝胶的形成机制, 可将这些材料分为物理交联水凝胶、化学交联水凝胶和物理/化学交联水凝胶。本文汇总了近10年来国内外对可注射的原位凝胶血管栓塞剂的研究进展, 介绍了其栓塞机制和优缺点, 最后对关键性问题进行了总结和讨论, 以期为未来新型栓塞剂的开发提供参考。
1 物理交联原位凝胶栓塞剂物理交联原位凝胶是基于范德华力、偶极-偶极、疏水相互作用、静电相互作用和氢键等次级相互作用形成的一类原位凝胶材料, 可通过体内环境刺激或离子原位交联等发生溶胶-凝胶相变, 具有易于注射和填充不规则血管、简单可调和良好的载药缓释性能等优势。
1.1 pH响应性原位凝胶 1.1.1 阴离子型pH响应性原位凝胶阴离子型pH响应性原位凝胶栓塞剂主要由基于磺胺二甲嘧啶(sulfamethazine, SM) 的共聚物材料制备而成。高pH环境(注射器和导管内) 到低pH环境(生理条件和肿瘤部位) 的转变使SM发生去离子化, 并诱导SM基聚合物从亲水状态转变为疏水状态, 导致胶束形成, 最终交联形成3D水凝胶网络[3]。例如, Nguyen等[3]以聚乙二醇[poly (ethylene glycol), PEG]-聚氨基甲酸酯磺胺二甲嘧啶[poly (urethane sulfide sulfamethazine), PUSSM] 共聚物PEG-PUSSM和碘海醇为原料设计了一种新型可注射不透射线液体栓塞剂。PEG-PUSSM共聚物体系可在pH 8.5时通过导管注入, 达到生理条件后形成高黏度的凝胶态, 并成功阻断了兔肾动脉和肝动脉。此外, SM共聚物还可通过静电相互作用有效负载多柔比星(doxorubicin, DOX) 等抗肿瘤药物, 具有应用于肝癌经导管动脉化疗栓塞(transcatheter arterial chemoembolization, TACE) 治疗的潜在价值[4]。载药SM基共聚物在体外4周累积药物释放量约为25%, 其缓释作用可归因于扩散和/或降解机制。研究表明, 将载DOX的SM基共聚物溶液与造影剂混合制备的不透射线液体栓塞系统可顺利通过微导管经肝动脉注射到兔肝肿瘤中, 并形成水凝胶进行TACE, 注射2周后显著抑制了肿瘤的生长[7]。
1.1.2 阳离子型pH响应性原位凝胶可生物降解的阳离子型聚胺基酯型聚氨酯[poly (amino ester urethane), PAEU] 嵌段共聚物也表现出pH触发的溶胶-凝胶转变, 并具有作为液体栓塞剂的潜在价值[9]。与基于SM的体系相反, PAEU共聚物水凝胶会随着pH值的升高而发生溶胶-凝胶转变, 凝胶区域覆盖生理条件(37 ℃, pH 7.4) 和肿瘤条件(37 ℃, pH 6.5~7.2), 其胶凝动力学受到PAEU分数、分子质量和共聚物浓度的影响。此外, PAEU共聚物可通过静电相互作用和氢键结合DOX等药物, 并可与碘化油混合增加不透射线性。电子计算机断层扫描(computed tomography, CT) 图像和组织学检查证实PEAU嵌段共聚物制备得到的不透射线液体化疗栓塞剂经2.0 Fr微导管介入后, 可在兔肝动脉和VX2肿瘤中形成稳定的水凝胶, 具有应用于肝癌TACE治疗的良好前景。
1.2 温度响应性原位凝胶温度响应性原位凝胶主要利用热诱导的材料在室温和人体温度下的特性变化来进行栓塞。在理想状态下, 此类液体栓塞剂在注射过程中应具有足够低的黏度, 并响应于体内目标部位的温度升高或降低而形成具有足够强度的凝胶, 以阻断血流。
1.2.1 聚(N-异丙基丙烯酰胺) [poly (N-isopropylacrylamide), PNIPAM]PNIPAM是一种生物相容性的温度响应型高分子聚合物, 其同时含有疏水性的异丙基和亲水性的酰胺基团, 低临界溶解温度(lower critical soluble temperature, LCST) 约为31 ℃[10, 11]。在LCST以下, 亲水性的酰胺基团占据主导, 并与水分子以氢键结合, 宏观表现为溶解态。当环境温度高于LCST时, 异丙基占据主导, 酰胺基团与水分子之间的氢键断裂, 在疏水相互作用下呈非均相, 宏观表现为溶液出现浊点, 形成凝胶态(图 1)[12]。PNIPAM的LCST与人体体温接近, 因此具有作为液体栓塞剂的潜在价值。Matsumaru等[13]首次将PNIPAM作为一种新型血管栓塞剂进行研究, 并通过血管造影术证实PNIPAM可成功闭塞兔肾动脉, 同时在毒性实验或组织学检查中均未观察到急性毒性。Sheng等[14, 15]在水凝胶中混入碘海醇以增加不透X射线性, 并在猪颅底血管网模型和两例临床肾癌患者进一步证实了PNIPAM的栓塞效果, 递送过程中无导管黏附发生, 手术后出血立刻停止, 并造成了永久性栓塞。
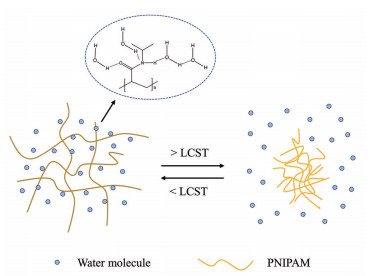
|
Figure 1 Schematic diagram of PNIPAM gelation mechanism. LCST: Lower critical soluble temperature; PNIPAM: Poly (N-isopropylacrylamide) |
由于PNIPAM凝胶往往存在机械强度低、载药能力有限和生物降解性差等缺点, 采用共聚法对其进行改性或可有效提高PNIPAM类材料的力学性能[16]、生物相容性[17]、生物可降解性[18]、载药缓释性能[19]、不透X射线性[20]或调节LCST[21]等。例如, 亲水性成分的引入会使聚合物LCST上升, 而疏水性成分的引入会使聚合物LCST降低。已报道的PNIPAM共聚物原位凝胶栓塞剂可分为无规共聚物、嵌段共聚物和接枝共聚物。Xiong[22]在PNIPAM聚合物网络中引入了可电离的丙烯酸, 通过乳液聚合法制备了温度/pH双重响应型的聚(N-异丙基丙烯酰胺-co-丙烯酸) 纳米凝胶, 克服了单一温敏材料因提前凝胶化导致推注困难甚至阻塞导管的缺点, 并采用酸敏感的腙键将DOX与纳米凝胶进行了偶联, 实现了pH敏感降解释药。Dai等[18]首次报道了BAB型三嵌段共聚物[A = N-异丙基丙烯酰胺(N-isopropylacrylamide, NIPAM), B =甲基丙烯酸羟乙酯(2-hydroxyethyl methacrylate, HEMA)] 在脑和肾脏的异常血管栓塞中的应用。HEMA/ NIPAM嵌段共聚物具有更为精确的分子结构, 其水溶液能够在高温下快速胶凝, 不透射线试剂的引入可以通过减弱混合物的脱水作用进而提高胶凝能力。此外, Chen等[17]开发了一种LCST为34.3 ℃的细菌纤维素纳米晶须接枝PNIPAM复合温敏材料(图 2)。细菌纤维素纳米晶须大大提高了该复合材料的生物相容性和凝胶的机械强度, 使其在经导管血管栓塞术(transcatheter arterial embolization, TAE) 治疗中具有优异的潜力。

|
Figure 2 Grafting of PNIPAM brushes from bacterial cellulose (BC) nano whiskers. DMAP: 4-Dimethylaminopyridine; DMF: N, N-Dimethylformamide; PMDETA: N, N, N′, N′, N″-Pentamethyldiethylenetriamine |
近年来, 将PNIPAM类聚合物与其他组分配制得到的多功能复合水凝胶受到越来越多的关注[23]。例如, Wu[24]制备了纳米级细菌纤维素和聚(N-异丙基丙烯酰胺-co-甲基丙烯酸丁酯) 纳米凝胶的互穿网络, 其相变温度为(29 ± 2) ℃。相比前期研究的纳米凝胶, 其凝胶化机械性能和生物相容性均大幅提高。此外, Liu等[25]开发了金纳米颗粒(gold nanoparticles, GNPs) 与聚(N-异丙基丙烯酰胺-co-甲基丙烯酸丁酯) 纳米凝胶的高浓度复合物分散体。纳米凝胶分散体的凝胶化可抑制GNPs的聚集, 显著提高X-射线成像能力(0.31 mol·L-1时的X-射线衰减能力比碘海醇高2.6倍)。同时GNPs可以提高温敏纳米凝胶的凝胶化强度, 进而提高TAE的治疗效果。兔肾动脉栓塞实验表明这种液体栓塞系统具有优异的血管造影能力和血管栓塞作用, 可用于栓塞术后的长期检测[26]。
1.2.2 壳聚糖(chitosan, CS) 类CS是甲壳素的脱乙酰化产物, 为天然阳离子碱性多糖[27], 因具有生物相容性、生物可降解性、生物活性、抗菌活性及成胶成膜性而成为目前最具有前景的生物材料及药剂辅料之一。通过加入碱性盐和制备CS衍生物可得到具有温敏特性的CS类水凝胶。
壳聚糖/甘油磷酸盐(chitosan/β-glycerophosphate, CS/β-GP) 体系由Chenite等[28]于2000年首次报道, 其可在人体温度下发生溶胶-凝胶相变, 具有作为血管栓塞剂的潜质[29]。CS在溶液pH值高于pKa (≈6.2) 时会因为链交联引起凝胶样沉淀物形成, 因此, 无法在生理环境(pH = 6.8~7.2) 下保持稳定, 而多元醇盐(β-GP) 的加入可将pH依赖性的CS溶液转变成温度/pH依赖性的混合物。研究表明, β-GP通过3种二级相互作用影响了CS (图 3): ①CS的氨基与GP的磷酸基团之间的静电相互作用[1]; ②GP的加入导致CS聚合物的中和, 静电排斥减弱导致CS链之间的氢键结合; ③CS分子之间的疏水作用[30]。CS的脱乙酰化度、β-GP的浓度、最终溶液的温度及pH值是影响CS/β-GP体系成胶速率和凝胶强度的关键因素, 钽粉[31]和碘基造影剂[32]的引入可用于增加CS/β-GP体系的不透X线性。Wang等[31]首次评估了CS/β-GP体系用于栓塞治疗的可行性。该团队以钽粉作为造影剂, 以7∶1的体积比制备了由2% CS和56% β-GP组成的混合液体。该液体制剂可完全闭塞兔肾动脉, 且在8周的观察期内没有发生血管再通。此外, CS/β-GP凝胶在扫描电子显微镜下显示相互连接的孔状结构(5~10 µm), 高度多孔的结构使CS/β-GP体系可作为大分子和小分子药物的良好储库, 具有作为栓塞治疗的可注射药物载体的潜力[30, 33]。Fatimi等[34]开发了一种负载硬化剂十二磺酸硫酸钠的新型可注射不透射线(iopamidol) CS/β-GP水凝胶。这种水凝胶材料表现出良好的机械性能、硬化性能及快速凝胶化的特点, 具有用于血管内动脉瘤修复后内漏治疗的广阔前景。Salis等[35]开发了载有吲哚菁绿(indocyanine, ICG) 的CS/β-GP溶液, ICG与CS之间强烈的静电相互作用可使其在该体系中稳定结合。这种混合溶液可在原位形成致密凝胶, 具有作为术中荧光成像和肝癌局部治疗栓塞剂的潜力。
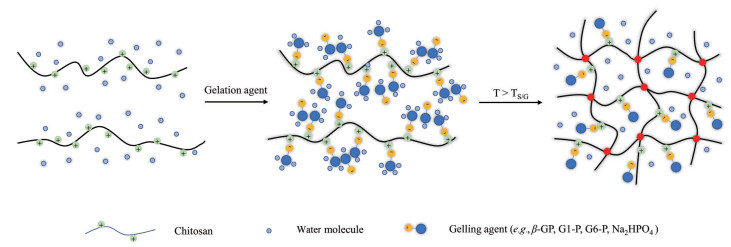
|
Figure 3 Schematic diagram of the formation chitosan/polyol phosphate hydrogel. β-GP: β-Glycerophosphate; G1-P: Glucose 1-phosphate; G6-P: Glucose-6-phosphate; TS/G: Sol-gel phase transition temperature |
除了β-GP诱导的CS的物理胶凝作用外, 其他胶凝剂(葡萄糖-1-磷酸、葡萄糖-6-磷酸等) 也可用于制备具有足够强度的CS类凝胶[36, 37]。例如, Zehtabi等[38]选用碳酸氢钠和磷酸缓冲液(pH 8) 作为制备CS凝胶的胶凝剂。通过改变胶凝剂的组成, CS凝胶的机械性能最终优化到体温下的初始储能模量(G′) 约为2 233 Pa。该团队还在温敏凝胶中加入强力霉素(一种基质金属蛋白酶抑制剂) 作为硬化性栓塞剂, 用于动脉瘤修复。这种强力霉素/壳聚糖凝胶对猪肾动脉的栓塞显示出86%的短期闭塞成功率, 而没有凝胶迁移或导管堵塞。
通过对CS分子上的羟基和/或氨基进行羟丁基、羟乙基和羧甲基等改性, 可得到具有温敏特性的CS衍生物。Wang[39]成功制备了温敏性羟丁基CS (hydroxybutyl chitosan, HBC), 该聚合物溶液在生理温度下可自发形成凝胶, 胶凝时间和胶凝温度可通过改变HBC溶液的浓度来调节。兔耳中动脉栓塞实验结果表明HBC凝胶能有效阻断动脉血流, 直至栓塞组织逐渐坏死。此外, HBC凝胶可负载DOX·HCl (1 mg·mL-1), 并具有良好的缓释性能, 小鼠乳腺癌4T1细胞在载药凝胶内部培养24 h后, 癌细胞数目显著下降。
1.2.3 聚环氧乙烷-聚环氧丙烷-聚环氧乙烷共聚物聚环氧乙烷-聚环氧丙烷-聚环氧乙烷三嵌段共聚物, 也称为泊洛沙姆, 是广泛用于药剂学和工业生产的非离子表面活性剂。泊洛沙姆407 (poloxamer 407, P407) 是泊洛沙姆系列中被研究最为广泛的一类, 其具有以下特性: ①高浓度(20%~30%) 下具有反向可逆热胶凝性质, 相变温度在人体体温附近; ②水溶性良好, 毒性低; ③独特的疏水内核-亲水外壳结构使P407通过疏水相互作用包裹疏水性药物。Raymond等[40]研究了P407作为临时血管栓塞剂的安全性和有效性。动物实验表明, 体内注射22%的P407可导致血管完全闭塞, 随后在10~90 min内完全再通而无并发症, 但其在体内的快速侵蚀限制了进一步的应用。Huang等[41]以P407、海藻酸钠(sodium alginate)、羟甲基纤维素(hydroxymethyl cellulose, HPMC) 和碘克沙醇(iodixanol) 为基质, 并引入Ca2+制备了一种新型温度响应性复合水凝胶(PSHI-Ca2+)。Ca2+的引入显著增加了凝胶强度和稳定性(凝胶质量保持5 h不变), 克服了PSHI在水环境中快速侵蚀(250 min后完全溶解) 的缺点, 这可能归因于Ca2+、P407、海藻酸钠和HPMC的共同相互作用。PSHI-Ca2+的凝胶温度为26.5 ℃, 可对兔VX2肿瘤及周围血管进行完全闭塞, 同时观察到肿瘤细胞的凋亡和坏死, 具有作为肝癌TAE治疗的液体栓塞剂的良好前景。但PSHI-Ca2+的注射过程较为复杂, 有待优化。
1.2.4 类丝弹性蛋白聚合物(silk-elastinlike protein polymers, SELPs)SELPs是由类丝蛋白模块(GAGAGS) 和类弹性蛋白模块(GXGVP, 其中X为除脯氨酸外的任意氨基酸) 串联重复组成的基因工程序列嵌段共聚物, 兼具丝蛋白优良的力学特性和弹性蛋白的刺激响应性和柔韧性, 同时具有性能高度可调性、良好的生物相容性和生物可降解性, 在药物控制释放、基因传输和组织工程等领域获得了广泛的关注。
部分SELPs (如SELP-47K、SELP-815K) 水溶液在注入人体时可迅速发生不可逆的热诱导溶胶-凝胶转变, 因此具有作为液体血管栓塞剂的潜能[42]。SELPs的流变学性质取决于聚合物的组成、浓度、温度及使用前的剪切加工过程等。例如, 12% (w/w) SELP-815K在5 min时的凝胶强度是同浓度SELP-47K的10倍, 因而更适合作为血管栓塞剂。这可能是由于SELP-815K与SELP-47K相比, 每个重复的类丝蛋白模块和类弹性蛋白模块嵌段的长度增加了1倍[42] (图 4)。该聚合物溶液具有良好的可注射性, 并可成功阻塞模拟血管系统流动条件的体外微流控装置和兔肝动脉的血液流动。与已上市的栓塞剂相比, SELPs所需施加的注射推力更小, 达到相同的血管阻塞程度所需材料体积更小(2~4 mL微球vs 0.8~0.9 mL SELPs)。此外, SELP-815K可通过物理混合负载DOX和索拉非尼, 从而具备用于肝癌TACE的潜能[43]。SELP-815K的总体载药量与临床规定的DC Bead的DOX载药量相当, 但索拉非尼由于电荷性质等而不能通过DC Bead递送。体外研究表明, 药物的基本形式对SELPs的流变学性质没有明显影响, 同时SELP液体栓塞系统对单药和两药联合递送可分别维持至少14和30天的治疗有效药物浓度。
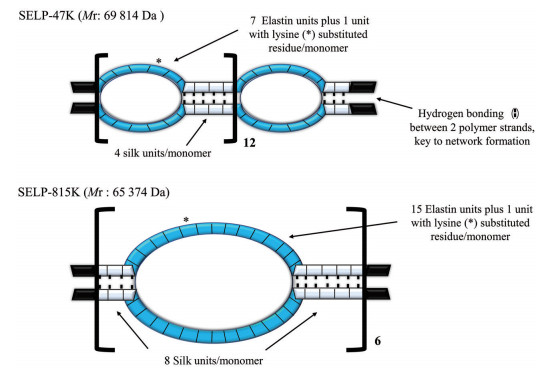
|
Figure 4 Schematic diagram of SELP-47K and SELP-815K protein polymer. SELP: Silk-elastinlike protein polymer |
与LCST型温度响应性聚合物相反, PNAGA类材料在某一温度以上时呈膨胀状态, 而在此温度以下呈机械性能更强的收缩凝胶态, 此温度则称为上临界溶解温度(upper critical solution temperature, UCST)[44]。近期, Shi等[45]合成了一种可用于肾动脉栓塞的温度响应性超分子共聚物水凝胶聚(N-丙烯酰基甘氨酰胺-co-丙烯酰胺) [p(N-acryloyl glycinamide-co-acrylamide), PNAGA-PAAm]。通过改变共聚单体的比例和浓度, 可以调节共聚物的溶胀度、G′和UCST。向PNAGA-PAAm溶胶中加入碘海醇后可得到UCST约为47 ℃的PNAGA-PAAm/碘海醇混合溶胶(PNAGA-PAAm-I)。在生理承受的温度范围内, PNAGA-PAAm-I可通过微导管顺利注射到兔子的肾动脉处。在37 ℃下, 溶胶能在原位快速地重新形成固体状的凝胶, 并且没有发生脱水现象, 成功阻断目标肾动脉, 在8周后仍没有发生再通现象。这些结果显示, 基于PNAGA的超分子共聚物水凝胶能对较大尺寸的动脉血管进行有效的栓塞。
1.3 离子交联原位凝胶离子交联原位凝胶是基于多聚物链中阴离子基团与金属阳离子间的静电相互作用而形成的水凝胶材料。无机离子的引入增强了水凝胶的柔韧性和机械强度, 赋予其优异的力学性能。其中, 海藻酸钙(calcium alginate, CA) 凝胶是研究最为广泛的离子交联原位凝胶栓塞剂[46]。CA凝胶是一种由海藻酸盐和氯化钙溶液组成的双组分生物相容性聚合物系统, 由于其固态的高机械强度和液态的低黏度而具有作为栓塞剂的潜力, 其相变机制在于Ca2+易与海藻酸盐链的G区(富含古洛糖醛酸) 进行离子交联[1], 促使多糖链间的弱极性相互作用被阳离子诱导的强静电相互作用所取代, 从而形成稳定的凝胶(图 5)。通过调节Ca2+含量、聚合物浓度和胶凝温度可以调节胶凝动力学和流变学性质。
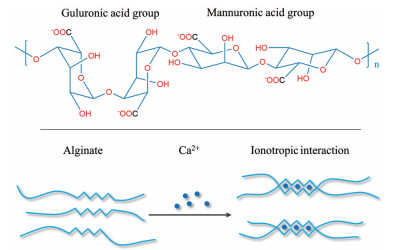
|
Figure 5 Alginate structure and gelation mechanism of calcium alginate gel |
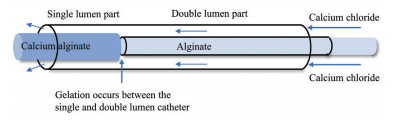
CA凝胶系统的主要优点是从导管中释放时的快速原位凝胶化, 而无需依赖血栓形成来进行阻塞, 在猪脑AVM模型[47]和动脉瘤[48]模型中已证实其具有良好的可注射性、血管穿透性、填充效果、机械稳定性和生物相容性。但该系统不具有成像功能, 同时需要海藻酸盐和Ca2+的分离递送(如同心导管/双腔导管) 以防止在导管内部发生聚合[49], 对操作经验有一定要求(图 6)。最近, Fan等[50]开发了一种不透射线液态金属/海藻酸钙(liquid metal/calcium alginate, LM/CA) 水凝胶。高质量密度LM液滴的引入使水凝胶可在X线和CT扫描下进行实时追踪, 并提高了水凝胶的柔韧性。体内实验表明LM/CA栓塞系统具有优异的栓塞效果, 治疗两周后兔耳部肿瘤明显缩小甚至消失。此外, Barnett等[51]开发了EmboGel/EmboClear联用液体栓塞剂。EmboGel在CA凝胶的基础上加入碘海醇, 可使产生的海藻酸钙凝胶具备不透X线性。EmboClear为海藻酸裂解酶和乙二胺四乙酸的混合物, 可在短时间内选择性溶解海藻酸钙凝胶。这种EmboGel/EmboClear系统可以逆转非靶向血管栓塞, 大大提高了海藻酸钙凝胶应用的安全性, 并已成功运用于兔动脉瘤和颅颈部循环的阻塞和再通。
|
Figure 6 Schematic diagram of the concentric tube microcatheter to deliver the alginate and CaCl2 |
LLCs是一定浓度的两亲性分子在水或极性溶剂中自组装形成的液晶材料。低黏度的液晶前驱体溶液注射到达栓塞部位后, 通过吸水形成高黏度原位立方液晶凝胶, 进而闭塞血管。
植烷三醇(phytantriol, PT) 是一种具有三羟基亲水头部和长碳链疏水尾部的生物相容性两亲性分子[52], 溶于水和有机溶剂的混合溶液中可得到低黏度、易于推注的前体溶液。该溶液与血液接触后, 在两者之间形成一个界面, 数秒内有机溶剂和血液迅速交换, 继而吸水溶胀原位形成具有生物黏附性的双菱形晶格型立方液晶[53]。Han等[54]首次报道了PT液晶作为新型栓塞剂的应用, 显示其可有效阻断肝动脉的血流, 并具有一定抗血流冲刷特性, 能长期滞留于病灶部位。此外, PT液晶不仅可以促进药物的持续释放, 而且可以负载不同极性的药物, 保护药物的生物活性, 有效克服羟基喜树碱[55]和多西紫杉醇[56]等药物的水溶性和/或稳定性差的问题。碘化油的引入可增加不透射线性, 并在一定程度上改善PT液晶的突释。最近, Fang等[57]以5-氟尿嘧啶(5-fluorouracil, 5-FU) 为模型药物, 开发了一种基于PT的新型液体栓塞剂。当植烷三醇、乙醇和水的三相比例为64∶16∶20时, 该液体栓塞剂具有最优的胶凝性能和栓塞效果, 可有效栓塞兔中耳动脉。同时, PT原位液晶可显著延长5-FU的生物半衰期和体内滞留时间, 具有用于肝癌TACE的前景。已有研究表明, 多西紫杉醇原位PT立方液晶栓塞治疗还可显著抑制兔VX2移植性肝癌的肿瘤生长速度[58]。
甘油单油酸酯(glyceryl monooleate, GMO) 是较早应用的溶致液晶基质材料, 但其在栓塞治疗中的应用的研究最近才有报道。Du等[59]首次以GMO为原料开发了一种新型液体血管栓塞剂。该团队通过构建GMO-水-乙醇三元相图, 选择了3种各向同性液体(isotropic liquids, ILs) [GMO∶乙醇∶水= 49∶21∶30、60∶20∶20和72∶18∶10 (w/w/w)] 作为潜在的液体栓塞剂。这些低黏度(30 mPa·s) 可注射前驱体ILs表现出优异的微导管输送能力和细胞相容性, 在与血液或水接触时自发转变为高黏度立方相凝胶, 在不到15 s内即可填充血管。在数字减影血管造影(digital subtraction angiography, DSA) 监测下, ILs可成功栓塞兔肾动脉, 栓塞后5周内无再通现象, 术后肾脏明显萎缩。这些数据表明, GMO液体栓塞剂在临床介入栓塞治疗中显示出可行性和有效性。但在输送GMO立方液晶前驱体前后, 都需要用乙醇彻底冲洗导管, 以避免因暴露于水时的相变而导致导管阻塞。
1.5 凝聚体 1.5.1 聚阳离子硫酸盐-聚阴离子肌醇六磷酸钠(salmine sulfate-inositol hexaphosphate, Sal-IP6) 凝聚体Sal-IP6凝聚体栓塞系统由Jones等[60]通过模拟含有相反聚电解质的海底流体黏合剂的化学性质开发得到, 其可响应环境中的NaCl浓度, 从高离子强度(如1.2 mol·L-1 NaCl) 下的可注射均质流体(黏度≈ 1 Pa·s) 转变成生理条件离子强度(如0.15 mol·L-1 NaCl) 下的刚性凝胶形态(黏度≈ 39.7 Pa·s) (图 7)。钽粉的引入可实现X射线下的可视化, 并导致黏度增加和反向剪切稀化行为。兔肾动脉经导管栓塞术表明, Sal-IP6凝聚体的穿透距离达4 cm, 可实现毛细血管水平穿透、均匀闭塞和肾脏供血的完全阻断, 且没有静脉循环的交叉栓塞和不良组织反应。由于Sal-IP6系统的相变机制依赖于NaCl向材料外的扩散, 因此未发生导管堵塞。这些数据表明, Sal-IP6系统作为一种离子依赖的凝聚物栓塞剂, 具有良好的可控性, 同时相比于NBCA和Onyx不会有黏连导管或使用有机溶剂的风险。

|
Figure 7 Schematic diagram of the preparation and solidification of Sal-IP6 embolic coacervate. Sal-IP6: Salmine sulfate-inositol hexaphosphate |
聚磷酸盐(polyphosphate, PP) 是磷酸盐单元通过共享氧原子连接形成的一种无机线性聚合物[61], 在其溶液中加入二价阳离子(M2+) 溶液会导致相分离和PP凝聚体的产生。这些液体可通过双腔导管输送到注射部位, 以形成阻塞血管的原位凝聚体。PP凝聚体的形成归因于M2+对聚磷酸链上负电荷的屏蔽, 并形成了疏水的M2+-磷酸配合物[62, 63]。PP凝聚体的外观和材料动力学取决于PP的浓度和聚合度, 以及M2+的种类。例如, Sr2+和Ba2+相比于Ca2+可与PP形成更为稳定的磷酸盐配位键, 因而形成的PP凝聚体具备更强的弹性和黏度[64], 同时降低了细胞毒性。Momeni等[65]证实PP凝聚体栓塞剂具有良好的体内生物相容性, 并成功闭塞了兔耳中央动脉。此外, PP凝聚体可促进凝血酶激活和随后的纤维蛋白生成, 增强血小板黏附, 缩短凝血时间, 表现出优异的止血性能[62]。另一份报道显示, PP凝聚体具有一定的药物包封能力, 其释放动力学受温度、pH值和蛋白质存在的影响[63]。但上述凝聚体存在降解和溶解速率快的局限性, 仅能作为短期栓塞剂。少量3价阳离子(M3+, 如Al3+、Ga3+) 的引入可减缓PP凝聚体的溶解速率, 这可能归因于M3+与磷酸基团间形成了更为直接的化学键, 进而更好地调整闭塞时间以满足临床要求[66]。
1.6 剪切稀化水凝胶(shear-thinning biomaterial, STB)STB是一种具有剪切稀化特性的特殊水凝胶材料, 因具有良好的可注射性、自愈性和输送细胞和生长因子的能力受到了极大的关注[67]。STB与经历溶胶-凝胶转变的其他原位凝胶系统不同, 其在注射前后均保持其天然凝胶结构。STB的可注射性取决于注射过程中高剪切速率下黏度的降低, 而血管闭塞可通过在递送后去除剪应力恢复STB强度来实现。
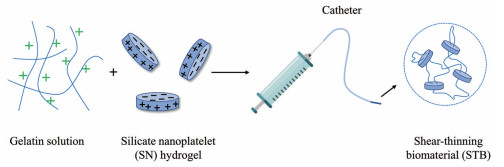
Avery等[68]最近设计了一种含有明胶和硅酸盐纳米片的剪切稀化纳米复合水凝胶血管栓塞系统。这种高电荷的合成生物活性硅酸盐纳米片的表面带负电荷, 边缘带正电荷。由于各向异性的电荷分布, 带正电荷的明胶与硅酸盐纳米片产生强烈的静电相互作用(图 8), 在外部刺激作用下自组装, 动态转变, 破裂, 并表现出剪切稀化行为。通过改变明胶和硅酸盐纳米片之间的比例可以调整STB的模量和黏度。在注射过程中, 该材料在导管和针头内表现出类似流体的行为。当应力消除后恢复到原始的凝胶态, 存储模量为200 Pa。此外, 明胶和硅酸盐纳米片均可促进血液凝固, 进一步稳定STB以避免凝胶迁移, 提示这种生物材料可能适合于抗凝治疗的患者或有凝血障碍的患者[69]。动物实验结果显示, STB可迅速阻断猪左髂外动脉(流速为100 cm·s-1) 血流, 对高流量目标血管具有稳定和完全的闭塞作用。CT和组织学分析显示, 猪模型栓塞24天后无再通现象, 且没有发生肺栓塞。组织学分析显示, 当STB被巨噬细胞或其他类型的细胞清除后, 增生的细胞会在空区沉积结缔组织, 从而确保稳定的、慢性的和不可再通的闭塞。这项研究表明STB具有作为止血栓塞剂的潜力[68]。
|
Figure 8 Schematic diagram of the formation of STB |
化学交联原位凝胶是化合物间通过迈克尔加成反应或席夫碱反应等形成共价键所构成的3D聚合物网络[8]。与物理交联原位凝胶不同, 共价交联本身是不可逆的, 因此可以制备机械强度和稳定性更强的材料。通过精确预测化学交联原位凝胶的反应动力学, 以液态前体溶液的形式注射入血管, 并最终在目标部位交联固化, 具有应用于栓塞治疗的潜在价值。下面根据化学反应类型的不同对化学交联原位凝胶的研究进行总结。
2.1 基于迈克尔加成反应的化学交联原位凝胶迈克尔加成反应是指亲电的共轭体系(电子受体) 与亲核的负碳离子(电子给体) 进行的共轭加成反应, 已被广泛用于化学交联原位凝胶的制备。聚丙二醇二丙烯酸酯-四(3-巯基丙酸) 季戊四醇酯[poly (propylene glycol) diacrylate-pentaerythritol tetrakis (3-mercaptopropionate), PPODA-QT] 溶液系统是目前在栓塞领域研究最多的此类凝胶。
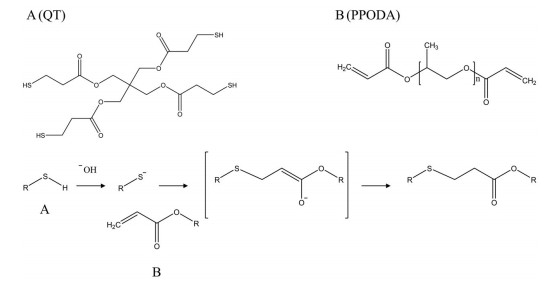
QT在造影剂(omnipaque/conray) 存在的碱性溶液中可发生巯基去质子化, 并与PPODA中的丙烯酸酯基发生迈克尔加成反应[70] (图 9)。PPODA-QT溶液体系在递送窗的范围应具有较低的黏度, 以保证在完全交联之前仍能够通过微导管。PPODA-QT系统的反应动力学、细胞毒性及交联后的长期稳定性受到pH值、有机单体的预混合时间、表面活性剂和造影剂种类的影响[70, 71]。例如, 与碘海醇系统相比, 在相同的预混合时间下碘肽葡胺系统中的胶凝时间更短(28.5 min vs 11.1 min), 这归因于碘肽葡胺在PPODA-QT有机相中具有更大的溶解度。此外, 碘代苯甲酰基聚乙二醇二丙烯酸酯[iodobenzoyl poly (ethylene glycol) diacrylate, IPEGA] 的引入可制备得到具有固有不透射线特性的碘基共价交联水凝胶栓塞剂[72]。一项小规模先导研究[73]证实PPODA-QT原位凝胶可促进猪颈动脉外侧壁动脉瘤的新生内膜组织生长, 同时不完全(80%~90%) 动脉瘤填充相对于完全(100%) 填充可能是一种更为安全有效的递送策略, 这可能归因于动脉瘤壁压力过大。该团队在犬侧壁动脉瘤模型上进一步评估PPODA-QT系统的长期疗效(6个月)[74]。结果表明, PPODA-QT原位凝胶可促进新生内膜组织更完全地覆盖动脉瘤颈部, 可能比传统的血管内线圈栓塞术更能降低动脉瘤栓塞后再通的风险。但PPODA-QT系统的存在未反应的QT (一种剧毒单体) 潜在泄漏的局限性。
|
Figure 9 Components and reaction scheme of PPODA-QT system. A: Pentaerythritol tetrakis (3-mercaptopropionate) (QT); B: Poly (propylene glycol) diacrylate (PPODA) |
席夫碱主要指含有亚胺或甲亚胺特性基团(-RC = N-) 的一类有机化合物, 通常由胺和活性羰基缩合而成。目前已报道的此类凝胶栓塞剂主要以含有氨基的壳聚糖类聚合物为原材料进行制备, 可通过席夫碱的水解作用和溶菌酶的降解作用进行生物降解, 并具有良好的生物相容性。Weng等[75]开发了含有碘基造影剂的羧甲基壳聚糖(carboxymethyl chitosan, CN)-氧化羧甲基纤维素(oxidized carboxymethyl cellulose, OCMC) 不透射线原位凝胶。动物实验显示, 前驱体混合溶液在栓塞手术过程中未发生堵塞, 同时比校准微球(100~300 µm) 实现了更远端动脉闭塞。同时, 该水凝胶高度多孔的内部结构(孔径为17 ± 4 µm) 赋予了其优异的载药和缓释性能。此外, 席夫碱反应所形成可逆亚胺键(一种动态共价化学键) 可用于制备具有损伤修复特性的自愈合水凝胶。Zhou等[76]基于乙二醇壳聚糖(glycol-chitosan, GC)、抗出血剂卡巴克洛和端二苯甲醛聚乙二醇[dibenzaldehyde-terminated poly (ethylene-glycol), DF-PEG] 研制了一种三组分自愈合壳聚糖动态水凝胶。通过席夫碱交联中亚胺键的解偶联和再偶联, 在GC、卡巴克洛和DF-PEG之间建立了明确的自愈合水凝胶网络(图 10)。这种水凝胶可以在生理条件下自愈, 并能够在注射过程中适应导管的形状, 抵抗递送过程中因剧烈运动而引起的破裂。大鼠的体内栓塞评价表明这种可注射自愈性水凝胶具有良好的栓塞效果, 在药物递送和癌症治疗中显示出潜在的应用前景。

|
Figure 10 Synthesis of carbazochrome-containing chitosan-PEG hydrogel. DF-PEG: Dibenzaldehyde-terminated poly (ethylene-glycol) |
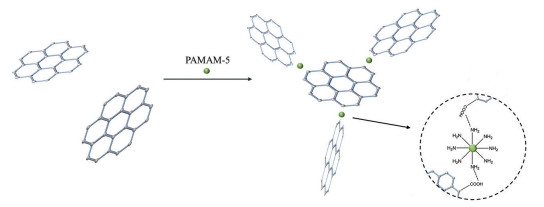
氧化石墨烯(graphene-oxide, GO) 是一种新型的二维碳纳米材料, 可用于改善水凝胶的力学性能。最近, Zhou等[77]开发了一种基于酰胺化反应的GO增强的聚合物水凝胶(GO enhanced polymer hydrogel, GPH), 其具有应用于脑血管疾病和恶性肿瘤TAE治疗的潜在价值。GPH的凝胶化机制为GO羧酸基团和第五代聚酰胺树枝状大分子[generation-five poly (amidoamine) dendrimer, PAMAM-5] 胺基之间的酰胺键共价交联, 并通过在PAMAM-5、NaOH和GO的预混合物中加入作为GO钝化羧基再活化剂的葡萄糖酸-δ-内酯(glucono-delta-lactone, GDL) 来触发凝胶的形成(图 11)。研究表明, NaOH/GDL比例可通过改变系统的pH而影响GPH的机械强度, 适当的比例可实现适用于栓塞治疗的可注射性和机械稳定性(储能模量和损耗模量分别为2 050 Pa和952 Pa)。此外, GPH/碘海醇混合物不仅实现了兔锁骨下动脉的完全栓塞, 而且通过血小板凝集作用刺激了血栓形成, 显示其作为液体栓塞剂的可行性。GPH临床转化的挑战在于其操作窗口有限, 延长注射时间可能会导致微导管内部水凝胶的堵塞。
|
Figure 11 Schematic diagram of the formation of GPH. PAMAM-5: Generation-five poly (amidoamine) dendrimer; GPH: Graphene-oxide enhanced polymer hydrogel |
尽管物理交联和化学交联原位凝胶在栓塞治疗应用中显示出巨大的潜力, 但均存在一定的缺陷。前者具有机械强度低的劣势, 在血流的恒定低频应力下表现出黏弹性流动, 可能会经历较大程度的蠕变。后者则可能较难注射, 并在体温下产生大幅溶胀。结合两种交联机制是克服上述不足的新策略, 可有效降低材料因低频应力产生的蠕变流动, 改善前体溶液在不规则血管中的可递送性, 并在提高弹性模量的同时减少水凝胶的过度溶胀。
目前已报道的物理/化学交联原位凝胶栓塞剂主要是PNIPAM类温敏材料和多功能硫醇化合物/聚合物的混合体系, 包括聚(N-异丙基丙烯酰胺-co-半胱胺) [poly (NIPAAm-co-cysteamine), NC][78]、聚(N-异丙基丙烯酰胺-半胱胺-co-乙烯砜) [poly (NIPAAm-cysteamine-co-vinylsulfone), NCVS][79]和聚(N-异丙基丙烯酰胺-co-HEMA-丙烯酸酯) [poly (NIPAAm-co-HEMA-acrylate), NHA][80]。这些混合溶液在室温下具有良好的可注射性, 并在体温的驱动下会迅速形成固体凝胶。而后, 聚合物之间通过硫醇和丙烯酸酯之间的迈克尔加成反应进行化学交联, 进一步固化和增强机械性能, 保持长期稳定性。硫醇和丙烯酸酯的数量和类型、预混合时间、缓冲液pH及聚合物分子质量是影响凝胶化动力学的主要因素。例如, NCVS中的乙烯砜基团相比于NHA具有更高的交联密度和迈克尔加成反应活性, 反应速率更快, 并且形成的凝胶形态更为致密, 稳定性和机械性能更强。此外, 延长预混合时间有助于聚合物混合更加均匀, 从而增加活性基团之间的碰撞, 减少胶凝时间[80]。
Bearat等[79]评估了NC-NHA系统和NC-NCVS系统作为动脉瘤栓塞剂的可能性。结果表明两种系统均可改善材料的性能, 增加弹性模量, 降低低频恒定应力的影响, 同时具有良好的细胞相容性。值得注意的是, 两种系统在体外1.5年内均未降解, 溶胀率保持稳定。此外, 大鼠皮下植入实验(1周和4周) 中仅观察到较小的慢性炎症, 而无系统的毒性反应。同时, 体外玻璃模型和体内猪模型的实验结果表明两种系统均易通过导管输送到动脉瘤部位。这些结果表明, 基于PNIPAM的物理/化学交联水凝胶在动脉瘤等疾病的栓塞治疗中具有潜在的应用前景。
4 不同类型原位凝胶栓塞剂的特点及在疾病中的应用 4.1 物理交联原位凝胶栓塞剂物理交联原位凝胶栓塞剂是研究最为广泛的原位凝胶栓塞剂, 由于凝胶形成机制和理化性质的不同, 各种物理交联原位凝胶栓塞剂具有不同的使用特点。温度响应性水凝胶是最早研究作为栓塞剂的原位凝胶材料, 其优势在于只借助体内外的温度变化而不依赖其他条件就可发生溶胶-凝胶相变[13], 并具有良好的材料可修饰性[16-21, 39]。但其可能存在生理温度下长距离递送中途阻塞的限制, 并缺乏与多种治疗药物相互作用的离子基团[3]。目前温度响应性原位凝胶主要被报道用于动脉瘤[34, 38]、AVM[81]和肝癌[41, 43]的栓塞治疗研究。pH响应性原位凝胶的递送不受限于生理温度, 可克服温度响应性原位凝胶的导管阻塞问题, 同时可通过静电相互作用结合抗肿瘤(如DOX) 或其他类型药物, 多用于肝癌TACE治疗新型栓塞剂的开发[3, 7, 9]。离子交联凝胶由于引入金属离子(如Ca2+) 而具有更优的力学性能, 同时研究较成熟, 具有应用于动脉瘤[47]、AVM[48]和肝癌[50]等疾病TAE治疗的良好前景。LLCs的优点在于其不仅具备在血液环境中相变阻断血流的特点[54], 同时可荷载和缓释不同极性的药物, 有效提高药物的血药浓度和生物利用度, 在肝癌TACE治疗中潜力巨大[56, 57]。凝聚体和剪切稀化水凝胶为最近报道的两类原位凝胶栓塞剂, 均可促进凝血酶激活和纤维蛋白生成[62, 69], 并有效阻断实验动物的动脉血流[65, 68], 可作为良好的止血栓塞材料。
4.2 化学交联原位凝胶栓塞剂化学交联原位凝胶由于共价键的形成而具有更强的机械性能和稳定性, 但其局限性在于: ①由于双组分系统特性而导致的手术过程的复杂性和技术依赖性[3]; ②交联时间不能准确控制而导致的导管内过早凝胶化或出导管后的稀释[7]; ③原位交联后在体内溶胀所导致的不稳定性[78]。目前报道的此类原位凝胶栓塞剂主要基于迈克尔加成反应[70]、席夫碱反应[72]和酰胺化反应[74]。PPODA-QT凝胶系统可在造影剂存在下进行原位交联, 并可与碘基聚合物进行共聚, 具有良好的不透射线性[72]。此外, PPODA-QT凝胶系统可实现动脉瘤的完全填充, 促进新生内膜组织的生长, 目前主要用于动脉瘤新型栓塞剂的开发[73, 74]。CN-OCMC系统[75]和GC/DF-PEG/carbazochrome三组分自愈水凝胶[76]具有良好的载药缓释性能和生物可降解性, 原料廉价易得, 在动脉瘤、癌症栓塞治疗和药物递送方面具有良好的前景。GPH[77]为最新研究的一种化学交联原位凝胶栓塞剂, 引入GO后材料具备更为优良的力学性能, 交联后稳定性增强, 在高速血流下不易破碎, 并减少了栓塞时间和毒性, 具有应用于肿瘤和脑血管疾病的栓塞治疗中的潜能。
4.3 物理/化学交联原位凝胶栓塞剂物理/化学交联原位凝胶结合了两种交联机制的优势, 物理交联显著提高了材料的可注射性和在体内的亲水-疏水平衡性, 而化学交联则提高了机械强度, 克服了血流恒定低频应力所导致的蠕变[78]。目前的研究主要集中于PNIPAM类温敏材料和多功能硫醇化合物/聚合物的混合体系的体外性能和生物安全性[80], 体内相关报道文献较少, 还存在巨大的开发空间。现有研究显示, 尽管物理/化学交联水凝胶栓塞剂仍需进一步优化, 但在动脉瘤等血管疾病的栓塞治疗中具有潜在的应用前景[79]。
5 总结与展望经导管血管栓塞术是临床介入治疗中的常用方法, 而栓塞剂的栓塞效果则直接决定了治疗结果。尽管已有多种不同类型的栓塞剂上市并在临床进行应用, 但这些产品的局限性需引起足够重视。目前主流学术观点认为理想的血管栓塞剂应具备以下特性[1, 82]: ①快速有效地阻断目标血管的血流; ②优异的可递送性或可注射性; ③良好的生物相容性和/或免疫调节作用; ④足够的机械强度防止材料的碎片化和迁移; ⑤在影像学手段(DSA、CT、磁共振成像等) 下的示踪性; ⑥可作为治疗性药物(如抗肿瘤药物) 的递送载体; ⑦一定的生物可降解性(取决于应用); ⑧原材料来源广泛、易得和可操作性强。
可注射的原位凝胶是当前新型血管栓塞剂的研究热点, 其在给药时(注射器和导管内) 和操作后(在体内) 可通过物理交联和/或化学交联以及剪切稀化行为发生材料的相变, 形成固体凝胶从而实现血管栓塞。原位凝胶栓塞剂不仅具有良好的血管穿透性和填充效果, 同时不涉及血管和导管的黏附以及DMSO等毒性溶剂的使用, 具备更优的安全性、可操作性、栓塞性能和一定的载药缓释能力, 其灵活性可满足不同疾病类型的栓塞治疗需求。但这些材料在进行使用或临床转化时, 一些关键性问题和参数不可忽视。第一, 黏度决定了原位凝胶栓塞剂经导管递送的可行性。低黏度液体可能会通过靶标部位进入静脉侧, 而高黏度物质可能不会到达病灶, 而只会阻塞近端动脉, 临界黏度值取决于目标血管的直径和压强。例如, 对于AVM和毛细血管, 30~150 mPa·s内的低黏度前驱体溶液是最佳的[83]; 第二, G′和耗损模量(G′′) 决定了原位凝胶栓塞剂的机械强度和长期稳定性。G′是衡量材料刚性和凝胶网络交联的指标, 其代表了原位凝胶栓塞剂阻塞血管及承受血压而不破裂的能力, 而G′′提供了材料是否经历应力松弛而耗散能量的信息。有研究指出, 初始G′达到600~800 Pa以上才能抵抗200 mmHg的压强, 实现良好的血管闭塞[32]; 第三, 胶凝时间与递送窗口和手术持续时间密切相关, 以避免因提前凝胶化而引起导管阻塞。例如, 对于温度响应性原位凝胶栓塞剂, 由于长导管可能在水凝胶前体溶液递送之前就已到达体温, 因此过快的温度触发的溶胶-凝胶转变可能会对手术过程造成不良影响; 第四, 原位凝胶栓塞剂的载药缓释性能取决于材料结构和离子强度。大部分原位凝胶栓塞剂呈现高度多孔的结构, 可通过物理混合的方式进行药物负载, 并随着材料的崩解(生物酶解、共价键水解等) 和扩散作用进行缓释。但这种载药方式具有一定的局限性(尤其对于疏水性药物), 而一些可与治疗药物产生静电相互作用(如pH响应性水凝胶) 或形成化学键合的材料可能具有更高的载药量和缓释性能[4]。其他关键性参数还有注射力、示踪性、生物相容性以及可回收性等。
目前大多数可注射原位凝胶栓塞剂仍处于临床前研究阶段, 未来的临床转化可能将面临诸多挑战: ①对临床手术设备要求较高(如CA凝胶和凝聚体需要使用同心管等); ②对临床医务人员的工作经验要求较高(如对递送窗的精准把握, 根据血管位置和大小调整原位凝胶前体用量等); ③缺乏完整统一的临床操作规程(文献报道的同一类型的原位凝胶栓塞剂的使用流程等不尽一致等); ④一定的生物安全性问题(如有机单体的泄漏、误栓后的处理问题等); ⑤部分载药原位凝胶栓塞剂(如温度响应性水凝胶) 存在药物突释的问题, 可能会影响临床治疗效果。但随着新型材料学科的快速发展和临床栓塞技术的不断创新, 将来必将会有更多的原位凝胶栓塞剂进入临床实际应用。
作者贡献: 史新萌收集资料和撰写; 陈彦和瞿鼎给出了关键性的意见和修改思路。
利益冲突: 所有作者声明没有任何利益冲突。
| [1] |
Hu J, Albadawi H, Chong BW, et al. Advances in biomaterials and technologies for vascular embolization[J]. Adv Mater, 2019, 31: e1901071. DOI:10.1002/adma.201901071 |
| [2] |
Loffroy R, Guiu B, Cercueil JP, et al. Endovascular therapeutic embolisation: an overview of occluding agents and their effects on embolised tissues[J]. Curr Vasc Pharmacol, 2009, 7: 250-263. DOI:10.2174/157016109787455617 |
| [3] |
Nguyen QV, Lee MS, Lym JS, et al. pH-sensitive sulfamethazine-based hydrogels as potential embolic agents for transcatheter vascular embolization[J]. J Mater Chem B, 2016, 4: 6524-6533. DOI:10.1039/C6TB01690A |
| [4] |
Lym JS, Nguyen QV, Ahn da W, et al. Sulfamethazine-based pH-sensitive hydrogels with potential application for transcatheter arterial chemoembolization therapy[J]. Acta Biomater, 2016, 41: 253-263. DOI:10.1016/j.actbio.2016.05.018 |
| [5] |
O'Leary JA. Tissue adhesives and pelvic hemostasis: an evaluation of isobutyl 2-cyanoacrylate[J]. J Surg Oncol, 1971, 3: 117-120. DOI:10.1002/jso.2930030204 |
| [6] |
Kónya A, Stephens LC, Wright KC. Pure ethiodized oil as a capillary embolic agent with and without ethanol-ethiodol mixture in the rabbit kidney: embolic efficacy and temporal histopathologic findings[J]. J Vasc Interv Radiol, 2010, 21: 1091-1099. DOI:10.1016/j.jvir.2010.02.037 |
| [7] |
Nguyen QV, Lym JS, Huynh CT, et al. A novel sulfamethazine-based pH-sensitive copolymer for injectable radiopaque embolic hydrogels with potential application in hepatocellular carcinoma therapy[J]. Polym Chem, 2016, 7: 5805. DOI:10.1039/C6PY01141A |
| [8] |
Park KM, Park KD. In situ cross-linkable hydrogels as a dynamic matrix for tissue regenerative medicine[J]. Tissue Eng Regen Med, 2018, 15: 547-557. DOI:10.1007/s13770-018-0155-5 |
| [9] |
Huynh CT, Nguyen QV, Lym JS, et al. Intraarterial gelation of injectable cationic pH/temperature-sensitive radiopaque embolic hydrogels in a rabbit hepatic tumor model and their potential application for liver cancer treatment[J]. RSC Adv, 2016, 6: 47687-47697. DOI:10.1039/C6RA03263J |
| [10] |
Nigro V, Angelini R, Bertoldo M, et al. Chemical-physical behaviour of microgels made of interpenetrating polymer networks of PNIPAM and poly (acrylic acid)[J]. Polymers (Basel), 2021, 13: 1353. DOI:10.3390/polym13091353 |
| [11] |
Yang L, Fan X, Zhang J, et al. Preparation and characterization of thermoresponsive poly (N-isopropylacrylamide) for cell culture applications[J]. Polymers (Basel), 2020, 12: 389. DOI:10.3390/polym12020389 |
| [12] |
Doberenz F, Zeng K, Willems C, et al. Thermoresponsive polymers and their biomedical application in tissue engineering- a review[J]. J Mater Chem B, 2020, 8: 607-628. |
| [13] |
Matsumaru Y, Hyodo A, Nose T, et al. Application of thermosensitive polymers as a new embolic material for intravascular neurosurgery[J]. J Biomater Sci Polym Ed, 1996, 7: 795-804. DOI:10.1163/156856296X00138 |
| [14] |
Sheng XZ, Liu ZQ, Wu LB, et al. Technical feasibility and histopathologic studies of poly (N-isopropylacrylamide) as a non-adhesive embolic agent in swine rete mirabile[J]. Chin Med J (Engl), 2006, 119: 391-396. DOI:10.1097/00029330-200603010-00007 |
| [15] |
Wang J, Pang Q, Liu Z, et al. A new liquid agent for endovascular embolization: initial clinical experience[J]. ASAIO J, 2009, 55: 494-497. DOI:10.1097/MAT.0b013e3181b4b5b7 |
| [16] |
Zhao H, Zheng C, Feng G, et al. Temperature-sensitive poly (N-isopropylacrylamide-co-butyl methylacrylate) nanogel as an embolic agent: distribution, durability of vascular occlusion, and inflammatory reactions in the renal artery of rabbits[J]. Am J Neuroradiol, 2013, 34: 169-176. DOI:10.3174/ajnr.A3177 |
| [17] |
Chen X, Huang L, Sun HJ, et al. Stimuli-responsive nanocomposite: potential injectable embolization agent[J]. Macromol Rapid Commun, 2014, 35: 579-584. DOI:10.1002/marc.201300720 |
| [18] |
Dai F, Tang L, Yang J, et al. Fast thermoresponsive BAB-type HEMA/NIPAAm triblock copolymer solutions for embolization of abnormal blood vessels[J]. J Mater Sci Mater Med, 2009, 20: 967-974. |
| [19] |
Qian K, Ma Y, Wan J, et al. The studies about doxorubicin-loaded p (N-isopropyl-acrylamide-co-butyl methylacrylate) temperature-sensitive nanogel dispersions on the application in TACE therapies for rabbit VX2 liver tumor[J]. J Control Release, 2015, 212: 41-49. DOI:10.1016/j.jconrel.2015.06.013 |
| [20] |
Lee BH, Leon C, McLemore R, et al. Synthesis and characterization of thermo-sensitive radio-opaque poly (N-isopropylacrylamide-co-PEG-2-iodobenzoate)[J]. J Biomater Sci Polym Ed, 2011, 22: 2357-2367. DOI:10.1163/092050610X539541 |
| [21] |
Li X, Liu W, Ye G, et al. Thermosensitive N-isopropylacrylamide-N-propylacrylamide-vinyl pyrrolidone terpolymers: synthesis, characterization and preliminary application as embolic agents[J]. Biomaterials, 2005, 26: 7002-7011. DOI:10.1016/j.biomaterials.2005.05.094 |
| [22] |
Xiong W. The Study of Dual Temperature/pH Sensitive Nanogels on the Construction, Drug Conjugation and Innovatice Vascular Embolization Materials (温度/pH双重敏感纳米凝胶的构建、药物偶联与新型血管栓塞材料的研究) [D]. Wuhan: Huazhong University of Science and Technology, 2011.
|
| [23] |
Xu X, Liu Y, Fu W, et al. Poly (N-isopropylacrylamide)-based thermoresponsive composite hydrogels for biomedical applications[J]. Polymers (Basel), 2020, 12: 580. DOI:10.3390/polym12030580 |
| [24] |
Wu L. Preparation, Characterization and Biological Evaluation of BC Whisker/P (NiPAAm-co-BMA) Nanogel Complex for Enterventional Therapy of Hepatocellular Carcinoma (肝癌介入治疗用的BC晶须/聚(N-异丙基丙烯酰胺-co-甲基丙烯酸丁酯) 复合物的制备、表征及相关生物学评价) [D]. Wuhan: Huazhong University of Science and Technology, 2012.
|
| [25] |
Liu Y, Peng X, Qian K, et al. Temperature sensitive p (N-isopropylacrylamide-co-acrylic acid) modified gold nanoparticles for trans-arterial embolization and angiography[J]. J Mater Chem B, 2017, 5: 907-916. DOI:10.1039/C6TB02383E |
| [26] |
Ma Y, Wan J, Qian K, et al. The studies on highly concentrated complex dispersions of gold nanoparticles and temperature-sensitive nanogels and their application as new blood-vessel-embolic materials with high-resolution angiography[J]. J Mater Chem B, 2014, 2: 6044-6053. DOI:10.1039/C4TB00748D |
| [27] |
Zhang YY, Du LN, Jin YG. Application of environmentally sensitive hydrogels in drug delivery[J]. Acta Pharm Sin (药学学报), 2012, 47: 652-656. |
| [28] |
Chenite A, Chaput C, Wang D, et al. Novel injectable neutral solutions of chitosan form biodegradable gels in situ[J]. Biomaterials, 2000, 21: 2155-2161. DOI:10.1016/S0142-9612(00)00116-2 |
| [29] |
Ning X, Zhao C, Pang J, et al. Experimental study of temperature-sensitive chitosan/β-glycerophosphate embolic material in embolizing the basicranial rete mirabile in swines[J]. Exp Ther Med, 2015, 10: 316-322. DOI:10.3892/etm.2015.2479 |
| [30] |
Ruel-Gariépy ER, Chenite A, Chaput C, et al. Characterization of thermosensitive chitosan gels for the sustained delivery of drugs[J]. Int J Pharm, 2000, 203: 89-98. DOI:10.1016/S0378-5173(00)00428-2 |
| [31] |
Wang Y, Xu N, Luo Q, et al. In vivo assessment of chitosan/β-glycerophosphate as a new liquid embolic agent[J]. Interv Neuroradiol, 2011, 17: 87-92. |
| [32] |
Fatimi A, Zehtabi F, Lerouge S. Optimization and characterization of injectable chitosan-iodixanol-based hydrogels for the embolization of blood vessels[J]. J Biomed Mater Res B Appl Biomater, 2016, 104: 1551-1562. DOI:10.1002/jbm.b.33500 |
| [33] |
Pakzad Y, Fathi M, Omidi Y, et al. Synthesis and characterization of timolol maleate-loaded quaternized chitosan-based thermosensitive hydrogel: a transparent topical ocular delivery system for the treatment of glaucoma[J]. Int J Biol Macromol, 2020, 159: 117-128. DOI:10.1016/j.ijbiomac.2020.04.274 |
| [34] |
Fatimi A, Chabrot P, Berrahmoune S, et al. A new injectable radiopaque chitosan-based sclerosing embolizing hydrogel for endovascular therapies[J]. Acta Biomater, 2012, 8: 2712-2721. DOI:10.1016/j.actbio.2012.04.006 |
| [35] |
Salis A, Rassu G, Budai-Szűcs M, et al. Development of thermosensitive chitosan/glicerophospate injectable in situ gelling solutions for potential application in intraoperative fluorescence imaging and local therapy of hepatocellular carcinoma: a preliminary study[J]. Expert Opin Drug Deliv, 2015, 12: 1583-1596. DOI:10.1517/17425247.2015.1042452 |
| [36] |
Supper S, Anton N, Seidel N, et al. Rheological study of chitosan/polyol-phosphate systems: influence of the polyol part on the thermo-induced gelation mechanism[J]. Langmuir, 2013, 29: 10229-10237. DOI:10.1021/la401993q |
| [37] |
Tan H, Rubin JP, Marra KG. Injectable in situ forming biodegradable chitosan-hyaluronic acid-based hydrogels for adipose tissue regeneration[J]. Organogenesis, 2010, 6: 173-180. DOI:10.4161/org.6.3.12037 |
| [38] |
Zehtabi F, Ispas-Szabo P, Djerir D, et al. Chitosan-doxycycline hydrogel: an MMP inhibitor/sclerosing embolizing agent as a new approach to endoleak prevention and treatment after endovascular aneurysm repair[J]. Acta Biomater, 2017, 64: 94-105. DOI:10.1016/j.actbio.2017.09.021 |
| [39] |
Wang QQ. The Research of Hydroxybutyl Chitosan Sensitive Hydrogel as a Blood Vessel Embolism Carrier (羟丁基壳聚糖温敏水凝胶及其血管栓塞载体的研究) [D]. Qingdao: Ocean University of China, 2013.
|
| [40] |
Raymond J, Metcalfe A, Salazkin I, et al. Temporary vascular occlusion with poloxamer 407[J]. Biomaterials, 2004, 25: 3983-3989. DOI:10.1016/j.biomaterials.2003.10.085 |
| [41] |
Huang L, Shen M, Li R, et al. Thermo-sensitive composite hydrogels based on poloxamer 407 and alginate and their therapeutic effect in embolization in rabbit VX2 liver tumors[J]. Oncotarget, 2016, 7: 73280-73291. DOI:10.18632/oncotarget.11789 |
| [42] |
Poursaid A, Price R, Tiede A, et al. In situ gelling silk-elastin like protein polymer for transarterial chemoembolization[J]. Biomaterials, 2015, 57: 142-152. DOI:10.1016/j.biomaterials.2015.04.015 |
| [43] |
Poursaid A, Jensen MM, Nourbakhsh I, et al. Silk-elastin like protein polymer liquid chemoembolic for localized release of doxorubicin and sorafenib[J]. Mol Pharm, 2016, 13: 2736-2748. DOI:10.1021/acs.molpharmaceut.6b00325 |
| [44] |
Sánchez-Moreno P, de Vicente J, Nardecchia S, et al. Thermo-sensitive nanomaterials: recent advance in synthesis and biomedical applications[J]. Nanomaterials (Basel), 2018, 8: 935. DOI:10.3390/nano8110935 |
| [45] |
Shi X, Gao H, Dai F, et al. A thermoresponsive supramolecular copolymer hydrogel for the embolization of kidney arteries[J]. Biomater Sci, 2016, 4: 1673-1681. DOI:10.1039/C6BM00597G |
| [46] |
Vaidya S, Tozer KR, Chen J. An overview of embolic agents[J]. Semin Intervent Radiol, 2008, 25: 204-215. DOI:10.1055/s-0028-1085930 |
| [47] |
Becker TA, Kipke DR, Preul MC, et al. In vivo assessment of calcium alginate gel for endovascular embolization of a cerebral arteriovenous malformation model using the Swine rete mirabile[J]. Neurosurgery, 2002, 51: 453-459. DOI:10.1097/00006123-200208000-00028 |
| [48] |
Becker TA, Preul MC, Bichard WD, et al. Preliminary investigation of calcium alginate gel as a biocompatible material for endovascular aneurysm embolization in vivo[J]. Neurosurgery, 2007, 60: 1119-1128. DOI:10.1227/01.NEU.0000255447.90106.12 |
| [49] |
Soga Y, Preul MC, Furuse M, et al. Calcium alginate provides a high degree of embolization in aneurysm models: a specific comparison to coil packing[J]. Neurosurgery, 2004, 55: 1401-1409. DOI:10.1227/01.NEU.0000143616.22174.67 |
| [50] |
Fan L, Duan M, Xie Z, et al. Injectable and radiopaque liquid metal/calcium alginate hydrogels for endovascular embolization and tumor embolotherapy[J]. Small, 2020, 16: e1903421. DOI:10.1002/smll.201903421 |
| [51] |
Barnett BP, Gailloud P. Assessment of emboGel- a selectively dissolvable radiopaque hydrogel for embolic applications[J]. J Vasc Interv Radiol, 2011, 22: 203-211. DOI:10.1016/j.jvir.2010.10.010 |
| [52] |
Akbar S, Anwar A, Ayish A, et al. Phytantriol based smart nano-carriers for drug delivery applications[J]. Eur J Pharm Sci, 2017, 101: 31-42. DOI:10.1016/j.ejps.2017.01.035 |
| [53] |
Qin LZ, Zhang X, Wu LN, et al. Preparation and in vitro embolic efficiency evaluation of hydroxycamptothecine-loaded liquid embolic agent[J]. Acta Pharm Sin (药学学报), 2014, 49: 1069-1075. |
| [54] |
Han K, Wang ZH, Dong YX, et al. Investigation on biocompatibility and in vivo characteristics of in situ phytantriol liquid crystalline[J]. Chin Pharm J (中国药学杂志), 2010, 45: 611-616. |
| [55] |
Qin L, Mei L, Shan Z, et al. Phytantriol based liquid crystal provide sustained release of anticancer drug as a novel embolic agent[J]. Drug Dev Ind Pharm, 2016, 42: 307-316. DOI:10.3109/03639045.2015.1052079 |
| [56] |
Han K, Pan X, Chen M, et al. Phytantriol-based inverted type bicontinuous cubic phase for vascular embolization and drug sustained release[J]. Eur J Pharm Sci, 2010, 41: 692-699. DOI:10.1016/j.ejps.2010.09.012 |
| [57] |
Fang X, Shen A. Preparation and evaluation of phytantriol liquid crystal as a liquid embolic agent[J]. Pharm Dev Technol, 2020, 25: 610-616. DOI:10.1080/10837450.2020.1725046 |
| [58] |
Han K, Ye LK, Wu CB. Pharmacodynamic evaluation of docetaxel-load phytantriol cubic liquid crystal in-situ for hepatical arterial embolization[J]. Chin J Hosp Pharm (中国医院药学杂志), 2014, 34: 1438-1442. |
| [59] |
Du LR, Lu XJ, Guan HT, et al. Development and evaluation of liquid embolic agents based on liquid crystalline material of glyceryl monooleate[J]. Int J Pharm, 2014, 471: 285-296. DOI:10.1016/j.ijpharm.2014.05.036 |
| [60] |
Jones JP, Sima M, O'Hara RG, et al. Water-borne endovascular embolics inspired by the undersea adhesive of marine sandcastle worms[J]. Adv Healthc Mater, 2016, 5: 795-801. DOI:10.1002/adhm.201500825 |
| [61] |
Müller WEG, Tolba E, Wang S, et al. Nanoparticle-directed and ionically forced polyphosphate coacervation: a versatile and reversible core-shell system for drug delivery[J]. Sci Rep, 2020, 10: 17147. DOI:10.1038/s41598-020-73100-5 |
| [62] |
Momeni A, Filiaggi MJ. Comprehensive study of the chelation and coacervation of alkaline earth metals in the presence of sodium polyphosphate solution[J]. Langmuir, 2014, 30: 5256-5266. DOI:10.1021/la500474j |
| [63] |
Momeni A, Filiaggi MJ. Degradation and hemostatic properties of polyphosphate coacervates[J]. Acta Biomater, 2016, 41: 328-341. DOI:10.1016/j.actbio.2016.06.002 |
| [64] |
Momeni A, Filiaggi MJ. Rheology of polyphosphate coacervates[J]. J Rheol, 2016, 60: 25-34. DOI:10.1122/1.4935127 |
| [65] |
Momeni A, Valliant EM, Brennan-Pierce EP, et al. Developing an in situ forming polyphosphate coacervate as a new liquid embolic agent: from experimental design to pilot animal study[J]. Acta Biomater, 2016, 32: 286-297. DOI:10.1016/j.actbio.2015.12.012 |
| [66] |
Valliant EM, Filiaggi MJ. Impact of trivalent ions on the stability and cohesion of calcium polyphosphate coacervates for embolization applications[J]. J Biomed Mater Res B Appl Biomater, 2019, 107: 2638-2648. DOI:10.1002/jbm.b.34353 |
| [67] |
Mealy JE, Chung JJ, Jeong HH, et al. Injectable granular hydrogels with multifunctional properties for biomedical applications[J]. Adv Mater, 2018, 30: e1705912. DOI:10.1002/adma.201705912 |
| [68] |
Avery RK, Albadawi H, Akbari M, et al. An injectable shear-thinning biomaterial for endovascular embolization[J]. Sci Transl Med, 2016, 8: 365ra156. |
| [69] |
Baker SE, Sawvel AM, Zheng N, et al. Controlling bioprocesses with inorganic surfaces: layered clay hemostatic agents[J]. Chem Mater, 2007, 19: 4390-4392. DOI:10.1021/cm071457b |
| [70] |
Brennecka CR, Preul MC, Vernon BL. In vitro delivery, cytotoxicity, swelling, and degradation behavior of a liquid-to-solid gelling polymer system for cerebral aneurysm embolization[J]. J Biomed Mater Res B Appl Biomater, 2012, 100: 1298-1309. |
| [71] |
Riley CM, McLemore R, Preul MC, et al. Gelling process differences in reverse emulsion, in situ gelling polymeric materials for intracranial aneurysm embolization, formulated with injectable contrast agents[J]. J Biomed Mater Res B Appl Biomater, 2011, 96: 47-56. |
| [72] |
Blakely B, Hoon Lee B, Riley C, et al. Formulation and characterization of radio-opaque conjugated in situ gelling materials[J]. J Biomed Mater Res B Appl Biomater, 2010, 93: 9-17. |
| [73] |
Brennecka CR, Preul MC, Bichard WD, et al. In vivo experimental aneurysm embolization in a swine model with a liquid-to-solid gelling polymer system: initial biocompatibility and delivery strategy analysis[J]. World Neurosurg, 2012, 78: 469-480. DOI:10.1016/j.wneu.2011.10.029 |
| [74] |
Brennecka CR, Preul MC, Becker TA, et al. In vivo embolization of lateral wall aneurysms in canines using the liquid-to-solid gelling PPODA-QT polymer system: 6-month pilot study[J]. J Neurosurg, 2013, 119: 228-238. DOI:10.3171/2013.3.JNS121865 |
| [75] |
Weng L, Rostambeigi N, Zantek ND, et al. An in situ forming biodegradable hydrogel-based embolic agent for interventional therapies[J]. Acta Biomater, 2013, 9: 8182-8191. DOI:10.1016/j.actbio.2013.06.020 |
| [76] |
Zhou X, Li Y, Chen S, et al. Dynamic agent of an injectable and self-healing drug-loaded hydrogel for embolization therapy[J]. Colloids Surf B Biointerfaces, 2018, 172: 601-607. DOI:10.1016/j.colsurfb.2018.09.016 |
| [77] |
Zhou F, Chen L, An Q, et al. Novel hydrogel material as a potential embolic agent in embolization treatments[J]. Sci Rep, 2016, 6: 32145. DOI:10.1038/srep32145 |
| [78] |
Robb SA, Lee BH, McLemore R, et al. Simultaneously physically and chemically gelling polymer system utilizing a poly (NIPAAm-co-cysteamine)-based copolymer[J]. Biomacromolecules, 2007, 8: 2294-2300. DOI:10.1021/bm070267r |
| [79] |
Bearat HH, Lee BH, Vernon BL. Comparison of properties between NIPAAm-based simultaneously physically and chemically gelling polymer systems for use in vivo[J]. Acta Biomater, 2012, 8: 3629-3642. DOI:10.1016/j.actbio.2012.06.012 |
| [80] |
Lee BH, West B, McLemore R, et al. In-situ injectable physically and chemically gelling NIPAAm-based copolymer system for embolization[J]. Biomacromolecules, 2006, 7: 2059-2064. DOI:10.1021/bm060211h |
| [81] |
Vernon B, Martinez A. Gel strength and solution viscosity of temperature-sensitive, in-situ-gelling polymers for endovascular embolization[J]. J Biomater Sci Polym Ed, 2005, 16: 1153-1166. DOI:10.1163/1568562054798536 |
| [82] |
Chen YP, Zhang JL, Zou Y, et al. Recent advances on polymeric beads or hydrogels as embolization agents for improved transcatheter arterial chemoembolization (TACE)[J]. Front Chem, 2019, 7: 408. DOI:10.3389/fchem.2019.00408 |
| [83] |
Agusti G, Jordan O, Andersen G, et al. Radiopaque iodinated ethers of poly(vinyl iodobenzyl ether)s: synthesis and evaluation for endovascular embolization[J]. J Appl Polym Sci, 2015, 132: 41791. |
 2022, Vol. 57
2022, Vol. 57

 ,
陈彦1,2
,
陈彦1,2