肿瘤微环境以“土壤”的角色为肿瘤的发生发展提供支持[1]。肿瘤微环境包括肿瘤血管网、胞外基质及自然杀伤(natural killer, NK) 细胞、T细胞、B细胞、树突状细胞(dendritic cells, DC)、巨噬细胞(macrophages)、髓源抑制性细胞(myeloid-derived suppressor cells, MDSC) 和肿瘤相关成纤维细胞(cancer-associated fibroblasts, CAFs) 等基质细胞[2]。其中, CAFs是肿瘤微环境中的主要基质细胞, 其在对肿瘤血管网、外基质及其他基质细胞的调控中起非常重要的作用[3, 4]。CAFs可通过分泌多种细胞因子或代谢产物抑制免疫细胞的功能, 促进肿瘤发展、侵袭、转移以及产生耐药; CAFs产生的胞外基质也会限制肿瘤治疗的疗效。因此, CAFs已成为肿瘤治疗的新靶点, 通过靶向调控CAFs或克服其屏障作用抑制肿瘤进展是提高肿瘤治疗效果的新手段。
针对CAFs对肿瘤发展的调控作用, 以CAFs为靶点的治疗策略表现出良好肿瘤抑制效果, 但面临传统递药方式造成药物生物利用度低、非特异性分布和毒副作用等问题。此外, CAFs还具有塑造肿瘤外基质、形成药物或治疗性免疫细胞渗透屏障的能力。因此, 迫切需要有效的方法来提高药物递送效率、减轻系统毒性并帮助克服肿瘤外基质屏障。纳米载体在药物递送方面展现了良好的应用前景[5]。经靶向修饰的纳米载体可有效提高药物在肿瘤部位的蓄积并减轻药物的全身性毒副作用; 纳米载体还可以实现特定条件下的药物响应性释放、改变载体粒径和载体电荷转变等。纳米载体的引入有望提高靶向CAFs治疗策略的临床应用潜力。本文对纳米载体在以CAFs为靶点的新型肿瘤治疗策略中的应用进行综述, 包括纳米载体用于CAFs靶向递药抑制肿瘤进展、纳米载体促进抗肿瘤药物跨CAFs转运、纳米载体将CAFs变成抗肿瘤药物转化储库等策略, 以期为以CAFs为靶点的新型肿瘤治疗策略早日应用于临床提供参考。
1 CAFs来源、特征和作用CAFs是肿瘤组织中含量最多的基质细胞, 占基质细胞总量的50%以上。CAFs最主要来源是组织中固有成纤维细胞或星状细胞在肿瘤来源激活因子如转化生长因子-β (transforming growth factor beta, TGF-β) 的刺激作用下转变为CAFs; 此外, 肿瘤组织中的上皮细胞、内皮细胞、脂肪细胞、周细胞、平滑肌细胞和肿瘤相关间充质干细胞也可分化为CAFs[6]。
肿瘤组织中CAFs具有异质性。不同亚型CAFs表面标志物表达情况不同, 如成纤维细胞活化蛋白(fibroblast activation protein, FAP)、α-平滑肌动蛋白(alpha smooth muscle actin, α-SMA)、成纤维细胞特异性蛋白1 (fibroblast specific protein 1, FSP1)、血小板衍生生长因子受体(platelet derived growth factor receptor, PDGFR) 等[7]。FAP被认为是CAFs特异性表达蛋白, 因此FAP被广泛用作靶向CAFs的靶标用于肿瘤治疗或影像学诊断[8, 9]。α-SMA是活化成纤维细胞的标志, 通常作为靶向CAFs治疗效果的一个主要评价指标。
一般来说, CAFs主要从三个方面塑造免疫抑制性微环境, 进而促进肿瘤进展(图 1)。第一, CAFs通过分泌各种细胞因子与其他基质细胞、肿瘤细胞进行信息交流, 抑制免疫细胞功能, 促进肿瘤发展。CAFs可分泌一系列细胞因子, 如血管内皮生长因子(vascular endothelial growth factor, VEGF) 可调控肿瘤血管网; TGF-β抑制DC成熟、促进Treg分化; 白细胞介素6 (interleukin-6, IL-6) 可促进MDSC分化, 抑制细胞毒性T细胞; CXCL12 (C-X-C motif chemokine ligand 12) 使肿瘤细胞抗凋亡蛋白Bcl-2和Survivin上调从而产生耐药性等; 第二, CAFs可调控外基质, 对药物与免疫细胞的浸润产生屏障作用。CAFs通过分泌大量胶原、纤连蛋白等促进肿瘤外基质固化, 抑制由肿瘤组织分泌趋化因子招募的免疫细胞、抗肿瘤药物的渗透; 第三, CAFs进行糖酵解排出大量乳酸与氢离子, 形成酸性微环境, 抑制免疫细胞活性。
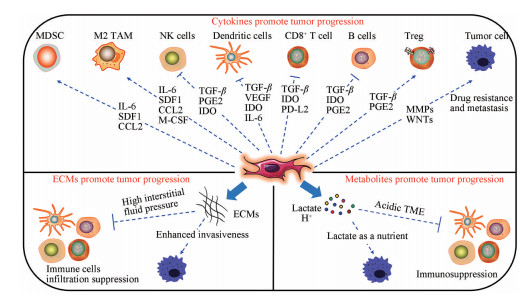
|
Figure 1 Mechanisms of tumor progress promoted by cancer-associated fibroblasts (CAFs). CAFs inhibits immune cells penetration, suppress immune cell ability and promotes tumor development by secreting cytokines, extracellular matrix (ECM) production and metabolism substances secretion. IL-6: Interleukin-6; SDF-1: Stromal cell-derived factor-1; CCL2: C-C motif chemokine ligand 2; M-CSF: Macrophage colony-stimulating factor; TGF-β: Transforming growth factor-β; PGE2: Prostaglandin E2; IDO: Indoleamine 2, 3-dioxygenase; VEGF: Vascular endothelial growth factor; PD-L2: Programmed death ligand 2; MMP: Matrix metalloproteinase; TME: Tumor microenvironment; MDSC: Myeloid-derived suppressor cells; TAM: Tumor-associated macrophages; NK: Natural killer |
此外, CAFs来源TGF-β还能诱导上皮细胞发生上皮-间质转化; CAFs产生的大量细胞外基质还能增加微环境刚性和间质压力, 促进肿瘤的侵袭与迁移; CAFs产生的乳酸和丙酮酸等代谢产物还能作为肿瘤细胞营养物质, 支持肿瘤代谢。
2 靶向调控CAFs抑制肿瘤进展的策略CAFs作为肿瘤组织中一类主要的基质细胞, 对肿瘤发展有着促进作用。因此, 靶向调控CAFs的肿瘤治疗策略有望抑制肿瘤进展。但传统药物递送策略仍存在药物分布特异性不足、易产生系统毒性等问题从而限制这一肿瘤治疗新策略的发展。纳米载体因其具备靶向递送能力、药物可控释放和生物相容性好等特点, 应用于靶向调控CAFs治疗策略可增强药物在靶部位的蓄积, 提高耐受剂量并增强疗效。目前靶向调控CAFs的肿瘤治疗策略主要包括杀伤CAFs、干扰CAFs功能和干扰CAFs活化3种, 具体机制如下。
2.1 杀伤CAFs杀伤CAFs策略是指以纳米载体高效递送细胞毒性药物或疫苗至CAFs以实现CAFs选择性杀伤, 缓解肿瘤抑制性微环境, 增加抗肿瘤药物渗透, 促进免疫细胞活化、浸润等功能(图 2a)。常用细胞毒性药物包括ABT263、吖啶黄和紫杉醇等[1, 10]。Fourniols等[11]以脂质体为载体测试多种细胞毒性药物对CAFs的作用, 结果表明吖啶黄和紫杉醇可以有效杀死CAFs并抑制成纤维细胞与癌细胞共培养3D肿瘤球的生长。FAP在本策略中至关重要, 如FAP抗体修饰的纳米载体能有效地将细胞毒药物递送至CAFs[12]; FAP作为瘤组织抗原, 制备编码FAP的DNA疫苗可用于激活抗肿瘤免疫; 还有研究人员将抗小鼠FAP抗体Fv结构域、人源CD8a铰链、跨膜结构域及4-1BB和CD3ζ信号结构域克隆到逆转录病毒载体并转染T细胞以建立靶向FAP的CAR-T细胞用于肿瘤治疗[13]。研究结果表明, 该疗法对胰腺癌等多种增生型肿瘤具有很好疗效, 改善了肿瘤微环境, 清除了70%成纤维细胞并减少80%胶原成分, 显著抑制了肿瘤进展。
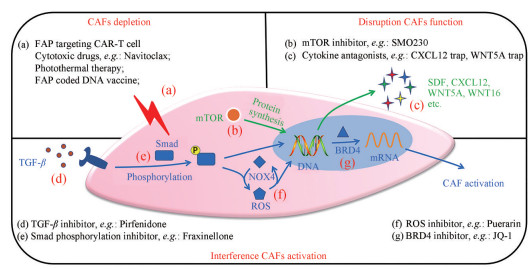
|
Figure 2 Cancer therapies by CAFs modulating. Arrows in blue express the pathway of CAFs activation. Arrows in green express the pathway of cytokines secretion. ROS: Reactive oxygen species; NOX4: NADPH oxidase 4; mTOR: Mammalian target of rapamycin |
此外, 纳米载体除作为杀伤CAFs药物的递送载体外, 其本身也能对CAFs起到一定的杀伤作用。如纳米载体联合光热疗法可增强CAFs杀伤能力。Nicolás-Boluda等[14]利用纳米药物在肿瘤组织的脱靶效应将Fe3O4-Au杂合纳米粒递送至肝癌相关CAFs并予以激光照射, 利用光热效应消除CAFs, 降低了肿瘤组织的刚性并抑制了肿瘤进展。
2.2 干扰CAFs功能干扰CAFs功能策略是指通过递送细胞因子拮抗剂[15, 16]、抗纤维化药物[17, 18]等手段减少CAFs分泌细胞因子, 从而阻断胞间信息交流, 有效削弱CAFs对肿瘤的促进作用(图 2b、c)。Huang等[19]以修饰了FHK多肽的脂质磷酸钙为载体(FHK-pLIGHT@CaMP) 靶向CAFs递送抗纤维化药物α-倒捻子素(α-mangostin)。该纳米粒减少了胰腺癌相关CAFs分泌CXCL12等细胞因子, 阻断了CAFs与肿瘤细胞间信息交流; 显著改善肿瘤微环境, 降低肿瘤组织α-SMA与纤连蛋白的表达水平, 增加免疫细胞浸润; 显著抑制了C57BL/6小鼠原位胰腺癌的生长及肺部转移。Leaf Huang课题组利用鱼精蛋白脂质体为载体靶向CAFs递送表达“陷阱”分子的质粒DNA或递送siRNA, 该策略切断了CAFs与肿瘤细胞间Wnt5A[20]、Wnt16[21]和CXCL12[22]等分子的信息交流, 显著抑制了小鼠膀胱癌与胰腺癌的生长并抑制肿瘤转移。
2.3 干扰CAFs活化CAFs活化是指静态成纤维细胞、星状细胞在肿瘤分泌的TGF-β/PDGF等刺激因子作用下转变为具有活化标志物、可分泌胶原与细胞因子的活化表型的过程。CAFs标志物在静态成纤维细胞中几乎不表达。此外, 成纤维细胞活化后胞内脂滴含量显著减少。
干扰CAFs活化策略可通过阻断CAFs激活通路或逆转CAFs表型[23]等方式实现。如阻断TGF-β/Smad/ROS通路(图 2d~f)、增加游离脂肪酸表达[24]、溴结构域蛋白4 (bromodomain proteins 4, BRD4) 抑制剂(图 2g) 干扰CAFs活化, 该策略既不会大量清除CAFs导致肿瘤细胞转移几率增加, 又能显著改善肿瘤部位免疫抑制微环境。氨基乙基茴香酰胺(aminoethyl anisamide, AEAA) 修饰的CAFs靶向载葛根素(puerarin) 脂质体[25]能够显著降低胞内ROS水平, 从而抑制成纤维细胞的活化, 进而改善肿瘤部位免疫抑制微环境并增加CD8+ T细胞、M1巨噬细胞等免疫细胞向肿瘤深层的浸润。该策略分别与PD-L1单抗和paclitaxel联用可显著增强BALB/c荷4T1小鼠乳腺癌疗效。
3 促进抗肿瘤药物穿过CAFs屏障的策略肿瘤组织中CAFs主要分布于血管附近, 其在血管与肿瘤细胞之间组成一道屏障, 严重阻碍了治疗药物与免疫细胞到达肿瘤深层[26]。一些功能性纳米载体具有粒径电荷可变、可生物响应释放等优点, 帮助抗肿瘤药物到达深层肿瘤部位, 提高肿瘤治疗效果。促进抗肿瘤药物穿过CAFs屏障的药物递送策略见图 3。
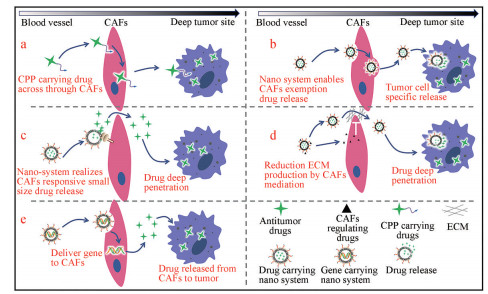
|
Figure 3 Enhanced drug delivery to tumor cells by overcoming CAFs barrier. a: Cell penetration peptide realizes drug delivery through CAFs; b: Responsive-drug release system enables CAFs exemption drug release and tumor cell specific release; c: CAFs responsive nano-system realizes CAFs responsive particle size shrinking to promote drug deep penetration; d: Reduction of extracellular matrix production by CAFs mediation strategy to promote drug deep penetration; e: Turning CAFs to an antitumor drug depot with gene approaches. CPP: Cell penetrating peptides |
利用细胞穿膜肽(cell penetrating peptides, CPP) 促进药物跨CAFs转运是促进抗肿瘤药物穿过CAFs屏障的策略之一(图 3a)[27]。CPP通常是不超过30个氨基酸的多肽分子, 能够不依赖特异膜受体独立或携带大分子穿过细胞膜, 增加药物渗透。Li等[28]以修饰了dNP2细胞穿透肽的脂质体为载体有效地穿过CAFs屏障, 将紫杉醇送至肿瘤细胞, 增加了药物在肿瘤部位的滞留时间并显著延长荷原位乳腺癌小鼠的生存时间。肿瘤球渗透实验表明, 该纳米粒能够实现肿瘤组织的深层渗透。Schnittert等[29]制备了二聚CPP与miRNA199的复合纳米粒用于治疗Panc-1胰腺癌。结果表明, 该纳米系统可显著抑制体内肿瘤及胰腺星状细胞与胰腺癌细胞杂合3D肿瘤球的生长。
3.2 促进药物CAFs豁免CAFs豁免是指利用CAFs与肿瘤细胞的差别, 使纳米药物只在肿瘤细胞环境响应释放, 而对CAFs胞内环境不响应的策略[30] (图 3b)。纳米药物经CAFs摄取后无法代谢而直接排出胞外, 进一步由肿瘤细胞摄取并发挥抗肿瘤效果。该策略能避免CAFs受到药物刺激引起肿瘤耐药, 如经顺铂治疗后的肿瘤组织CAFs可释放Wnt16分子, 进而引起肿瘤耐药[21]。根据肿瘤细胞与CAFs内酯酶含量差异, Qiu等[31]设计了酯酶响应的聚合物纳米粒递送TRAIL质粒基因, 该载体在酯酶含量低的CAFs中不释放药物, 在酯酶含量高的肿瘤细胞中响应释放, 避免了药物对CAFs刺激, 有效降低CAFs分泌耐药因子WNT 16B并显著抑制了小鼠HeLa宫颈癌进展。
3.3 实现CAFs响应粒径减小CAFs上的FAP具有二肽基肽酶活性。针对这一特点设计含FAP特异性降解肽[32, 33]的纳米载体能够实现药物FAP敏感释放, 并且释放的药物粒径减小有助于深层渗透(图 3c)。Yu等[32]在载药蛋白-脂质纳米粒上插入FAP降解肽, 并装载白蛋白-紫杉醇, 当纳米粒到达肿瘤组织外部CAFs时, FAP降解肽裂解释放小粒径的白蛋白-紫杉醇, 载体粒径从120 nm减小到10 nm, 实现肿瘤部位的深层渗透并显著提高白蛋白-紫杉醇对Panc 02胰腺癌原位及皮下瘤的抗肿瘤作用。Kim等[34]制备了一种修饰FAP降解肽, 共载蜂毒肽与多柔比星纳米片。该纳米片具有CAFs响应释药的特点, 显著增强药物递送效率。实验结果表明, 该纳米片对HT29结直肠癌的抑瘤率近80%。
3.4 靶向CAFs降低微环境刚性肿瘤微环境中CAFs通过自身细胞的纤维化, 分泌大量基质成分使得微环境的刚性增强。纳米载体可以共载抗纤维化药物及抗肿瘤药物, 先抑制CAFs纤维化或抑制基质成分分泌使环境刚性降低, 以促进抗肿瘤药物的渗透(图 3d)。Nie等[35]以蜂窝状碳材料为载体负载多柔比星并修饰AEAA靶头, 以FAP降解肽进一步连接各纳米粒, 并将氯沙坦封装于间隙中。纳米粒到达CAFs后载体分解为氯沙坦和载多柔比星纳米粒, 氯沙坦抑制CAFs分泌胶原和纤连蛋白, 促进载多柔比星纳米粒的肿瘤组织深层渗透以实现更好的肿瘤治疗效果。结果表明, 该载体可将4T1三阴性乳腺癌小鼠中位生存期从37天提高至69天。Pei等[36]设计了靶向CAFs的梣酮(fraxinellone) 装载纳米粒(Frax-NP-CGKRK) 和靶向肿瘤的载Kras siRNA纳米粒(siKras-LCP-ApoE3)。结果表明, Frax-NP-CGKRK显著减少了CAFs对纤连蛋白和α-SMA的表达, 改善肿瘤微环境, 增强了siKras-LCP-ApoE3向肿瘤细胞的递送效率及抗肿瘤效果。
3.5 CAFs作为抗肿瘤药物储库由于肿瘤组织中存在大量基质细胞, 到达肿瘤组织的药物大部分被基质细胞摄取, 仅有少量到达肿瘤细胞[37]。为增强抗肿瘤效果, 可以将基质细胞转变为抗肿瘤药物的转化储库, 由基质细胞分泌的药物能够有效被肿瘤细胞摄取并发挥抗肿瘤效果[38, 39]。特别是, CAFs被认为是以包裹肿瘤细胞的方式分布于肿瘤组织, 因此, 将CAFs作为抗肿瘤药物的转化储库能够全面且充分地将药物递送至肿瘤细胞(图 3e)。Miao等[39]以鱼精蛋白-脂质体为载体装载表达TRAIL蛋白的质粒DNA, CAFs原位产生过量的TRAIL并分泌到胞外被肿瘤细胞摄取, 纳米载体的使用可显著提高基因的转染效率与稳定性, 实现较为理想的抗肿瘤药物递送, 并将UMUC3膀胱癌小鼠中位生存期从43天延长至65天。星状细胞作为CAFs的前体同样广泛分布于肿瘤组织中。Jiang等[38]利用PEI聚合物纳米载体递送TRAIL质粒DNA并包覆聚γ-谷氨酸(poly γ-glutamic acid, γ-PGA) 靶向胰腺星状细胞。类似地, 胰腺星状细胞表达过量TRAIL并分泌到胞外, 作用于肿瘤细胞, 该策略使部分荷BxPC3-luc胰腺癌小鼠肿瘤完全消退。
4 结论与展望本文综述了CAFs在肿瘤进展过程中所起的作用, 以及靶向CAFs策略在新型肿瘤治疗中的应用。CAFs可通过分泌细胞因子进行细胞间信息交流发挥肿瘤促进与免疫抑制作用, 还可对肿瘤外基质进行调控形成治疗屏障。基于此, 直接清除CAFs的策略有望缓解肿瘤进展。但研究表明, CAFs的过度清除反而会促进肿瘤的转移及免疫抑制。因此, 纳米载体的应用以提高对特定促肿瘤CAFs亚型的靶向性是一个重要的解决方案。另外, 选择干扰CAFs与肿瘤细胞间的交流、抑制CAFs活化等更为温和的策略能够抑制肿瘤进展同时避免激活肿瘤防御机制。
CAFs产生的肿瘤基质已被认为是阻碍抗肿瘤药物输送的主要障碍。因此, 递送载体的引入对于克服药物递送屏障具有重要意义。如已被广泛临床使用的白蛋白结合型紫杉醇可显著增加紫杉醇的肿瘤组织渗透能力; 伊立替康脂质体可显著提高临床疗效并降低其毒副作用。此外, 利用功能性载体以实现药物定点响应释放、降低基质刚性等策略可促进药物深层渗透与肿瘤部位有效递送。利用基因传递策略巧妙地将药物传递屏障CAFs转化为抗肿瘤药物的转化储库可实现外围CAFs递药, 内部肿瘤杀灭, 克服药物传递屏障以达到更好的疗效。相信随着现代药剂学的发展, 对CAFs研究的不断深入, 靶向CAFs的肿瘤治疗策略将会为肿瘤治疗带来新的进展。
作者贡献: 袁诗俊负责查阅文献、论文撰写; 刘永军与张娜负责论文思路构建、文章修改。
利益冲突: 所有的作者声明不存在利益冲突。
| [1] |
Hauge A, Rofstad EK. Antifibrotic therapy to normalize the tumor microenvironment[J]. J Transl Med, 2020, 18: 207. DOI:10.1186/s12967-020-02376-y |
| [2] |
Roma-Rodrigues C, Mendes R, Baptista PV, et al. Targeting tumor microenvironment for cancer therapy[J]. Int J Mol Sci, 2019, 20: 840. DOI:10.3390/ijms20040840 |
| [3] |
Chen X, Song E. Turning foes to friends: targeting cancer-associated fibroblasts[J]. Nat Rev Drug Discov, 2019, 18: 99-115. DOI:10.1038/s41573-018-0004-1 |
| [4] |
Sahai E, Astsaturov I, Cukierman E, et al. A framework for advancing our understanding of cancer-associated fibroblasts[J]. Nat Rev Cancer, 2020, 20: 174-186. DOI:10.1038/s41568-019-0238-1 |
| [5] |
Mu W, Chu Q, Liu Y, et al. A review on nano-based drug delivery system for cancer chemoimmunotherapy[J]. Nanomicro Lett, 2020, 12: 142. |
| [6] |
Liu T, Han C, Wang S, et al. Cancer-associated fibroblasts: an emerging target of anti-cancer immunotherapy[J]. J Hematol Oncol, 2019, 12: 86. DOI:10.1186/s13045-019-0770-1 |
| [7] |
Pelon F, Bourachot B, Kieffer Y, et al. Cancer-associated fibroblast heterogeneity in axillary lymph nodes drives metastases in breast cancer through complementary mechanisms[J]. Nat Commun, 2020, 11: 404. DOI:10.1038/s41467-019-14134-w |
| [8] |
Lindner T, Loktev A, Giesel F, et al. Targeting of activated fibroblasts for imaging and therapy[J]. EJNMMI Radiopharm Chem, 2019, 4: 16. DOI:10.1186/s41181-019-0069-0 |
| [9] |
Fitzgerald AA, Weiner LM. The role of fibroblast activation protein in health and malignancy[J]. Cancer Metastasis Rev, 2020, 39: 783-803. DOI:10.1007/s10555-020-09909-3 |
| [10] |
Chen B, Wang Z, Sun J, et al. A tenascin C targeted nanoliposome with navitoclax for specifically eradicating of cancer-associated fibroblasts[J]. Nanomedicine, 2016, 12: 131-141. DOI:10.1016/j.nano.2015.10.001 |
| [11] |
Fourniols T, Bastien E, Canevat A, et al. Inhibition of colorectal cancer-associated fibroblasts by lipid nanocapsules loaded with acriflavine or paclitaxel[J]. Int J Pharm, 2020, 584: 119337. DOI:10.1016/j.ijpharm.2020.119337 |
| [12] |
Fang J, Hu B, Li S, et al. A multi-antigen vaccine in combination with an immunotoxin targeting tumor-associated fibroblast for treating murine melanoma[J]. Mol Ther Oncolytics, 2016, 3: 16007. DOI:10.1038/mto.2016.7 |
| [13] |
Lo A, Wang LCS, Scholler J, et al. Tumor-promoting desmoplasia is disrupted by depleting FAP-expressing stromal cells[J]. Cancer Res, 2015, 75: 2800-2810. DOI:10.1158/0008-5472.CAN-14-3041 |
| [14] |
Nicolás-Boluda A, Vaquero J, Laurent G, et al. Photothermal depletion of cancer-associated fibroblasts normalizes tumor stiffness in desmoplastic cholangiocarcinoma[J]. ACS Nano, 2020, 14: 5738-5753. DOI:10.1021/acsnano.0c00417 |
| [15] |
Lang J, Zhao X, Qi Y, et al. Reshaping prostate tumor microenvironment to suppress metastasis via cancer-associated fibroblast inactivation with peptide-assembly-based nanosystem[J]. ACS Nano, 2019, 13: 12357-12371. DOI:10.1021/acsnano.9b04857 |
| [16] |
Zhu H, Liu Q, Miao L, et al. Remodeling the fibrotic tumor microenvironment of desmoplastic melanoma to facilitate vaccine immunotherapy[J]. Nanoscale, 2020, 12: 3400-3410. DOI:10.1039/C9NR09610H |
| [17] |
Ren Q, Zhang LY, Li Z. Advances in the research of anti-organ fibrosis drugs[J]. Acta Pharm Sin (药学学报), 2020, 55: 2510-2528. |
| [18] |
Zhang WD, Wang RF, Wu HM, et al. Research progress in drugs for anti-hepatic fibrosis[J]. Acta Pharm Sin (药学学报), 2018, 53: 667-675. |
| [19] |
Huang Y, Chen Y, Zhou S, et al. Dual-mechanism based CTLs infiltration enhancement initiated by Nano-sapper potentiates immunotherapy against immune-excluded tumors[J]. Nat Commun, 2020, 11: 622. DOI:10.1038/s41467-020-14425-7 |
| [20] |
Liu Q, Zhu H, Tiruthani K, et al. Nanoparticle-mediated trapping of Wnt family member 5A in tumor microenvironments enhances immunotherapy for B-Raf proto-oncogene mutant melanoma[J]. ACS Nano, 2018, 12: 1250-1261. DOI:10.1021/acsnano.7b07384 |
| [21] |
Miao L, Wang Y, Lin CM, et al. Nanoparticle modulation of the tumor microenvironment enhances therapeutic efficacy of cisplatin[J]. J Control Release, 2015, 217: 27-41. DOI:10.1016/j.jconrel.2015.08.027 |
| [22] |
Shen L, Li J, Liu Q, et al. Local blockade of interleukin 10 and C-X-C motif chemokine ligand 12 with nano-delivery promotes antitumor response in murine cancers[J]. ACS Nano, 2018, 12: 9830-9841. DOI:10.1021/acsnano.8b00967 |
| [23] |
Stratton MS, Bagchi RA, Felisbino MB, et al. Dynamic chromatin targeting of BRD4 stimulates cardiac fibroblast activation[J]. Circ Res, 2019, 125: 662-677. DOI:10.1161/CIRCRESAHA.119.315125 |
| [24] |
Hossen MN, Rao G, Dey A, et al. Gold nanoparticle transforms activated cancer-associated fibroblasts to quiescence[J]. ACS Appl Mater Interfaces, 2019, 11: 26060-26068. DOI:10.1021/acsami.9b03313 |
| [25] |
Xu H, Hu M, Liu M, et al. Nano-puerarin regulates tumor microenvironment and facilitates chemo- and immunotherapy in murine triple negative breast cancer model[J]. Biomaterials, 2020, 235: 119769. DOI:10.1016/j.biomaterials.2020.119769 |
| [26] |
Miao L, Newby JM, Lin CM, et al. The binding site barrier elicited by tumor-associated fibroblasts interferes disposition of nanoparticles in stroma-vessel type tumors[J]. ACS Nano, 2016, 10: 9243-9258. DOI:10.1021/acsnano.6b02776 |
| [27] |
Xie J, Bi Y, Zhang H, et al. Cell-penetrating peptides in diagnosis and treatment of human diseases: from preclinical research to clinical application[J]. Front Pharmacol, 2020, 11: 697. DOI:10.3389/fphar.2020.00697 |
| [28] |
Li M, Shi K, Tang X, et al. Synergistic tumor microenvironment targeting and blood-brain barrier penetration via a pH-responsive dual-ligand strategy for enhanced breast cancer and brain metastasis therapy[J]. Nanomedicine, 2018, 14: 1833-1843. |
| [29] |
Schnittert J, Kuninty PR, Bystry TF, et al. Anti-microRNA targeting using peptide-based nanocomplexes to inhibit differentiation of human pancreatic stellate cells[J]. Nanomedicine, 2017, 12: 1369-1384. DOI:10.2217/nnm-2017-0054 |
| [30] |
Wang C, Chen S, Wang Y, et al. Lipase-triggered water-responsive "Pandora's Box" for cancer therapy: toward induced neighboring effect and enhanced drug penetration[J]. Adv Mater, 2018, 30: 1706407. DOI:10.1002/adma.201706407 |
| [31] |
Qiu N, Liu X, Zhong Y, et al. Esterase-activated charge-reversal polymer for fibroblast-exempt cancer gene therapy[J]. Adv Mater, 2016, 28: 10613-10622. DOI:10.1002/adma.201603095 |
| [32] |
Yu Q, Qiu Y, Li J, et al. Targeting cancer-associated fibroblasts by dual-responsive lipid-albumin nanoparticles to enhance drug perfusion for pancreatic tumor therapy[J]. J Control Release, 2020, 321: 564-575. DOI:10.1016/j.jconrel.2020.02.040 |
| [33] |
Hou L, Chen D, Hao L, et al. Transformable nanoparticles triggered by cancer-associated fibroblasts for improving drug permeability and efficacy in desmoplastic tumors[J]. Nanoscale, 2019, 11: 20030-20044. DOI:10.1039/C9NR06438A |
| [34] |
Kim MG, Shon Y, Kim J, et al. Selective activation of anticancer chemotherapy by cancer-associated fibroblasts in the tumor microenvironment[J]. J Natl Cancer Inst, 2017, 109: djw186. DOI:10.1093/jnci/djw186 |
| [35] |
Nie Z, Hou L, Chen D, et al. Transformable honeycomb-like nanoassemblies of carbon dots for regulated multisite delivery and enhanced antitumor chemoimmunotherapy[J]. Angew Chem Int Ed, 2021, 60: 6581-6592. DOI:10.1002/anie.202014397 |
| [36] |
Pei Y, Chen L, Huang Y, et al. Sequential targeting TGF-β signaling and KRAS mutation increases therapeutic efficacy in pancreatic cancer[J]. Small, 2019, 15: 1900631. DOI:10.1002/smll.201900631 |
| [37] |
Hessmann E, Patzak MS, Klein L, et al. Fibroblast drug scavenging increases intratumoural gemcitabine accumulation in murine pancreas cancer[J]. Gut, 2018, 67: 497-507. DOI:10.1136/gutjnl-2016-311954 |
| [38] |
Jiang H, Wang S, Zhou X, et al. New path to treating pancreatic cancer: TRAIL gene delivery targeting the fibroblast-enriched tumor microenvironment[J]. J Control Release, 2018, 286: 254-263. DOI:10.1016/j.jconrel.2018.07.047 |
| [39] |
Miao L, Liu Q, Lin CM, et al. Targeting tumor-associated fibroblasts for therapeutic delivery in desmoplastic tumors[J]. Cancer Res, 2017, 77: 719-731. DOI:10.1158/0008-5472.CAN-16-0866 |
 2022, Vol. 57
2022, Vol. 57


