据统计, 截至2020年全球近1 000万人死于癌症, 预防和治疗干预措施对全球癌症控制至关重要[1]。DNA损伤反应(DNA damage response, DDR) 是当DNA受到损伤之后激活蛋白质翻译后修饰网络, 并激活损伤检测点(checkpoints), 从而诱导DNA损伤修复和细胞凋亡。其主要核心包括3种关键激酶: 共济失调毛细血管扩张突变基因和Rad3相关蛋白(ataxia telangiectasia and RAD3-related kinase, ATR)、共济失调毛细血管扩张突变基因(ataxia telangiectasia mutated kinase, ATM) 和DNA依赖蛋白激酶(DNA-dependent protein kinase, DNA-PKcs)。在结构上, ATR激酶与ATM激酶类似, 而且在N末端均包含P53、BRCA1、ATRIP等结合位点, 有研究发现ATM激酶和ATR激酶在兴奋性和抑制性囊泡种群中有互补作用[2]。另外, 这三者有类似的结构域, 但又对不同的损伤有反应。DNA-PKcs激酶和ATM激酶主要被双链DNA断裂(double strand breaks, DSBs) 激活。但与二者不同的是, ATR激酶主要针对DNA单链(single-stranded DNA, ssDNA) 产生应激, 如当紫外线辐射引起的DNA损伤反应或当细胞受到靶向DNA的药物作用时形成DNA单链, ATR激酶就被激活, 并参与多种DNA损伤的修复。因此ATR激酶对于复制细胞的生存能力至关重要。
ATR属于磷脂酰肌醇3-激酶(PIKK) 家族中的丝氨酸-苏氨酸激酶, 在DNA损伤之后激活细胞应答, 阻止细胞周期并修复DNA, 从而避免细胞凋亡。它是由2 644个氨基酸组成, 在其N端存在着ATR相互作用蛋白(ATR interacting protein, ATRIP) 结构域, 这是ATR激酶激活的重要区域。在它的C端有下游蛋白磷酸化的激酶结构域, 能够将靶蛋白如细胞周期检测点激酶1 (CHK1) 等丝氨酸或苏氨酸磷酸化。ATR激酶激活后可通过多种信号调控细胞生物过程, 包括细胞周期阻滞、抑制复制起点、促进脱氧核苷酸合成、启动复制叉以及修复DNA双链断裂[3, 4]。
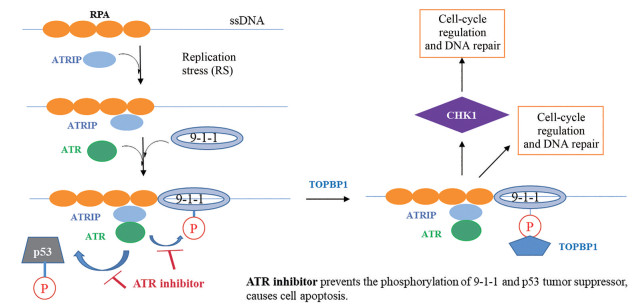
ATR激酶作为一种重要的调节因子, 在DNA损伤反应中发挥着关键作用, 而ATR激酶的激活是一个复杂的多步骤过程(图 1), 包括ATR激酶的自磷酸化, Rad17-Rfc2-5募集到ssDNA和dsDNA之间的连接处, 装载Rad9-Rad1-Hus1 (9-1-1) 检查点钳以及募集拓扑异构酶结合蛋白1 (topoisomerase-binding protein 1, TOPBP1) 等[4, 5]。ATR激酶被激活后诱导多种下游靶标执行细胞功能, 如CHK1、SMC-1、ATM和p21等的磷酸化。然而, 针对DNA损伤, ATR激酶主要通过CHK1的磷酸化和活化发挥作用, 它可以调控CDC25A、RAD51、p53和DNA-PK等分子, 如促进CDC25A的蛋白酶体降解, 降低细胞周期蛋白依赖性激酶(CDK) 活性, 抑制细胞周期进程, 为DNA修复争取时间。另外, CHK1还通过BRCA1、BRCA2和RAD51的磷酸化促进同源重组(homologous recombination, HR), 通过DNA-PK的磷酸化促进非同源重组途径(non-homology end joining, NHEJ) 等[6]。另外神经突蛋白1 (neuritin 1, NRN1) 甲基化在食管癌细胞(esophageal cancer, EC) 中通过抑制PI3K-Akt-mTOR信号通路轴从而抑制细胞生长, 因此NRN1甲基化在PI3K和ATR激酶抑制剂的协同作用时发挥着重要作用[7]。
|
Figure 1 Activation pathway of ATR in DNA damage response. ATRIP: ATR interacting protein; 9-1-1: Rad9-Rad1-Hus1; RPA: Replication protein A; TOPBP1: Topoisomerase-binding protein 1 |
基因组不稳定性和易突变是肿瘤细胞的一个基本特征, 通常伴随着大量稳定和修复基因组DNA的功能缺失, 而常规的化疗和放疗更进一步加剧了肿瘤细胞的基因组不稳定性, 抑制ATR激酶活性能协同增强常规肿瘤治疗对癌细胞的杀伤活性。ATR激酶是一种DNA修复的关键激酶, 一旦感受到DNA损伤的迹象, ATR激酶就会活化细胞固有的修复系统, 对基因组稳定以及肿瘤的发生、发展和治疗都至关重要。有科研人员研究发现, ATR激酶抑制剂能够显著降低DNA末端切除因子(BRCA1、BLM和CTIP), 损害DNA末端切除, 从而使细胞发生损伤或凋亡[8]。在ATM缺陷或复制应激高的肿瘤细胞中, ATR激酶抑制剂更具有优势[9]。具有更大效力和选择性的ATR激酶抑制剂已被开发成药物如AZD-6738。一些研究表明, 一些肿瘤对ATR激酶抑制剂与其他修复蛋白(如PARP和CHK1) 抑制剂的联合用药的效果更佳。因此, ATR激酶抑制剂在癌症治疗上具有重要应用前景。本课题组长期致力于靶向DDR及相关通路的药物研发, 包括靶向DNA-PK的小分子抑制剂研究[10]。本文将对靶向ATR激酶的小分子抑制剂的最新进展进行综述, 旨在为本领域的科研工作者提供获得最新成果的便利, 并展望今后研究开发ATR抑制剂抗肿瘤药物的挑战和前景。
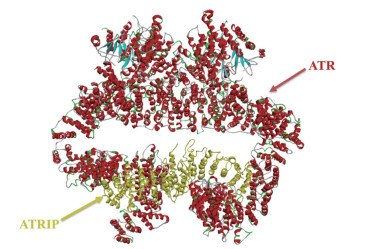
1 靶向ATR激酶的小分子抑制剂ATR激酶抑制剂是以ATR激酶作为靶点的小分子抑制剂, 通过检查点激酶1 (CHK1) 的磷酸化对复制应激(replication stress, RS) 进行反应, 使其在S、G2和M阶段触发细胞周期阻滞, 从而抑制由ATR激酶介导的修复通路, 高效杀死肿瘤细胞[11]。ATR激酶抑制剂作为单一疗法或与其他靶向药物联合使用, 在杀死肿瘤细胞方面显示出很高的潜力[12]。在过去的十多年中, 科研人员积累了越来越多有关ATR激酶的知识。2017年, 蔡刚课题组与王伟武课题组合作, 成功解析了来源于酵母的ATR-ATRIP复合体的近原子分辨率(3.9 Å) 结构[13]。不久后, 徐彦辉课题组与王宏伟、王佳伟课题组合作, 以分辨率4.7 Å确定了人源ATR-ATRIP复合体的冷冻电子显微镜(EM) 结构[14] (图 2, PDB code: 5YZ0), 这些为理解ATR-ATRIP复合体的组装提供了结构基础, 并为表征ATR介导的DNA修复功能的分子机制研究提供了重要的结构信息。虽然已发现了许多具有多种支架的选择性ATR激酶抑制剂, 但截止到目前, 并没有ATR激酶蛋白或ATR-ATRIP复合体与ATR激酶小分子抑制剂共晶结构的报道。
|
Figure 2 Structure of ATR-ATRIP complex (PDB code: 5YZ0) |
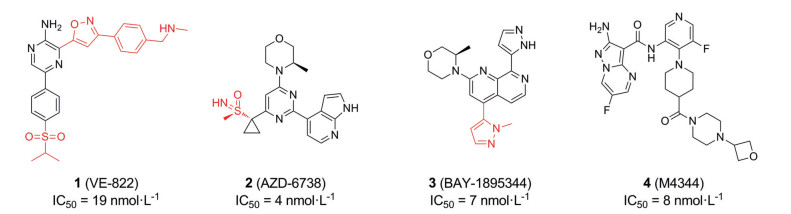
目前, 科研人员已经开发出8种选择性ATR激酶抑制剂进入临床试验阶段, 它们分别为VE-822、AZD-6738、BAY-1895344、M4344、M1774、ATRN-119、RP-3500、ART-0380。前4种ATR激酶抑制剂的结构已经公布, 后四种ATR激酶抑制剂的结构尚未公布(图 3)。
|
Figure 3 Structures of known ATR clinical inhibitors |
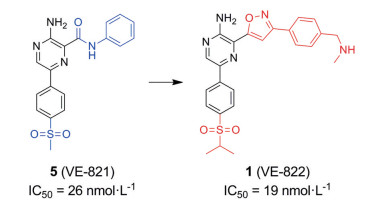
Berzosertib (VE-822, M6620, VX-970) (1) 是第一个进入临床试验的ATR激酶抑制剂, 由福泰制药(Vertex Pharmaceuticals) 开发。2012年, Charrier等[15]首次报道了一种具有高选择性的ATR激酶抑制剂VE-821 (5), 它对具有ATM激酶缺陷的癌细胞系显示出强大的细胞毒性活性, 但对正常细胞没有影响。Vertex公司的科学家们保留VE-821的核心结构2-氨基吡嗪并对侧链进行结构优化, 获得高选择性衍生物Berzosertib (图 4), 它对ATR激酶有很强的抑制活性, 相对于DNA-PK, Berzosertib对ATR的选择性比对DNA-PK的选择性超过4 000倍(ATR酶Ki = 0.17 nmol·L-1; DNA-PK Ki > 4 000 nmol·L-1)[16]。科研人员还发现Berzosertib对下游ATR激酶底物CHK1的磷酸化有显著的抑制作用[17, 18]。目前, Berzosertib被用作单一疗法或与DNA损伤化疗和放疗联合使用, 至少有21项注册临床Ⅰ/Ⅱ期试验。2018年, Thomas等[19]首次报道采用Berzosertib与拓扑替康(topotecan) 联合使用时在铂类难治性小细胞肺癌中有一定疗效。在胰腺癌细胞(pancreatic ductal adenocarcinoma, PDAC) 和异种移植物中, Berzosertib联合化疗可显著增强PDAC的治疗效果, 且对正常细胞和组织无毒性[3, 18]。另外, Berzosertib在治疗卵巢癌时通过阻断蛋白磷酸化来抑制ATR激酶信号诱导卵巢癌细胞凋亡[20]。类似地, 在晚期实体瘤患者中, Berzosertib联合顺铂(cisplatin) 或吉西他滨(gemcitabine) 试验时具有良好的耐受性, 并显示出初步的临床活性, 为评估Ⅱ期试验提供依据[21, 22]。Baschnagel等[23]报告中提到Berzosertib联合放疗提高了非小细胞肺癌(non-small cell lung cancer, NSCLC) 脑转移小鼠的总体生存率。该结果支持了正在进行的NSCLC脑转移患者中使用Berzosertib联合全脑照射的临床试验(美国临床试验数据库网站, 临床试验ID号: NCT02589522)。然而, 在Pal等[24]的Ⅱ期试验中与顺铂联合吉西他滨相比, 在转移性尿路上皮癌患者中, 在顺铂联合吉西他滨中添加Berzosertib并不能延长生存率, 并且观察到这种联合用药的生存率有降低的趋势, 可能是由于联合用药导致毒性增加引起的。尽管顺铂与吉西他滨联用的剂量减少, 但Berzosertib联合顺铂与吉西他滨合用的血液毒性显著增加。
|
Figure 4 The clinical compound berzosertib was obtained from the lead compound VE-821 through structural optimization |
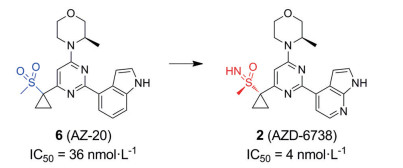
Ceralasertib是由阿斯利康公司开发的, 目前已经完成临床前所有研究, 正处在多个临床试验中, 用于治疗各种癌症[25]。Foote等[26]在对先导化合物AZ-20 (6) 进行结构优化时, 将甲基砜基团换成亚氨基磺胺酮, 即得到化合物2 (公司内部代号为AZD-6738; 后续因为进入临床前研究, 化合物2被命名为Ceralasertib)。研究人员发现, Ceralasertib比Berzosertib具有多方面明显的优势: 如改善了化合物在水中的溶解性、消除CYP3A4的时间依赖性抑制(TDI) 活性、提供了对其他靶点的选择性、提高了体外生物活性和改善了药代动力学(pharmacokinetic, PK) 特性(ATR酶IC50 = 4 nmol·L-1; 细胞活性IC50 = 74 nmol·L-1) (图 5)。Ceralasertib在临床试验中被用作单一疗法和联合疗法两种策略, 但这些临床试验大多仍处于进行中或招募阶段, 该药物的全部临床潜力尚待揭示。2020年, Gorecki等[27]研究发现, 在P53、ATM激酶缺陷模型中Ceralasertib显示出较好的抗肿瘤活性, 已被用于评估治疗晚期、复发性、耐药性和转移性癌症的试验中。此外, Ceralasertib在胃癌、NSCLC和慢性淋巴细胞白血病(chronic lymphocytic leukemia, CLL) 细胞系等疾病中均具有潜在的治疗作用[28]。2021年, Kim等[29]公布了Ceralasertib与紫杉醇联合治疗的Ⅰ期结果发现晚期恶性肿瘤患者对联合治疗耐受性良好, 并显示出抗肿瘤活性。在抗PD-1/PD-L1治疗耐药的晚期皮肤、肢端和黏膜黑色素瘤患者中观察到持久抗肿瘤效果。同样Yap等[30]报告Ceralasertib联合卡铂, 确定其Ⅱ期推荐剂量(recommended phase Ⅱ dose, RP2D) 为40 mg, 每天一次(第1~2天), 每3周服用一次卡铂(carboplatin), 通过药代动力学和药效学研究为其抗肿瘤活性提供初步证据。
|
Figure 5 The clinical compound ceralasertib (AZD-6738) was obtained by structural optimization from the lead compound AZ-20 |
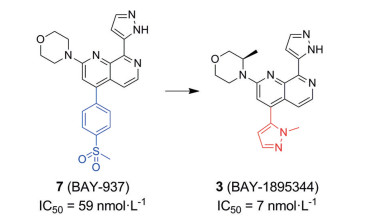
BAY-1895344 (Elimusertib, 3) 是一款由拜耳公司(Bayer) 开发的针对DDR的口服ATR激酶抑制剂, Luecking等[31]利用高通量筛选(high throughput screening, HTS) 从活性较弱的喹啉入手, 得到先导化合物BAY-937 (7), 再对7进行结构优化得到3 (图 6)。BAY-1895344显示出比BAY-937更强效的ATR激酶抑制活性(ATR酶IC50 = 7 nmol·L-1; 细胞活性IC50 = 36 nmol·L-1), 同时对PIKK家族的其他激酶也表现出优越的选择性(对ATM的选择性 > 200倍; 对DNA-PK的选择性 > 40倍; 对PI3K的选择性 > 400倍)[32, 33]。BAY-1895344目前正处在多个临床Ⅰ/Ⅱ期试验中。2017年, 拜耳公司开展了以BAY-1895344作为肿瘤单一疗法的临床试验[34], 目前已经有8项临床研究正在进行, 主要集中在晚期实体瘤。另外, BAY-1895344与美国食品与药品管理局(US Food & Drug Administration, 简称FDA) 批准的Alpha放射性药物镭-223联用, 在去势抵抗性前列腺癌(castration-resistant prostate cancer, CRPC) 的骨转移异种移植模型中具有协同作用[28, 31]。2021年, Yap等[35]对ATM突变或ATM蛋白缺失的患者采用剂量递增的方法, 确定了BAY-1895344最大耐受剂量(maximal tolerance dose, MTD) 为40 mg。但最常见的不良反应是血液学毒性。
|
Figure 6 The clinical compound BAY-1895344 is obtained from the lead compound BAY-937 through structural optimization |
M4344 (VX-803, 4) 最初由福泰制药(Vertex pharmaceuticals) 研究开发, 代号为VX-803, 后被德国默克公司(Merck KGaA) 收购, 给予另外一个代号M4344。它是目前报道的最有效的口服ATR激酶抑制剂(ATR酶IC50 = 0.15 nmol·L-1; 细胞活性IC50 = 8 nmol·L-1)[36, 37]。M4344通过有效抑制ATR激酶驱动的CHK1磷酸化, 从而阻断DNA损伤引起的信号转导, 导致细胞死亡, 因此具有明显的抗肿瘤活性。2021年, Jo等[36]提出M4344与多种临床相关复制应激诱导剂具有高度协同作用, 如与拓扑替康(topotecan) 和伊立替康(irinotecan) 在治疗患者源性肿瘤类器官和异种移植模型中具有显著作用。进一步的研究证明RS和神经内分泌(neuroendocrine, NE) 基因表达特征与M4344治疗的反应显著相关。因此, RS和NE基因表达特征可作为M4344的生物标记物。这些结果为M4344在临床研究中的应用奠定了基础。目前M4344已作为单药治疗肿瘤进入两个Ⅰ期临床试验, 并与卡铂和顺铂联合治疗晚期固体肿瘤[38], 并联合尼拉帕立(niraparib), 一种靶向聚腺苷酸二磷酸核糖基聚合酶(poly ADP-ribose polymerase, PARP) 的上市药品治疗PARP耐药复发性卵巢癌[39]。然而一些临床前数据未被报道[3], 科学家仍在继续探索其潜在的适应症和各种联合用药的可能性。
1.1.5 M1774M1774是由德国默克子公司EMD Serono研究所研发的一种ATR激酶抑制剂。目前, 它作为单药或和PARP抑制剂尼拉帕立治疗转移性或局部晚期不可切除实体瘤正在Ⅰ期临床试验中[40]。截止到目前, M1774的结构式尚未公布。
1.1.6 ATRN-119ATRN-119是由美国宾夕法尼亚州的Atrin Pharmaceuticals开发的。该公司于2016年在美国癌症研究协会(American Association for Cancer Research, AACR) 第107届年会上首次公布了ATRN-119的实验数据[41]。该公司于2019年AACR会议[42]再次提到了ATRN-119, 并发布了更多数据(细胞活性IC50 = 20 nmol·L-1, 其选择性是PIKK相关家族的2 000倍以上)。据称, ATRN-119是一款口服的ATR激酶抑制剂, 它对人胰腺癌和结肠癌异种移植物以及原位卵巢患者源性异种移植物(patient derived xenograft, PDX) 肿瘤显示出显著的抗肿瘤作用。另外, 通过让大鼠和犬多次口服高剂量该化合物以探索其毒性, 结果表明该化合物具有良好耐受性, 且无贫血或中性粒细胞减少的现象。此外, ATRN-119与各种PARP抑制剂表现出显著的协同作用, 且能够恢复对PARP抑制剂产生耐药的肿瘤细胞对ATR抑制剂的敏感性。该公司报告的其他证据也支持ATRN-119的临床开发[43]。截至目前, ATRN-119的结构式尚未正式公布。作者从Atrin Pharma近年来公开的两项ATR抑制剂专利里推断, ATRN-119很可能是大环化合物。
1.1.7 RP-3500RP-3500是由加拿大的Repare Therapeutics开发的一种口服抑制剂。2020年7月22日, 它作为单药或联合PARP抑制剂他拉唑帕利(talazoparib) 治疗晚期实体瘤正在Ⅰ/Ⅱa期试验中[44]; 2021年7月21日, 又开展了RP-3500联合PARP抑制剂尼拉帕利(niraparib) 或奥拉帕尼(olaparib) 在晚期实体瘤患者的Ⅰb/Ⅱ期试验[45], 以确定MTD和联合用药后的安全性、耐受性、药代动力学(PK) 和药效学(PD), 并研究其在实体瘤中的抗肿瘤活性。截止到目前, RP-3500的结构式尚未公布。
1.1.8 ART-0380ART-0380是由Artios Pharma公司从美国MD Anderson癌症中心和中国Shang Pharma Innovation获得许可) 开发的一种新的口服ATR抑制剂。2021年1月13日, 在美国启动一项开放标签、顺序分配、多中心、两部分的Ⅰ/Ⅱa期试验, 以评估ART-0380作为单一疗法或与吉西他滨(gemcitabine) 联合治疗晚期或转移性实体瘤(包括卵巢癌、输卵管癌和腹膜肿瘤) 患者(预期n = 180) 的耐受性、PK和初步疗效[46]。截止到目前, ART-0380的结构式尚未公布。
1.2 ATR激酶抑制剂与临床化合物的合成致死治疗癌症合成致死是用两种不同药物共同作用后杀灭某种或者全部肿瘤细胞, 而对正常细胞无影响。虽然前面提及的ATR激酶抑制剂正在临床试验中, 但关于它们的疗效、毒性仍在临床探索中。有证据显示, 单独使用ATR激酶抑制剂来治疗癌症, 其抗肿瘤药效有一定的局限性。因此, 基于合成致死的原理, 将ATR激酶抑制剂与其他DNA损伤药物、放射性疗法及靶向抗肿瘤药物联合使用, 可以达到叠加的抗肿瘤药效, 延缓耐药性的产生。表 1列出了ATR激酶抑制剂与多种临床抑制剂合成致死治疗癌症, 下面具体讨论与铂类、PARP抑制剂、拓扑异构酶I抑制剂、化疗、放疗等方面的联合用药。
| Table 1 Summary of ATR inhibitors currently in clinical trials |
铂类药物属于细胞周期非特异性药物, 目前最常用的3种铂类药物有顺铂、卡铂和奥沙利铂。它们通过与DNA共价交联作用来损害正常的DNA功能, 从而诱导细胞坏死或凋亡。但其最大的缺点是易产生耐药性, 因此经常将它与ATR激酶抑制剂联用以提高疗效。Berzosertib与顺铂联合治疗头颈部鳞状细胞癌或淋巴结(局部或者晚期) 的一项临床试验中, 研究了联合用药后的最佳剂量和不良反应[47]。另外, Yap等[17]选用17位患者评估Berzosertib单药治疗(每周一次或两次) 和23位患者联合卡铂(第1、2、9天: 卡铂/Berzosertib, 21天为一个周期) 的安全性和耐受性, 结果发现相比单药治疗, 联合治疗后对下游ATR底物CHK1的磷酸化有更显著抑制作用, 其药代动力学与剂量成比例, 且超过临床前的有效水平, 推荐Ⅱ期剂量(the recommended phase Ⅱ dose, RP2D) 为Berzosertib 90 mg·m-2和卡铂曲线下面积(AUC) 为5。
1.2.2 与PARP抑制剂的联合用药聚腺苷二磷酸核糖聚合酶(PARP) 在DNA修复通路中起关键作用, 因此是肿瘤细胞中的一个重要靶点, 而PARP抑制剂能够抑制DNA单链损伤的修复过程而产生单药抗肿瘤活性。目前常有的PARP抑制剂有奥拉帕尼、瑞卡帕尼、尼拉帕尼等, 但是在临床实践中, PARPi单一疗法会出现耐药性, 比如对铂和PARPi均敏感的BRCA2突变卵巢癌细胞系, 为克服这一缺点, 常与其他激酶抑制剂联合使用, 如ATR激酶抑制剂、BRD4抑制剂[48]等。研究表明ATR激酶抑制剂Ceralasertib单独或联合奥拉帕尼可以治疗肾细胞癌、尿路上皮癌、胰腺癌、子宫内膜癌以及其他实体肿瘤[49]。另外, 已有研究表明在ATM激酶缺乏型前列腺癌(prostate cancer, PC) 中PARP和ATR激酶抑制联用使用有更好的抗肿瘤作用[35, 36]。在治疗BRCA1/2突变的乳腺癌或卵巢癌中, PARP与ATR激酶抑制剂联合使用时也有类似结果。目前, PARP抑制剂与ATR激酶抑制剂联合的进一步临床研究已扩展到多个Ⅱ期试验, 包括三阴性乳腺癌、小细胞肺癌和卵巢癌的研究中[28, 50, 51]。
1.2.3 与拓扑异构酶I抑制剂的联合用药拓扑异构酶Ⅰ (topoisomerase I) 在基因表达调控中发挥着重要的作用, 是目前常用的化疗药物靶点之一[52]。拓扑异构酶I抑制剂能够抑制DNA的转录和翻译的过程, 从而造成DNA损伤, 诱导细胞凋亡, 起到抗肿瘤作用。常用的拓扑异构酶I抑制剂有羟喜树碱(camptothecin)、伊立替康(irinotecan) 和拓扑替康(topotecan) 等。在小细胞肺癌, 低分化神经内分泌癌以及胰腺癌中伊立替康或拓扑替康中加入BAY-1895344可能有助于减缓肿瘤的生长, 与单药治疗相比, 联合用药的药效更显著[53]。
2 临床前ATR激酶抑制剂与其他化合物的合成致死治疗癌症研究ATR激酶抑制剂与一些临床抑制剂的合成致死治疗癌症已在1.2描述过, 但是除了1.2提及的联合用药外, ATR激酶抑制剂与其他化合物的联合用药仍在不断探索中。
2.1 与HDACs抑制剂的联合用药组蛋白去乙酰化酶(histone deacetylases, HDACs) 作为抗肿瘤药物中一个临床验证过的靶点, 在DNA损伤反应方面发挥着重要作用, 能够与TP53、HSP70等关键蛋白发生作用而调控肿瘤进程。HDACs抑制剂通过增加细胞内组蛋白的乙酰化程度, 提高p21等基因的表达水平等途径, 抑制肿瘤细胞的增殖, 从而诱导细胞分化和凋亡[54]。Onxeo公司在2017年递交的一篇欧洲专利申请中报道, 采用ATR激酶抑制剂(如AZD-6738和VE-821) 和HDACs抑制剂贝利司他(Belinostat, 临床上用于治疗复发或难治性皮肤T细胞淋巴瘤) 联合用药, 对人乳腺癌细胞株MDA-MB231和淋巴瘤细胞株U937的增殖有叠加的抑制肿瘤效果[55]。
2.2 与HSP90激酶抑制剂的联合用药热休克蛋白90 (heat shock protein 90, HSP90) 是由热激发合成的一类蛋白质, 参与其他蛋白质折叠, 调节多种信号通路, 对癌症细胞生长发挥着十分重要的作用[56]。尤文氏肉瘤(Ewing's sarcoma, ES) 是儿童中常见的一种恶性肿瘤, 常规的治疗方法易产生耐药性。Dubrez等[57]将HSP90抑制剂AUY922与ATR激酶抑制剂VE-821或ATM激酶抑制剂KU55933联合使用观察在ES中的有效性, 结果表明AUY922与VE-821联合使用后能够诱导胚胎干细胞凋亡, 增强内质网应激水平。无论p53状态如何, HSP90和ATR抑制剂联合治疗都可能是一种有效的治疗方法, 但相比之下, AUY922与KU55933的结合没有产生理想的效果。此外, HSP90抑制剂和ATR激酶抑制剂在Ⅰ/Ⅱ期临床试验中已经被用于治疗各种类型的癌症, 特别是BRCA和p53基因缺陷的实体肿瘤。
2.3 与WEE1抑制剂的联合用药WEE1激酶作为癌症治疗的另一个有前途的靶点, 是S期和G2期细胞周期检查点阻滞所必需的。它通过磷酸化CDK的Thr-14和Tyr-15位点来抑制CDK激酶的活性, 进而抑制细胞进入有丝分裂。Rødland等[58]之前报道中提到WEE1抑制剂MK1775与CHK1抑制剂联合使用时对抑制癌细胞有协同作用, 但最近又报道了WEE1抑制剂Adavosertib和ATR激酶抑制剂Berzosertib单独或联合使用对骨肉瘤细胞系U2OS和4种不同肺癌细胞系(H460、A549、H1975、SW900) 影响(其中对肺癌的影响是首次研究), 研究发现联合WEE1和ATR激酶抑制剂在某些情况下可能有利于癌症治疗, 在不同癌细胞系的效应也是不同的, 但还没有找到一种统一的机制来解释观察到的不同效应。此外, WEE1和ATR激酶抑制剂与放疗联合治疗后的协同作用降低, 这表明单一抑制剂与放疗联合治疗可能是一种可取的方法。
2.4 与XPO1抑制剂的联合用药人类核输出蛋白(exportin 1, XPO1) 在结直肠癌(colorectal cancer, CRC) 细胞中表达高于正常结肠上皮细胞, 与正常细胞相比, XPO1抑制能显著抑制增殖并诱导恶性细胞凋亡。XPO1作为一个治疗靶点, 能够抑制CRC中特定DDR基因的表达, 从而诱导细胞凋亡, 因此使用XPO1抑制剂, 特别是与ATR激酶抑制剂联合使用, 能够显著延长TP53突变转移性结直肠癌小鼠的生存期。因此这可能是治疗CRC患者的一种新的治疗方法。例如联合使用XPO1抑制剂KPT-8602和ATR抑制剂Ceralasertib, 在TP53突变模型中具有显著的抗肿瘤效果[59]。
2.5 与ALDH抑制剂的联合用药乙醛脱氢酶(aldehyde dehydrogenase, ALDH) 在包括卵巢癌在内的多种癌症干细胞(cancer stem cells, CSCs) 中发挥重要作用, 通常在癌细胞中表达上调, 并与治疗性耐药性相关, 因此能作为一个潜在的新的治疗靶点。其中ALDH2是保护细胞免受乙醛毒性的主要线粒体酶, 其功能障碍与肿瘤发生相关, 能够与联合其他疗法共同治疗癌症[60]。此外, ALDH抑制剂通过诱导细胞内基因毒性醛的积累导致DSB, 尤其在HR中ALDHi可与ATM和ATR激酶抑制剂协同作用, 降低体外的细胞活力和体内的肿瘤生长程度[61]。
2.6 与AXL抑制剂的联合用药AXL是一种TAM (TYRO3、AXL和MERTK) 家族受体酪氨酸激酶, 通过激活自身的酪氨酸激酶活性来激活下游信号, 从而在DNA损伤反应中发挥作用。它在治疗复发性NSCLC、大细胞神经内分泌癌(large-cell neuroendocrine carcinoma, LCNEC) 亚群中高度表达。研究表明在p53缺陷的NSCLC和LCNEC中, 选择性的小分子AXL抑制剂如Bemcentinib (BGB324) 和ATR激酶抑制剂的联合使用时RPA32高度磷酸化、DNA双链断裂, gH2Ax水平显著增加。另外, 有学者利用ATR激酶抑制剂联合BGB324进行5天的细胞增殖实验, 结果表明有AXL高耐药性肺癌细胞对ATR激酶抑制剂高度敏感。因此AXL和ATR激酶抑制剂的联合使用有望成为治疗NSCLC、LCNEC和其他癌症的一种方法[62]。
2.7 与SWI/SNF (BAF) 抑制剂的联合用药染色质重塑复合物SWI/SNF (BAF) 在细胞周期、DNA损伤修复中发挥重要作用, 但也易发生突变, 为了规避SWI/SNF抑制的潜在毒性, 作者确定了一些相对无毒的小分子抑制剂如BD98 (尤其在恶性横纹肌样肿瘤和滑膜肉瘤), 和ATR激酶抑制剂联用可以产生协同作用, 其作用机制可能与BRG1和BAF170的ATR/ATM磷酸化促进BAF与DNA损伤位点。尽管BD98和ATRi之间有很强的协同作用, 但将这些大环化合物做动物模型试验仍存在较大的挑战[63]。
2.8 与Aurora-A抑制剂的联合用药Aurora-A激酶属于类丝氨酸/苏氨酸激酶家族, 是一种有丝分裂调节因子, 在维持基因组稳定发挥着重要的作用。研究发现在抑制MYCN扩增神经母细胞瘤(MYCN-amplified neuroblastoma) 小鼠模型中, Aurora-A激酶抑制剂与ATR激酶抑制剂联合使用时肿瘤细胞会发生特异性凋亡和消退, 使得一部分小鼠的肿瘤永久根除, 且这种联合诱导是特异性的, 并不会干扰到周围的组织和细胞。为了在人类肿瘤样本测试其效果, Roeschert等[64]用MLN8237、Ceralasertib单药治疗或二者联合治疗了4例MYCN扩增和4例MYCN非扩增的患者来源的神经母细胞瘤异种移植物, 结果显示联合用药的大鼠都获得了比单一用药更长的生命周期, 这表明Aurora-A和ATR激酶抑制剂联合用药比单一治疗能够更好抑制肿瘤生长。
2.9 与BRAD4抑制剂的联合用药BRAD4属于组蛋白乙酰化阅读器的含溴结构域和额外终端域家族蛋白(bromo and extra-C terminal domain, BET) 的一员, 调节CHK1信号以响应内源性和外源性DNA复制应激。目前, BRAD4抑制剂已经在急性白血病、淋巴瘤和NUT中线癌(NUT midline carcinoma, NMC) 中发挥良好的临床活性。Zhang等[65]发现了一种BRD4在DNA复制应激反应中的新生物学功能, 即BRD4以转录独立的方式调控DNA损伤反应信号。BETi治疗使癌细胞对复制应激诱导药物敏感如依托泊苷(etoposide), 并与ATR激酶抑制剂Ceralasertib协同抑制很多癌细胞系。当Ceralasertib与JQ1或AZD5153结合时, pCHK1几乎完全被抑制, 因此在体内发挥更大的抗肿瘤疗效。此外, AZD5153和Ceralasertib之间的协同作用可转化为体内卵巢细胞系和患者来源的异种移植模型。
3 结论和展望ATR激酶作为PIKKs家族中对DNA损伤反应和修复途径起重要作用的关键成员之一, 靶向ATR激酶来研究开发抗肿瘤药物近年来受到了学术界和制药公司的广泛关注。大量科学论文、综述和专利的出版给出了足够的证据说明ATR激酶是癌症治疗的一个潜在的药物靶点。截至目前, 已经有8种ATR激酶抑制剂正在临床阶段, 足以显示这一领域的药物发现比以往任何时候都更加激烈。
本文总结了抗肿瘤活性的小分子ATR激酶抑制剂的最新进展。基于化合物库的高通量筛选是发现ATR激酶抑制剂的重要途径, 如利用高通量筛选得到先导化合物BAY-937。这些先导化合物再采用Suzuki偶联反应、Buchwald-Hartwig芳胺化反应等构建ATR激酶抑制剂的母核, 并通过酰胺缩合反应、酯水解反应等有机合成方法进行优化; 最后利用系统的药代动力学、药效学和毒理学评价新衍生物筛选出候选药物。截至目前, ATR-ATRIP复合体结构已被解析, 但是尚未有小分子抑制剂与ATR激酶蛋白或ATR-ATRIP复合体的共晶结构报道。这将是药物化学家和生物学家在今后短的时间里共同攻克的目标。小分子与蛋白的共晶结构将对人们利用计算机辅助的手段来设计新的ATR激酶抑制剂提供强有力的帮助, 也会进一步加速ATR抑制剂抗肿瘤药物的研究和开发。
虽然ATR激酶抑制剂单药治疗和联合治疗都得到了临床前研究结果的支持, 但是单药治疗的抗癌效果可能有限。另一方面, 在当前的合成致死概念下, 联合治疗已成为制药行业的焦点。在临床前研究和临床研究中, ATR激酶抑制剂和放疗、化疗及靶向药物的联合使用在多种不同类型的癌症都显示出协同抗癌作用。
尽管这一领域已经取得了令人鼓舞的进展, 但开发具有治疗作用的ATR抑制剂仍面临着一些挑战。第一个挑战是选择性, ATR激酶在结构上与其他PIKKs家族成员(ATM和DNA-PK) 以及PI3脂类激酶非常接近。抑制所有PIKKs家族成员和PI3K的抑制剂可能具有潜在毒性。其次, 寻找合适的生物标志物来指导潜在的药物组合将是近期该领域药物发现的重点。据报道, 诸如ARID1A突变、ATM突变、BRCA1/BRCA2突变、MYC扩增和CCNE1扩增等生物标记物存在于不同癌症类型的大量癌症患者群体肿瘤细胞中[66]。Lloyd等[67]利用CRISPR-Cas9技术发现, 某些基因(如细胞周期蛋白C和CDK8) 的缺失可抑制心房颤动的抗肿瘤疗效, 而其他基因的缺失可增强心房颤动的疗效。Schlafen 11 (SLFN11) 被Jo等[68]确定为可能影响ATR激酶抑制剂抗癌效果的预测性生物标记物之一。比以往任何时候都更清楚的是, 抑制ATR激酶所导致的生物标志物变化可能会影响ATR激酶抑制剂的抗癌疗效, 并且可能可以应用到临床上对癌症患者进行分流, 对治疗方案提出指导, 选择包括ATR激酶抑制剂在内的合适的药物组合[69]。因此寻找和发现与ATR激酶抑制相关联的可引起合成致死的生物标记物将是今后开发ATR激酶抑制剂药物的研究重点和研究方向。
作者贡献: 袁滢惠、段吉隆负责文献检索及论文撰写; 叶向阳和谢恬负责文章选题、指导写作; 惠子修改及校对文章。
利益冲突: 本文无利益冲突。
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71: 209-249. DOI:10.3322/caac.21660 |
| [2] |
Cheng A, Zhao T, Tse KH, et al. ATM and ATR play complementary roles in the behavior of excitatory and inhibitory vesicle populations[J]. Proc Natl Acad Sci U S A, 2018, 115: E292-E301. |
| [3] |
Barnieh PM, Loadman PM, Falconer RA. Progress towards a clinically-successful ATR inhibitor for cancer therapy[J]. Pharmacol Drug Discov, 2021, 2: 100017. |
| [4] |
Maréchal A, Zou L. DNA damage sensing by the ATM and ATR kinases[J]. Cold Spring Harb Perspect Biol, 2013, 5: a012716. DOI:10.1101/cshperspect.a012716 |
| [5] |
Menolfi D, Zha S. ATM, ATR and DNA-PKcs kinases-the lessons from the mouse models: inhibition ≠ deletion[J]. Cell Biosci, 2020, 10: 8. DOI:10.1186/s13578-020-0376-x |
| [6] |
Hauge S, Eek Mariampillai A, Rødland GE, et al. Expanding roles of cell cycle checkpoint inhibitors in radiation oncology[J]. Int J Radiat Biol, 2021, 20: 1-10. |
| [7] |
Du W, Gao A, Herman JG, et al. Methylation of NRN1 is a novel synthetic lethal marker of PI3K-Akt-mTOR and ATR inhibitors in esophageal cancer[J]. Cancer Sci, 2021, 112: 2870-2883. DOI:10.1111/cas.14917 |
| [8] |
Dibitetto D, Sims JR, Ascenção CFR, et al. Intrinsic ATR signaling shapes DNA end resection and suppresses toxic DNA-PKcs signaling[J]. NAR Cancer, 2020, 2: zcaa006. DOI:10.1093/narcan/zcaa006 |
| [9] |
Gralewska P, Gajek A, Marczak A, et al. Participation of the ATR/CHK1 pathway in replicative stress targeted therapy of high-grade ovarian cancer[J]. J Hematol Oncol, 2020, 13: 39. DOI:10.1186/s13045-020-00874-6 |
| [10] |
Hu S, Hui Z, Lirussi F, et al. Small molecule DNA-PK inhibitors as potential cancer therapy: a patent review (2010-present)[J]. Expert Opin Ther Pat, 2021, 31: 435-452. DOI:10.1080/13543776.2021.1866540 |
| [11] |
Abdel-Magid AF. ATR inhibitors as potential treatment for cancers[J]. ACS Med Chem Lett, 2018, 9: 292-293. DOI:10.1021/acsmedchemlett.8b00107 |
| [12] |
Reaper PM, Griffiths MR, Long JM, et al. Selective killing of ATM- or p53-deficient cancer cells through inhibition of ATR[J]. Nat Chem Biol, 2011, 7: 428-430. DOI:10.1038/nchembio.573 |
| [13] |
Wang X, Ran T, Zhang X, et al. 3.9 Å structure of the yeast Mec1-Ddc2 complex, a homolog of human ATR-ATRIP[J]. Science, 2017, 358: 1206-1209. DOI:10.1126/science.aan8414 |
| [14] |
Rao Q, Liu M, Tian Y, et al. Cryo-EM structure of human ATR-ATRIP complex[J]. Cell Res, 2018, 28: 143-156. DOI:10.1038/cr.2017.158 |
| [15] |
Charrier JD, Durrant SJ, Golec JM, et al. Discovery of potent and selective inhibitors of ataxia telangiectasia mutated and Rad3 related (ATR) protein kinase as potential anticancer agents[J]. J Med Chem, 2011, 54: 2320-2330. DOI:10.1021/jm101488z |
| [16] |
Knegtel R, Charrier JD, Durrant S, et al. Rational design of 5-(4-(isopropylsulfonyl)phenyl)-3-(3-(4-((methylamino)methyl)phenyl)isoxazol-5-yl)pyrazin-2-amine (VX-970, M6620): optimization of intra- and intermolecular polar interactions of a new ataxia telangiectasia mutated and rad3-related (ATR) kinase inhibitor[J]. J Med Chem, 2019, 62: 5547-5561. DOI:10.1021/acs.jmedchem.9b00426 |
| [17] |
Yap TA, O'Carrigan B, Penney MS, et al. Phase Ⅰ trial of first-in-class ATR inhibitor M6620 (VX-970) as monotherapy or in combination with carboplatin in patients with advanced solid tumors[J]. J Clin Oncol, 2020, 38: 3195-3204. DOI:10.1200/JCO.19.02404 |
| [18] |
Fokas E, Prevo R, Pollard JR, et al. Targeting ATR in vivo using the novel inhibitor VE-822 results in selective sensitization of pancreatic tumors to radiation[J]. Cell Death Dis, 2012, 3: e441. DOI:10.1038/cddis.2012.181 |
| [19] |
Thomas A, Redon CE, Sciuto L, et al. Phase Ⅰ study of ATR inhibitor M6620 in combination with topotecan in patients with advanced solid tumors[J]. J Clin Oncol, 2018, 36: 1594-1602. DOI:10.1200/JCO.2017.76.6915 |
| [20] |
Feng W, Dean DC, Hornicek FJ, et al. ATR and p-ATR are emerging prognosticbiomarkers and DNA damage response targets in ovarian cancer[J]. Ther Adv Med Oncol, 2020, 12: 1-18. |
| [21] |
Shapiro GI, Wesolowski R, Devoe C, et al. Phase 1 study of the ATR inhibitor berzosertib in combination with cisplatin in patients with advanced solid tumours[J]. Br J Cancer, 2021, 125: 520-527. DOI:10.1038/s41416-021-01406-w |
| [22] |
Middleton MR, Dean E, Evans TRJ. Phase 1 study of the ATR inhibitor berzosertib (formerly M6620, VX-970) combined with gemcitabine ± cisplatin in patients with advanced solid tumours[J]. Br J Cancer, 2021, 125: 510-519. DOI:10.1038/s41416-021-01405-x |
| [23] |
Baschnagel AM, Elnaggar JH, VanBeek HJ, et al. ATR inhibitor M6620 (VX-970) enhances the effect of radiation in non-small cell lung cancer brain metastasis patient-derived xenografts[J]. Mol Cancer Ther, 2021, 20: 2129-2139. DOI:10.1158/1535-7163.MCT-21-0305 |
| [24] |
Pal SK, Frankel PH, Mortazavi A, et al. Effect of cisplatin and gemcitabine with or without berzosertib in patients with advanced urothelial carcinoma: a phase 2 randomized clinical trial[J]. JAMA Oncol, 2021, 7: 1536-1543. DOI:10.1001/jamaoncol.2021.3441 |
| [25] |
Graham MA, Askey H, Campbell AD, et al. Development and scale-up of an improved manufacturing route to the ATR inhibitor ceralasertib[J]. Org Proc Res Dev, 2021, 25: 43-56. DOI:10.1021/acs.oprd.0c00482 |
| [26] |
Foote KM, Nissink JWM, McGuire T, et al. Discovery and characterization of AZD6738, a potent inhibitor of ataxia telangiectasia mutated and Rad3 related (ATR) kinase with application as an anticancer agent[J]. J Med Chem, 2018, 61: 9889-9907. DOI:10.1021/acs.jmedchem.8b01187 |
| [27] |
Gorecki L, Andrs M, Rezacova M, et al. Discovery of ATR kinase inhibitor berzosertib (VX-970, M6620): clinical candidate for cancer therapy[J]. Pharmacol Ther, 2020, 210: 107518. DOI:10.1016/j.pharmthera.2020.107518 |
| [28] |
Mei L, Zhang J, He K, et al. Ataxia telangiectasia and Rad3-related inhibitors and cancer therapy: where we stand[J]. J Hematol Oncol, 2019, 12: 43. DOI:10.1186/s13045-019-0733-6 |
| [29] |
Kim ST, Smith SA, Mortimer P, et al. Phase Ⅰ study of ceralasertib (AZD6738), a novel DNA damage repair agent, in combination with weekly paclitaxel in refractory cancer[J]. Clin Cancer Res, 2021, 27: 4700-4709. DOI:10.1158/1078-0432.CCR-21-0251 |
| [30] |
Yap TA, Krebs MG, Postel-Vinay S, et al. Ceralasertib (AZD6738), an oral ATR kinase inhibitor, in combination with carboplatin in patients with advanced solid tumors: a phase Ⅰ study[J]. Clin Cancer Res, 2021, 27: 5213-5224. DOI:10.1158/1078-0432.CCR-21-1032 |
| [31] |
Luecking U, Wortmann L, Wengner AM, et al. Damage incorporated: discovery of the potent, highly selective, orally available ATR inhibitor BAY 1895344 with favorable pharmacokinetic properties and promising efficacy in monotherapy and in combination treatments in preclinical tumor models[J]. J Med Chem, 2020, 63: 7293-7325. DOI:10.1021/acs.jmedchem.0c00369 |
| [32] |
Wengner AM, Siemeister G, Lücking U, et al. The novel ATR inhibitor BAY 1895344 is efficacious as monotherapy and combined with DNA damage-inducing or repair-compromising therapies in preclinical cancer models[J]. Mol Cancer Ther, 2020, 19: 26-38. |
| [33] |
Luecking UT, Lefranc J, Wengner A, et al. Abstract 983: identification of potent, highly selective and orally available ATR inhibitor BAY 1895344 with favorable PK properties and promising efficacy in monotherapy and combination in preclinical tumormodels [C]. Washington, DC: The American Association for Cancer Research Annual Meeting (AACR), 2017.
|
| [34] |
Bayer. First-in-human study of ATR inhibitor BAY1895344 in patients with advanced solid tumors and lymphomas [DB/OL]. U. S. National Library of Medicine database, 2021 [2021-09-30]. https://clinicaltrials.gov/ct2/show/NCT03188965.
|
| [35] |
Yap TA, Tan DSP, Terbuch A, et al. First-in-human trial of the oral ataxia telangiectasia and RAD3-related (ATR) inhibitor BAY 1895344 in patients with advanced solid tumors[J]. Cancer Discov, 2021, 11: 80-91. DOI:10.1158/2159-8290.CD-20-0868 |
| [36] |
Jo U, Senatorov IS, Zimmermann A, et al. Novel and highly potent ATR inhibitor M4344 kills cancer cells with replication stress, and enhances the chemotherapeutic activity of widely used DNA damaging agents[J]. Mol Cancer Ther, 2021, 20: 1431-1441. DOI:10.1158/1535-7163.MCT-20-1026 |
| [37] |
Gorecki L, Andrs M, Rezacova M, et al. Discovery of ATR kinase inhibitor berzosertib (VX-970, M6620): clinical candidate for cancer therapy[J]. Pharmacol Ther, 2020, 210: 107518. DOI:10.1016/j.pharmthera.2020.107518 |
| [38] |
EMD Serono Research & Development Institute, Inc. First in human study of M4344 in participants with advanced solid tumors [DB/OL]. U. S. National Library of Medicine database, 2021 [2021-09-30]. https://clinicaltrials.gov/ct2/show/NCT02278250.
|
| [39] |
Arend R. Trial of M4344 and niraparib in patients with poly (ADP-ribose) polymerase (PARP) resistant recurrent ovarian cancer (PARP) [DB/OL]. U. S. National Library of Medicine database, 2021 [2021-09-30]. https://clinicaltrials.gov/ct2/show/NCT04149145.
|
| [40] |
EMD Serono Research & Development Institute, Inc. M1774 in participants with metastatic or locally advanced unresectable solid tumors (DDRiver solid tumors 301) [DB/OL]. U. S. National Library of Medicine database, 2021 [2021-09-30]. https://clinicaltrials.gov/ct2/show/NCT04170153.
|
| [41] |
Butler LR, Ragland RL, Breslin HJ, et al. Abstract 1226: Highly specific ATR inhibitors as a therapeutic approach for a broad spectrum of cancers [C]. New Orleans, LA. Philadelphia (PA): The American Association for Cancer Research Annual Meeting (AACR), 2016.
|
| [42] |
Pamarthy S, Li D, Goliadze E, et al. Abstract 3498: Highly specific macrocyclic ATR inhibitors for the targeted treatment of a broad spectrum of cancers showing lack of anemia or neutropenia in pre-clinical animal models [C]. Atlanta, GA: The American Association for Cancer Research Annual Meeting (AACR), 2019.
|
| [43] |
Pharmaceuticals Atrin. Study Of ATRN-119 in patients with advanced solid tumors [DB/OL]. U. S. National Library of Medicine database, 2021 [2021-11-05]. https://clinicaltrials.gov/ct2/show/NCT04905914.
|
| [44] |
Therapeutics Repare. Study of RP-3500 in advanced solid tumors [DB/OL]. U. S. National Library of Medicine database, 2021 [2021-11-05]. https://clinicaltrials.gov/ct2/show/NCT04497116.
|
| [45] |
Therapeutics Repare. Study of RP-3500 with niraparib or olaparib in advanced solid tumors (ATTACC) [DB/OL]. U. S. National Library of Medicine database, 2021 [2021-11-05]. https://clinicaltrials.gov/ct2/show/NCT04972110.
|
| [46] |
Artios Pharma Ltd. A Study of ART0380 for the treatment of advanced or metastatic solid tumors [DB/OL]. U. S. National Library of Medicine database, 2021 [2021-11-05]. https://clinicaltrials.gov/ct2/show/NCT04657068.
|
| [47] |
National Cancer Institute (NCI). Testing the addition of M6620 (VX-970, Berzosertib) to usual chemotherapy and radiation for head and neck cancer [DB/OL]. U. S. National Library of Medicine database, 2021 [2021-9-30]. https://clinicaltrials.gov/ct2/show/NCT02567422.
|
| [48] |
Chang X, Sun D, Shi D, et al. Design, synthesis, and biological evaluation of quinazolin-4(3H)-one derivatives co-targeting poly(ADP-ribose) polymerase-1 and bromodomain containing protein 4 for breast cancer therapy[J]. Acta Pharm Sin B, 2021, 11: 156-180. DOI:10.1016/j.apsb.2020.06.003 |
| [49] |
Aggarwal R. Phase Ⅱ trial of AZD6738 alone and in combination with olaparib [DB/OL]. U. S. National Library of Medicine database, 2021 [2021-9-30]. https://clinicaltrials.gov/ct2/show/NCT03682289.
|
| [50] |
Quigley DA. One of these things is not like the others: targeting ATM-mutant prostate cancer[J]. Eur Urol, 2021, 79: 212-213. DOI:10.1016/j.eururo.2020.11.018 |
| [51] |
Neeb A, Herranz N, Arce-Gallego S, et al. Advanced prostate cancer with ATM loss: PARP and ATR inhibitors[J]. Eur Urol, 2021, 79: 200-211. DOI:10.1016/j.eururo.2020.10.029 |
| [52] |
Hevener K, Verstak TA, Lutat KE, et al. Recent developments in topoisomerase-targeted cancer chemotherapy[J]. Acta Pharm Sin B, 2018, 8: 844-861. DOI:10.1016/j.apsb.2018.07.008 |
| [53] |
National Cancer Institute (NCI). Testing the addition of an anti-cancer drug, BAY 1895344, to usual chemotherapy for advanced stage solid tumors, with a specific focus on patients with small cell lung cancer, poorly differentiated neuroendocrine cancer, and pancreatic cancer [DB/OL]. U. S. National Library of Medicine database, 2021 [2021-9-30]. https://clinicaltrials.gov/ct2/show/NCT04514497.
|
| [54] |
Thurn KT, Thomas S, Raha P, et al. Histone deacetylase regulation of ATM-mediated DNA damage signaling[J]. Mol Cancer Ther, 2013, 12: 2078-2087. DOI:10.1158/1535-7163.MCT-12-1242 |
| [55] |
Onxeo. Combination of a DNA damage response cell cycle checkpoint inhibitors and Belinostat for treating cancer: EP, 3461480A1 [P], 2019-04-03.
|
| [56] |
Serwetnyk MA, Blagg BSJ. The disruption of protein-protein interactions with co-chaperones and client substrates as a strategy towards Hsp90 inhibition[J]. Acta Pharm Sin B, 2021, 11: 1446-1468. DOI:10.1016/j.apsb.2020.11.015 |
| [57] |
Dubrez L, Causse S, Borges Bonan N, et al. Heat-shock proteins: chaperoning DNA repair[J]. Oncogene, 2020, 39: 516-529. DOI:10.1038/s41388-019-1016-y |
| [58] |
Rødland GE, Hauge S, Hasvold G, al Bet. Differential effects of combined ATR/WEE1 inhibition in cancer cells[J]. Cancers (Basel), 2021, 13: 3790. DOI:10.3390/cancers13153790 |
| [59] |
Inoue A, Robinson FS, Minelli R, et al. Sequential administration of XPO1 and ATR inhibitors enhances therapeutic response in TP53-mutated colorectal cancer[J]. Gastroenterology, 2021, 161: 196-210. DOI:10.1053/j.gastro.2021.03.022 |
| [60] |
Zhang H, Fu L. The role of ALDH2 in tumorigenesis and tumor progression: targeting ALDH2 as a potential cancer treatment[J]. Acta Pharm Sin B, 2021, 11: 1400-1411. DOI:10.1016/j.apsb.2021.02.008 |
| [61] |
Grimley E, Cole AJ, Luong TT, et al. Aldehyde dehydrogenase inhibitors promote DNA damage in ovarian cancer and synergize with ATM/ATR inhibitors[J]. Theranostics, 2021, 11: 3540-3551. DOI:10.7150/thno.51885 |
| [62] |
Ramkumar K, Stewart CA, Cargill KR, et al. AXL inhibition induces DNA damage and replication stress in non-small cell lung cancer cells and promotes sensitivity to ATR inhibitors[J]. Mol Cancer Res, 2021, 19: 485-497. DOI:10.1158/1541-7786.MCR-20-0414 |
| [63] |
Chory EJ, Kirkland JG, Chang CY, et al. Chemical inhibitors of a selective SWI/SNF function synergize with ATR inhibition in cancer cell killing[J]. ACS Chem Biol, 2020, 15: 1685-1696. DOI:10.1021/acschembio.0c00312 |
| [64] |
Roeschert I, Poon E, Henssen AG, et al. Combined inhibition of Aurora-A and ATR kinase results in regression of MYCN-amplified neuroblastoma[J]. Nat Cancer, 2021, 2: 312-326. DOI:10.1038/s43018-020-00171-8 |
| [65] |
Zhang J, Dulak AM, Hattersley MM, et al. BRD4 facilitates replication stress-induced DNA damage response[J]. Oncogene, 2018, 37: 3763-3777. DOI:10.1038/s41388-018-0194-3 |
| [66] |
Pilié PG, Tang C, Mills GB, et al. State-of-the-art strategies for targeting the DNA damage response in cancer[J]. Nat Rev Clin Oncol, 2019, 16: 81-104. |
| [67] |
Lloyd RL, Urban V, Muñoz-Martínez F, et al. Loss of cyclin C or CDK8 provides ATR inhibitor resistance by suppressing transcription-associated replication stress[J]. Nucleic Acids Res, 2021, 49: 8665-8683. DOI:10.1093/nar/gkab628 |
| [68] |
Jo U, Murai Y, Takebe N, et al. Precision oncology with drugs targeting the replication stress, ATR, and Schlafen 11[J]. Cancers (Basel), 2021, 13: 4601. DOI:10.3390/cancers13184601 |
| [69] |
Cleary JM, Aguirre AJ, Shapiro GI, et al. Biomarker-guided development of DNA repair inhibitors[J]. Mol Cell, 2020, 78: 1070-1085. |
 2022, Vol. 57
2022, Vol. 57


