艾滋病(acquired immune deficiency syndrome, AIDS)、乙肝(viral hepatitis type B) 等病毒感染导致的慢性传染性疾病严重危害人类的健康与生命, 目前现有的抗病毒药物存在耐药性、不良反应大等问题, 特别是耐药性是使上市药物降低甚至丧失临床疗效的主要原因。此外, 近年来的严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus, SARS)、埃博拉病毒(Ebola virus, EBOV)、中东呼吸综合征冠状病毒(middle east respiratory syndrome coronavirus, MERS-CoV) 以及新型冠状肺炎病毒(severe acute respiratory syndrome-coronavirus 2, SARS-CoV-2) 等病毒感染导致的多次严重疫情, 给人类社会造成了极大的危害。更为严重的是, 耐药性的进一步发展使全球公共卫生体系面临严峻的挑战, 使人类面临新一轮疫情的威胁。因此, 研发高效抗耐药性的新型抗病毒药物是临床长期迫切需求, 也是药物化学工作者长期持续性的研究工作[1-24]。
化学基础学科是药物发现的理论基石。其中, 生物无机化学又称生物配位化学, 是20世纪60年代以来逐步形成的以无机化学、生物化学、医学等多种学科交叉的领域。其研究对象是生物体内的金属(和少数非金属) 元素及其配合物, 特别是痕量金属元素和生物大分子配体形成的生物配合物, 如各种金属酶、金属蛋白等[25-28]。无机药物化学是生物无机化学的主要方向之一, 其在抗病毒药物研究领域发挥着不可或缺的作用, 目前已有多类以金属酶为靶标的抗病毒药物上市, 金属配合物、无机纳米材料也成为抗病毒药物的重要物质基础。本文总结了当前该领域的研究热点, 特别是我国生物无机化学家在抗病毒药物研究领域已取得的成就。在此基础上, 探讨了基于生物无机化学的抗病毒药物研发领域的挑战与未来发展的策略与方向。
1 以金属酶为靶标的抗病毒药物研究许多金属蛋白(含金属的酶) 是治疗多种人类疾病的重要药物靶点, 包括病毒感染、细菌感染、癌症、糖尿病、贫血、高血压、纤维化和神经退行性疾病。这种金属酶通常在催化部位含有一个或多个金属离子, 对发挥生物作用至关重要。对酶结构与机制的深入了解是设计有效抑制剂的基础。与抗病毒药物设计相关的酶主要包括镁离子和锌离子依赖的酶[29, 30]。
1.1 以镁离子依赖性酶为靶标的抗病毒药物研究 1.1.1 已上市或处于临床阶段的抗病毒药物由于特殊的物理化学特性, 镁离子参与了核酸生物化学中的许多催化过程, 从而在许多不同病毒的复制中发挥关键作用。镁离子依赖的抗病毒药物靶标主要包括: 人类免疫缺陷病毒(human immunodeficiency virus, HIV) 整合酶(integrase, IN)、HIV/乙肝病毒(hepatitis B virus, HBV) 核酸水解酶(ribonuclease H, RNase H)、流感病毒(influenza virus) 核酸内切酶(endonuclease)、丙型肝炎病毒(hepatitis C virus, HCV) 聚合酶(polymerase)、人巨细胞病毒(human cytomegalovirus, HCMV) pUL89核酸内切酶、单纯性疱疹病毒(herpes simplex virus, HSV) pUL15、登革病毒(dengue virus, DENV) RNA聚合酶等[31-37], 它们均属于二价镁离子依赖性蛋白, 具有类似的氨基酸序列的催化位点及类似的催化机制, 都需要二价金属离子作为酶催化功能的金属辅因子。其中, HIV-1 IN的研究最为深入, 经3′-加工及链转移过程将病毒DNA并入宿主DNA (图 1)。IN的活性位点包括两个天冬氨酸残基和一个谷氨酸残基(也被称为催化DDE三联体) 以及一对Mg2+。两个Mg2+负责激活DNA引物3′-羟基。
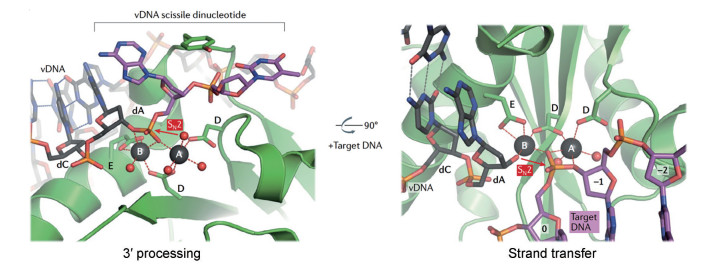
|
Figure 1 IN active sites primed for 3' processing (left, PDB code 4E7I) and strand transfer (right, PDB code 4E7K)[30]. dA: Deoxyadenosine; dC: Deoxycytidine |
以镁离子依赖性酶为靶标的抗病毒药物中, 目前美国FDA已批准了5种HIV-1整合酶链转移抑制剂[拉替拉韦(raltegravir)、埃替拉韦(elvitegravir)、多替拉韦(dolutegravir)、比卡格韦(bictegravir)、卡博特韦(cabotegravir)] 及一种甲型流感病毒PA内切酶(PAN endonuclease) 抑制剂巴洛沙韦(baloxavir marboxil) (图 2)。它们的结构中具有相似的药效团模型, 即一个可以与二价金属离子(Mg2+) 配合的金属螯合基序, 一个能够与活性中心保守氨基酸残基或脱氧腺苷产生堆积力的疏水区域和一个灵活的“连接臂”。而它们发挥抑制作用和结合靶标所依赖的关键作用力均为金属螯合基序与催化活性中心形成的配位键, 因而螯合骨架对该类化合物活性至关重要。同时, 疏水区域和“连接臂”对靶点选择性、理化性质的显著影响不容忽视。相较于早期的抑制剂拉替拉韦和埃替拉韦, 新一代HIV-1整合酶抑制剂多替拉韦和比卡格韦及流感病毒内切酶抑制剂巴洛沙韦具有以下显著特征: 金属螯合区域呈现出较高的立体性特征, 多含有非芳香性的桥环结构, 这可能是其具有较好理化性质、较高成药性的原因。
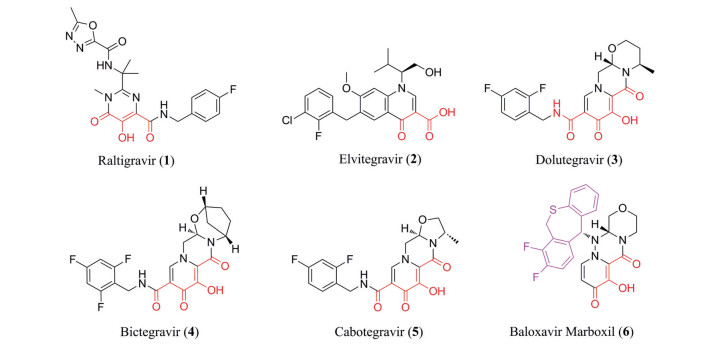
|
Figure 2 The representative antiviral drugs featuring a metal-binding group (in red) |
HIV-1 RNase H结构域位于RT p66亚基C末端, 大小约15 kDa, 从氨基酸Tyr427开始是其保守催化区域, 与聚合酶活性位点相距约60 Å (相当于18个碱基对)。RNase H结构域含有两个二价金属离子(Mg2+或Mn2+)、4个α螺旋结构和5个特征性β折叠片段, 其中, 第1~3个α螺旋和第4个α螺旋分列于第4个β折叠的两侧, 第2个β折叠与其他的β折叠反向平行(图 3)[38-40]。
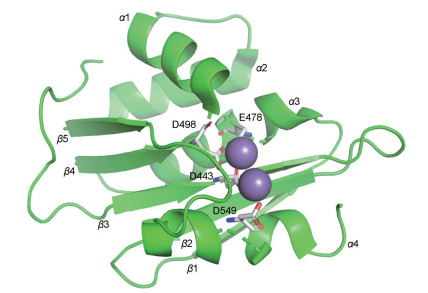
|
Figure 3 The catalytic domain of HIV-1 RNase H (PDB code: 3K2P). This figure was generated using PyMol (www.pymol.org) |
HIV-1 RNase H必需两个二价金属离子(Mg2+或Mn2+等) 参与协作才能发挥其催化活性。HIV-1 RNase H活性位点具有高度保守的DEDD模序(由Asp443、Glu478、Asp498和Asp549组成), 在金属离子的协作参与下, 通过双分子亲核取代反应(SN2) 完成磷酰基转移。该SN2反应涉及水分子的去质子化和磷酸二酯键的断裂(图 4)。在二价金属离子的作用下, 结合水发生去质子化, 形成一个带负电的OH-, 从而亲核进攻病毒RNA链上5′-易断裂的磷酸基团, 破坏磷酸二酯键。另一个二价金属离子则破坏酶和底物结合的稳定性, 并与离去基团作用以稳定五价过渡态。这两个金属离子之间距离的灵活性保证了RNase H的水解功能, 并与DEDD模序中的催化性残基相互协调, 将水解反应位点固定于RNase H催化活性位点, 其中任一催化性残基发生突变, 都会导致RNase H活性丧失。同样, 阻碍这些催化性残基与金属离子对于RNA底物的亲核取代反应, 也将导致RNase H失活, 这为基于RNase H为靶标的药物设计提供了重要依据[38-40]。
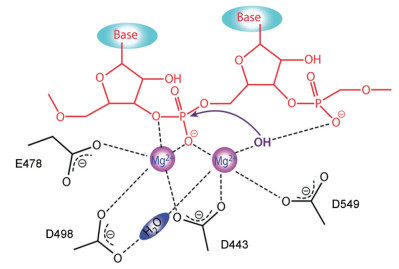
|
Figure 4 Hydrolysis mechanism of HIV-1 RNase H[37] |
近年来, 越来越多关于RNase H抑制剂的研究被报道, 基于结合位点的不同, 该类抑制剂可分为活性位点抑制剂和变构抑制剂。活性位点抑制剂与活性位点高度保守的DEDD模序相互作用, 同时螯合两个催化必需的二价金属离子, 占据底物(RNA/DNA杂合体) 结合口袋, 阻碍RNase H对底物的识别, 从而抑制其降解作用。目前报道的HIV-1 RNase H活性位点抑制剂来源于天然产物和化学合成的小分子。来自天然产物的抑制剂主要为环庚三烯酚酮类[β-thujaplicinol (7) 和Manicol (8)]; 化学合成的小分子主要有: 3-羟基嘧啶-2, 4-二酮类(9~11)、2-羟基异喹啉-1, 3-二酮类(12)、二酮酸类(13~15)、N-羟基苯并嘧啶-2, 4-二酮类(16)、嘧啶酮类(17)、萘啶酮类(18)、嘧啶羧酸类(19)、吡啶酮酸类(20)、硝基呋喃羧酸类(21)、多酚类(22)、吡啶并吡嗪酮类(23) 等(图 5)[38-40]。可以看到, 该类抑制剂结构中一般含有由多个氧原子或氮原子构成的桥联配体, 以同时与两个二价金属离子形成配位作用, 这些金属离子螯合基团一般附着于一些稠杂环体系中, 且取代基中也含有较大的π体系, 导致分子整体刚性强、晶格能大, 具有水溶性低、细胞渗透性差的缺点。此外, 与HIV-1整合酶相比, RNase H表面相对开放, 酶与抑制剂的相互作用较少, 导致该类抑制剂还存在特异性差、细胞毒性大的缺点。这是目前尚无RNase H抑制剂进入临床应用的主要原因。因此开发具有成药性的HIV-1 RNase H抑制剂成为迫切需求[41-44]。
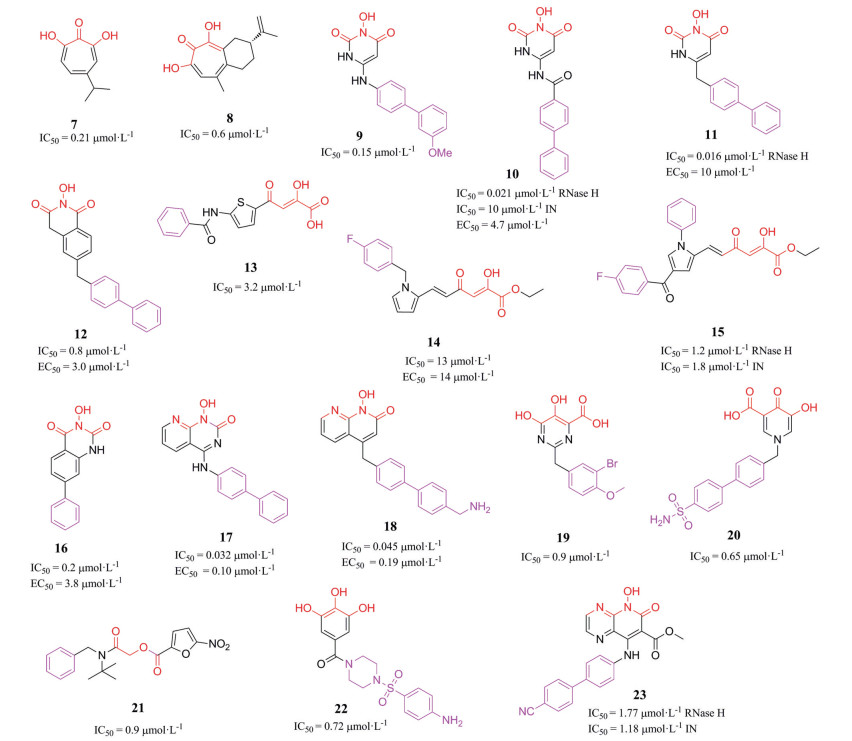
|
Figure 5 Representative RNase H active site inhibitors |
活性位点抑制剂的药效团元素包括金属离子螯合基团、“连接臂”与疏水性基团三部分。其中金属离子螯合基团(配位结合区) 通过与酶活性位点的二价金属离子配位结合发挥抗病毒活性。对于特定金属离子螯合基团, 活性位点环境对金属-配体相互作用有显著影响, 连接臂与疏水性基团的位置及性质也会显著影响活性与理化性质。疏水性基团(变构结合区) 位于蛋白溶剂界面, 附着力弱。因此, 可通过优化金属螯合基团并在取代基部分引入形成新“附着力”的基团, 增加焓效应对吉布斯自由值的贡献, 从而提高化合物对靶点的亲和性与抗耐药性[45]。
此外, 由于现有分子模拟对金属蛋白的研究存在着局限性, 传统力场的一般参数无法全面综合地考虑配位数、配体类型和配体的空间排列等金属配位的力场参数, 这给基于金属蛋白结构的合理药物设计带来了很大挑战, 此时基于优势结构与基于片段的药物设计策略就显得尤为重要。优势结构(privileged structures) 是指多种靶蛋白的配体分子中的共有结构或者可以衍生出对多种靶蛋白均具有高亲和力的分子骨架(图 6)。优势结构的优点主要表现在: ①具有良好的类药性, 因而基于优势结构获得的化合物有较高的成药概率; ②具有多个合适的结构修饰位点, 可通过修饰侧链以实现多种生物活性; ③具有化学合成的可及性, 可以快速制备大量衍生物, 构建聚焦库(foused library) 用于构效关系探究; ④与其他药效团相辅相成, 在药物设计中, 优势结构决定了配体对靶标的有效性, 其他药效团决定了配体对不同靶标的选择性, 提高了靶标的命中率。因此, 基于优势结构的药物设计已成为新药研发中富有成效的方法。

|
Figure 6 Inhibiting integrase/RNase H-like metalloenzymes with metal-binding small molecules (chelating triads are highlighted in red). Pharmacophore resemblance among inhibitors of RNase H-like enzymes[46] |
鉴于HIV-1 RNase H与HIV整合酶、流感病毒内切酶作用机制及抑制剂结构类型的类似性, 运用优势结构再定位策略, 将一些具有成药性的金属螯合基团“嫁接”到HIV-1 RNase H等新型镁离子依赖蛋白的抑制剂中, 有望大幅提高小分子与蛋白亲和力和小分子的成药性, 该思路已经得到初步验证[46]。
1.2 以锌离子依赖蛋白为靶标的抗病毒药物研究锌指蛋白参与各种DNA转录和修复过程, 其锌指结构域由包含半胱氨酸和组氨酸残基的氨基酸序列组成, 介导了大量DNA结合蛋白的序列识别。近几年, 锌指蛋白已成为被普遍关注的抗病毒新靶点。
HIV-1的核壳体蛋白7 (nucleocapsid protein 7, NCp7) 是由55个氨基酸残基组成的短肽, 并具有2个锌指结构域。NCp7在病毒逆转录与整合过程中都起到重要作用, 且具有高度的保守性。因此, 针对此靶点设计合成的药物不易因蛋白突变而产生耐药性[47]。其中锌结合硫代物后可以与亲电试剂反应, 导致Zn2+被逐出, 使病毒蛋白功能丧失(图 7)。近年来NCp7已经成为抗病毒药物研究中备受关注的新作用靶点之一, 其中基于锌离子“逐出”机制的抑制剂是重要的结构类型[48-50]。

|
Figure 7 Labile Zn-sites where Zn-bound cysteines react with electrophilic agents |
基于锌离子“逐出”机制的抑制剂多存在弱亲电基团, 这些弱亲电基团能与NCp7锌指结构域远端关键的半胱氨酸亲核连接形成共价络合物, 使锌离子被排出, 从而破坏了NCp7的正常三级结构。目前已经报道了不同种类的弱亲电基团, 例如: C-亚硝基类化合物中的氮原子、2, 2′-联硫类和二噻烷类化合物中的硫原子、2, 2′-二硒双苯酰胺中的硒原子, 苯甲酰胺硫酯类及其前药中的碳原子以及过渡金属配合物中的过渡金属原子(图 8) 等, 其作用机制主要包括(图 9): ①对锌指的亲电攻击; ②锌离子螯合; ③铂类等金属配合物与半胱氨酸残基的共价结合[47-50]。虽然两个Cys残基都能够参与共价结合, 但远端(C端) 亲核半胱氨酸的巯基易于接近, 是亲电攻击的主要靶点。亲电攻击是由分子内或分子间二硫键的形成或半胱氨酸和赖氨酸残基的酰化促进的。
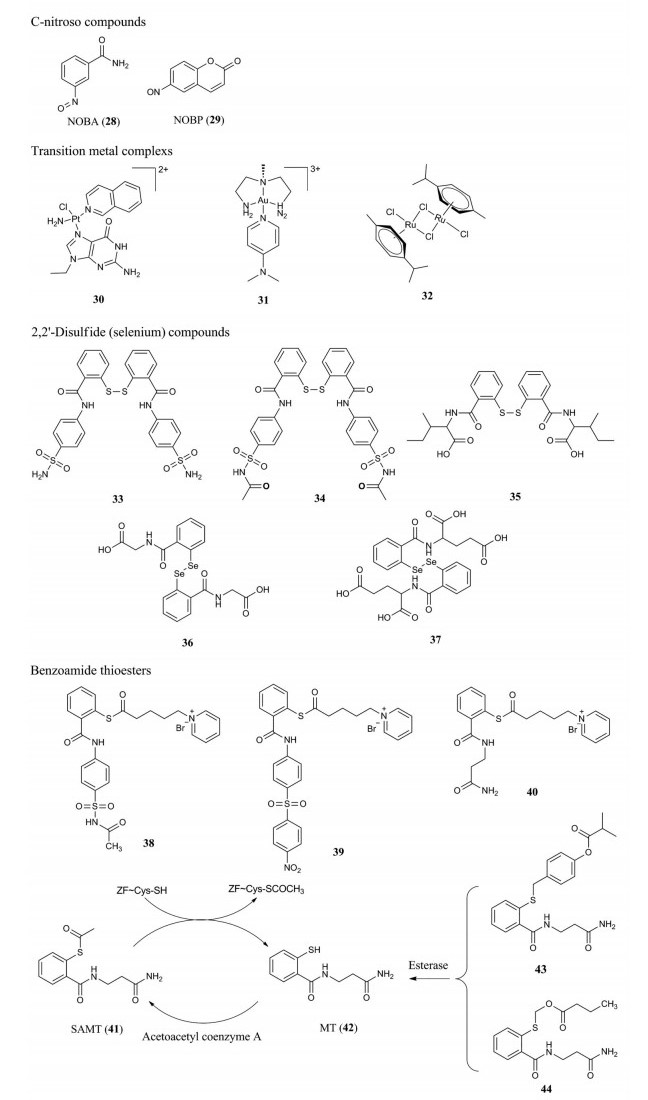
|
Figure 8 Representative chemical structures of nucleocapsid protein 7 (NCp7) covalent inhibitors |

|
Figure 9 Proposed mechanisms of NCp7 covalent inhibition. (a) C-nitroso compounds; (b) platinum-based complexes; and (c) pyridinioalkanoyl thioester (PATE) compounds[48] |
C-亚硝基类化合物是首类作用于NCp7锌指受体的化合物, 代表化合物为3-亚硝基苯甲酰胺(NOBA, 化合物28) 和6-亚硝基-1, 2-苯并吡喃酮(NOBP, 化合物29)。它们通过使NCp7锌指结构域中的半胱氨酸的巯基形成二硫键, 破坏其结构, 使NCp7失去与核酸结合的能力, 从而抑制其功能。NOBA在外周血单核细胞中抑制HIV-1的EC50值为1.56 μmol·L-1, 抑制NCp7的IC50值为50 μmol·L-1。虽然NOBA和NOBP能够抑制HIV-1的复制, 但是该类化合物对NCp7和宿主蛋白缺乏选择性, 因此细胞毒性较高, 使进一步研究受限[47-49]。
铂配合物类NCp7抑制剂30具有中等的体外抗HIV-1活性(EC50 = 41.9 μmol·L-1, CC50 > 200 μmol·L-1)。该化合物中的铂酸盐碱基以非共价键π-π堆积作用与NCp7的色氨酸进行分子识别, 然后铂离子与蛋白复合物结合, NCp7锌指中的锌离子被逐出。金配合物31与铂配合物的作用机制相似, 其抗HIV-1活性有了提高(EC50 = 19.1 μmol·L-1, CC50 > 100 μmol·L-1)。钌配合物对NCp7锌指结构域也有不同的亲和力, 其中32活性较好, 它能干扰NCp7的DNA结合并阻断蛋白功能, 且毒性较低[47-49]。
2, 2′-联硫(硒) 类化合物(33~37) 通过与NCp7锌指受体中半胱氨酸残基的硫原子作用形成二硫键, 逐出锌离子, 从而破坏NCp7活性结构, 削弱病毒感染力, 具有广谱抗病毒活性。但是因结构中的二硫(硒) 键不稳定, 体内半衰期很短, 需要进一步修饰[47-49]。
苯甲酰胺硫酯类结构的代表化合物为38~40, 38和39均通过与NCp7共价结合进而改变NCp7构象, 但是它们却作用于病毒复制的不同阶段, 化合物38能够将NCp7两个锌指结构中的Zn2+逐出, 化合物39能够使Gag前体发生交联并且抑制前体处理, 导致生成结构不完整的NCp7蛋白[49]。将38和39中的芳香磺酰基结构用脂肪胺基酰胺取代得到化合物40, 分子质量减小, 水溶性和抗病毒活性增加(EC50 = 0.94 μmol·L-1, CC50 = 101 μmol·L-1)。S-酰基-2-巯基苯甲酰胺硫酯(SAMT, 化合物41) 只与NCp7锌指结构域的C端结合, 选择性较高。SAMT通过亲核作用乙酰化Cys39, 随后通过分子内酰基转移到Lys33和Lys38, 最终使NCp7的锌指结构发生改变并逐出Zn2+。发挥作用之后, SAMT转化得到2-巯基苯甲酰胺硫酯(MT, 化合物42), MT可以通过细胞内的乙酰辅酶A乙酰化得到SAMT, 再次发挥作用。通过循环利用, 延长了抑制剂的半衰期, 减少了剂量。然而MT结构中存在巯基, 使其具有极性较大、跨膜性差、容易被氧化、毒性较大等缺陷, 通常使用前药策略来改善其缺陷。化合物43和44为MT的前药, 可通过酯酶水解消除得到MT, 其中44表现出更好的靶向NCp7活性。结果表明: MT在人外周血单核细胞(peripheral blood mononuclear cell, PBMC) 和单核巨噬细胞系中的抗HIV-1的EC50分别为1.44~10.7 μmol·L-1和2.5~19 μmol·L-1; 44在PBMC细胞和单核巨噬细胞系中抗HIV-1的EC50分别为0.6~20 μmol·L-1和0.87~12.3 μmol·L-1。相对于母药MT, 44抗HIV-1活性提高了2~3倍[51, 52]。
需要指出的是, 理想的锌离子逐出剂应只将病毒靶标蛋白中的锌离子逐出, 而不影响人体必需含锌蛋白中的Zn2+。老药新用无疑是克服这一问题的有效方法, 例如使用临床使用的双硫仑(45)、依布硒(46) 等Zn2+逐出剂。
2016年, Lee等[53]发现双硫仑可以从HCV NS5A (一种锌结合多功能非结构蛋白) 中将Zn2+逐出, 发挥抑制HCV RNA复制的作用, 同时验证了NS5A是抗HCV治疗的一个有吸引力的靶点。近期发现, 临床上应用的Zn2+逐出剂药物双硫仑和依布硒, 可以靶向高度保守的SARS-CoV-2 PLpro和nsp10中的Zn2+结合和/或催化半胱氨酸区域, 作用机制如图 10所示[54]。寨卡病毒NS5 RNA依赖RNA聚合酶(RNA-dependent RNA polymerase, RdRp) 及登革病毒NS5 RdRp中也有多个锌离子结合域, 可作为药物设计的作用位点[55]。

|
Figure 10 Schematic diagram to illustrate the mechanism of action by disulfiram (left) and ebselen (right) to release Zn2+ (a and b) or form a covalent adduct with a catalytic cysteine (c and d). In (a) and (c), half of disulfiram, diethyl-dithiol-carbamate, is covalently bonded to a Zn2+-bound/catalytic Cys [54] |
人APOBEC3酶家族是一类具有抗病毒活性的蛋白, 能够从病毒单链DNA的腺嘌呤或胞嘧啶上脱氨基使之分别变为黄嘌呤或尿嘧啶, 从而产生对病毒致死的G→A高突变, 从而发挥抗病毒活性。其中, APOBEC3G (A3G) 是重要的天然免疫因子, 其N端和C端结构域含有两个锌离子, 它可被HIV-1感染因子(Vif) 蛋白泛素化, 被蛋白酶体降解。研究发现, 锌螯合剂SN-1 (47, 图 11) 可与A3G的锌离子结合, 在Vif存在的情况下能够提高A3G的表达水平, 使其发挥抗病毒作用[56]。

|
Figure 11 Structures of free zinc ion chelating agents as antiviral compounds |
1, 4, 8, 11-四-吖环四癸烷类化合物(cyclams) 是有效的HIV抑制剂, 代表化合物为AMD3100 (48), 其作用机制可能是与Zn2+等含有d电子的金属离子形成强复合物, 这些复合物与HIV细胞入侵所需受体CXCR4上的特定序列作用。钒酰氧基联环胺配合物49和50抑制HIV-1 (ⅢB) 和HIV-2 (ROD) 的EC50值分别处于1~5、0.1~0.3 μmol·L-1水平。此外, bicyclams与齐多夫定(AZT) 的缀合物(51) 也显示出较强的抗HIV活性[57, 58]。
1.4 其他螺旋酶(helicases, 又译解旋酶或解螺旋酶) 是生物体维持生命所必需的一类酶, 可分为多种类型。细菌、病毒和人类细胞编码的螺旋酶被认为是研发新型抗病毒、抗生素和抗癌药物的靶点, 例如寨卡病毒的NS3解旋酶[59-61]。
新冠病毒的RNA依赖RNA聚合酶是病毒复制的核心组件, 包括nsp12、nsp7和nsp8等。新冠病毒RdRp的三维结构已通过冷冻电镜技术得以解析。近日, 美国研究者发现新冠病毒RNA聚合酶催化亚基存在铁硫簇(图 12), 对于病毒的复制至关重要, 利用氧化剂破坏铁硫簇能够有效抑制病毒复制[62]。
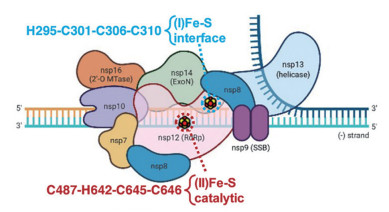
|
Figure 12 Fe-S cofactors in the SARS-CoV-2 RNA-dependent RNA polymerase [62] |
由于金属配合物中金属的类型多种多样, 金属氧化状态、配体的种类和数目以及配位几何结构也存在多样性, 导致金属药物种类繁多、性质各异, 其生物活性非常广泛, 受到药物研究者的普遍关注[63-68] (图 13)。

|
Figure 13 Representative metal complexes with antiviral activity |
例如, 铜配合物52是有效的HIV蛋白酶抑制剂[69]; 多核铂配合物(polynuclear platinum complex, PPC) TriplatinNC (53) 的作用机制是通过与细胞表面糖胺聚糖形成加合物, 进而阻断病毒的进入[70, 71]。金配合物Auranofin (54) 在低微摩尔浓度下抑制SARS-CoV-2在人细胞中的复制, 并显著减轻人细胞的炎症反应[72]; Auranofin及其类似物55~59是SARS-CoV-2 spike蛋白与血管紧张素转换酶2 (angiotensin-convertingenzyme 2, ACE2) 相互作用抑制剂, 也是SARS-CoV和SARS-CoV-2的木瓜样蛋白酶(papain-like protease, PLpro) 的高效抑制剂。重要的是, 对PLpro的强烈抑制作用与金配合物干扰酶中锌离子的能力有关[73]。水溶性的氧化钒(Ⅳ) 四芳基卟啉(60) 在溶液中稳定性好, 能抵抗谷胱甘肽还原作用, 在Hut/CCR5细胞中高效抑制HIV-1复制(5 μmol·L-1浓度下抑制率为97%)[74]。钴配合物CTC-96 (61) 是抑制单纯疱疹病毒1型(herpes simplex virus type 1, HSV-1) 等包被病毒的广谱抑制剂[75]。Co (Ⅲ) 己胺(62) 显著抑制幼仓鼠肾(BHK) 细胞中Sindbis病毒的复制, 且呈剂量和时间依赖性[76]。铑配合物63和64对SARS-CoV-2有直接的抗病毒活性, 均对Vero E6和Calu-3细胞毒性较低[77]。铼三羰基配合物65是新发现的SARS-CoV-2 3CLpro共价抑制剂[78]。
铁配合物中研究较多的是二茂铁, 它具有独特的夹心结构: 两个环戊二烯基负离子和一个正二价铁离子, 同时由d轨道重叠形成特殊的共价键。因此, 其环戊二烯是典型的非芳香环, 容易发生取代反应, 且化学性质比苯活泼, 并能进行一系列亲电取代反应从而得到二茂铁金属衍生物[79]。二茂铁三唑肽缀合物UM15 (66) 及环合化合物AAR029b (67) 是HIV-1侵入抑制剂, 二者能与HIV-1 gp120结合, 抑制Env蛋白与宿主细胞受体的相互作用, 抑制细胞感染, 并引起gp120脱落和病毒膜裂解[80, 81]。Achillion公司开发了一种含有二茂铁的HCV NS5A复制复合物抑制剂。二茂铁赋予该分子非常规的线性与非平面拓扑特征。特别是化合物68抑制HCV基因型1a和1b的活性达到皮摩尔级, 且肝细胞毒性低, 在大鼠体内具有良好的药动学特性[82]。
由于铋具有抗菌活性, 长期以来一直被用于治疗幽门螺旋杆菌导致的胃溃疡等各种疾病, 典型的药物有枸橼酸铋雷尼替丁(RBC, 69)[83]。2020年, 香港大学研究团队发现69可有效抑制SARS-CoV-2感染, 显著降低受SARS-CoV-2感染的动物细胞中的病毒载量, 且细胞毒性低, 选择指数达975 (瑞德西韦仅为129)。进一步研究发现69可通过铋离子不可逆地置换解旋酶中的锌离子, 破坏酶的功能, 从而有效抑制病毒复制[84]。
3 类金属有机化合物类金属(metalloid) 又称“准金属”, 是性质介于金属和非金属之间的元素。通常包括硼、硅、砷、锑、碲、钋, 而硒、铝在极少数的情况下也被认为属于类金属。目前具有抗病毒活性的类金属有机化合物中以含硒、硅、硼元素的化合物最为代表(图 14)。
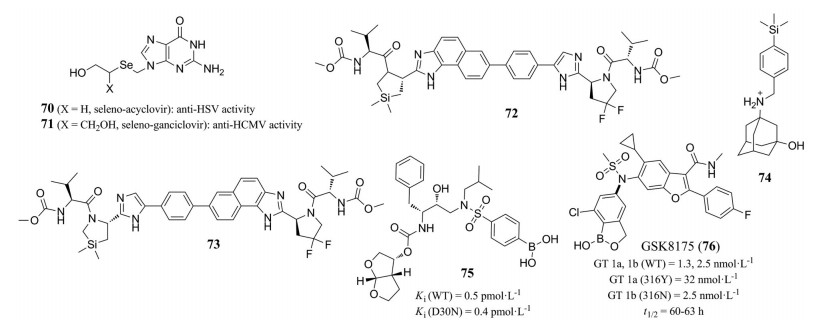
|
Figure 14 Representative metalloid compounds with antiviral activity |
从新药开发的角度, 硒具有抗氧化和高亲脂性等优点, 可增强跨细胞膜的渗透性, 从而提高口服生物利用度。硒是氧的经典等排体, 具有类似的生物活性[85]。
基于阿昔洛韦和更昔洛韦的结构, 研究者设计合成了硒代阿昔洛韦(70) 和硒代更昔洛韦(71)。70具有较强的抗HSV-1和HSV-2活性, 而71具有中等的抗HCMV活性[86]。有机硒化合物依布硒(ebselen, 46) 可与多种病毒蛋白的巯基反应, 形成硒硫键, 从而具有广谱抗病毒活性。Ebselen抑制HCV NS3解旋酶与核酸结合, 阻止病毒复制[87]。Ebselen也是HIV-1衣壳C末端结构域(carboxy-terminal domain, CTD) 二聚化抑制剂。电喷雾质谱分析显示, Ebselen与HIV-1衣壳蛋白CTD共价结合, 可能通过硒硫键与Cys198和Cys218结合[88]; Ebselen通过靶向LEDGF/p75破坏LEDGF/p75-HIV-1整合酶相互作用[89]; Ebselen减轻寨卡病毒感染小鼠睾丸, 阻止其性传播[90]。2020年以来, 多个课题组通过计算机辅助药物设计、虚拟筛选和高通量筛选等途径, 确定Ebselen及其类似物为SARS-CoV-2 Mpro和PLpro抑制剂[91-95]。
3.2 有机硅化合物硅可以引入分子中, 调节其类药性, 为药物化学家提供了一种非常规取代碳原子的策略[96]。代表性的抗病毒分子包括硅代吡咯烷类HCV NS5A抑制剂MK-8325 (72) 和73[97], 以及甲型流感病毒抑制剂74[98]。
3.3 有机硼化合物在过去的20年中, 已有5个含硼药物获得美国FDA批准, 即硼替佐米、他伐硼罗、依沙佐米、克立硼罗和法硼巴坦, 并且还有一些含硼化合物处于临床研究的不同阶段。含硼酸化合物通过可逆的共价键、多重氢键或金属离子配位键与生物靶标“精准”结合, 从而提高生物活性并克服耐药性, 在抗病毒药物设计中日益受到关注[99]。
例如, 含硼酸的HIV-1蛋白酶抑制剂75 (Ki = 0.5 ± 0.3 pmol·L-1) 对耐药性的D30N突变株保持高亲和力(Ki = 0.4 ± 0.3 pmol·L-1)。结构生物学证明硼酸参与3个氢键的形成, 尤其是, 硼酸的羟基与Asp30 (或Asn30) 羰基之间的氢键很短(rO··O = 2.2Å), 显示出较高的共价性[100]。GSK8175 (76) 是含有硼酸基团的HCV非核苷聚合酶(NS5B) 抑制剂, 对野生型以及临床耐药的HCV突变株具有较高的活性, 且半衰期长。结构生物学研究表明, 在GSK8175与NS5B的结合中, 硼酸贡献了由水分子介导的6个氢键[101]。
4 抗病毒无机纳米材料当前, 纳米技术广泛应用于药物分子设计、药物递送以及疾病诊断等领域。病毒与细胞表面的受体、蛋白存在明显的多价态(multivalency) 结合现象[102, 103], 因此, 多价态概念与纳米技术结合被广泛应用于抗病毒药物研究领域, 通过在其表面包复多个配体来增强纳米粒子的结合力, 以提高生物活性和克服药动学问题[104, 105]。
4.1 纳米银早期研究发现, 纳米银(AgNPs) 对包括HIV、HBV、HSV和呼吸道合胞病毒在内的几种病毒(respiratory syncytial virus, RSV) 均具有抑制活性[106]。近期研究发现, 银纳米粒协同递送奥司他韦可以通过ROS介导的信号通路来发挥抑制H1N1流感病毒复制的作用[107]; 谷胱甘肽修饰的Ag2S纳米簇通活性氧(reactive oxygen species, ROS) 阻断病毒RNA的合成和裂解抑制冠状病毒的增殖[108]。
4.2 纳米金纳米金也称为胶体金, 是病毒检测中的成熟技术, 新冠疫情期间, 多家公司运用胶体金法研发的SARS-CoV-2抗体检测试剂盒通过了国家药监局应急审批[109]。功能化纳米金(AuNPs) 与DNA或RNA等生物分子具有良好的生物相容性、多价性以及独特的结构特性, 是诊断和治疗HIV的理想载体[110]。研究发现, 金纳米粒偶联形式的肽三唑(AuNP-PT) 对HIV-1的抗病毒作用明显强于相应的原型肽三唑[111]。
金纳米载体有助于将抗HIV药物司他夫定递送到原代人巨噬细胞, 显著提高了巨噬细胞摄取司他夫定的效率, 诱导了有助于巨噬细胞抗病毒活性的特异性促炎激活模式, 为抗HIV治疗提供了新的方案[112]。最近的研究表明, AuNPs也对SARS-CoV-2具有显著的抑制作用[113]。
病原体常利用多价凝集素-多糖相互作用来结合和感染宿主细胞。糖缀合物可以阻断这种相互作用, 从而预防感染。最近, 研究发现甘露聚糖-金纳米粒子(GNP) 作为多功能探针用于研究多价凝集素-聚糖的结合。GNP-聚糖能有效或完全抑制树突状细胞特异性细胞间黏附分子3结合非整合素(endritic cell specific intercellular adhesion molecule-3 grabbing non integrin, DC-SIGN) 介导的埃博拉病毒糖蛋白驱动的细胞侵入环节(IC50值降至95 pmol·L-1), 但只能部分阻断DC-SIGNR介导的病毒感染。该研究提示, 糖缀合物同时阻断靶凝集素的所有结合位点是抗病毒药物设计的关键, 为阻断病毒感染和纳米粒子组装提供了新启发[114]。
过去几年, 小分子缀合型纳米金技术成功应用于HIV整合酶及侵入环节的抑制剂中(与金形成纳米颗粒的小分子片段77~79, 见图 15)[115-117]。最近研究者运用生物物理技术发现作为HIV-1 gp160多肽载体的金纳米颗粒是潜在的HIV肽基疫苗结构类型[118]。

|
Figure 15 Application of small molecules conjugated gold nanoparticles as anti-HIV agents |
病毒与细胞表面硫酸乙酰肝素蛋白聚糖(heparan sulfate proteoglycans, HSPG) 之间的多重相互作用是病毒入胞的关键。因此, 广谱物质可以通过模拟HSPG这一病毒连接配体(viral attachment ligands, VALs) 靶位来阻止病毒与细胞相互作用。2018年, 洛桑联邦理工学院的研究者设计了模仿HSPG的抗病毒金纳米颗粒, 病毒与VAL重复单元的结合最终产生使病毒不可逆变形的力(~190 pN)。病毒检测、电子显微镜图像和分子动力学模拟都证明了所提出的机制。这些纳米颗粒细胞毒性低, 且在体外纳摩尔浓度可抑制单纯疱疹病毒、人乳头瘤病毒、呼吸道合胞病毒、登革热和慢病毒[119]。
4.3 其他无机材料GSH修饰的硫化锌纳米颗粒(GSH-ZnS NPs) 对疱疹病毒科DNA病毒、伪狂犬病病毒、冠状病毒科正义RNA病毒、猪流行性腹泻病毒、弹状病毒(Rhabdoviridae) 负链RNA病毒、水泡性口炎病毒均有较强的抗病毒作用[120]。
碳纳米管、石墨烯、氧化石墨烯、量子点等碳基纳米材料及硒纳米材料在流感及新冠疫情防治方面也发挥了较大作用[121-124]。基于金属氧化物纳米颗粒如Cu2O、TiO2、SiO2、Fe3O4等逐渐用于新冠疫情的防控与病毒检测[125]。金属有机框架材料(metal-organic frameworks, MOFs) 具有较高孔隙率和较大比表面积与孔径, 已被广泛用于药物递送。与游离的AZT-TP相反, 负载AZT-TP的金属-有机框架纳米颗粒可以穿透HIV主要靶细胞并释放活性三磷酸化的AZT, 有效抑制HIV感染[126]。
Cs2K4Na [SiW9Nb3O40] 对甲型流感、乙型流感、HSV-1/2、HIV-1及HBV具有广谱抗病毒活性, 可能与其靶向细胞表面有关[127]。无机多面体金属碳硼烷是野生型和突变的HIV蛋白酶的竞争性抑制剂[128, 129]。
5 总结与展望新冠疫情暴发以来, 截至2022年1月27日, 全球新冠肺炎累计超过3.60亿人感染, 死亡人数超过562万人, 新冠病毒在全球肆虐的态势依然未见消退, 新的病毒突变株不断产生, 严重影响人类生存与社会发展。后疫情时代应如何战胜新冠病毒及长期困扰人类社会的艾滋病、乙肝等慢性病毒感染, 开发特效药物及广谱抗耐药性抗病毒药物是当前及未来长期的重大科研课题[130]。
金属酶代表了一大类尚未完全开发的抗病毒药物靶标。以金属酶为靶点的有效疗法的发现正是生物无机化学和药物化学的结合点。基于靶标结构的药物设计(structure-based drug design, SBDD) 是新药研发的最理性策略, 其通过分子模拟, 研究配体与其靶标的结合信息(结合构象、静电作用、氢键、范德华力或疏水作用等), 设计出针对该靶标的高亲和配体, 为新药的发现奠定基础。然而, 现有分子模拟对金属蛋白的研究存在着局限性, 传统的力场参数往往只涉及天然氨基酸和核酸, 而含金属配位的力场参数则要综合考虑配位数、配体类型和配体的空间排列等因素, 并且纯分子力学无法描述涉及“电子行为”的过程, 因而分子模拟无法准确描述金属蛋白体系中金属的配位状况, 这给基于金属蛋白结构的合理药物设计带来了很大挑战。此外, 部分金属酶如整合酶由于可溶性低, 且在测定条件下易多聚等问题, 其全酶空间结构尚未成功解析, 目前多数是采用同源酶来研究整合酶与配体的结合模式, 因此与真实的结合情况还存在较大的偏差, 为基于结构的药物设计增加了新的不确定性。
因此, 现有绝大多数以HIV-1整合酶和RNase H抑制剂为代表的金属酶抑制剂的发现都是随机的, 高通量筛选技术及“反复试错”的先导化合物优化模式造成了资源和时间的浪费, 并且这些新抑制剂的效力很可能不会超过现有的抑制剂, 因此亟须形成新的药物发现思路。特别是基于靶标与基于优势结构的药物设计策略具有很好的互补性, 在针对金属蛋白的药物设计中发挥重要作用。
金属酶变构抑制剂靶向非活性位点, 诱导催化构象发生改变, 进而无法与底物结合。该类变构抑制剂结构中一般不需要金属离子螯合结构, 故该类抑制剂的细胞透膜性较好。此外, 靶向金属离子催化位点之外的区域, 引入特异性基团形成氢键、离子键、共价结合等新作用力或设计变构调控剂, 是提高化合物与靶标亲和力的重要策略。其中, 靶向整合酶-LEDGF/p75相互作用抑制剂、HIV-1 RNase H变构调节剂及HIV-1 NCp7变构调节剂是当前的新方向。
过渡金属配合物凭借其广泛的氧化数、价态、几何构型及特殊的动力学和热力学性质, 为发现新结合模式的小分子抗病毒药物开辟了一条新的途径。在分子水平上理解蛋白质-抑制剂相互作用将为金属药物的设计提供重要思路。目前亟须解决的问题还包括: 通过优化结构提高对靶标的选择性和亲和力, 利用前药和靶向策略减少配合物的不良反应。
原创新药的源头是新靶标的发现, 通过金属组学(metallomics) 方法挖掘病毒潜在的蛋白靶标, 并进一步表征有机小分子或配位化合物与靶标的相互作用, 将为深入理解作用机制, 并合理设计原创药物奠定基础[131]。
无机纳米材料为发现高亲和力、广谱抗病毒药物及有效的递药系统开辟了新的途径, 代表了生物无机化学、材料科学及药剂学中一些最新的、目前还相对未被完全发掘的领域。
总之, 无机和生物无机化学在过去的半个世纪里为人类健康做出了重要贡献。如今, 含金属的诊断试剂和治疗药物构成了价值数十亿美元的产业。相信在关乎全球命运与国计民生的抗病毒药物研究领域, 生物无机化学也必将继续发挥着举足轻重的作用。
作者贡献: 徐淑静和张续杰负责全文的撰写; 丁当负责全文的格式修改; 刘新泳和展鹏对论文进行整体的指导和修改。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Sun YY, Kang DW, Gao SH, et al. Recent advances in the research of nucleoside antiviral agents[J]. Chin J Med Chem (中国药物化学杂志), 2021, 31: 55-75. |
| [2] |
Fu ZP, Kang DW, Liu XY, et al. Advances of research on target-based anti-AIDS drugs[J]. Prog Pharm Sci (药学进展), 2020, 44: 681-697. |
| [3] |
Qi WT, Ju H, Hou LX, et al. Basic pharmaceutical knowledge in SARS-CoV-2 detection and drug discovery[J]. Univ Chem (大学化学), 2020, 35: 21-28. |
| [4] |
Jiang XY, Li J, Wei XY, et al. Advances in Chikungunya virus inhibitors[J]. Acta Pharm Sin (药学学报), 2020, 55: 754-762. |
| [5] |
Tao YC, Hao X, Liu XY, et al. Advances in the discovery of anti-enterovirus-71 agents[J]. Acta Pharm Sin (药学学报), 2020, 55: 744-753. |
| [6] |
Fu ZP, Zhou ZX, Liu XY, et al. Advances in the study of antiviral natural products[J]. Acta Pharm Sin (药学学报), 2020, 55: 703-719. |
| [7] |
Zhang T, Zhou ZX, Zhan P, et al. New progress in medicinal chemistry of anti-poxvirus drugs research[J]. Acta Pharm Sin (药学学报), 2020, 55: 734-743. |
| [8] |
Liang RP, Zhao T, Zhan P, et al. Research progress on the West Nile virus inhibitors[J]. Acta Pharm Sin (药学学报), 2020, 55: 763-772. |
| [9] |
Sun YY, Zuo XF, Zhan P, et al. Recent advances in the discovery and development of adenovirus inhibitors[J]. Acta Pharm Sin (药学学报), 2020, 55: 720-733. |
| [10] |
Ren YJ, Zhang S, Wei FJ, et al. Recent advances in the discovery and development of Ebola virus inhibitors[J]. Acta Pharm Sin (药学学报), 2020, 55: 694-702. |
| [11] |
Dong Y, Zhan P, Liu XY. New progress in anti-norovirus drugs and vaccines[J]. Acta Pharm Sin (药学学报), 2020, 55: 640-651. |
| [12] |
Li J, Liu XY, Zhan P. Advances in human cytomegalovirus inhibitors[J]. Acta Pharm Sin (药学学报), 2020, 55: 585-596. |
| [13] |
Ma Y, Wei FJ, Yu J, et al. Advances in research on HBV inhibitors based in new targets (1): capsid protein inhibitors[J]. Acta Pharm Sin (药学学报), 2020, 55: 554-565. |
| [14] |
Huang TG, Sun L, Zhan P, et al. Recent advances in the research of broad-spectrum antiviral agents[J]. Acta Pharm Sin (药学学报), 2020, 55: 679-693. |
| [15] |
Wei WX, Jing LL, Liu XY, et al. New progress in medicinal chemistry of anti-herpesviruses drug research[J]. Acta Pharm Sin (药学学报), 2020, 55: 575-584. |
| [16] |
Wei FJ, Ma Y, Yu J, et al. Advances in research on HBV inhibitors based on new targets (2): RNase H and others[J]. Acta Pharm Sin (药学学报), 2020, 55: 566-574. |
| [17] |
Li Z, Jia RF, Zhan P, et al. Progress on the discovery and development of anti-zika virus agents[J]. Acta Pharm Sin (药学学报), 2020, 55: 627-639. |
| [18] |
Song S, Gao P, Zhan P, et al. Recent progress in inhibitors against hepatitis C virus[J]. Acta Pharm Sin (药学学报), 2020, 55: 652-668. |
| [19] |
Hou LX, Ju H, Zhan P, et al. Recent advances in the discovery of dengue virus inhibitors[J]. Acta Pharm Sin (药学学报), 2020, 55: 669-678. |
| [20] |
Xu SJ, Liu XY, Zhan P. New progress in research on respiratory syncytial virus inhibitors[J]. Acta Pharm Sin (药学学报), 2020, 55: 597-610. |
| [21] |
Xiu SY, Zhang J, Ju H, et al. Progress on IFV drug targets and small molecule inhibitors[J]. Acta Pharm Sin (药学学报), 2020, 55: 611-626. |
| [22] |
Li J, Jiang XY, Xu SJ, et al. Medicinal chemistry strategies in seeking coronavirus inhibitors[J]. Acta Pharm Sin (药学学报), 2020, 55: 537-553. |
| [23] |
Huo ZP, Zuo XF, Kang DW, et al. Progress on AIDS drug targets and small molecule inhibitors[J]. Acta Pharm Sin (药学学报), 2018, 53: 356-374. |
| [24] |
Ma Y, Frutos-Beltrán E, Kang D, et al. Medicinal chemistry strategies for discovering antivirals effective against drug-resistant viruses[J]. Chem Soc Rev, 2021, 50: 4514-4540. DOI:10.1039/D0CS01084G |
| [25] |
Wang K. Future bioinorganic chemistry—editor's viewpoints[J]. Prog Chem (化学进展), 2013, 25: 431-434. |
| [26] |
Mao WZ, An Y, Ji LN. Consideration on the development strategy of bioinorganic chemistry in China[J]. Prog Chem (化学进展), 2004, 16: 660-666. |
| [27] |
Cohen SM. New approaches for medicinal applications of bioinorganic chemistry[J]. Curr Opin Chem Biol, 2007, 11: 115-120. DOI:10.1016/j.cbpa.2007.01.012 |
| [28] |
Giannakopoulou E, Pardali V, Zoidis G. Metal-chelating agents against viruses and parasites[J]. Future Med Chem, 2018, 10: 1283-1285. DOI:10.4155/fmc-2018-0100 |
| [29] |
Rogolino D, Carcelli M, Sechi M, et al. Viral enzymes containing magnesium: metal binding as a successful strategy in drug design[J]. Coordin Chem Rev, 2012, 256: 3063-3086. DOI:10.1016/j.ccr.2012.07.006 |
| [30] |
Maertens GN, Engelman AN, Cherepanov P. Structure and function of retroviral integrase[J]. Nat Rev Microbiol, 2022, 20: 20-34. DOI:10.1038/s41579-021-00586-9 |
| [31] |
Ju H, Zhang J, Huang B, et al. Inhibitors of influenza virus polymerase acidic (PA) endonuclease: contemporary developments and perspectives[J]. J Med Chem, 2017, 60: 3533-3551. DOI:10.1021/acs.jmedchem.6b01227 |
| [32] |
Kharkwal H, Kumar BK, Murugesan S, et al. Search for new therapeutics against HIV-1 via dual inhibition of RNase H and integrase: current status and future challenges[J]. Future Med Chem, 2021, 13: 269-286. DOI:10.4155/fmc-2020-0257 |
| [33] |
Tavis JE, Zoidis G, Meyers MJ, et al. Approaches to inhibiting the hepatitis B virus ribonuclease H[J]. ACS Infect Dis, 2019, 5: 655-658. DOI:10.1021/acsinfecdis.8b00045 |
| [34] |
Xu HT, Colby-Germinario SP, Hassounah S, et al. Identification of a pyridoxine-derived small-molecule inhibitor targeting dengue virus RNA-dependent RNA polymerase[J]. Antimicrob Agents Chemother, 2015, 60: 600-608. |
| [35] |
Masaoka T, Zhao H, Hirsch DR, et al. Characterization of the C-terminal nuclease domain of herpes simplex virus pUL15 as a target of nucleotidyltransferase inhibitors[J]. Biochemistry, 2016, 55: 809-819. DOI:10.1021/acs.biochem.5b01254 |
| [36] |
Bongarzone S, Nadal M, Kaczmarska Z, et al. Structure-driven discovery of α, γ-diketoacid inhibitors against UL89 herpesvirus terminase[J]. ACS Omega, 2018, 3: 8497-8505. DOI:10.1021/acsomega.8b01472 |
| [37] |
Wang X, Gao P, Menendez-Arias L, et al. Update on recent developments in small molecular HIV-1 RNase H inhibitors (2013-2016): opportunities and challenges[J]. Curr Med Chem, 2018, 25: 1682-1702. DOI:10.2174/0929867324666170113110839 |
| [38] |
Cao L, Song W, De Clercq E, et al. Recent progress in the research of small molecule HIV-1 RNase H inhibitors[J]. Curr Med Chem, 2014, 21: 1956-1967. DOI:10.2174/0929867321666140120121158 |
| [39] |
Yu F, Liu X, Zhan P, et al. Recent advances in the research of HIV-1 RNase H inhibitors[J]. Mini Rev Med Chem, 2008, 8: 1243-1251. DOI:10.2174/138955708786141052 |
| [40] |
Gao P, Cheng X, Sun L, et al. Design, synthesis and biological evaluation of 3-hydroxyquinazoline-2, 4(1H, 3H)-diones as dual inhibitors of HIV-1 reverse transcriptase-associated RNase H and integrase[J]. Bioorg Med Chem, 2019, 27: 3836-3845. DOI:10.1016/j.bmc.2019.07.011 |
| [41] |
Gao P, Wang X, Sun L, et al. Design, synthesis, and biologic evaluation of novel galloyl derivatives as HIV-1 RNase H inhibitors[J]. Chem Biol Drug Des, 2019, 93: 582-589. DOI:10.1111/cbdd.13455 |
| [42] |
Sun L, Gao P, Dong G, et al. 5-Hydroxypyrido[2, 3-b]pyrazin-6(5H)-one derivatives as novel dual inhibitors of HIV-1 reverse transcriptase-associated ribonuclease H and integrase[J]. Eur J Med Chem, 2018, 155: 714-724. DOI:10.1016/j.ejmech.2018.06.036 |
| [43] |
Gao P, Zhang L, Sun L, et al. 1-Hydroxypyrido[2, 3-d]pyrimidin-2(1H)-ones as novel selective HIV integrase inhibitors obtained via privileged substructure-based compound libraries[J]. Bioorg Med Chem, 2017, 25: 5779-5789. DOI:10.1016/j.bmc.2017.09.006 |
| [44] |
Martin DP, Blachly PG, McCammon JA, et al. Exploring the influence of the protein environment on metal-binding pharmacophores[J]. J Med Chem, 2014, 57: 7126-7135. DOI:10.1021/jm500984b |
| [45] |
Cohen SM. A bioinorganic approach to fragment-based drug discovery targeting metalloenzymes[J]. Acc Chem Res, 2017, 50: 2007-2016. DOI:10.1021/acs.accounts.7b00242 |
| [46] |
Wang L, Edwards TC, Sahani RL, et al. Metal binding 6-arylthio-3-hydroxypyrimidine-2, 4-diones inhibited human cytomegalovirus by targeting the pUL89 endonuclease of the terminase complex[J]. Eur J Med Chem, 2021, 222: 113640. DOI:10.1016/j.ejmech.2021.113640 |
| [47] |
Sancineto L, Iraci N, Tabarrini O, et al. NCp7: targeting a multitasking protein for next-generation anti-HIV drug development part 1: covalent inhibitors[J]. Drug Discov Today, 2018, 23: 260-271. DOI:10.1016/j.drudis.2017.10.017 |
| [48] |
Iraci N, Tabarrini O, Santi C, et al. NCp7: targeting a multitask protein for next-generation anti-HIV drug development part 2. Noncovalent inhibitors and nucleic acid binders[J]. Drug Discov Today, 2018, 23: 687-695. DOI:10.1016/j.drudis.2018.01.022 |
| [49] |
Jia HY, Yu J, Liu XH, et al. Recent progress of inhibitors targeting HIV-1 NCp7[J]. Acta Pharm Sin (药学学报), 2017, 52: 1652-1659. |
| [50] |
Anzellotti AI, Liu Q, Bloemink MJ, et al. Targeting retroviral Zn finger-DNA interactions: a small-molecule approach using the electrophilic nature of trans-platinum-nucleobase compounds[J]. Chem Biol, 2006, 13: 539-548. DOI:10.1016/j.chembiol.2006.04.004 |
| [51] |
Spell SR, Mangrum JB, Peterson EJ, et al. Au(iii) compounds as HIV nucleocapsid protein (NCp7)-nucleic acid antagonists[J]. Chem Commun (Camb), 2016, 53: 91-94. |
| [52] |
Bernardes VH, Qu Y, Du Z, et al. Interaction of the HIV NCp7 protein with platinum(Ⅱ) and gold(Ⅲ) complexes containing tridentate ligands[J]. Inorg Chem, 2016, 55: 11396-11407. DOI:10.1021/acs.inorgchem.6b01925 |
| [53] |
Lee YM, Duh Y, Wang ST, et al. Using an old drug to target a new drug site: application of disulfiram to target the Zn-site in HCV NS5A protein[J]. J Am Chem Soc, 2016, 138: 3856-3862. DOI:10.1021/jacs.6b00299 |
| [54] |
Sargsyan K, Lin CC, Chen T, et al. Multi-targeting of functional cysteines in multiple conserved SARS-CoV-2 domains by clinically safe Zn-ejectors[J]. Chem Sci, 2020, 11: 9904-9909. DOI:10.1039/D0SC02646H |
| [55] |
Nascimento IJDS, Santos-Júnior PFDS, Aquino TM, et al. Insights on Dengue and Zika NS5 RNA-dependent RNA polymerase (RdRp) inhibitors[J]. Eur J Med Chem, 2021, 224: 113698. DOI:10.1016/j.ejmech.2021.113698 |
| [56] |
Radwan MO, Sonoda S, Ejima T, et al. Zinc-mediated binding of a low-molecular-weight stabilizer of the host anti-viral factor apolipoprotein B mRNA-editing enzyme, catalytic polypeptide-like 3G[J]. Bioorg Med Chem, 2016, 24: 4398-4405. DOI:10.1016/j.bmc.2016.07.030 |
| [57] |
De Clercq E. Fifty years in search of selective antiviral drugs[J]. J Med Chem, 2019, 62: 7322-7339. DOI:10.1021/acs.jmedchem.9b00175 |
| [58] |
Ross A, Soares DC, Covelli D, et al. Oxovanadium(Ⅳ) cyclam and bicyclam complexes: potential CXCR4 receptor antagonists[J]. Inorg Chem, 2010, 49: 1122-1132. DOI:10.1021/ic9020614 |
| [59] |
Cao X, Li Y, Jin X, et al. Molecular mechanism of divalent-metal-induced activation of NS3 helicase and insights into Zika virus inhibitor design[J]. Nucleic Acids Res, 2016, 44: 10505-10514. |
| [60] |
Shadrick WR, Ndjomou J, Kolli R, et al. Discovering new medicines targeting helicases: challenges and recent progress[J]. J Biomol Screen, 2013, 18: 761-781. DOI:10.1177/1087057113482586 |
| [61] |
Meagher JL, Takata M, Gonçalves-Carneiro D, et al. Structure of the zinc-finger antiviral protein in complex with RNA reveals a mechanism for selective targeting of CG-rich viral sequences[J]. Proc Natl Acad Sci U S A, 2019, 116: 24303-24309. DOI:10.1073/pnas.1913232116 |
| [62] |
Maio N, Lafont BAP, Sil D, et al. Fe-S cofactors in the SARS-CoV-2 RNA-dependent RNA polymerase are potential antiviral targets[J]. Science, 2021, 373: 236-241. DOI:10.1126/science.abi5224 |
| [63] |
de Paiva REF, Marçal Neto A, Santos IA, et al. What is holding back the development of antiviral metallodrugs? A literature overview and implications for SARS-CoV-2 therapeutics and future viral outbreaks[J]. Dalton Trans, 2020, 49: 16004-16033. DOI:10.1039/D0DT02478C |
| [64] |
Sun RW, Ma DL, Wong EL, et al. Some uses of transition metal complexes as anti-cancer and anti-HIV agents[J]. Dalton Trans, 2007(43): 4884-4892. DOI:10.1039/b705079h |
| [65] |
Marzo T, Messori L. A role for metal-based drugs in fighting COVID-19 infection? The case of auranofin[J]. ACS Med Chem Lett, 2020, 11: 1067-1068. DOI:10.1021/acsmedchemlett.0c00190 |
| [66] |
Karges J, Cohen SM. Metal complexes as antiviral agents for SARS-CoV-2[J]. Chembiochem, 2021, 22: 2600-2607. DOI:10.1002/cbic.202100186 |
| [67] |
Maldonado N, Amo-Ochoa P. The role of coordination compounds in virus research. Different approaches and trends[J]. Dalton Trans, 2021, 50: 2310-2323. DOI:10.1039/D0DT04066E |
| [68] |
Cirri D, Pratesi A, Marzo T, et al. Metallo therapeutics for COVID-19. Exploiting metal-based compounds for the discovery of new antiviral drugs[J]. Expert Opin Drug Discov, 2021, 16: 39-46. DOI:10.1080/17460441.2020.1819236 |
| [69] |
Lebon F, Boggetto N, Ledecq M, et al. Metal-organic compounds: a new approach for drug discovery. N1-(4-methyl-2-pyridyl)-2, 3, 6-trimethoxybenzamide copper (Ⅱ) complex as an inhibitor of human immunodeficiency virus 1 protease[J]. Biochem Pharmacol, 2002, 63: 1863-1873. DOI:10.1016/S0006-2952(02)00918-8 |
| [70] |
Bailly B, Gorle AK, Dirr L, et al. Platinum complexes act as shielding agents against virus infection[J]. Chem Commun (Camb), 2021, 57: 4666-4669. DOI:10.1039/D1CC01593A |
| [71] |
Shoup M, Ourahmane A, Ginsburg EP, et al. Substitution-inert polynuclear platinum compounds inhibit human cytomegalovirus attachment and entry[J]. Antiviral Res, 2020, 184: 104957. DOI:10.1016/j.antiviral.2020.104957 |
| [72] |
Rothan HA, Stone S, Natekar J, et al. The FDA-approved gold drug auranofin inhibits novel coronavirus (SARS-COV-2) replication and attenuates inflammation in human cells[J]. Virology, 2020, 547: 7-11. DOI:10.1016/j.virol.2020.05.002 |
| [73] |
Gil-Moles M, Basu U, Büssing R, et al. Gold metallodrugs to target coronavirus proteins: inhibitory effects on the spike-ACE2 interaction and on PLpro protease activity by auranofin and gold organometallics[J]. Chemistry, 2020, 26: 15140-15144. DOI:10.1002/chem.202004112 |
| [74] |
Wong SY, Wai-Yin Sun R, Chung NP, et al. Physiologically stable vanadium(Ⅳ) porphyrins as a new class of anti-HIV agents[J]. Chem Commun (Camb), 2005, 28: 3544-3546. |
| [75] |
Schwartz JA, Lium EK, Silverstein SJ. Herpes simplex virus type 1 entry is inhibited by the cobalt chelate complex CTC-96[J]. J Virol, 2001, 75: 4117-4128. DOI:10.1128/JVI.75.9.4117-4128.2001 |
| [76] |
Delehanty JB, Bongard JE, Thach DC, et al. Antiviral properties of cobalt(Ⅲ)-complexes[J]. Bioorg Med Chem, 2008, 16: 830-837. DOI:10.1016/j.bmc.2007.10.022 |
| [77] |
Chuong C, DuChane CM, Webb EM, et al. Noble metal organometallic complexes display antiviral activity against SARS-CoV-2[J]. Viruses, 2021, 13: 980. DOI:10.3390/v13060980 |
| [78] |
Karges J, Kalaj M, Gembicky M, et al. ReI tricarbonyl complexes as coordinate covalent inhibitors for the SARS-CoV-2 main cysteine protease[J]. Angew Chem Int Ed Engl, 2021, 60: 10716-10723. DOI:10.1002/anie.202016768 |
| [79] |
Santos MM, Bastos P, Catela I, et al. Recent advances of metallocenes for medicinal chemistry[J]. Mini Rev Med Chem, 2017, 17: 771-784. DOI:10.2174/1389557516666161031141620 |
| [80] |
Aneja R, Rashad AA, Li H, et al. Peptide triazole inactivators of HIV-1 utilize a conserved two-cavity binding site at the junction of the inner and outer domains of Env gp120[J]. J Med Chem, 2015, 58: 3843-3858. DOI:10.1021/acs.jmedchem.5b00073 |
| [81] |
Rashad AA, Kalyana Sundaram RV, Aneja R, et al. Macrocyclic envelope glycoprotein antagonists that irreversibly inactivate HIV-1 before host cell encounter[J]. J Med Chem, 2015, 58: 7603-7608. DOI:10.1021/acs.jmedchem.5b00935 |
| [82] |
Gadhachanda VR, Eastman KJ, Wang Q, et al. Ferrocene-based inhibitors of hepatitis C virus replication that target NS5A with low picomolar in vitro antiviral activity[J]. Bioorg Med Chem Lett, 2018, 28: 3463-3471. DOI:10.1016/j.bmcl.2018.09.023 |
| [83] |
Li H, Wang R, Sun H. Systems approaches for unveiling the mechanism of action of bismuth drugs: new medicinal applications beyond Helicobacter Pylori infection[J]. Acc Chem Res, 2019, 52: 216-227. DOI:10.1021/acs.accounts.8b00439 |
| [84] |
Yuan S, Wang R, Chan JF, et al. Metallodrug ranitidine bismuth citrate suppresses SARS-CoV-2 replication and relieves virus-associated pneumonia in Syrian hamsters[J]. Nat Microbiol, 2020, 5: 1439-1448. DOI:10.1038/s41564-020-00802-x |
| [85] |
Ruberte AC, Sanmartin C, Aydillo C, et al. Development and therapeutic potential of selenazo compounds[J]. J Med Chem, 2020, 63: 1473-1489. DOI:10.1021/acs.jmedchem.9b01152 |
| [86] |
Sahu PK, Umme T, Yu J, et al. Selenoacyclovir and selenoganciclovir: discovery of a new template for antiviral agents[J]. J Med Chem, 2015, 58: 8734-8738. DOI:10.1021/acs.jmedchem.5b00804 |
| [87] |
Mukherjee S, Weiner WS, Schroeder CE, et al. Ebselen inhibits hepatitis C virus NS3 helicase binding to nucleic acid and prevents viral replication[J]. ACS Chem Biol, 2014, 9: 2393-2403. DOI:10.1021/cb500512z |
| [88] |
Thenin-Houssier S, de Vera IM, Pedro-Rosa L, et al. Ebselen, a small-molecule capsid inhibitor of HIV-1 replication[J]. Antimicrob Agents Chemother, 2016, 60: 2195-2208. DOI:10.1128/AAC.02574-15 |
| [89] |
Zhang DW, Yan HL, Xu XS, et al. The selenium-containing drug ebselen potently disrupts LEDGF/p75-HIV-1 integrase interaction by targeting LEDGF/p75[J]. J Enzyme Inhib Med Chem, 2020, 35: 906-912. DOI:10.1080/14756366.2020.1743282 |
| [90] |
Simanjuntak Y, Liang JJ, Chen SY, et al. Ebselen alleviates testicular pathology in mice with Zika virus infection and prevents its sexual transmission[J]. PLoS Pathog, 2018, 14: e1006854. DOI:10.1371/journal.ppat.1006854 |
| [91] |
Jin Z, Du X, Xu Y, et al. Structure of Mpro from SARS-CoV-2 and discovery of its inhibitors[J]. Nature, 2020, 582: 289-293. DOI:10.1038/s41586-020-2223-y |
| [92] |
Haritha CV, Sharun K, Jose B. A new candidate therapeutic against SARS-CoV-2[J]. Int J Surg, 2020, 84: 53-56. DOI:10.1016/j.ijsu.2020.10.018 |
| [93] |
Ma C, Hu Y, Townsend JA, et al. Ebselen, disulfiram, carmofur, PX-12, tideglusib, and shikonin are nonspecific promiscuous SARS-CoV-2 main protease inhibitors[J]. ACS Pharmacol Transl Sci, 2020, 3: 1265-1277. DOI:10.1021/acsptsci.0c00130 |
| [94] |
Menéndez CA, Byléhn F, Perez-Lemus GR, et al. Molecular characterization of ebselen binding activity to SARS-CoV-2 main protease[J]. Sci Adv, 2020, 6: eabd0345. DOI:10.1126/sciadv.abd0345 |
| [95] |
Sies H, Parnham MJ. Potential therapeutic use of ebselen for COVID-19 and other respiratory viral infections[J]. Free Radic Biol Med, 2020, 156: 107-112. DOI:10.1016/j.freeradbiomed.2020.06.032 |
| [96] |
Ramesh R, Reddy DS. Quest for novel chemical entities through incorporation of silicon in drug scaffolds[J]. J Med Chem, 2018, 61: 3779-3798. DOI:10.1021/acs.jmedchem.7b00718 |
| [97] |
Nair AG, Zeng Q, Selyutin O, et al. MK-8325: a silyl proline-containing NS5A inhibitor with pan-genotype activity for treatment of HCV[J]. Bioorg Med Chem Lett, 2018, 28: 1954-1957. DOI:10.1016/j.bmcl.2018.03.049 |
| [98] |
Hu Y, Wang Y, Li F, et al. Design and expeditious synthesis of organosilanes as potent antivirals targeting multidrug-resistant influenza A viruses[J]. Eur J Med Chem, 2017, 135: 70-76. DOI:10.1016/j.ejmech.2017.04.038 |
| [99] |
Song S, Gao P, Sun L, et al. Recent developments in the medicinal chemistry of single boron atom-containing compounds[J]. Acta Pharm Sin B, 2021, 11: 3035-3059. DOI:10.1016/j.apsb.2021.01.010 |
| [100] |
Windsor IW, Palte MJ, Lukesh JC, et al. Sub-picomolar inhibition of HIV-1 protease with a boronic acid[J]. J Am Chem Soc, 2018, 140: 14015-14018. DOI:10.1021/jacs.8b07366 |
| [101] |
Chong PY, Shotwell JB, Miller J, et al. Design of N-benzoxaborole benzofuran GSK8175-optimization of human pharmacokinetics inspired by metabolites of a failed clinical HCV inhibitor[J]. J Med Chem, 2019, 62: 3254-3267. DOI:10.1021/acs.jmedchem.8b01719 |
| [102] |
Zhan P, Li X, Kang DW, et al. Novel strategies in rational design of anti-HIV agents: multitarget and multivalency ligands[J]. Chin J Med Chem (中国药物化学), 2013, 5: 406-416. |
| [103] |
Song Y, Zhan P, Li X, et al. Multivalent agents: a novel concept and preliminary practice in anti-HIV drug discovery[J]. Curr Med Chem, 2013, 20: 815-832. |
| [104] |
Chauhan PS, Yadav D, Dubey A, et al. Nano-biomaterials as sensing and therapeutic tool to mitigate viral pathogenesis with special reference to COVID-19[J]. Curr Pharm Des, 2021, 27: 3424-3434. DOI:10.2174/1381612827666210203142934 |
| [105] |
Imani SM, Ladouceur L, Marshall T, et al. Antimicrobial nanomaterials and coatings: current mechanisms and future perspectives to control the spread of viruses including SARS-CoV-2[J]. ACS Nano, 2020, 14: 12341-12369. DOI:10.1021/acsnano.0c05937 |
| [106] |
Ciriminna R, Albo Y, Pagliaro M. New antivirals and antibacterials based on silver nanoparticles[J]. ChemMedChem, 2020, 15: 1619-1623. DOI:10.1002/cmdc.202000390 |
| [107] |
Li Y, Lin Z, Zhao M, et al. Silver nanoparticle based codelivery of oseltamivir to inhibit the activity of the H1N1 influenza virus through ROS-mediated signaling pathways[J]. ACS Appl Mater Interfaces, 2016, 8: 24385-24393. DOI:10.1021/acsami.6b06613 |
| [108] |
Du T, Liang J, Dong N, et al. Glutathione-capped Ag2S nanoclusters inhibit coronavirus proliferation through blockage of viral RNA synthesis and budding[J]. ACS Appl Mater Interfaces, 2018, 10: 4369-4378. DOI:10.1021/acsami.7b13811 |
| [109] |
Huang C, Wen T, Shi FJ, et al. Rapid detection of IgM antibodies against the SARS-CoV-2 virus via colloidal gold nanoparticle-based lateral-flow assay[J]. ACS Omega, 2020, 5: 12550-12556. DOI:10.1021/acsomega.0c01554 |
| [110] |
Gulati S, Singh P, Diwan A, et al. Functionalized gold nanoparticles: promising and efficient diagnostic and therapeutic tools for HIV/AIDS[J]. RSC Med Chem, 2020, 11: 1252-1266. DOI:10.1039/D0MD00298D |
| [111] |
Rosemary Bastian A, Nangarlia A, Bailey LD, et al. Mechanism of multivalent nanoparticle encounter with HIV-1 for potency enhancement of peptide triazole virus inactivation[J]. J Biol Chem, 2015, 290: 529-543. DOI:10.1074/jbc.M114.608315 |
| [112] |
Zazo H, Colino CI, Warzecha KT, et al. Gold nanocarriers for macrophage-targeted therapy of human immunodeficiency virus[J]. Macromol Biosci, 2017, 17. DOI:10.1002/mabi.201600359 |
| [113] |
Mehranfar A, Izadyar M. Theoretical design of functionalized gold nanoparticles as antiviral agents against severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2)[J]. J Phys Chem Lett, 2020, 11: 10284-10289. DOI:10.1021/acs.jpclett.0c02677 |
| [114] |
Budhadev D, Poole E, Nehlmeier I, et al. Glycan-gold nanoparticles as multifunctional probes for multivalent lectin-carbohydrate binding: implications for blocking virus infection and nanoparticle assembly[J]. J Am Chem Soc, 2020, 142: 18022-18034. DOI:10.1021/jacs.0c06793 |
| [115] |
Garrido C, Simpson CA, Dahl NP, et al. Gold nanoparticles to improve HIV drug delivery[J]. Future Med Chem, 2015, 7: 1097-1107. DOI:10.4155/fmc.15.57 |
| [116] |
Bowman MC, Ballard TE, Ackerson CJ, et al. Inhibition of HIV fusion with multivalent gold nanoparticles[J]. J Am Chem Soc, 2008, 130: 6896-6897. DOI:10.1021/ja710321g |
| [117] |
Sanna V, Youssef MF, Pala N, et al. Inhibition of human immunodeficiency virus-1 integrase by β-diketo acid coated gold nanoparticles[J]. ACS Med Chem Lett, 2020, 11: 857-861. DOI:10.1021/acsmedchemlett.9b00648 |
| [118] |
Garaiova Z, Melikishvili S, Michlewska S, et al. Dendronized gold nanoparticles as carriers for gp160 (HIV-1) peptides: biophysical insight into complex formation[J]. Langmuir, 2021, 37: 1542-1550. DOI:10.1021/acs.langmuir.0c03159 |
| [119] |
Cagno V, Andreozzi P, D'Alicarnasso M, et al. Broad-spectrum non-toxic antiviral nanoparticles with a virucidal inhibition mechanism[J]. Nat Mater, 2018, 17: 195-203. DOI:10.1038/nmat5053 |
| [120] |
Zhou YR, Tong T, Jiang XH, et al. GSH-ZnS nanoparticles exhibit high-efficiency and broad-spectrum antiviral activities via multistep inhibition mechanisms[J]. ACS Appl Bio Mater, 2020, 3: 4809-4819. DOI:10.1021/acsabm.0c00332 |
| [121] |
Mallakpour S, Azadi E, Hussain CM. Fight against COVID-19 pandemic with the help of carbon-based nanomaterials[J]. New J Chem, 2021, 45: 8832-8846. DOI:10.1039/D1NJ01333E |
| [122] |
Das Jana I, Kumbhalkar P, Banerjee S, et al. Copper nanoparticle-graphene composite-based transparent surface coating with antiviral activity against influenza virus[J]. ACS Appl Nano Mater, 2021, 4: 352-362. DOI:10.1021/acsanm.0c02713 |
| [123] |
Wang C, Chen H, Chen D, et al. The Inhibition of H1N1 influenza virus-induced apoptosis by surface decoration of selenium nanoparticles with β-thujaplicin through reactive oxygen species-mediated AKT and p53 signaling pathways[J]. ACS Omega, 2020, 5: 30633-30642. DOI:10.1021/acsomega.0c04624 |
| [124] |
He L, Zhao J, Wang L, et al. Using nano-selenium to combat coronavirus disease 2019 (COVID-19)[J]. Nano Today, 2021, 36: 101037. DOI:10.1016/j.nantod.2020.101037 |
| [125] |
Mallakpour S, Azadi E, Hussain CM. The latest strategists for the fight against COVID-19 pandemic: the role of metals and metal oxides nanoparticles[J]. New J Chem, 2021, 45: 6167-6179. DOI:10.1039/D1NJ00047K |
| [126] |
Agostoni V, Chalati T, Horcajada P, et al. Towards an improved anti-HIV activity of NRTI via metal-organic frameworks nanoparticles[J]. Adv Healthc Mater, 2013, 2: 1630-1637. DOI:10.1002/adhm.201200454 |
| [127] |
Wang J, Liu Y, Xu K, et al. Broad-spectrum antiviral property of polyoxometalate localized on a cell surface[J]. ACS Appl Mater Interfaces, 2014, 6: 9785-9789. DOI:10.1021/am502193f |
| [128] |
Kozísek M, Cígler P, Lepsík M, et al. Inorganic polyhedral metallacarborane inhibitors of HIV protease: a new approach to overcoming antiviral resistance[J]. J Med Chem, 2008, 51: 4839-4843. DOI:10.1021/jm8002334 |
| [129] |
Rezácová P, Pokorná J, Brynda J, et al. Design of HIV protease inhibitors based on inorganic polyhedral metallacarboranes[J]. J Med Chem, 2009, 52: 7132-7141. DOI:10.1021/jm9011388 |
| [130] |
Adamson CS, Chibale K, Goss RJM, et al. Antiviral drug discovery: preparing for the next pandemic[J]. Chem Soc Rev, 2021, 50: 3647-3655. DOI:10.1039/D0CS01118E |
| [131] |
De Jesus JR, De Araújo Andrade T. Understanding the relationship between viral infections and trace elements from a metallomics perspective: implications for COVID-19[J]. Metallomics, 2020, 12: 1912-1930. DOI:10.1039/d0mt00220h |
 2022, Vol. 57
2022, Vol. 57


