2. 贵州大学动物科学学院, 贵州 贵阳 550025
2. College of Animal Science, Guizhou University, Guiyang 550025, China
托品烷生物碱(tropane alkaloids, TAs) 是一类主要产于少数茄科植物的次生代谢产物, 具有抗胆碱活性, 主要包括莨菪碱(hyoscyamine)、东莨菪碱(scopolamine) 和药效较低的山莨菪碱(anisodamine), 临床上应用最多的是莨菪碱和东莨菪碱。莨菪碱有止痛解痉的功能, 可治疗胆道、胃痉挛, 也可用于治疗周围血管病、突发性耳聋、各种神经疼痛、晕船、癫痫等疾病。东莨菪碱作为颠茄中药理作用最强的一种生物碱, 可用作副交感神经系统抑制剂, 作用较强且短暂。临床上用它的氢溴酸盐治疗咳嗽、平喘、麻醉镇痛等疾病, 也可作为控制由帕金森病引起的震颤、僵硬等症状的药物[1]。颠茄(Atropa belladonna L.) 虽然是《中国药典》收录的TAs的主要商业药源植物, 但野生颠茄中的TAs含量较低, 其中莨菪碱含量大约为干重的0.02%~0.17%, 东莨菪碱含量仅为干重的0.01%~0.08%, 因此培育高产TAs含量的颠茄植株是现代中药产业化的重要目标[2]。
植物外植体经发根农杆菌浸染后, 农杆菌中Ri质粒的T-DNA区被整合到宿主植物基因组中, 可在伤口部位诱导产生发根, 发根相比母体植物的根具有更强的次生代谢产物合成能力, 其代谢物含量往往高于自然根数倍。研究发现这主要是由发根农杆菌Ri质粒T-DNA区的rol基因引起的, rol基因家族现已鉴定有rolA、B、C、D四个成员[3]。以植物细胞和器官培养为研究体系, 发现单个的rol基因在茄科、茜草科、五加科和蔷薇科中能够促进植物细胞产生大量的次生代谢产物[4]。rolB和rolC基因是诱导植物生根和激活代谢物质合成的主效基因。rolB基因能够提高茜草愈伤中的蒽醌含量达15倍[5]、青蒿中的青蒿素提高达9倍[6], 使山葡萄中的白藜芦醇含量提高达干重的3.15%, 是对照的100倍[7]。rolC转化的人参根培养物中人参皂苷含量极高(干重6.58%), 提高达3倍[8]; 莴笋经rolC转化后总酚含量提高53%~98%, 总黄酮含量增加45%~58%[9]。虽然目前rol基因在植物中的作用机制尚不明晰, 但利用rol基因提高细胞次生代谢物生产的方法已得到大量关注。
颠茄中TAs主要在根中合成, 悬浮细胞和愈伤组织中基本不能积累TAs, 且利用植物细胞培养体系进行基因功能研究尚可, 但用于次生代谢物大规模工业生产还不成熟。在很长一段时间内, 植物药用活性成分获得还是以植株提取为主, 所以, 在植株水平研究rol基因对颠茄植株中TAs合成的作用对相关产业有更重要的意义。本研究通过代谢工程技术获得rolC基因超表达的转基因颠茄植株, 观察超表达rolC基因颠茄与野生型颠茄的表型差异、检测其生物碱含量以及颠茄生物碱合成途径中的关键酶基因表达量, 探讨rol基因对颠茄生物碱合成的影响, 为高产TAs的颠茄分子育种奠定基础。
材料与方法植物材料 颠茄种子(Atropa belladonna L.)由西南大学生命科学学院廖志华教授提供, 繁育并保存于贵州大学植物生理生化与分子生物学实验室。
仪器和试剂 高效液相色谱仪(Waters 2695, 美国Waters公司); 实时荧光定量PCR仪(Bio-Rad CFX Connect); PCR仪(Bio-Rad T100TM Thermal Cycler); 头孢霉素(cefradine, Cef)、卡那霉素(kanamycin, Kan)、赤霉素(gibberellins, GAs)、6-苄氨基腺嘌呤(6-benzylaminopurine, 6-BA)、萘乙酸(1-naphthaleneacetic acid, NAA)、乙酰丁香酮(acetosyringone, AS)、玉米素(zeatin, ZT)、吲哚-3-乙酸(indole-3-acetic acid, IAA) 和3-吲哚丁酸(3-indolebutyric acid, IBA) (索莱宝生物技术有限公司); 胶回收试剂盒TIANgel Midi Purification Kit、质粒提取试剂盒TIAprep Mini Plasmid Kit和总RNA提取试剂盒(北京天根生化科技有限公司); 莨菪碱、山莨菪碱和东莨菪碱标品(美国Sigma公司); 重组试剂盒ClonExpress II One Step Cloning Kit (南京诺唯赞生物科技有限公司); Phenomenex Gemini C18 110A色谱柱(上海岛津GL公司); 高保真Taq DNA聚合酶为PrimeSTAR HS DNA Polimerse、PrimeScriptTM RT reagent Kit反转录试剂盒、TB Green® premix Ex Taq TM Ⅱ试剂盒(TaKaRa生物技术有限公司)。本研究所用引物及测序服务由北京擎科新业生物技术有限公司提供。其他试剂均为分析纯国产试剂。
rolC基因的克隆 根据已发表的发根农杆菌中pRiA4质粒的序列(其中包含rolC基因编码序列) GenBank (序列号: X03433), 按重组试剂盒说明分别设计含有BamH I和Sac I酶切位点的rolC基因重组引物F-rolC: ACGGGGGACTCTAGAGGATCCGTTAACAT GGCTGAAGACGA和R-rolC: CGATCGGGGAAATTC GAGCTCGACTAACCATTAGCCGATTG。用高保真酶扩增rolC基因, 反应程序为: 95 ℃预变性5 min, 30个循环(94 ℃变性30 s, 56 ℃退火, 72 ℃延伸45 s), 最后72 ℃延伸2 min。对PCR产物进行胶回收纯化, 测定浓度, 用于后续与pBI121质粒进行重组。
rolC基因超表达载体的构建 以pBI121为植物表达载体, 用限制性内切酶BamH Ⅰ和Sac Ⅰ在37 ℃下进行双酶切2 h, 胶回收纯化载体大片段。按重组试剂盒说明, 在37 ℃条件下将线性化的载体片段和rolC基因重组PCR产物(摩尔比1∶3) 连接30 min, 反应体系为: 2 μL 5×CEⅡ buffer、1 μL E-naseⅡ、3 μL PBI121酶切产物、1 μL rolC基因片段、3 μL ddH2O。将连接产物转化大肠杆菌DH5α感受态细胞, 在含Kan (50 mg·L-1) 的LB平板上筛选阳性克隆, 分别进行PCR和测序验证, 将验证正确的质粒命名为pBI121-rolC。图 1为rolC基因超表达载体示意图。
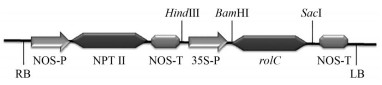
|
Figure 1 Construction of rolC gene expression vector |
CaMV35S-rolC转基因颠茄的获得 挑选饱满的颠茄种子用1 g·L-1的赤霉素浸泡24 h, 流水反复冲洗0.5 h后, 转移至超净工作台。用无菌水冲洗3~4次, 再用75%的酒精消毒1 min, 无菌水漂洗除尽酒精, 再用50%的次氯酸钠溶液消毒8~10 min, 无菌水反复冲洗, 除尽残留消毒液。用无菌滤纸将种子表面水分吸干, 接种在含有Cef (200 mg·L-1) 的MS固体培养基上, 25 ℃温室培养, 光周期为16 h/8 h (亮/暗)。待颠茄种子长出两片子叶后, 剪取其下胚轴和子叶作为外植体, 在含有pBI121-rolC质粒的根癌农杆菌EHA105菌液中浸染8 min, 无菌滤纸吸干外植体上多余的菌液, 将其移至含有100 µmol·L-1乙酰丁香酮、1 mg·L-1 6-BA和1 mg·L-1 NAA的MS基本培养基上25 ℃暗处共培4 d, 再转移到含有1 mg·L-1的ZT、0.5 mg·L-1 IAA、400 mg·L-1的Cef和100 mg·L-1 Kan的MS基本培养基除菌筛选抗性芽, 待分化出抗性芽后, 将其转移到含有0.2 mg·L-1吲哚丁酸和400 mg·L-1的Cef的MS生根培养基中, 正常光周期条件下培养, 直至长成完整植株。每4周对转基因植物进行传代培养, 除菌彻底后提取DNA进行分子检测, 确认是否转入外源rolC基因, 并根据农杆菌EHA105的VirD区设计一对引物F-VirD: GAGTAT GAAACCTTTTCCTATCA和R-VirD: GGGATACGGA CAAAATGGAG, 避免残留农杆菌造成假阳性。
颠茄的表型分析 拍照记录CaMV35S-rolC颠茄各个时期的表型变化, 将颠茄移至田间栽培, 记录颠茄的叶长、叶宽、节间及叶鲜重, 通过IBM SPSS Statistics 22分析转基因颠茄与野生型颠茄在表型上的差异。
生物碱标准曲线的制作 精确称取1.000 mg的莨菪碱、山莨菪碱和东莨菪碱标准品粉末, 配制成1.000 mg·L-1的标准母液, 再依次稀释为500、250、100、50、25、10 µg·mL-1的标准液。每个梯度样品重复进样3次, 进行HPLC检测, 以浓度为横坐标, 峰面积为纵坐标, 对3种生物碱的标准曲线进行线性拟合, 线性回归方程分别为: 莨菪碱y = 7.93×103x - 1.87×103 (R2 = 0.999 6), 山莨菪碱y = 4.59×103x + 5.37×103 (R2 = 0.999 8), 东莨菪碱y = 6.31×103x - 2.60×103 (R2 = 0.999 4)。
颠茄生物碱的提取和测定 颠茄生物碱的提取参照Ashtiania等[10]的方法, 稍有改动。用HPLC测定莨菪碱、山莨菪碱及东莨菪碱的含量, 每个株系取3株颠茄叶片混合样作为1个处理, 共3个重复。根据各线性回归方程计算出莨菪碱、山莨菪碱和东莨菪碱含量。色谱柱为C18液相色谱柱(250 mm×4.6 mm, 5 μm); 流动相为甲醇和乙腈等比例混合液: 乙酸铵缓冲液(0.1%甲酸, pH = 4.0) = 17∶83, v/v; 检测波长为215 nm; 柱温40 ℃; 流速为1.0 mL·min-1; 检测时间20 min, 进样量为20 µL。
RNA的提取及cDNA的合成 取1个月大的颠茄幼苗叶片及根部, 液氮速冻, 研磨至粉状。根据总RNA提取试剂盒提取颠茄RNA, 用微量核酸浓度检测仪及琼脂糖凝胶电泳测定核酸的浓度和质量, A260/A280均大于1.8小于2.1, 表明RNA无蛋白和DNA污染, -80 ℃冰箱保存备用。按照反转录试剂盒说明书, 每个样品反转录500 ng RNA合成cDNA第一链, -20 ℃冰箱保存备用。加样体系: 2 μL 5×PrimeScriptTM Buffer (for Real Time)、1 μL Oligo dT Primer (50 μmol·L-1)、0.5 μL PrimeScriptTM RT Enzyme Mix I、2 μL Random 6 mers (100 μmol·L-1)、1 μL总RNA, 补足RNase Free H2O至10 μL, 反转录反应条件: 37 ℃ 15 min, 85 ℃ 5 s。
引物设计与qRT-PCR检测 根据NCBI上公布的序列, 利用Vector NTI Suite 8.0软件设计TAs合成途径中的关键酶基因引物序列(表 1)。将反转录得到的cDNA稀释5倍, 取2 μL作为qRT-PCR模板, 以ACTIN (序列号: JX154681) 和PGK (序列号: JX154676) 为内参, 采用Pfaffl Method进行相对表达量计算。qRT-PCR的反应体系组成为: 10 μL SYBR Premix EX Taq (2×)、Forward & Reverse Primer各0.8 μL、6.4 μL ddH2O和2 μL cDNA, 每个样品设置3个重复, 反应程序为95 ℃ 30 s, 95 ℃ 5 s, 适当温度退火30 s (在此收集荧光信号), 40个循环; PCR结束后, 95 ℃ 15 s, 60 ℃ 60 s, 95 ℃ 30 s, 60 ℃ 15 s, 分析熔解曲线。
| Table 1 qRT-PCR Primer and sequences |
数据整理及软件分析 IBM SPSS Statistics 22软件对所有实验数据进行统计分析, 转基因样本与对照样本进行t检验, 显著水平为P < 0.05, 极显著水平为P < 0.01, 采用Origin 2019b制图。
结果与分析 1 pBI121-rolC表达载体的构建设计rolC基因的同源重组克隆引物, 从发根农杆菌pRiA4质粒的农杆菌C58C1中扩增得到含有BamH I和Sac I位点的rolC基因(图 2A), 用BamH I和Sac I酶切pBI121获得载体骨架, 将其重组后, 转入DH5α大肠杆菌, 通过菌检并测序得到pBI121-rolC的表达载体(图 2B)。
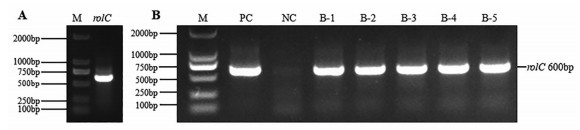
|
Figure 2 Detection of rolC gene by PCR. A: PCR amplification of rolC gene; B: PCR detection of rolC gene in colonies. M: DNA marker; PC: Positive control; NC: Negative control; B-1 to B-5: Positive bacterial clones |
剪取15 d左右的颠茄幼苗子叶及下胚轴(图 3A), 经EHA105-pBI121-rolC菌液转化共培后, 将外植体转移至含有100 mg·L-1 Kan的筛选培养基上, 未转基因的组织无法在Kan筛选培养基上存活, 而pBI121-rolC中的NptII基因能够使转基因组织对Kan具有抗性, 转基因组织可以诱导出抗性芽(图 3B)。待抗性芽长至2 cm后将其剪下并转入含有IBA (0.2 mg·L-1) 的MS生根培养基中(图 3C), 待长成完整植株, 将颠茄移植至育苗钵温室培养(图 3D), 提取DNA进行rolC基因的PCR检测, 用F-VirD和R-VirD引物排除由于农杆菌污染造成的假阳性现象, 最终选取3个株系的CaMV35S-rolC转基因植株用于分析(图 4)。

|
Figure 3 Genetic ransformation flow chart of A. belladonna. A: Obtaining sterile belladonna seedlings through detoxification; B: Obtainment of kanamycin-resistant plants through selecting on medium with 100 mg·L-1 kanamycin; C: Propagation of transgenic A. belladonna plants; D: Transplantation of partial transgenic A. belladonna plants |

|
Figure 4 Detection of the rolC gene and the VirD gene by PCR. M: DNA marker; PC: Positive control; WT: Wild-type (as control); C-1, C-3, C-5: CaMV35S-rolC transgenic A. belladonna line |
CaMV35S-rolC颠茄3个转基因株系相比于对照, 花期提前、数量增多、侧芽丛生、腋芽分化旺盛(图 5A~C), 其中C-1株系叶片表现为皱叶(图 5A); CaMV35S-rolC颠茄花朵体型小、花径短、雄蕊柱长高于雌蕊(图 5D), 而对照表型与之相反; CaMV35S-rolC颠茄生根和根系发育能力明显增强, 根系更为发达茂密(图 5E)。将CaMV35S-rolC颠茄与对照移至田间种植1个月后, 观测园艺性状, 结果见表 2, CaMV35S-rolC颠茄的叶宽、叶长、节间距及鲜重均显著低于对照, 但叶片长宽比显著高于对照, 表现为狭长叶, 而对照叶片稍钝圆(图 5D)。

|
Figure 5 The phenotypes of A. belladonna (wild-type and transgenic). A-C: Wild-type and transgenic A. belladonna seedlings in the pots; D: Comparison of flowers of wild-type and transgenic A. belladonna. E: Comparison of roots of wild-type and transgenic A. belladonna. WT: Wild-type (as control); C: CaMV35S-rolC transgenic A. belladonna line |
| Table 2 Statistical table of phenotypic of wild-type and transgenic A. belladonna. Note: Followed by different low case letter in each column are significantly different (P < 0.05); WT: Wild-type (as control) |
通过HPLC检测田间种植3个月的颠茄叶片中的生物碱含量, 结果见图 6。CaMV35S-rolC颠茄的莨菪碱、东莨菪碱和山莨菪碱含量均显著高于对照, 莨菪碱含量由高到低为C-5 > C-1 > C-3 > WT, C-5株系的莨菪碱含量(6 547.38 μg·g-1 DW) 是对照(2 538.50 μg·g-1 DW) 的2.58倍(图 6A); 山莨菪碱含量为C-1 > C-3 > C-5 > WT, C-1株系的山莨菪碱含量为721.16 μg·g-1 DW, 是对照(200.81 μg·g-1 DW) 的3.59倍(图 6B); 东莨菪碱含量为C-1 > C-3 > C-5 > WT, 其中C-1株系的东莨菪碱含量为1 986.43 μg·g-1 DW, 是对照(125.99 μg·g-1 DW) 的15.77倍(图 6C)。
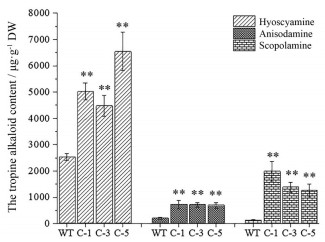
|
Figure 6 The contents of hyoscyamine, anisodamine and scopolamine in leaves of A. belladonna. **P < 0.01 vs WT (wild-type, as control) |
在CaMV35S-rolC颠茄和野生型颠茄叶片中均未检测到TAs合成途径关键酶基因PMT、TRⅠ和H6H基因, 仅在颠茄根中检测到。CaMV35S-rolC颠茄根中PMT、TRⅠ和H6H基因表达量均显著高于对照, C-1株系根中PMT、TRⅠ和H6H基因的表达量上调倍数最大, 分别是对照的8.96、3.61和30.43倍(图 7)。H6H是提高幅度最大的下游途径基因, 相比对照提高了24倍以上。未在野生颠茄中检测到rolC基因, 仅在CaMV35S-rolC颠茄的根及叶片中检测到(图 8)。
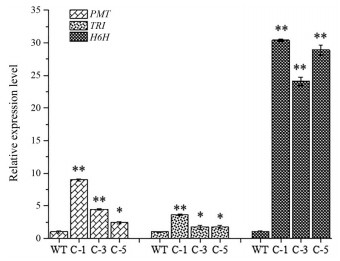
|
Figure 7 Gene expression levels of key enzymes in the TAs synthesis pathway in A. belladonna roots. *P < 0.05, **P < 0.01 vs WT (wild-type, as control) |
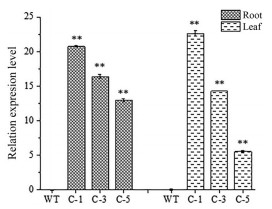
|
Figure 8 rolC gene expression level in A. belladonna roots and leaves. **P < 0.01 vs WT (wild-type, as control) |
颠茄中的莨菪碱和东莨菪碱是具有重要医疗价值的抗胆碱药物, 市场需求巨大, 提高药源植物中这两种生物碱含量是植物次生代谢研究的热点之一。对rol基因的研究最初在于阐明其对植物发根的诱导能力, 后来发现rolB和rolC还具有天然的促进植物次生代谢合成的能力。Bonhomme等[11]用携带rolC基因的根癌农杆菌GV3101浸染颠茄子叶诱导产生了发根, 发现rolC基因在促进毛状根生长以及生物碱的积累方面发挥了重要作用, 使发根生长速率提高了17倍, 生物碱含量达未转化根的12倍。Grishchenko等[12]用CaMV35S启动子控制rolC基因在朝鲜槐愈伤中表达, 发现转基因朝鲜槐的鲜重及异黄酮类化合物的含量均高于对照。Bulgakov等[13]和Shkryl等[5]发现rolC基因同样能够提高茜草细胞中蒽醌的合成, 其含量达到了未转化细胞的1.3~4.3倍。因此rolC基因对植物中次生代谢产物合成的促进作用是广谱的, 它可作为植物次生代谢工程潜在的有效靶基因。
本研究同时也观察到CaMV35S-rolC颠茄植株地上部分发育变异, 导致园艺性状发生了较大的改变。转rolC颠茄顶端优势降低, 相比对照植株矮小、节间缩短、腋芽丛生、节间数及分支数繁多, 同时叶片狭长、提前开花、花多但花形小。在烟草和青蒿中也报道过类似现象, rolC基因在提高次生代谢产物的同时也诱导植物表型发生一系列的可遗传变异[14]。rolC基因曾报道在芽的形成过程中表现出重要的作用, 它含有一个大小为540 bp的开放阅读框, 编码的蛋白具有细胞分裂素β-葡萄糖苷酶活性, 可以促进受体植物内细胞分裂素水平提高[8], 这可能是导致CaMV35S-rolC颠茄植株腋芽茂盛, 侧芽丛生的主要原因。
关于CaMV35S-rolC颠茄花朵的表型差异与前人研究一致[15, 16], CaMV35S-rolC颠茄相比野生型颠茄提前开花, 但在烟草中rolC基因的转入导致了烟草花期推迟[17]。因此在不同物种中rolC基因调控植株的开花时间也存在差异。Schmülling等[18]研究发现单转rolC基因的烟草花朵花粉产量减少、种子蒴果小且雄性不育。本研究已获得转基因T1代植株, T0代转基因植株通过自交法无法获得T1代植株, 已得到的T1代转基因植株是通过用野生型颠茄给T0代CaMV35S-rolC颠茄授粉获得。表明CaMV35S-rolC颠茄也存在雄性不育这一性状, 雄性不育这个性状能够在一定程度上减少基因漂移造成的基因污染。
rolC基因的导入同样诱导颠茄地下部分缺失顶端优势, 所以根系发达, 根生物量显著增多。TAs主要在颠茄的须根中合成, 再运输到地上部位[19]。颠茄根生物量的增加, 有助于促进TAs生物碱的合成, 提高颠茄中TAs含量。徐洪伟[20]研究发现经发根农杆菌侵染的玉米毛状根和再生植株根系发达、节根分节较多, 经PCR和PCR-Southern分子杂交检测出在玉米毛状根及再生植株基因组中整合了Ri质粒上的rolC基因。由于毛状根再生植株的发达, 在水分胁迫下依旧能提供植物生长代谢过程中所需的水分, 表现出了很好的抗旱性。而本研究中获得的CaMV35S-rolC颠茄根系在表型上与经农杆菌侵染的玉米毛状根再生植株一致, 在后续研究中可探究CaMV35S-rolC颠茄的抗旱能力。
东莨菪碱在野生颠茄中含量极低但药效更强, 已有很多针对提高东莨菪碱含量的代谢工程研究。PMT和H6H作为TAs合成途径中的第一个和最后一个关键酶是被研究得最深入的。托品烷还原酶Ⅰ (TRⅠ) 位于TAs合成途径的重要分支处, 可控制TAs的代谢分流, 与托品烷还原酶Ⅱ (TRⅡ) 存在竞争关系, 催化整个反应向莨菪碱方向合成[19, 21]。PMT、TRI和H6H均具有组织特异性, 仅在颠茄的根部表达, Wang等[22]在颠茄中同时超表达了PMT和H6H, 证实了PMT和H6H之间呈协同作用的关系, H6H的表达量与东莨菪碱的含量之间呈正相关关系。本研究未在颠茄叶片中检测到TAs合成途径关键酶基因PMT、TRI和H6H, CaMV35S-rolC颠茄根中的H6H的相对表达量与野生型相比提高了20.10~49.89倍, 转基因颠茄的东莨菪碱含量也显著高于对照, 其中H6H表达量最高的株系C-1的东菪碱含量是对照的15.77倍。由此也可看出, rolC基因也可用作提高颠茄中东莨菪碱含量的靶基因。Yun等[23]和Wang等[22]发现超表达H6H在促进东莨菪碱生物合成, 提高东莨菪碱在转基因植株中积累的同时, 也会导致莨菪碱的积累降低, 本研究在颠茄中超表达rolC基因后, 在催化代谢流向东莨菪碱合成的同时也促进了莨菪碱的合成与积累。
CaMV35S启动子会驱动rol基因在整株颠茄中表达, 造成转基因颠茄地上部分呈现出与野生颠茄的表型差异。颠茄须根是TAs的合成部位, 合成途径中的关键酶基因PMT[24]、TRⅠ、H6H[25]的启动子均已被分离, 且具有根组织特异性, 因此下一步利用这些启动子驱动rolC基因与合成途径基因协调表达, 预期能有效地保留和发挥rolC基因在须根中对颠茄中TAs合成的促进作用, 同时也能避免转rolC基因颠茄地上部位表达造成的发育变异, 同样地避免了转基因的颠茄雄性不育这一性状, 从而获得纯系的转rolC基因颠茄植株, 更好地实现rolC基因在代谢工程中的合理利用。
综上所述, 外源引入rolC基因可导致颠茄园艺性状改变, 但可通过提高TAs合成途径中关键酶基因的表达量大幅度提高颠茄中莨菪碱、山莨菪碱及东莨菪碱含量。本研究选育的高产莨菪碱及东莨菪碱的转基因株系可进一步改造培育为更具优势的药源品种, 也可为研究rolC基因调控次生代谢产物的合成机制奠定基础。
作者贡献: 强玮、谭艾娟和张明生设计了本实验; 周浩、敖雯雯构建了植物表达载体; 满建民和路星星完成了颠茄的遗传转化、种植及相关指标的记录及检测; 吕世明和路星星分别完成了数据分析和论文初稿的写作; 强玮、谭艾娟、吕世明及张明生共同指导论文的写作与修改。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Kohnen-Johannsen KL, Kayser O. Tropane alkaloids: chemistry, pharmacology, biosynthesis and production[J]. Molecules, 2019, 24: 796-818. DOI:10.3390/molecules24040796 |
| [2] |
Xia K, Liu X, Zhang Q, et al. Promoting scopolamine biosynthesis in transgenic Atropa belladonna plants with pmt and h6h overexpression under field conditions[J]. Plant Physiol Biochem, 2016, 106: 46-53. DOI:10.1016/j.plaphy.2016.04.034 |
| [3] |
Chandra S, Chandra R. Engineering secondary metabolite production in hairy roots[J]. Phytochem Rev, 2011, 10: 371-395. DOI:10.1007/s11101-011-9210-8 |
| [4] |
Chandra S. Natural plant genetic engineer Agrobacterium rhizogenes: role of T-DNA in plant secondary metabolism[J]. Biotechnol Lett, 2012, 34: 407-415. DOI:10.1007/s10529-011-0785-3 |
| [5] |
Shkryl YN, Veremeichik GN, Bulgakov VP, et al. Individual and combined effects of the rolA, B, and C genes on anthraquinone production in Rubia cordifolia transformed calli[J]. Biotechnol Bioeng, 2008, 100: 118-125. DOI:10.1002/bit.21727 |
| [6] |
Dilshad E, Cusido RM, Palazon J, et al. Enhanced artemisinin yield by expression of rol genes in Artemisia annua[J]. Malaria J, 2015, 14: 1-10. DOI:10.1186/1475-2875-14-1 |
| [7] |
Kiselev KV, Dubrovina AS, Veselova MV, et al. The rolB gene-induced overproduction of resveratrol in Vitis amurensis transformed cells[J]. J Biotechnol, 2007, 12: 681-692. |
| [8] |
Bulgakov VP. Functions of rol genes in plant secondary metabolism[J]. Biotechnol Adv, 2008, 26: 318-324. DOI:10.1016/j.biotechadv.2008.03.001 |
| [9] |
Ismail H, Dilshad E, Waheed MT, et al. Transformation of Lactuca sativa L. with rolC gene results in increased antioxidant potential and enhanced analgesic, anti-inflammatory and antidepressant activities in vivo[J]. 3 Biotech, 2016, 6: 215. |
| [10] |
Ashtiania F, Sefidkonb F. Tropane alkaloids of Atropa belladonna L. and Atropa acuminata Royle ex Miers plants[J]. J Med Plants Res, 2011, 5: 6515-6522. |
| [11] |
Bonhomme V, Laurain-Mattar D, Fliniaux MA. Effects of the rolC gene on hairy root: induction development and tropane alkaloid production by Atropa belladonna[J]. J Nat Prod, 2000, 63: 1249-1252. DOI:10.1021/np990614l |
| [12] |
Grishchenko OV, Kiselev KV, Tchernoded GK, et al. The influence of the rolC gene on isoflavonoid production in callus cultures of Maackia amurensis[J]. Plant Cell Tissue Org, 2013, 113: 429-435. DOI:10.1007/s11240-012-0283-x |
| [13] |
Bulgakov VP, Tchernoded GK, Mischenko NP, et al. Effect of salicylic acid, methyl jasmonate, ethephon and cantharidin on anthraquinone production by Rubia cordifolia callus cultures transformed with the rolB and rolC genes[J]. J Biotechnol, 2002, 97: 213-221. DOI:10.1016/S0168-1656(02)00067-6 |
| [14] |
Khan S, Saema S, Banerjee S, et al. Role of rol genes: potential route to manipulate plants for genetic improvement[M]//Ahmad N, Anis M. Plant Tissue Culture: Propagation, Conservation and Crop Improvement. Singapore: Springer, 2016: 419-446.
|
| [15] |
Sun GF. The effect of rolC gene on flowering[J]. Biotechnol Bull (生物技术通报), 1992(03): 11. |
| [16] |
Kurioka Y, Suzuki Y, Kamada H, et al. Promotion of flowering and morphological alterations in Atropa belladonna transformed with a CaMV35S-rolC chimeric gene of the Ri plasmid[J]. Plant Cell Rep, 1992, 12: 1-6. |
| [17] |
Zhang Z, Sun AJ, Fang JG. Study on Agrobacteriun-mediated transformation of tobacco plant with rolC gene[J]. J Nanjing Agric Univ (南京农业大学学报), 2001, 24: 25-29. |
| [18] |
Schmülling T, Schell J, Spena A. Single genes from Agrobacterium rhizogenes influence plant development[J]. EMBO J, 1988, 7: 2621-2629. DOI:10.1002/j.1460-2075.1988.tb03114.x |
| [19] |
Qiang W, Wang YX, Zhang QZ, et al. Expression pattern of genes involved in tropane alkaloids biosynthesis and tropane alkaloids accumulation in Atropa belladonna[J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 52-58. |
| [20] |
Xu HW. Research of Regenerative Plants Induced by Agrobacterium rhizogenes in Hairy Root Cultures and Drought Resistance in Maize (发根农杆菌诱导玉米毛状根再生植株及抗旱性研究)[D]. Changchun: Northeast Normal University, 2007.
|
| [21] |
Qing W, Xia K, Zhao XP, et al. Cloning and enzymatically functional characterization of a novel tropinone reductase Ⅰ (DaTRI 2) gene in Datura arborea[J]. Acta Pharm Sin (药学学报), 2019, 54: 574-581. |
| [22] |
Wang X, Chen M, Yang C, et al. Enhancing the scopolamine production in transgenic plants of Atropa belladonna by overexpressing pmt and h6h genes[J]. Physiol Plant, 2011, 143: 309-315. DOI:10.1111/j.1399-3054.2011.01506.x |
| [23] |
Yun DJ, Hashimoto T, Yamada Y. Metabolic engineering of medicinal plants: transgenic Atropa belladonna with an improved alkaloid composition[J]. Proc Natl Acad Sci U S A, 1992, 89: 11799-11803. DOI:10.1073/pnas.89.24.11799 |
| [24] |
Suzuki K, Yamada Y, Hashimoto T. Expression of Atropa belladonna putrescine N-methyltransferase gene in root pericycle[J]. Plant Cell Physiol, 1999, 40: 289-297. DOI:10.1093/oxfordjournals.pcp.a029540 |
| [25] |
Suzuki K, Yun DJ, Chen XY, et al. An Atropa belladonna hyoscyamine 6β-hydroxylase gene is differentially expressed in the root pericycle and anthers[J]. Plant Mol Biol, 1999, 40: 141-152. DOI:10.1023/A:1026465518112 |
 2022, Vol. 57
2022, Vol. 57


