2. 北京中医药大学中药学院中药现代研究中心, 北京 100029;
3. 中药材规范化生产教育部工程研究中心, 北京 100102
2. Modern Research Center for Traditional Chinese Medicine, School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 100029, China;
3. Engineering Research Center of Good Agricultural Practice for Chinese Crude Drugs of Ministry of Education, Beijing 100102, China
大黄(Rhei Rhizoma) 是常用大宗药材之一[1], 具有泻下攻积、清热泻火、凉血解毒、逐瘀痛经、利湿退黄的功效[2], 临床上常用于治疗慢性肝炎[3]、肝纤维化[4]、便秘[5]、慢性肾衰[6]、黄疸[7]、上消化道出血等多种疾病[8]。大黄是一种典型的多基原、多炮制、多功效药材[9], 其正品来源为蓼科植物掌叶大黄(Rheum palmatum L.)、唐古特大黄(Rheum tanguticum Maxim.ex Balf.) 或药用大黄(Rheum officinale Baill) 的根及根茎[2]。已有研究表明, 不同基原大黄化学成分含量存在一定差别, 其中蒽醌类及其衍生物差别较大[10, 11], 并且3种基原大黄其药理活性也存在不同差异[12], 其中大黄蒽醌类化合物是发挥泻下攻积作用的主要成分[13, 14], 鞣质类成分为清热泻火的药效物质基础[15, 16], 为确保大黄更为精确的对症用药, 有必要针对不同功效用途, 选取不同基原大黄入药, 因此, 鉴别大黄市场样品基原及种质具有重要的意义。
近年来, 基于DNA序列标记的中药材分子鉴定技术在中药鉴定领域被广泛应用, 与中药材性状鉴定、药材理化鉴定等方法相比, DNA序列标记技术重复性好并且准确度高[17, 18]。叶绿体基因通过母系遗传给后代, 结构简单、分子量小、序列保守, 因此广泛用于中药材种质资源鉴定[19, 20]及系统进化分析[21-23]。叶绿体基因matK具有分子质量小、序列和结构保守性强、进化速率快等特点, 常被应用于中药材分子鉴定[24]及亲缘性研究[25]。如matK基因作为石斛属系统进化关系及亲缘关系分析具有更高的遗传多样[24]。课题组前期研究结果表明matK基因能够鉴别大黄的真伪[9], 及不同产地野生型和栽培型大黄的种质, 因此可以利用matK基因实现对市场销售的大黄进行种质资源鉴别, 并推断其产地来源。
大黄临床应用范围广, 组方中包含有大黄的中成药有868种, 如防风通圣丸、牛黄上清丸等, 均配有大黄药材, 大黄的质量直接关系到中药处方和制剂的临床疗效。大黄的质量与大黄的有效成分息息相关, 《中华人民共和国药典》 (2020版) 中明确规定大黄药材中总蒽醌含量应不低于2.0%, 游离蒽醌含量应不低于0.2%。因此, 检测市场销售大黄的总蒽醌和游离蒽醌的含量有利于确定大黄药材的质量, 确保大黄临床疗效。本研究从27省40市收集89份大黄市场样品, 通过检测matK基因型确定市售样品的基原、种质, 判断其产地, 通过UPLC检测市售大黄样品的总蒽醌和游离蒽醌含量, 确定大黄质量, 为后续指导大黄市场样品流通及大黄临床用药奠定基础, 同时也对其他多基原、多种质的中药材的市场样品检测及科学合理临床用药具有重要指导意义。
材料与方法材料 本研究样本于2020年11月至2021年5月从全国27省40市收集89份市售大黄饮片, 将其粉碎, 过6号筛, 样品信息见表 1。植物基因组提取试剂盒(Vazyme, 中国), 产物纯化试剂盒(Vazyme, 中国), Taq DNA聚合酶(TaKaRa), 琼脂糖(Biowest Agrose, 西班牙), 核酸Marker和核酸染料购自北京拜尔迪生物科技有限公司, 芦荟大黄素对照品(T28D6F8264)、大黄酸对照品(F27J7S18516)、大黄素对照品(T17A10F95418)、大黄酚对照品(T23A8F42188)、大黄素甲醚对照品(T18O10F100404) (上海源叶生物科技有限公司), matK引物由北京六合华大基因科技有限公司合成。
| Table 1 Sample list |
仪器 冷冻高速离心机(TGL-16, 湘仪离心机仪器有限公司), 粉碎机(BJ-150, 拜杰多功能粉碎机), 电热恒温水浴锅(HH-S4A, 北京科伟永兴仪器有限公司), 涡旋器(GL-88B, 海门市其林贝尔仪器制造有限公司), 超高效液相(岛津SPD-M40), 色谱柱(Waters, 2.1 mm × 100 mm, 1.7 μm), 超声波清洗机(GW1030, 深圳市冠博科技实业有限公司), 电子天平(PL602E, METTLER TOLEDO), 凝胶成像仪(WD-9413B, 北京六一生物科技有限公司), 电泳仪(JY300E, 北京君意东方电泳设备有限公司), 超微量分光光度计(NanoDrop, Thermo Fisher), PCR仪(T100, Bio-Rad)。
DNA提取与检测 按照植物DNA提取试剂盒(Vazyme, 中国) 实验操作步骤进行DNA提取, 利用NanoDrop检测DNA浓度, 同时利用1.0%琼脂糖凝胶电泳检测DNA的完整性和质量。
PCR扩增与测序 本研究根据大黄matK片段设计特异性引物matK-F: ATGGAGGAATTCCAAGGATATT TAG, matK-R: ATAATTATGACTGGCCAAATCATAA, 并对89份样品进行PCR扩增。扩增体系为DNA 1 μL、10×Taq buffer 5 μL、dNTP Mix (2.5 mmol·L-1) 4 μL、rTaq (2.5 U·μL-1) 1 μL、0.1% BSA 1 μL、10 μmol primer各2 μL, ddH2O补足至终体积50 μL。扩增程序: 95 ℃预变性5 min, 94 ℃ 30 s, 50 ℃ 50 s, 72 ℃ 1 min, 35个循环, 72 ℃延伸反应10 min, 4 ℃保存。1.0%琼脂糖凝胶电泳检测PCR产物, 目的片段回收和纯化按照胶回收试剂盒说明书进行。回收产物送北京六合华大基因科技有限公司测序。
对照品溶液制备 分别精密称取芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚对照品, 依次为1.88、1.66、1.25、3.55和0.95 mg, 加纯甲醇溶液超声使之充分溶解, 分别定容至10 mL量瓶中, 备用; 将上述溶液作为对照品贮备溶液, 置于4 ℃冰箱中备用。
供试品溶液制备 市售大黄饮片游离蒽醌和总蒽醌提取参考[26, 27]等方法。取市售大黄粉末1.0 g, 精密称定, 置具50 mL塞锥形瓶中, 加入45 mL甲醇, 称定质量。超声处理30 min, 放至室温, 加甲醇补足质量, 摇匀, 过滤, 取续滤液过0.45 μm微孔滤膜, 作为游离蒽醌供试品溶液。取市售大黄粉末0.1 g, 精密称定, 置100 mL量瓶中, 加入约99 mL甲醇, 超声提取0.5 h, 放至室温, 加甲醇定容至刻度, 摇匀, 滤过。取续滤液15 mL置圆底烧瓶中, 加盐酸0.8 mL, 80 ℃水浴加热回流30 min, 放至室温, 加10% NaOH溶液3 mL调节pH值为3~4, 摇匀, 转移至25 mL容量瓶中, 加甲醇至刻度线, 摇匀, 过滤, 取续滤液过0.45 μm微孔滤膜, 作为总蒽醌供试品溶液。
色谱条件 采用UPLC进行含量测定, 总蒽醌UPLC条件: 岛津SPD-M40 (日本), 色谱柱为Waters Acquity UPLC® BEH C18色谱柱(2.1 mm × 100 mm, 1.7 μm); 流动相为乙腈(A)-0.1%磷酸水(B) 梯度洗脱。洗脱条件为0 min 97% B, 1.5 min 97% B, 3 min 96% B, 5 min 95% B, 8 min 90% B, 14 min 85% B, 18 min 75% B, 20 min 64% B, 25 min 40% B, 40 min 40% B; 流速0.3 mL·min-1; 检测波长254 nm; 柱温40 ℃。游离蒽醌UPLC条件: 岛津SPD-M40 (日本), 色谱柱为Waters Acquity UPLC® BEH C18色谱柱(2.1 mm × 100 mm, 1.7 μm); 流动相为乙腈(A)-0.1%磷酸水(B) 梯度洗脱。洗脱条件为0 min 64% B, 3 min 45% B, 5 min 41% B, 6 min 40% B, 10 min 40% B; 流速0.3 mL·min-1; 检测波长254 nm; 柱温40 ℃。
序列分析及数据处理 采用ContingExpress校对拼接, 去除低质量序列及引物区。用DNAman软件将测序得到的matK序列与文献中大黄序列进行碱基分析, 获得市场大黄饮片基因型信息, 并根据基因型判断市场大黄饮片基原。以本研究收集的大黄饮片为材料, 采用MEGA X软件中的K2P (kimura2-parameter) 模型计算不同种间和种内的遗传距离, 生成距离矩阵以及构建基因型NJ树。采取SPSS 19.0统计软件中的单因素分析比较采集地与总蒽醌和游离蒽醌的相关性以及单倍型与总蒽醌和游离蒽醌的相关性。
结果与分析 1 市售大黄样品的收集本实验收集27个省40个市89份市场销售大黄, 样品信息见表 1, 其中北京市12份样品, 安徽省10份样品, 四川省和贵州省各7份样品, 河南省6份样品, 吉林省5份样品, 辽宁省和黑龙江省各4份样品, 云南省、江西省、河北省和山东省各3份样品, 内蒙古自治区、新疆维吾尔自治区、陕西省、广东省、天津市、福建省和山西省各2份样品, 重庆市、湖南省、海南省、江苏省、甘肃省、青海省、宁夏回族自治区和广西壮族自治区各1份样品。
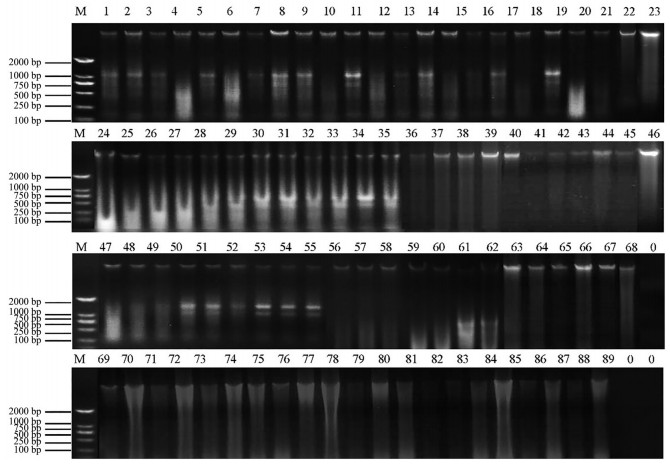
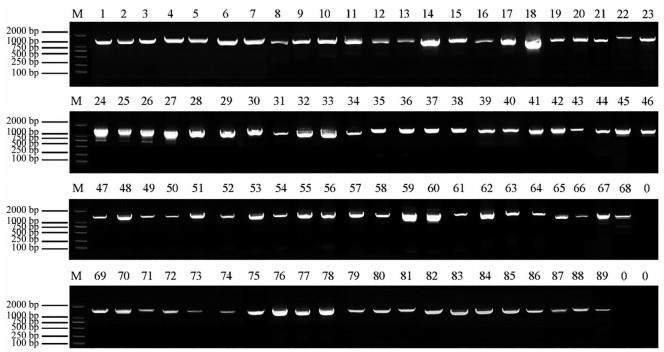
2 市售大黄DNA条形码matK基因的扩增成功提取89份市售大黄样品DNA, DNA浓度是33.2~107.0 ng·μL-1, 具体结果如图 1所示; 以提取的DNA为模板, 通过PCR扩增matK基因, 89份样品中都扩增到了1 500 bp的片段, 具体结果如图 2所示。PCR产物经纯化后进行双向测序, 测序结果经拼接后, 通过与NCBI中大黄matK序列(AB115669) 进行比对, 确定其为大黄matK基因序列。
|
Figure 1 Genomic DNA of the commercial Rheum samples (M: DL2000) |
|
Figure 2 PCR amplification results of matK sequence of the commercial Rheum samples (M: DL2000) |
本课题组前期研究结果表明, 目前检测的中国地区的大黄正品及伪品共41个单倍型, 3个基原的大黄共29个单倍型(基因型), 其中药用大黄5个、掌叶大黄16个、唐古特大黄8个。本研究89份市场样品均为正品大黄, 而且均是掌叶大黄的单倍型, 共8个基因型, 分别为Rp1、Rp2、Rp3、Rp4、Rp5、Rp6、Rp10和Rp12, 基因型序列变异位点见表 2, 其中基因型Rp4数量最多, 占总样本量40.45%, 共36份, 其次是Rp6, 共有33份, 占总样本量37.08%; 基因型数量由高至低排列如下: Rp4 > Rp6 > Rp5 > Rp3 > Rp10 > Rp2 > Rp1 = Rp12 (图 3)。市售大黄中Rp4基因型分布在18个省, 占全国省级行政区的52.94%, 包括北京市、广东省、云南省、河南省、吉林省、福建省、内蒙古自治区、贵州省、湖南省、山西省、广西壮族自治区、黑龙江省、辽宁省、新疆维吾尔自治区、安徽省、江西省、江苏省和山东省; 以前的研究结果表明Rp4基因型来自甘肃省、云南省和宁夏回族自治区, 其中云南省和甘肃省为栽培大黄, 宁夏回族自治区为野生大黄; 说明来自甘肃、云南的栽培大黄和来自宁夏的野生大黄可能销售到全国18个省份。Rp6基因型分布16个省份, 占全国省级行政区的47.06%, 包括北京市、辽宁省、四川省、安徽省、云南省、吉林省、黑龙江省、天津市、新疆维吾尔自治区、河北省、河南省、贵州省、海南省、陕西省、山东省和江西省, 课题组前期研究结果表明Rp6基因型来自四川省的栽培大黄; 说明四川的栽培大黄销售到全国16个省份。以上结果表明, 市售大黄饮片的基因型比较集中, 来源地也相对集中。
| Table 2 Comparison of the matK gene sequence among 89 commercial specimens of Rheum species. *Base in this site is the same as that in the first row. (-) denotes alignment gaps |

|
Figure 3 Proportion of each haplotype in the total |
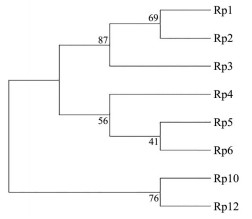
采用MEGA X将市售大黄8个matK基因型序列构建进化树。从进化树可以看出8个基因型共分成两个大支, 其中Rp10和Rp12聚为一大支, 支持率为76%; Rp1、Rp2、Rp3、Rp4、Rp5和Rp6聚为另一大支(图 4)。对获得的8个基因型进行种内遗传距离分析, 8个基因型平均遗传距离为0.004, 遗传距离在0.001~0.010之间, 最大遗传距离为0.010, 发生在Rp10和Rp1之间, 最小遗传距离为0.001, 发生Rp2和Rp3之间(表 3)。此外, 研究发现市售大黄饮片主要流通的Rp4和Rp6基因型聚在一小支上, 支持率为56%, 其遗传距离为0.003, 表明2个基因型亲缘关系较近。
|
Figure 4 Phylogenetic tree constructed using NJ method based on 8 chloroplast matK gene sequences |
| Table 3 The intraspecific genetic distances between 8 chloroplast matK gene sequences |
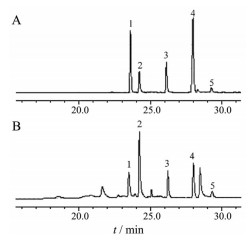
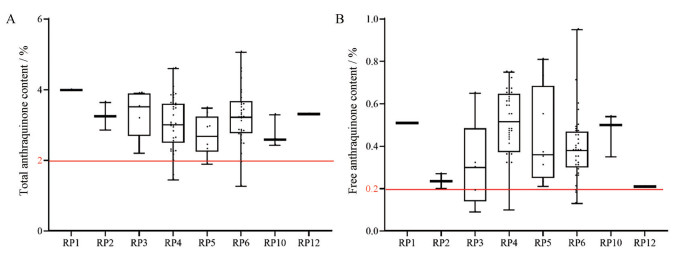
采用UPLC对大黄中游离蒽醌和总蒽醌成分(芦荟大黄素、大黄酸、大黄素、大黄酚和大黄素甲醚) 进行线性关系考察(图 5、6, 表 4、5), 结果表明游离蒽醌和总蒽醌成分相关系数R2符合分析要求。采用该方法对89份市售大黄饮片进行游离蒽醌和总蒽醌含量测定, 结果表明89份样品中83份市售大黄饮片总蒽醌和游离蒽醌含量符合药典标准, 合格率为93.26%, 其中辽宁省、内蒙古自治区、黑龙江省、广西壮族自治区和陕西省大黄饮片存在总蒽醌含量不合格情况, 北京市、云南省、安徽省、宁夏回族自治区和辽宁省大黄饮片存在游离蒽醌含量不合格情况(表 6)。市售大黄中总蒽醌的含量为1.27%~5.06%, 总蒽醌含量最高的省份是海南省, 平均值为4.59%, 含量最低的省份是广西壮族自治区, 平均值为1.98%; 市售大黄样品的游离蒽醌含量为1.10%~0.09%。游离蒽醌含量最高的省份为甘肃省, 平均值为0.81%, 含量最低的省份为宁夏回族自治区, 平均值为0.19% (图 7), 这些结果表明市售大黄样品总蒽醌和游离蒽醌含量参差不齐。实验采用SPSS 19.0对采集省份的市售大黄游离蒽醌和总蒽醌含量进行相关性分析, 发现各采集省份之间的市售大黄游离蒽醌和总蒽醌含量无显著性差别。对市售大黄8个基因型的总蒽醌含量和游离蒽醌含量进行相关性分析, 总蒽醌含量最高的基因型为Rp1, 含量最低的基因型为Rp10; 游离蒽醌含量最高的基因型为Rp4, 含量最低的基因型为Rp12 (图 8); 采用SPSS 19.0对各基因型大黄中总蒽醌和游离蒽醌含量进行相关性分析, 结果表明各基因型间大黄总蒽醌和游离蒽醌含量无显著性差别。
|
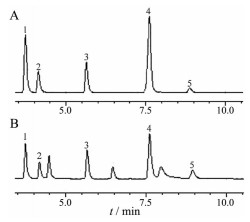
Figure 5 Free anthraquinone UPLC of mixed reference substances (A) and sample (B). 1: Aloe-emodin; 2: Rhein; 3: Emodin; 4: Chrysophanol; 5: Physcion |
|
Figure 6 Total anthraquinone UPLC of mixed reference substances (A) and sample (B). 1: Aloe-emodin; 2: Rhein; 3: Emodin; 4: Chrysophanol; 5: Physcion |
| Table 4 Regression equations of free anthraquinone |
| Table 5 Regression equations of total anthraquinone |
| Table 6 The total anthraquinone content and free anthraquinone content of commercial speciems |

|
Figure 7 Content determination of the 89 commercial Rheum samples. A: Total anthraquinone content; B: Free anthraquinone content. Red line: Standards of Pharmacopoeia of the People's Republic of China |
|
Figure 8 Content determination of the 8 haplotype (A: Total anthraquinone content; B: Free anthraquinone content). Red line: Standards of Pharmacopoeia of the People's Republic of China |
2020版《中华人民共和国药典》规定正品来源是掌叶大黄、唐古特大黄和药用大黄, 因此大黄是多基原药材[2], 有文献表明不同基原药材的药理活性不同[12, 16], 对市场上大黄的种质资源鉴定对指导临床上合理用药尤为重要。传统的药材鉴定方法无法实现对药材基原及种质的鉴别[9]。近年来, 基于DNA序列标记的中药材分子鉴定技术在中药鉴定领域得到了广泛的应用[9]。其中叶绿体基因matK、trnH/trnL等基因和核基因ITS[18]序列常用于中药材分子鉴定, 目前的研究表明matK在大黄正品及伪品鉴别、基原鉴定、种质资源鉴别过程中起到重要的作用[28, 29]。但是由于大黄是多炮制的药材, 炮制后的大黄DNA样品不易提取, PCR片段不易扩增等原因, 对大黄市场样品的种质资源的鉴定目前还未见报道。本研究首次从全国27省40市收集89份药材提取的DNA样品中扩增到matK基因的全长并进行序列分析, 令人惊奇的是, 89份来自不同省市的大黄市售样品都是同一基原, 为掌叶大黄, 共发现掌叶大黄的8个单倍型, 其中Rp4和Rp6基因型数量为36份和33份, 占样品总体40.45%和37.08%; 以前的研究结果表明Rp4基因型主要来源于云南省、甘肃省和宁夏回族自治区, 其中云南和甘肃省的大黄是栽培大黄, 宁夏回族自治区为野生大黄, RP6基因型主要是四川省的栽培大黄[9], 进化树和遗传距离分析结果表明RP4和RP6的基因型亲缘关系比较接近, 遗传距离较小; 这些实验结果表明市售大黄饮片的基原较单一, 基因型集中, 大部分可能是人工栽培的掌叶大黄。
中药质量与中药处方和制剂的临床疗效和安全息息相关, 中药的质量主要是由中药的活性成分决定的[30]。如现代药理学研究表明大黄结合蒽醌具有致泻作用[13], 游离蒽醌具有抑菌抗炎等功效[15]。《中华人民共和国药典》 (2020版) 明确规定大黄中总蒽醌的含量应不低于2.0%, 游离蒽醌的含量应不低于0.2%; 王红娟等[31]利用紫外-可见分光光度测定不同产地大黄中游离蒽醌结合蒽醌含量, 发现不同产地大黄中结合蒽醌成分含量范围为7.38%~6.15%; 游离蒽醌成分含量为0.563%~0.668%; 已有文献报道掌叶大黄和唐古特大黄质量较好, 药用大黄质量较差, 产地不同, 大黄的质量差异也比较大[32], 但是目前对市售大黄的质量研究比较少。本研究利用UPLC对市售样品的总蒽醌和游离蒽醌进行测定, 结果表明有83份样品中总蒽醌和游离蒽醌含量符合药典规定; 但是样品间总蒽醌含量和游离蒽醌的含量差异显著, 样品中游离蒽醌最高含量是1.10%, 最低含量是0.09%, 相差1.01%; 总蒽醌含量最高为5.06%, 最低为1.27%, 相差3.79%; 同时对不同采集省份的市售大黄样品的总蒽醌和游离蒽醌含量进行分析, 结果表明相同采集省份的大黄的总蒽醌和游离蒽醌的含量差异比较大, 导致地区之间没有显著性差异。对不同基因型的大黄市售样品的总蒽醌和游离蒽醌含量进行分析, 结果表明相同基因型的样品之间差异比较大, 如RP4和RP6收集的样品中, 总蒽醌最高含量是5.06%, 最低含量是1.27%; 游离蒽醌最高含量是1.10%, 最低含量是0.10%; 总蒽醌和游离蒽醌含量差异最大的基因型均是Rp4, 但是基因型之间的市售大黄的总蒽醌和游离蒽醌含量没有显著性差异。这些结果表明大部分市场销售的大黄质量符合《中华人民共和国药典》的要求, 但是样品质量参差不齐, 采集地区和基因型与大黄的质量关联性不强。本研究为后续指导大黄的市场流通和科学合理的临床用药具有重要意义。
作者贡献: 满金辉负责matK基因的扩增、序列分析和数分析; 石玥负责市场大黄样品中总蒽醌和游离蒽醌含量检测、数据分析和论文初步撰写; 张靖晗、张志飞、尹光耀负责市场大黄样品打粉、DNA提取; 王馨、刘风波和张媛负责全国各地区样品的收集; 王晓晖和魏胜利负责设计论文的实验思路, 指导学生实验, 论文撰写及修改。
利益冲突: 无相关利益冲突。
| [1] |
Li RJ, Xin TY, Song LK, et al. Research progress in original species identification in industry chain of Rhei Radix et Rhizoma[J]. China J Chin Mater Med (中国中药杂志), 2021, 46: 1060-1066. |
| [2] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Beijing: China Medical Science Press, 2020.
|
| [3] |
Lee JC, Tseng CK, Wu SF, et al. San-Huang-Xie-Xin-Tang extract suppresses hepatitis C virus replication and virus-induced cyclooxygenase-2 expression[J]. J Viral Hepatitis, 2011, 18: 315-324. |
| [4] |
Pan TL, Wang PW, Huang CH, et al. Herbal formula, Scutellariae radix and Rhei rhizoma attenuate dimethylnitrosamine-induced liver fibrosis in a rat model[J]. Sci Rep, 2015, 5: 11734. DOI:10.1038/srep11734 |
| [5] |
Shi YB, Li JC, Ren Y, et al. Pharmacokinetics and tissue distribution of emodin loaded nanoemulsion in rats[J]. J Drug Deliv Sci Technol, 2015, 30: 242-249. DOI:10.1016/j.jddst.2015.10.019 |
| [6] |
Takizawa Y, Nishimura H, Morota T, et al. Pharmacokinetics of TJ-8117(Onpi-to), a drug for renal failure (I): plasma concentration, distribution and excretion of[3H]-(-)epicatechin 3-O-gallate in rats and dogs[J]. Eur J Drug Metab Pharmacokinet, 2004, 29: 91-101. DOI:10.1007/BF03190582 |
| [7] |
Lin YC, Lu J, Lim LC, et al. Berberine-induced haemolysis revisited: safety of Rhizoma coptidis and Cortex phellodendri in chronic haematological diseases[J]. Phytother Res, 2012, 26: 682-686. DOI:10.1002/ptr.3617 |
| [8] |
Tu C, He Q, Zhou YY, et al. Metabolomic study on the hepatotoxic or hepatoprotective effects of rhubarb to normal or hepatic fibrosis rats[J]. Acta Pharm Sin (药学学报), 2018, 53: 1139-1147. |
| [9] |
Zhang XQ, Liu CS, Yan XL, et al. Sequence analysis and identification of a chloroplast matK gene in Rhei Rhizoma from different botanical origins[J]. Acta Pharm Sin (药学学报), 2013, 48: 1722-1728. |
| [10] |
Tan P, Zhang HZ, Zhang Q, et al. Simultaneous determination of 10 anthraquinone derivatives in Rhei Radix et Rhizoma based on UPLC[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 928-934. |
| [11] |
Zhang C, Li L, Xiao YQ, et al. HPLC simultaneous determination of two anthraquinone-O-glucosides in different botanical origins of rhubarb[J]. Chin J Pharm Anal (药物分析杂志), 2010, 30: 53-55. |
| [12] |
Liu J, Liu CS, Wei SL. The review of medicinal constituents and pharmacological activities of Rhei Radix et rhizoma[C]//China Association of Traditional Chinese Medicine Tenth Identification of Chinese Academic Proceedings (中华中医药学会第十届中药鉴定学术会议论文集). Xi'an: China Association of Chinese Medicine, 2010: 374.
|
| [13] |
Fu YD, Zhang J, Liu Y, et al. Analysis on bidirectional regulation of purging and astringency about raw and steamed products of Rhei Radix et Rhizoma and their active components[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2019, 25: 127-132. |
| [14] |
Takayama K, Tsutsumi H, Ishizu T, et al. The influence of rhein 8-O-β-D-glucopyranoside on the purgative action of sennoside a from rhubarb in mice[J]. Biol Pharm Bull, 2012, 35: 2204-2208. DOI:10.1248/bpb.b12-00632 |
| [15] |
Chen YY, Tang YP, Chen JQ, et al. Research progress and utilization strategy on resource chemistry of Rhei Radix et Rhizoma[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 5170-5178. |
| [16] |
Wang LX, Liu T, Hui LQ, et al. Study on antipyretic effect of rhubarb on rats and its antipyretic ingredients[J]. China J Chin Mater Med (中国中药杂志), 2020, 45: 1128-1134. |
| [17] |
Xin TY, Hui Y, Luo K, et al. Stability and accuracy of the identification of Notopterygii Rhizoma et Radix using the ITS/ITS2 barcodes[J]. Acta Pharm Sin (药学学报), 2012, 47: 1098-1105. |
| [18] |
Luo K, Ma P, Yao H, et al. Identification of gentianae Macrophyllae Radix using the ITS2 barcodes[J]. Acta Pharm Sin (药学学报), 2012, 47: 1710-1717. |
| [19] |
Yang JP, Zhu ZL, Fan YJ, et al. Comparative plastomic analysis of three Bulbophyllum medicinal plants and its significance in species identification[J]. Acta Pharm Sin (药学学报), 2020, 55: 2736-2745. |
| [20] |
Wu X, Jiang M, Chen HM, et al. Comparative analysis of three complete chloroplast genomes of Inula genus with phylogenetic analysis of 49 plants from Carduoideae[J]. Acta Pharm Sin (药学学报), 2020, 55: 288-295. |
| [21] |
Wu LW, Cui YX, Nie LP, et al. The characteristics of complete chloroplast genome sequence and phylogenetic analysis of Dendrobium moniliforme[J]. Acta Pharm Sin (药学学报), 2020, 55: 1056-1066. |
| [22] |
Zhang MY, Wang XF, Gao J, et al. Complete chloroplast genome of Paeonia mairei H. Lév.: characterization and phylogeny[J]. Acta Pharm Sin (药学学报), 2020, 55: 168-176. |
| [23] |
Zhang MY, Zhang YQ, Li YM, et al. Complete plastid genomes of Bupleurum chinense DC. and B. boissieuanum H.Wolff, with comparative and phylogenetic analyses of medicinal Bupleurum species[J]. Acta Pharm Sin (药学学报), 2021, 56: 618-629. |
| [24] |
Liu J, He T, Chun Z. Analysis and authentication of chloroplast matK gene sequences of Herba Dendrobii[J]. Acta Pharm Sin (药学学报), 2009, 44: 1051-1055. |
| [25] |
Liu YP, Cao H, Han GR, et al. matK and its nucleotide sequencing of crude drug chuanxiong and phylogenetic relationship between their species from China and Japan[J]. Acta Pharm Sin (药学学报), 2002, 37: 63-68. |
| [26] |
Yan YG, Yin LM, Wang HY, et al. HPLC method for simultaneous determination of nine components from leaves of Rheum officinale by HPLC[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 2360-2364. |
| [27] |
Bian L, Dou ZH, Wang DD, et al. Improvement of determination method of total anthraquinone in Rhei Radix et Rhizoma in Pharmacopoeia of the People's Republic of China[J]. Int J Tradit Chin Med (国际中医中药杂志), 2021, 43: 156-160. |
| [28] |
Yang DY, Fushimi H, Cai SQ, et al. Molecular analysis of Rheum species used as Rhei Rhizoma based on the chloroplast matK gene sequence and its application for identification[J]. Biol Pharm Bull, 2004, 27: 375-383. DOI:10.1248/bpb.27.375 |
| [29] |
Yang DY, Fushimi H, Cai SQ, et al. Polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP) and amplification refractory mutation system (ARMS) analyses of medicinally used Rheum species and their application for identification of Rhei Rhizoma[J]. Biol Pharm Bull, 2004, 27: 661-669. DOI:10.1248/bpb.27.661 |
| [30] |
Liu Y, Nie Q, Chen J. Suggestions to strengthen quality management of herbal decoction pieces-based on production chain of herbal decoction piece[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 3319-3322. |
| [31] |
Wang HJ, Wang F, Lv XX, et al. Determination of free anthraquinone and bound anthraquinone in Rhubarb from different producing areas[J]. Chin J Tradit Med Sci Technol (中国中医药科技), 2021, 28: 213-224. |
| [32] |
Komatsu K, Nagayama Y, Tanaka K, et al. Comparative study of chemical constituents of Rhubarb from different origins[J]. Chem Pharm Bull, 2006, 54: 1491-1499. DOI:10.1248/cpb.54.1491 |
 2022, Vol. 57
2022, Vol. 57


