2. 上海康桥中药饮片有限公司, 上海 201315;
3. 云南省农业科学院高山经济植物研究所, 云南 丽江 674100
2. Shanghai Kangqiao Chinese Herbal Pieces Co., Ltd., Shanghai 201315, China;
3. Institute of Alpine Economic Plants, Yunnan Academy of Agricultural Sciences, Lijiang 674100, China
中药诸品种基原的多样性及药材道地性是中药鲜明特色之一, 具有丰富的中医药文化及科学内涵。同时, 种质来源、药材产地及其产出药材的加工炮制方法, 是临床优质药材(饮片) 生产的基本要素。秦艽为多来源品种, 基原涉及龙胆科龙胆属秦艽组(Sect. Cruciata) 秦艽Gentiana macrophylla Pall.、麻花秦艽G. straminea Maxim.、粗茎秦艽G. crassicaulis Duthie ex Burk.或小秦艽G. dahurica Fisch. 4种植物, 根入药, 可祛风湿, 清湿热, 止痹痛, 退虚热[1]。上述植物形态彼此相近而不同, 花色亦有蓝紫色及黄白色之分, 加之各物种自然分布区有所不同, 取4种植物根部做临床中药秦艽入药, 药效学的一致性如何, 是一个必需回答的科学问题。同时, 各物种自然分布区或不同栽培区内, 地理种群(栽培品系) 生长小生态环境多样, 同一物种内个体形态变化及药效学差异程度与具体产地的相关性如何(道地性), 是值得深入探讨的又一科学问题。
秦艽基原植物之一——粗茎秦艽G. crassicaulis Duthie ex Burk., 我国特有物种, 自然分布区广泛, 涉及西藏、云南、四川、贵州、青海及甘肃等省区, 多见于海拔2 100~4 500 m的高山草甸、林下及林缘[2]。云南丽江为粗茎秦艽的模式标本产地[2], 同时, 该地区具有悠久的规模化栽培生产(粗茎) 秦艽药材的历史[3]。课题组前期开展了秦艽组(Sect. Cruciata) 秦艽G. macrophylla Pall.、麻花秦艽G. straminea Maxim.、粗茎秦艽G. crassicaulis Duthie ex Burk.及小秦艽G. dahurica Fisch.等多种植物的遗传背景分析及生药学研究工作[4-14], 在此基础上, 拟进一步聚焦丽江产秦艽的溯源及品质评价工作, 确定试验样地, 种质分类学鉴定; 鉴于中药材加工炮制方法是影响其质量的重要因素, 并设置产地及饮片厂药材加工组别, 评价道地药材不同初加工方法, 构建具有种下不同产地特征的DNA条形码, 以期为生产临床质量稳定且优的秦艽药材(饮片)、多来源中药品种的科学评价及道地药材溯源及生产等提供科学资料。
材料与方法试验样地 在丽江市玉龙县粗茎秦艽传统种植区域选择试验样地一块(图 1)。

|
Figure 1 A: A bird's eye view of sampling plot; B: Sampling plot; C: Plot sampling; D: Corolla with stamens and pistil (Zhao ZL, et al 2020YN001, cultivated in Lijiang, scale bar = 1 mm); E: Habit (Zhao ZL, et al 2020YN001); F: Habit (Zhao ZL, et al 2020YN005, alt. 3 090 m, yulong, Lijiang); G: Corolla with stamens and pistil (Zhao ZL, et al 2020YN005, scale bar = 1 mm) |
原药材基原植物分类学鉴定 试验样地已种植3年生粗茎秦艽药材, 采集样地栽培植物花期标本, 采集日期: 2020年8月20日, 采集号: 赵志礼、张玉萱等2020YN001。另确定当地栽培环境相近的二年生粗茎秦艽种植地一块, 采集二年生栽培植株标本, 采集日期: 2020年8月20日, 采集号: 赵志礼、张玉萱等2020YN003。同时, 考察并采集丽江粗茎秦艽野生居群样本, 样点: 丽江市玉龙县白沙镇, 山坡草地, 海拔3 090 m, 采集日期: 2020年8月21日, 采集号: 赵志礼、张玉萱等2020YN005 (图 1, 表 1)。凭证标本均经植物分类学鉴定后存放于上海中医药大学中药学院药物植物标本室。
| Table 1 Voucher specimens from different populations of G. crassicaulis. -: Same as above; N: No |
原药材初加工方法 2020年12月3~4日试验样地三年生药材采挖; 同时取二年生粗茎秦艽药材适量做对比, 产地与饮片厂分别加工处理。干燥方式为自然晾晒或加热烘干(温度不高于45 ℃); 炮制加工方法: ①发汗处理或不经发汗处理; ②切片或不切片; ③饮片厂加工处理时, 去芦头。实验分组情况: 饮片厂处理: 晾晒组(原个子, 切片)、烘干组(原个子, 切片)、发汗组(原个子, 切片)。产地处理: 三年生晾晒组(原个子, 切片)、三年生烘干组(原个子, 切片)、二年生烘干组(原个子)。所有样品含水量均低于10%, 入饮片厂常温药材库房贮藏备用。详见表 2。
| Table 2 Information of sample processing. -: Same as above; Y: Yes; N: No |
丽江产药材的DNA条形码 为确保溯源工作的准确性及可操作性, 构建粗茎秦艽物种DNA条形码(另文发表) 及云南丽江产粗茎秦艽DNA条形码。步骤: ①基于课题组前期已获得粗茎秦艽自然分布区8个样点标本及丽江栽培植株标本的叶绿体基因组9条完整序列(GenBank登录号见表 1), 筛选出位于trnC-GCA-petN、atpB-rbcL、psbN、ndhB-rps7及ycf1片段上的鉴定位点。②取上述丽江试验样地A~K各药材样品, 各平行制备3份, 2020YN005丽江野生植物3株, 分别测定相关序列; 同时, 再分别制备西藏、四川、青海、甘肃、贵州、云南丽江栽培品及野生样品各2份(前期已获得各自相关序列1组, 总计3份), 测序进行验证, 以构建丽江产药材的DNA条形码; 引物见表 3, 样品及相关序列GenBank登录号等见表 1、2。
| Table 3 PCR primer sequence |
药品与试剂 对照品龙胆苦苷(批号Y30J9Q66926)、马钱苷酸(批号K17S11B124207), 獐牙菜苦苷(批号Y25J10H91429)、獐牙菜苷(批号P25010F101344)、6′-O-β-D-葡萄糖基龙胆苦苷(批号P07D9S76867), 质量分数均 > 98%, 购于上海研谨生物科技有限公司; 乙腈和冰醋酸为色谱纯, 其他试剂为分析纯, 购自国药集团化学试剂有限公司。
不同方法处理后各组药材的指标性成分含量测定 参考《中国药典》秦艽项下相关方法[1]进行指标性成分含量测定。
HPLC指纹图谱构建 供试品溶液制备: 各组样品粉碎后过三号筛, 具体步骤参考相关文献[1]; 各组样品分别平行制备3份供试品溶液。混合对照品溶液制备: 精密称取马钱苷酸、龙胆苦苷、6′-O-β-D-葡萄糖基龙胆苦苷、獐牙菜苦苷和獐牙菜苷5种对照品适量, 分别加甲醇溶解。各吸取上述对照品母液适量, 加甲醇制成含马钱苷酸0.228 4 mg·mL-1、龙胆苦苷0.642 4 mg·mL-1、6′-O-β-D-葡萄糖基龙胆苦苷0.123 6 mg·mL-1、獐牙菜苦苷0.091 2 mg·mL-1、獐牙菜苷0.020 04 mg·mL-1的混合对照品溶液。色谱条件: 参考课题组前期工作[15]。指纹图谱分析: 精密吸取混合对照品溶液10 μL, 注入液相色谱仪, 每个样品重复2次进样检测, 进样量均为10 μL。中药指纹图谱相似度系统评价软件(2012A) 对样品的HPLC色谱图进行分析。
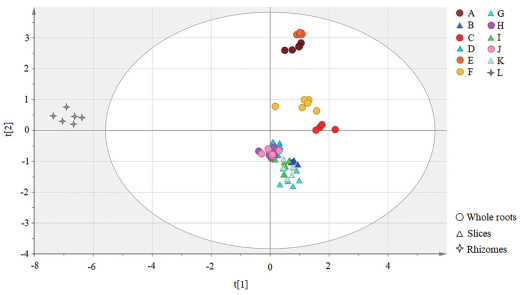
主成分分析(PCA) 将所有样品数据共有峰的相对峰面积作为变量导入SIMCA 14.1统计软件进行PCA建模, 提取出2个贡献率较大的主成分, 解释了原始数据的80.4%, 以此2个新变量对样品进行分析。
结果 1 试验样地的确定丽江鲁甸乡拉美荣确定长方形样地一块, 海拔2 858 m, 地理坐标N27°9.513′, E99°29.055′, 面积约450 m2; 已种植粗茎秦艽(三年生)。
2 药材基原植物分类学位置经查阅模式标本、参考相关分类学文献并进行分类学鉴定, 丽江鲁甸乡拉美荣试验样地栽培植物及丽江野生居群标本的系统学位置: 龙胆科龙胆属Gentiana秦艽组Sect. Cruciata粗茎秦艽Gentiana crassicaulis Duthie ex Burk.。
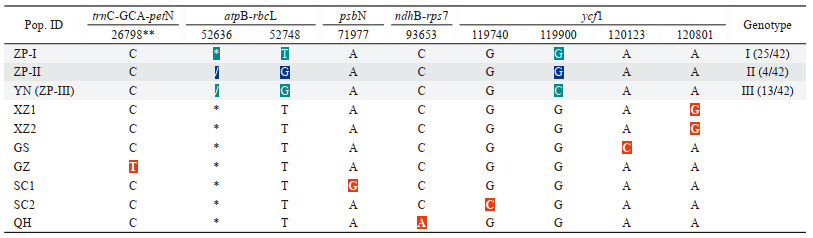
3 种下不同产地样品DNA条形码的构建共得到trnC-GCA-petN、atpB-rbcL、psbN、ndhB-rps7及ycf1相关序列: 丽江试验样地A~K各药材样品, 2020YN005丽江野生植物(平行3份), 36组180条; 另测定西藏、四川、青海、甘肃、贵州、云南丽江栽培品及野生粗茎秦艽样品(平行2份), 18组90条; 共计: 270条相关序列。结合课题组前期获得的粗茎秦艽自然分布区8个样点标本及丽江栽培植株标本的叶绿体基因组9条完整序列(GenBank登录号见表 1) 资料, 结果显示: 6个丽江产野生粗茎秦艽样本, 序列相互一致, 且在atpB-rbcL具一11 bp长度的特征性缺失, 与粗茎秦艽分布区内其他植株明显不同; 36个丽江产粗茎秦艽栽培品样本, 分3个基因型, 其中Ⅲ型与野生居群共享(表 4)。由此构建云南丽江产粗茎秦艽(野生与栽培品) 的DNA条形码(图 2)。
| Table 4 SNPs in plastid genomes of G. crassicaulis and genotypes in populations from Lijiang. * GCTATTTAGAT; / del; ** locus. ZP: Cultivated in Lijiang, Yunnan; YN: Lijiang, Yunnan; XZ1: Changdu, Tibet; XZ2: Dingqing, Tibet; GS: Maqu, Gansu; GZ: Weining, Guizhou; SC1: Kangding, Sichuan; SC2: Daofu, Sichuan; QH: Banma, Qinghai |

|
Figure 2 DNA barcoding for Yunnan populations of G. crassicaulis |
各组内马钱苷酸、龙胆苦苷含量的RSD值均分别 < 3%。按干燥品计算各组样品中指标性成分的含量见表 5。结果显示, 各组马钱苷酸、龙胆苦苷的总含量均大于《中国药典》规定的2.5%; 其中芦头组的总含量相对最低, 但也高达4.506%, 其中马钱苷酸的含量仅为0.410%; 其次为二年生的样品, 总含量为7.32%, 其中龙胆苦苷的含量小于5%, 低于所有三年生药材; 其余各组的总含量均大于8%, 龙胆苦苷的含量均在5%以上。所有组别中, 总含量最大的是发汗切片组(I)。与产地加工相比, 饮片厂加工样品的总含量整体稍高, 可能与其去除芦头有关。
| Table 5 Content of loganic acid and gentiopicroside (%, n = 3) |
将各组数据分别导入中药指纹图谱相似度系统评价软件(2012A) 进行分析, 时间窗宽度为0.3 s, 采用多点校正后进行自动匹配, 获得A~L组参照指纹图谱, 并依据各组参照指纹图谱生成共有模式, 确定9个共有峰(图 3)。将所有数据用相同方法获得整体共有模式, 同样可确定该9个共有峰。通过对照品定位, 指认其中2号峰为马钱苷酸、4号峰为獐牙菜苦苷、5号峰为6′-O-β-D-葡萄糖基龙胆苦苷、6号峰为龙胆苦苷、7号峰为獐牙菜苷(图 3)。将共有峰的相对峰面积进行相似度评价, 各组内相似度均大于0.999; 各组参照指纹图谱与共有模式相比, 芦头组(L) 为0.973, 二年生组(E) 为0.994, 其余各组均≥ 0.997。

|
Figure 3 HPLC fingerprints of 12 batches of samples, common modeling (R) and mixed reference substances. (2: Loganic acid; 4: Swertiamarine; 5: 6′-O-β-D-Glucosylgentiopicroside gentiopicroside; 6: Gentiopicroside; 7: Swertiamarin) |
PCA得分图见图 4。结果显示, 芦头组(L) 为单独一类; 所有切片样品聚为一簇; 而原个子样品分布较为分散。
|
Figure 4 PCA score plot of samples |
植物物种在形成与进化过程中, 不断应对环境胁迫; 同时, 物种自然分布区内多样的地形地貌、地理种群间小生态环境的差异性及植株的适应性应答等, 使道地药材形成成为可能。道地药材是人们传统公认且来源于特定产地的名优正品药材, 进一步揭示中药材道地性的科学内涵, 有许多工作要做[16]。
秦艽基原植物之一——粗茎秦艽G. crassicaulis, 我国西南及西北为其自然分布区。云南丽江具有悠久的规模化栽培生产(粗茎) 秦艽药材的历史。本文在云南丽江栽培品、野生样品植物系统学位置溯源基础上, 对云南丽江粗茎秦艽道地药材遗传背景进行分析, 其栽培品分出3个基因型, 其中III型与野生居群共享。推断当地长期对野生种质栽培驯化, 栽培品系出现分化, 在遗传背景方面得到一定体现。下一步, 可开展不同基因型或品系之间的转录组与代谢组学等分析, 为揭示道地药材的科学内涵以及优质种质选育提供更为有力的证据。同时, 进一步扩大样品量, 验证、完善丽江产粗茎秦艽(野生与栽培品) 的DNA条形码方法, 使其在该药材生产、流通及临床应用中发挥应有的作用。
中药材的科学炮制与加工, 对临床药材的增效、减毒作用不言而喻。目前, 2020年版《中国药典》粗茎秦艽的加工炮制方法较为笼统: “鲜原药材-去泥沙-发汗或否-晒干; 干燥原药材洗净-润透-切厚片-干燥”[1]。有报道, 秦艽药材中龙胆苦苷的保存量趁鲜清洗高于先干燥后清洗[17], 干燥温度保持100 ℃, 龙胆苦苷的损失量最小[18]。同时, 不同加工方法对药材整体化学谱的影响, 尚需要深入探讨。本文开展产地、饮片厂分别加工炮制, 分组比较工作, 结果显示, 纯芦头组马钱苷酸、龙胆苦苷总量低于饮片厂去芦头各组样品近50%, 其中马钱苷酸含量相对极低, 两种成分的比例为0.10; 而去芦头各组样品为0.37~0.45。由于产地各组样品均未去除芦头, 因此, 其各组样品的总量多低于饮片厂去芦头的各组样品。为提升药材品质, 建议将“去芦头”步骤列入粗茎秦艽道地药材的加工方法中。另外, 饮片厂发汗切片组, 马钱苷酸、龙胆苦苷总量为各组之首, 其成因值得进一步探讨。
PCA分析中, 无论是否发汗处理、干燥方式如何, 切片各组均聚为一簇, 而原个子各组(完整根) 散在分布。推测, 药材采挖后, 趁鲜切制, 干燥, 次生代谢产物谱的稳定性较好。
云南丽江产粗茎秦艽药材的生产模式常为一年育苗, 二年或三年采收药材。就二年生与三年生所测药材样品而言, 其指标性成分含量均高于《中国药典》标准; 指纹图谱亦显示两者之间次生产物的高度相似性。因此, 可视栽培成本及市场价格波动等具体情况, 适时采挖。
作者贡献: 季文静、张玉萱是本文的共同第一作者, 负责分子生物学实验、药材品质评价工作及稿件撰写; 李尉涛承担部分分子生物学实验; 竺琛欣、陈翔负责原药材饮片厂初加工处理工作; 杨少华负责原药材产地初加工处理工作; 赵志礼、倪梁红为本文的共同通讯作者, 负责样品采集、分类学鉴定, 研究工作总体设计及稿件修改等工作。
利益冲突: 本文的研究内容无任何利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China: Vol I (中华人民共和国药典: 一部)[S]. Beijing: China Medical Science Press, 2020: 282.
|
| [2] |
Ho TN. Gentianaceae in Flora Reipublicae Popularis Sinicae: Vol 62(中国植物志: 62卷)[M]. Beijing: Science Press, 1988: 67-68.
|
| [3] |
Zhang M, Fang QM, Zhou XJ. Survey of Gentiana crassicaulis resources in Qinghai-Xizhang plateau[J]. Resour Devel Market (资源开发与市场), 2014, 30: 448-450. |
| [4] |
Zhao ZL, Dorje Gaawe, Wang ZT. Identification of medicinal plants used as Tibetan traditional medicine Jie-Ji[J]. J Ethnopharmacol, 2010, 132: 122-126. DOI:10.1016/j.jep.2010.07.051 |
| [5] |
Ni LH, Zhao ZL. A morphometric comparison of three closely related species of Gentiana (Gentianaceae), endemic to the region of the Qinghai-Tibet Plateau[J]. Botany, 2018, 96: 209-215. DOI:10.1139/cjb-2017-0166 |
| [6] |
Ni LH, Zhao ZL, Xu HX, et al. Chloroplast genome structures in Gentiana (Gentianaceae), based on three medicinal alpine plants used in Tibetan herbal medicine[J]. Curr Genet, 2017, 63: 241-252. DOI:10.1007/s00294-016-0631-1 |
| [7] |
Ni LH, Zhao ZL, Xiong B, et al. A strategy for identifying six species of Sect. Cruciata (Gentiana) in Gansu using DNA barcode sequences[J]. Acta Pharm Sin (药学学报), 2016, 51: 821-827. |
| [8] |
Lu JN, Zhao ZL, Ni LH, et al. The identification of Sect. Cruciata (Gentiana) species using mtDNA nad1/b-c and nad5/d-e fragments[J]. Acta Pharm Sin (药学学报), 2019, 54: 166-172. |
| [9] |
Zong FF, Zhao ZL, Ni LH, et al. DNA fingerprinting and genetic diversity in a threatened alpine medicinal plant, Gentiana crassicaulis (Gentianaceae) using AFLP[J]. Acta Pharm Sin (药学学报), 2020, 55: 1941-1950. |
| [10] |
Kang H, Zhao ZL, Ni LH, et al. Transcriptome analysis and exploration of genes involved in the biosynthesis of iridoids in Gentiana crassicaulis (Gentianaceae)[J]. Acta Pharm Sin (药学学报), 2021, 56: 2005-2014. |
| [11] |
Wang L, Zhao ZL, Ni LH, et al. Assessment of genetic diversity on Gentiana straminea based on ISSR markers[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 3168-3174. |
| [12] |
Wang YY, Zhao ZL, Wu JR, et al. HPLC fingerprint of Radix Gentianae crassicaulis[J]. Chin Tradit Herb Drugs (中草药), 2009, 40: 120-123. |
| [13] |
Xiong B, Zhao ZL, Ni LH, et al. DNA-based identification of Gentiana robusta and related species[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 4680-4685. |
| [14] |
Gu CY, Zhao ZL, Wu JR, et al. Pharmacognostical study on Gentiana lhassica Burk. and Gentiana waltonii Burk[J]. Chin J Inf Tradit Chin Med (中国中医药信息杂志), 2010, 17: 41-43. |
| [15] |
Li QF, Wu JR, Zhao ZL, et al. HPLC fingerprint of Radix Gentianae Stramineae from Ruoergai, Sichuan[J]. Chin J Inf Tradit Chin Med (中国中医药信息杂志), 2012, 19: 49-51. |
| [16] |
Xiao XH, Chen SL, Huang LQ, et al. Survey of investigation on Daodi Chinese medicinal materials in China since 1980s[J]. China J Chin Mater Med (中国中药杂志), 2009, 34: 519-523. |
| [17] |
Zhang WY, Li JA, Yang TS, et al. Effect of different preprocessing method on the contents of gentiopicroside in planting Gentiana (Radix Gentianae Macrophyllae)[J]. Chin Hosp Pham J (中国医院药学杂志), 2009, 29: 724. |
| [18] |
Gao J, Wang YZ, Sun WJ. Influence of baking conditions on gentiopicroside content in Gentiana nacrophylla[J]. J Northwest Univ (Nat Sci Edit) (西北大学学报-自然科学版), 2006, 36: 257. |
 2022, Vol. 57
2022, Vol. 57