世界卫生组织调查数据显示, 全球约有4.5亿精神健康障碍患者, 截止到2015年, 全世界患有抑郁症的人数已经远远超过3亿[1]。精神障碍是严重慢性精神疾病且复发率高。缩宫素(oxytocin, OT) 是一种环状的九肽分子, 近年来, 国内外临床研究表明OT在精神疾病方面具有治疗效果[2-5]。国内市售的OT鼻喷雾剂(oxytocin nasal spray)——奥赛托星®经鼻给药后可经鼻黏膜迅速吸收而进入血液循环系统, 但在脑内摄取率低。为发挥OT在精神疾病治疗方面潜力, 应提高其在脑内的蓄积。对于脑部递送药物, 血脑屏障(blood brain barrier, BBB) 会限制大分子多肽蛋白类药物进入脑内发挥治疗作用, 而经鼻给药能够绕过BBB, 将药物直接递送至大脑[6]。但多肽类极性药物的黏膜渗透能力差、因鼻黏液的更新而被清除[7]或在鼻腔中易被酶降解, 因此, 经鼻入脑的药量仍然很低[8]。幸运的是, 纳米递药系统能够有效保护多肽蛋白类药物避免酶降解, Zaman等[9]制备了负载OT的PLGA纳米粒, 旨在经鼻入脑递送。但若要显著提高治疗效果, 仍需克服鼻黏膜屏障对纳米粒的阻碍[10]。
细胞穿膜肽(cell-penetrating peptides, CPP) 是一类可介导生物大分子或药物载体进入细胞的短肽, CPP修饰策略可以有效提高药物的胞内递送效率[11]。研究表明, CPP在经鼻入脑给药中可显著增加纳米载体在嗅上皮的渗透能力[12]。转录激活因子穿膜肽(trans-activator of transcription, TAT) 修饰胶束经鼻递送喜树碱入脑治疗脑胶质瘤, 显著提高脑内浓度, 有效延长荷瘤小鼠的中位生存期[13]。可见, CPP在促进大分子经鼻入脑递送方面非常有潜力。脂质体(liposomes) 在经鼻入脑给药具有良好的应用前景, 可较好地透过血脑屏障[14, 15], 且经CPP修饰后可有效提高脑部分布[16]。
本文以脂质体包载水溶性多肽药物OT (OT@LPs), 并以阳离子型细胞膜穿透性寡肽——八聚精氨酸(arginine octamer, R8) 进行表面修饰显著提高脂质体表面电位, 以增强的静电吸引力与表面荷负电的鼻黏液相互作用提高其生物黏附性[17]以延长其鼻腔滞留时间。由此构建新型经鼻入脑递释系统(OT@LPs-R8), 对其理化性质进行表征, 并初步评价其经鼻入脑的能力。
材料与方法药品与试剂 OT (上海苏毫亿明制药有限公司); 胆固醇、蛋黄卵磷脂(大连美仑生物技术有限公司); 水溶性近红外染料胺活性琥珀酰亚胺酯(cyanine 7 NHS ester, Cy7-NHS, 纯度 > 95%, 西安瑞禧生物科技有限公司); 二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000 (1, 2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000], DSPE-PEG2000)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000-马来酰亚胺(1, 2-distearoyl-sn-glycero-3-phosphoethanolamine-N- [methoxy(polyethylene glycol)-2000]-maleimide, DSPE-PEG2000-Mal) (上海艾韦特医药科技有限公司); 半胱氨酸-八聚精氨酸(cysteine-arginine octamer, Cys-R8, 纯度 > 98%, 吉尔生化有限公司); 葡聚糖凝胶G50 (南京森贝伽生物科技有限公司); 其他试剂均为分析纯。
仪器 核磁共振仪(Varian 400 MHz, 美国Palo Alto公司); Zetasizer激光粒度仪(英国马尔文公司); 岛津高效液相色谱仪(LC-20AT, 日本岛津有限公司); ZORBAX SB-C18色谱柱[250 mm × 4.6 mm, 5 μm, 安捷伦科技(中国) 有限公司]; 透射电镜(FEI Tencnai G2 F20 S-TWIN, 美国FEI公司); 活体光学成像系统[IVIS Lumina S5, 铂金艾尔墨(上海) 有限公司]。
实验动物 实验小鼠(ICR小鼠) 购于上海斯莱克实验动物有限责任公司, 合格证号SCXK (沪) 2017-0005, 小鼠饲养于复旦大学药学院SPF级动物中心, 动物实验符合复旦大学实验动物科学部关于动物实验伦理的规定, 并在通过复旦大学动物伦理委员会审查后进行。
DSPE-PEG2000-R8材料的合成与表征 通过DSPE-PEG2000-Mal的马来酰亚胺与Cys-R8末端半胱氨酸的巯基共价连接合成DSPE-PEG2000-R8。具体方法: 精密称取DSPE-PEG2000-Mal 50 mg和Cys-R8 35 mg, 以10 mL去离子水溶解, 室温下以磁力搅拌器温和搅拌6 h。将反应液以去离子水透析3天(透析袋截留分子量1 500 Da) 以除去反应液中过量的Cys-R8, 冷冻干燥即得DSPE-PEG2000-R8。将DSPE-PEG2000-Mal和合成产物DSPE-PEG2000-R8分别溶解在氘代氯仿中, 以核磁共振仪扫描检测验证产物。
R8修饰的缩宫素脂质体(OT@LPs-R8)的制备 以逆向蒸发法制备包封水溶性多肽OT的脂质体[18], 精密称取胆固醇75 mg、蛋黄卵磷脂270 mg和DSPE-PEG2000 30 mg, 以10 mL氯仿溶解得有机相; 精密称取OT 30 mg以2 mL的低渗的磷酸盐缓冲液(phosphate buffered saline, PBS, pH 5.6) 溶解得到水相; 将水相注入有机相中, 以50 W探头超声5 min得到稳定不分层的油包水(W/O) 型乳液; 于40 ℃水浴中负压旋转蒸发除去有机溶剂, 补充低渗PBS (pH 5.6) 溶液8 mL于60 ℃水合40 min; 以100 W探头超声5 min进行整粒; 过葡聚糖G50凝胶柱层析法[19]以除去游离药物, 得到缩宫素脂质体(OT@LPs)。
将磷脂膜材更换为蛋黄卵磷脂270 mg、DSPE-PEG2000 24 mg和DSPE-PEG2000-R8 6 mg, 其他处方和工艺步骤同上, 最终制得R8修饰的缩宫素脂质体(OT@LPs-R8)。
OT@LPs-R8的理化性质表征
粒径分布及表面电位 取一定体积的OT@LPs和OT@LPs-R8溶液, 以去离子水稀释至适宜浓度分别置于粒径池和电位池中, 于25 ℃下以激光粒度仪测定其粒径和zeta电位。
形态学考察 取OT@LPs和OT@LPs-R8溶液各100 μL, 分别以去离子水稀释10倍后, 吸取10 μL稀释后的样品置于铜网上, 静置10 min后用滤纸吸去铜网上多余的样品, 室温下干燥, 在透射电子显微镜下观察其形态并拍照。
载药量和包封率 将OT@LPs和OT@LPs-R8冻干后, 精密称取一定量的冻干粉末, 乙腈溶解后过0.22 μm有机膜过滤, 以高效液相色谱法测定样品中OT的含量。检测波长为220 nm, 流动相: A相为0.13 mol·L-1 NaH2PO4, B相为体积分数50%的乙腈溶液, 流速: 1 mL·min-1, OT的保留时间为9.58 min。按照表 1的梯度设定流动相体积。按公式(1) 和(2) 分别计算脂质体的载药量(drug loading, DL) 和包封率(encapsulation efficiency, EE):
| $ \mathrm{D}\mathrm{L}\mathrm{\%}=\frac{{W}_{1}}{{W}_{0}}\times 100 $ | (1) |
| $ \mathrm{E}\mathrm{E}\mathrm{\%}=\frac{{W}_{1}}{{W}_{2}}\times 100 $ | (2) |
| Table 1 Gradient of mobile phase for the analysis of oxytocin (OT). A: 0.13 mol·L-1 NaH2PO4; B: 50% Acetonitrile |
其中, W0为脂质体总质量; W1为脂质体中OT质量; W2为处方中OT的投料量。
稳定性 据文献[20]报道鼻腔内的温度为28~34 ℃, 一般采用30 ℃模拟鼻腔温度, 鼻腔环境pH 6.3~6.7, 一般采用pH 6.6模拟鼻腔环境pH[20]。将脂质体与等体积pH 6.6的PBS混合, 于30 ℃恒温水浴8 h, 于0、2、4、6和8 h取样检测其粒径、多分散系数(polydispersity index, PDI) 及包封率。
体外释放特性
OT体外释放特性 以透析袋法考察其体外释药特性。将OT直接溶解在去离子水中以制备OT游离药(OT-S); 分别取OT@LPs、OT@LPs-R8及等量的OT-S各2 mL, 平行3份, 放置于预先处理好的透析袋(截留分子量3 500 Da) 内, 释放介质为pH 6.6 PBS 50 mL, 于30 ℃水浴中100 r·min-1温和振荡, 在预定的时间点0.5、1、2、4、6、8和10 h各取样1 mL, 同时补充等体积预热PBS以保持体积固定。取出的样品以表 1所述的液相条件进样, 检测OT浓度, 计算并绘制其药物累积释放曲线。
Cy7体外释放特性 将50 µg水溶性荧光探针Cy7-NHS与30 mg OT一同溶解于2 mL低渗PBS中得到水相, 按照前述的制备工艺, 制备Cy7标记的OT脂质体(Cy7-OT@LPs和Cy7-OT@LPs-R8)。
以透析袋法考察Cy7从脂质体内释放特性以证明Cy7标记的脂质体施用到小鼠体内时, 其荧光信号的强弱及位置可代表OT。将OT和Cy7-NHS直接溶解在去离子水中以制备OT游离药(Cy7-OT-S); 分别取Cy7-OT@LPs、Cy7-OT@LPs-R8及等量的OT-S各2 mL, 平行3份, 放置于预先处理好的透析袋(截留分子量3 500 Da) 内, 释放介质为pH 6.6 PBS 50 mL, 于30 ℃水浴中避光条件下100 r·min-1温和振荡, 在预定的时间点0.5、1、2、4、6、8和10 h各取样1 mL, 同时补充等体积预热PBS以保持体积固定。以荧光分光光度计于激发波长750 nm, 发射波长773 nm下测定各样品中Cy7的荧光信号强度, 并绘制Cy7释放曲线。
以GraphPad Prism软件分析OT和Cy7从不同制剂中的释放特性的相关性。
OT@LPs-R8的脑靶向性初步评价
鼻黏膜刺激性 将雄性ICR小鼠随机分为5组, 每组3只。第1组小鼠鼻腔给予生理盐水; 第2组大鼠鼻腔给予1%十二烷基硫酸钠(sodium dodecyl sulfate, SDS) 溶液; 其余3组小鼠分别给予OT-S、OT@LPs和OT@LPs-R8。每日均给药2次, 每个鼻孔10 µL, 连续7天。最后一次给药24 h后处死小鼠, 将带上皮细胞膜的鼻中隔与骨小心分离。分离出的组织样本以4%多聚甲醛固定, 切片机切片, 苏木精-伊红(HE) 染色, 光学显微镜下观察形态。
鼻腔滞留性 按照前述方法制备Cy7标记的各组脂质体。ICR小鼠随机分成3组, 分别给予含同等浓度Cy7的Cy7-OT-S、Cy7-OT@LPs和Cy7-OT@LPs-R8, 每组3只, 腹腔注射8%水合氯醛麻醉, 每个鼻孔给药10 µL。分别在给药后0、1、2、4、6和8 h以近红外荧光活体成像仪于激发波长750 nm, 发射波长773 nm采集荧光信号并进行半定量分析。
体内分布 ICR小鼠随机分成3组, 分别给予含同等浓度Cy7的Cy7-OT-S、Cy7-OT@LPs和Cy7-OT@LPs-R8, 每组3只, 给药20 µL, 每个鼻孔10 µL。鼻腔给药2 h后, 处死小鼠, 收集心、肝、脾、肺、肾和脑等重要脏器组织, 收集的组织样品用以近红外荧光活体成像仪采集荧光信号并进行半定量分析。
统计学分析 实验数据以平均值±标准差表示, 以GraphPad Prism8.0软件采用t检验分析比较各组数据, P < 0.05时被认为具有统计学意义。
结果与讨论 1 DSPE-PEG2000-R8材料的合成与表征反应物DSPE-PEG2000-Mal和反应产物DSPE-PEG2000-R8的1H-NMR图谱如图 1所示。比较两种物质的氢谱图可见, DSPE-PEG2000-Mal图谱中的马来酰亚胺基团的特征峰(δ 7) 在DSPE-PEG2000-R8的图谱上不存在。结果表明, DSPE-PEG2000-Mal上的马来酰亚胺基团和Cys-R8上的巯基反应完全, 成功得到了R8修饰的功能化材料DSPE-PEG2000-R8。
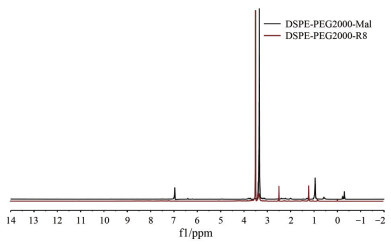
|
Figure 1 NMR spectrum of 1, 2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000]-maleimide (DSPE-PEG2000-Mal) and 1, 2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000]-maleimide-arginine octamer (DSPE-PEG2000-R8) |
以动态光散射法测定脂质体的粒径分布情况, 如图 2和表 2所示, OT@LPs的粒径分布在98 nm左右, 表面呈电中性; OT@LPs-R8的粒径分布在110 nm左右, 表面电位高达+18.4 mV。经R8修饰后OT脂质体的粒径变化不大, 但电位显著提高, 表明R8成功修饰在脂质体表面。
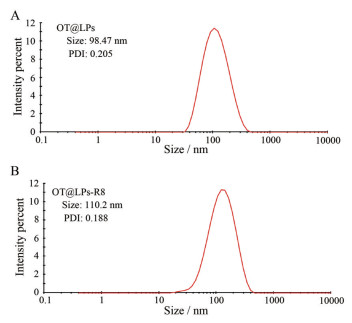
|
Figure 2 Particle size distribution of oxytocin loaded liposomes (OT@LPs, A) and arginine octamer (R8) modified oxytocin loaded liposomes (OT@LPs-R8, B). PDI: Polydispersity index |
|
Table 2 Physicochemical properties of OT@LPs and OT@LPs-R8. n = 3, |
透射电镜图(图 3) 显示, OT@LPs和OT@LPs-R8呈球形或类球形, 边界清晰, 有良好的表面形态。脂质体粒径均在90~120 nm, 大小均匀, 分散性良好。

|
Figure 3 Transmission electron microscopic images of OT@LPs (A) and OT@LPs-R8 (B) |
如表 2所示, 经R8修饰后脂质体的载药量和包封率无明显变化, 二者的载药量均大于5%, 包封率均大于60%。
2.4 稳定性由图 4可见, 脂质体在模拟鼻腔环境中8 h后其粒径与包封率均无明显变化, 说明制备的脂质体在鼻腔环境下稳定, 无明显聚集和泄露情况, 为后续鼻腔给药奠定了稳定基础。

|
Figure 4 Stability of liposomes. A: OT@LPs; B: OT@LPs-R8. n = 3, |
以透析袋法考察OT脂质体的体外释放行为, 通过处理并分析数据, 得其释药曲线(图 5A)。OT-S有明显的突释行为, 1 h后累积释药量将近100%, 释药速度过快; 而脂质体组OT@LPs和OT@LPs-R8释放速度较慢, 累积释放6 h后释药量接近100%。与游离溶液相比, 包裹在脂质体中的药物释放时间明显延长, 表明脂质体可能具有缓释效果, 为鼻黏液渗透争取了时间。此外, OT@LPs和OT@LPs-R8的释药特性相似, 这有助于后期精确地比较R8修饰对促进药物经鼻入脑、体内分布的影响。
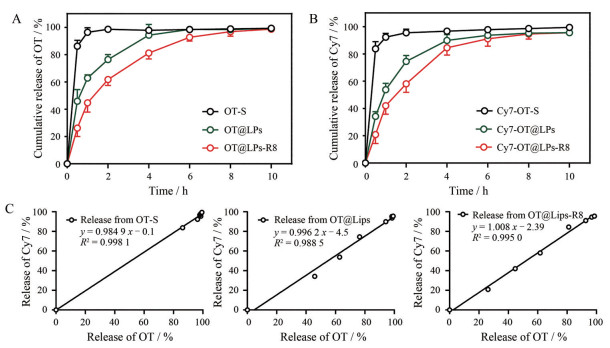
|
Figure 5 In vitro release behavior of liposomes. A: Cumulative release of OT; B: Cumulative release of Cy7; C: Correlation analysis between cumulative release of OT and cumulative release of Cy7 from various liposomes. n = 3, |
以透析袋法考察Cy7从脂质体内的释放特性, 结果如图 5B所示。并以OT的累积释放量为横坐标, 以同时间点Cy7的累积释放量为纵坐标分析了两者相关性, 如图 5C所示, Cy7的累积释放量与同时间点OT的累积释放量呈正相关, 且相关性系数均大于0.9, 表明以Cy7标记的脂质体施用于小鼠体内时, 其荧光信号的强弱及位置可以代表OT在小鼠体内的多少及位置。
3 OT@LPs-R8的脑靶向性 3.1 鼻黏膜刺激性鼻腔覆盖假复层纤毛柱状细胞, 这些细胞大部分被一层纤毛覆盖, 纤毛以协调一致的方式将黏液层推向咽部, 并有助于阻隔有害物质的入侵。
大鼠鼻腔黏膜的HE切片结果如图 6所示, 图 6A为生理盐水阴性对照组, 鼻腔给予生理盐水后, 鼻黏膜表面的纤毛排列整齐, 对鼻腔黏膜无明显损害。图 6B为1% SDS阳性对照组[16], 鼻腔黏膜完整性被破坏, 上皮细胞破坏较为严重, 发生皱缩, 细胞浸润生长。与阴性和阳性对照相比, OT-S (图 6C)、OT@LPs (图 6D) 和OT@LPs-R8 (图 6E) 3组的假复层纤毛柱状上皮几乎完整, 没有明显的损伤, 纤毛整齐排列于黏膜表面, 说明药物的游离溶液及脂质体相对安全, 对鼻黏膜无明显损伤, 可用于后续实验研究。

|
Figure 6 Evaluation of nasal mucosal irritation. HE stained histology section of nasal cavity mucosal. A: Normal saline; B: 1% Sodium dodecyl sulfate solution; C: Oxytocin solution (OT-S); D: OT@LPs; E: OT@LPs-R8 |
图 7显示鼻腔给药后不同时间IVIS成像测量的荧光强度。通过比较游离组(OT-S) 与脂质体组(OT@LPs、OT@LPs-R8), 脂质体剂型在鼻腔中滞留的时间显著延长。OT-S在鼻腔中1 h后荧光强度骤降, 给药6 h后已基本消失, 鼻腔内滞留量仅5.43%, 这可能是游离药物被更快吸收与鼻黏膜纤毛清除的共同作用的结果; 与OT@LPs相比, 经R8修饰后的脂质体OT@LPs-R8在给药8 h后仍有较强的荧光, 鼻腔内脂质体滞留量高达31.85%, 表明OT@LPs-R8在鼻腔中滞留的时间更长, 八聚精氨酸是阳离子型穿膜肽, 经R8修饰后显著提高了脂质体的表面电位, 增强了与鼻黏液间的静电作用[17], 赋予脂质体的生物黏附性, 有效延长鼻腔内滞留时间。

|
Figure 7 Retention of liposomes in nasal. A: Whole animal near-infrared fluorescence imaging after nasal administration; B: Semi-quantitative data of fluorescence intensity after nasal administration. n = 3, |
鼻腔给予Cy7-OT-S、Cy7-OT@LPs和Cy7-OT@LPs-R8 2 h后离体脏器的荧光分布结果如图 8所示, 各组动物的肝、肾中均有荧光, 这很可能是因为药物于体内吸收后经肝脏代谢、肾脏排泄的缘故; 由鼻腔经呼吸道进入肺部故肺部可见明显荧光。游离组(OT-S) 的荧光弱于脂质体组(OT@LPs、OT@LPs-R8), 这可能是因为游离组经鼻给药后在体内吸收较快, 代谢的时间较短。与OT@LPs相比, OT@LPs-R8在肺、肝脏和肾脏的荧光信号更强, 这可能是由于经细胞穿膜肽修饰后促进了鼻黏膜中脂质体的渗透吸收。分离出的各组脑组织以IVIS进行离体成像, 脂质体组在脑内的荧光强度明显高于游离OT, 其中, 以OT@LPs-R8的荧光强度最高, 且其脑内相对荧光强度是游离OT组的10倍(表 3), 说明细胞穿膜肽的修饰增加了药物在脑内的含量。
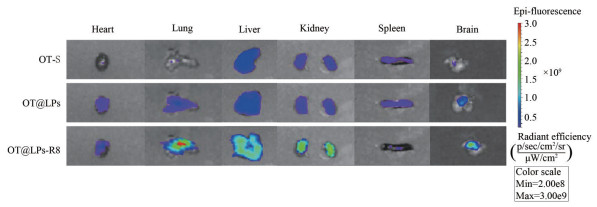
|
Figure 8 In vivo distribution of liposome: fluorescence imaging of isolated organs after 2 hours nasal administration |
|
Table 3 Relative fluorescence intensity in brain after 2 hours nasal administration. n = 3, |
本文构建R8修饰的缩宫素脂质体(OT@LPs-R8) 鼻腔给药后, 显著延长鼻腔内的滞留时间, 且给药2 h后在脑内的分布明显高于其他游离OT和OT@LPs, 显示出更佳的经鼻入脑靶向能力, 对于难以透过血脑屏障的中枢活性多肽药物, LPs-R8是一个有潜力的载体系统。
致谢: 感谢复旦大学药学院提供实验仪器及科研平台。
作者贡献: 吕风梅和梁会敏负责实施实验; 吕风梅负责数据处理; 随力和刘哲鹏提出研究思路; 吕风梅设计实验方案并撰写和修改论文。
利益冲突: 所有作者声明不存在任何利益冲突。
| [1] |
Robson SE, Repetto L, Gountouna VE, et al. A review of neuroeconomic gameplay in psychiatric disorders[J]. Mol Psychiatry, 2020, 25: 67-81. DOI:10.1038/s41380-019-0405-5 |
| [2] |
Keech B, Crowe S, Hocking DR. Intranasal oxytocin, social cognition and neurodevelopmental disorders: a meta-analysis[J]. Psychoneuroendocrinology, 2018, 87: 9-19. DOI:10.1016/j.psyneuen.2017.09.022 |
| [3] |
Guastella AJ, Hickie IB, Mcguinness MM, et al. Recommendations for the standardisation of oxytocin nasal administration and guidelines for its reporting in human research[J]. Psychoneuroendocrinology, 2013, 38: 612-625. DOI:10.1016/j.psyneuen.2012.11.019 |
| [4] |
Erdman SE, Poutahidis T. Microbes and oxytocin: benefits for host physiology and behavior[J]. Int Rev Neurobiol, 2016, 131: 91-126. |
| [5] |
Li YG, Lin GY, Chen SS. New advances in oxytocin therapy for autism spectrum disorders[J]. J Biol Edu (教育生物学杂志), 2018, 6: 38-41. |
| [6] |
Illum L. Transport of drugs from the nasal cavity to the central nervous system[J]. Eur J Pharm Sci, 2000, 11: 1-18. DOI:10.1016/S0928-0987(00)00087-7 |
| [7] |
Marttin E, Schipper N, Verhoef JC, et al. Nasal mucociliary clearance as a factor in nasal drug delivery[J]. Adv Drug Deliv Rev, 1998, 29: 13-38. DOI:10.1016/S0169-409X(97)00059-8 |
| [8] |
Illum L. Nasal drug delivery--possibilities, problems and solutions[J]. J Control Release, 2003, 87: 187-198. DOI:10.1016/S0168-3659(02)00363-2 |
| [9] |
Zaman RU, Mulla NS, Keegan BG, et al. Nanoparticle formulations that allow for sustained delivery and brain targeting of the neuropeptide oxytocin[J]. Int J Pharm, 2018, 548: 698-706. DOI:10.1016/j.ijpharm.2018.07.043 |
| [10] |
Kashyap K, Shukla R. Drug delivery and targeting to the brain through nasal route: mechanisms, applications and challenges[J]. Curr Drug Deliv, 2019, 16: 887-901. DOI:10.2174/1567201816666191029122740 |
| [11] |
Tashima T. Intelligent substance delivery into cells using cell-penetrating peptides[J]. Bioorg Med Chem Lett, 2017, 27: 121-130. DOI:10.1016/j.bmcl.2016.11.083 |
| [12] |
Lu Y, Wang H, Jiang Y, et al. Cell-penetrating peptide-modified PLGA nanoparticles for enhanced nose-to-brain macromolecular delivery[J]. Macromol Res, 2013, 21: 435-441. DOI:10.1007/s13233-013-1029-2 |
| [13] |
Tka B, Ht B, Ho B. Nose-to-brain drug delivery system with ligand/cell-penetrating peptide-modified polymeric nano-micelles for intracerebral gliomas[J]. Eur J Pharm Biopharm, 2020, 152: 85-94. DOI:10.1016/j.ejpb.2020.05.001 |
| [14] |
Samaridou E, Alonso MJ, et al. Nose-to-brain peptide delivery-the potential of nanotechnology[J]. Bioorg Med Chem, 2018, 26: 2888-2905. DOI:10.1016/j.bmc.2017.11.001 |
| [15] |
Costa C, Moreira JN, Amaral MH, et al. Nose-to-brain delivery of lipid-based nanosystems for epileptic seizures and anxiety crisis[J]. J Control Release, 2019, 295: 187-200. DOI:10.1016/j.jconrel.2018.12.049 |
| [16] |
Yang ZZ, Zhang YQ, Wang ZZ, et al. Enhanced brain distribution and pharmacodynamics of rivastigmine by liposomes following intranasal administration[J]. Int J Pharm, 2013, 452: 344-354. DOI:10.1016/j.ijpharm.2013.05.009 |
| [17] |
Ci LQ, Huang ZG, Lv FM, et al. Enhanced delivery of imatinib into vaginal mucosa via a new positively charged nanocrystal-loaded in situ hydrogel formulation for treatment of cervical cancer[J]. Pharmaceutics, 2019, 11: 15-30. DOI:10.3390/pharmaceutics11010015 |
| [18] |
Yu Y, Zheng Z, Yi C, et al. Preparation and in vitro evaluation of artemisinin loaded long-circulating liposomes[J]. Acta Pharm Sin (药学学报), 2018, 53: 1002-1008. |
| [19] |
Ding T, Guan J, Wang M, et al. Natural IgM dominates in vivo performance of liposomes[J]. J Control Release, 2020, 319: 371-381. DOI:10.1016/j.jconrel.2020.01.018 |
| [20] |
Sosnik A, Neves JD, Sarmento B. Mucoadhesive polymers in the design of nano-drug delivery systems for administration by non-parenteral routes: a review[J]. Prog Polym Sci, 2014, 39: 2030-2075. DOI:10.1016/j.progpolymsci.2014.07.010 |
 2022, Vol. 57
2022, Vol. 57


