2. 中国食品药品检定研究院, 国家药品监督管理局药用辅料质量研究与评价重点实验室, 北京 100050;
3. 重庆大学生物工程学院, 生物流变科学与技术教育部重点实验室, 重庆 400030
2. NMPA Key Laboratory for Quality Research and Evaluation of Pharmaceutical Excipients, National Institutes for Food and Drug Control, Beijing 100050, China;
3. Key Laboratory of Biorheological Science and Technology Ministry of Education, College of Bioengineering, Chongqing University, Chongqing 400030, China
药用辅料是指为了改善药物的安全性、有效性、稳定性、顺从性和成型性等性质而在制剂中加入除药物活性成分外所有药用物料的统称, 可通过增溶、控释等来增加药物疗效和减少毒副作用[1]。羟丙甲纤维素(hydroxypropyl methylcellulose, HPMC) 是一种由纤维素醚化而成的半合成高分子聚合物, 目前是国内外制备缓控释制剂用量最大的药用辅料之一[2]。虽然市售的产品都符合国家药典标准[3], 但是不同供应商或同一供应商的不同批次之间的质量仍存在较大差异[4, 5]。HPMC作为直压辅料[6], 其来源差异会引起粉体学性质差异, 继而会对骨架型缓释片的成型性、药物释放行为产生一定的影响[7, 8]。因此, 不同来源HPMC关键质量属性的研究对于质量控制及其制剂产品开发具有重要的意义。
SeDeM专家系统是Suñé-Negre等[9, 10]提出的一种应用于固体制剂处方前或处方研究的原辅料质量评估方法。该系统提供原辅料在粉末直压工艺中可压缩性的物理信息, 并且还用于评价原辅料来源或批次间差异、同功能辅料间差异等。Zhang等[11]借鉴该系统提出了粉末物理指纹图谱, 并应用于不同来源或不同批次的中药提取物粉末质量一致性评价。本实验通过粉末物理指纹图谱定量可视化不同来源HPMC物理质量属性的差异, 从粉体学角度来评估辅料关键质量属性, 全面综合考察HPMC的来源差异。
HPMC亲水骨架片的溶出不仅受骨架材料的影响, 而且也受药物溶解度的影响[12]。根据羟丙氧基和甲氧基含量的不同, HPMC分为不同的规格和取代等级。本实验应用于缓释制剂的是2208系列HPMC, 即国产K系列HPMC, 主要是通过快速水化形成阻碍药物释放屏障的水凝胶层来达到缓释效果[13]。因此, 本实验考察来自两个生产厂家3个规格的HPMC (K4M、K15M、K100M) 在粒径分布、物理形态、黏度及粉末物理质量属性的差异, 选用水溶性的氨茶碱和盐酸二甲双胍以及难溶性的双氯芬酸钠作模型药物, 对应不同规格的HPMC制备缓释片, 进一步探索HPMC理化性质差异对药物缓释效果的影响, 为HPMC的合理应用进一步提供数据支撑及理论指导。
材料与方法仪器 Mastersizer3000激光衍射粒度分析仪(英国马尔文仪器有限公司); JSM-7800F场发射扫描电子显微镜(日本电子株式会社); NDJ-5S数字式旋转黏度计(上海衡平仪器仪表厂); BT-100松密度测定仪、BT-301振实密度测定仪、HYL-105休止角测定仪(丹东百特公司); DP30A单冲压片机(北京新龙立科技有限公司); CT3-10k质构仪(美国博勒飞公司); UV-1100紫外可见分光光度仪(上海美谱达仪器有限公司); ZPJ-4智能片剂四用仪(天津市鑫洲科技有限公司)。
材料 A厂家的HPMC 3个规格(编号为A-K4M、A-K15M、A-K100M); B厂家的HPMC 5个规格(编号为B-K4M、B-K4MCR、B-K15M、B-K15MCR、B-K100MCR); K4M、K15M、K100M对应2208型HPMC样品的黏度分别为4 000、15 000和100 000 mPa·s; 氨茶碱(宜昌永诺药业有限公司, 批号: YR20180827); 双氯酚酸钠(河南东台市制药有限公司, 批号: 301160916-5); 盐酸二甲双胍(上海植信化工有限公司, 批号: 20170609); 氨茶碱标准品和双氯酚酸钠标准品(上海源叶生物有限公司); 盐酸二甲双胍标准品(中国食品药品检定研究院); 淀粉、微晶纤维素、硬脂酸镁、羧甲基纤维素钠、滑石粉等辅料均来自安徽山河药用辅料有限公司; 其他试剂均为分析纯。
粒径及物理形貌 使用激光粒度仪3000干法进行粒径的表征。取适量HPMC粉末放置干法进样器样品盘中, 均匀铺平, 距样品盘口约2 cm。仪器参数设置: 振动速率为50%, 分散气压为200 kPa, 折射率为1.34, 吸光度为0.01。粒子累积分布的10%、50%和90%的粒径所对应d10、d50、d90和比表面积(specific surface area, SSA) 为仪器自动输出值, 粒度分布宽度(size distribution width, Span) 由d10、d50、d90计算而得, 公式如下:
| $ \mathrm{S}\mathrm{p}\mathrm{a}\mathrm{n}=\frac{{d}_{90}-{d}_{10}}{{d}_{50}} $ | (1) |
取适量干燥的粉末, 均匀地撒在双面胶纸的样品座上, 再用洗耳球吹去未黏住的粉末, 镀上一层导电膜, 然后将镀膜的样品放到扫描电镜仪观察, 得到样品的微观样貌。仪器参数设置: 加速电压为5.0 kV, 发射电流为5 nA, 放大倍数为200倍。
黏度 参考《中国药典》2020年版黏度测定法(0633), 测定2% (w/w) HPMC水溶液在20 ± 0.1 ℃条件下的真实黏度。
HPMC物理质量属性表征 根据粉末自身物理性质及药用功能, 将其物理质量属性分为5个方面, 即堆积性、流动性、均一性、可压性和稳定性, 并作为粉体物理指纹图谱的一级指标。由松密度、振实密度、粒径小于50 μm的粉体粒子所占百分比、相对均齐度指数、豪斯纳比、休止角、粉末流动时间、颗粒间孔隙率、卡尔指数、内聚力指数、干燥失重和吸湿性总共12个定量参数构成HPMC物理指纹图谱的二级指标, 其中一级指标和二级指标所属对应关系见表 1。
| Table 1 Limit values and standardized conversion of the physical quality indexes. v: The experimental values of the 12 secondary parameters measured |
HPMC物理质量指标的测定方法
松密度(bulk density, Da) 精密称取10 g待测粉末, 缓慢加入到25 mL量筒中, 读取粉末的体积为Va, 质量为m, Da计算如公式2所示:
| $ Da=\frac{m}{Va} $ | (2) |
振实密度(tapped density, Dc) 将已测Da的量筒密封并固定在振实密度仪, 参数设置: 冲程为3 mm, 震动频率为每分钟200次, 振动次数为1 250次。读取振实后粉末的体积为Vc, Dc计算公式如下:
| $ Dc=\frac{m}{Vc} $ | (3) |
粒径 < 50 μm百分比(particles < 50 μm, %Pf) 使用激光粒度仪测定, 取适量粉末置于干法进样器样品盘中, 均匀铺平, 距样品盘口约2 cm。仪器参数设置为: 振动速率50%, 分散气压200 kPa, 折射率1.34, 吸光度0.01。
相对均齐度指数(homogeneity index, Iθ) 测定方法同%Pf, 设定Fm-2、Fm-1、Fm、Fm+1、Fm+2分别为0~50、50~100、100~212、212~355和 > 355 μm待测粉末所占的百分比, dm-2、dm-1、dm、dm+1、dm+2分别为0~50、50~100、100~212、212~355和 > 355 μm待测粉末平均直径, Iθ计算如公式(4)。
豪斯纳比(hausner ratio, IH)[10] 由Da与Dc计算而得, 公式如下:
| $ IH=\frac{Dc}{Da} $ | (5) |
休止角(angle of repose, α) 将100 g待测粉末加入到休止角测定仪中, 使其从喷嘴直径为10 mm漏斗自然下落堆积在底面为直径100 mm的圆盘, 形成锥体, 从量角器中直接读出数值。
粉末流动时间(flowability, t") 使用粉末流动性测定仪, 将100 g待测粉末加入到喷嘴直径10 mm的漏斗中, 打开通道并开始计时, 记录粉末全部通过漏斗的时间。
| $ I\theta =\frac{{F}_{\mathrm{m}}}{100+({d}_{\mathrm{m}}-{d}_{\mathrm{m}-1})\times {F}_{\mathrm{m}-1}+({d}_{\mathrm{m}+1}-{d}_{\mathrm{m}})\times {F}_{\mathrm{m}+1}+({d}_{\mathrm{m}}-{d}_{\mathrm{m}-2})\times {F}_{\mathrm{m}-2}+({d}_{\mathrm{m}+2}-{d}_{\mathrm{m}})\times {F}_{\mathrm{m}+2}} $ | (4) |
颗粒间孔隙率(interparticle porosity, Ie)[10] 由Da与Dc计算而得, 公式如下:
| $ Ie=\frac{Dc-Da}{Dc\times Da} $ | (6) |
卡尔指数(carr index, IC)[10] 由Da与Dc计算而得, 公式如下:
| $ IC=\frac{Dc-Da}{Dc}\times 100 $ | (7) |
内聚力指数(cohesion index, Icd)[10] 适量待测粉末在单冲压片机经过最大偏心压缩力压制成片剂后, 测得片剂的平均硬度。为了测试原始粉末的可压性, 首先对HPMC粉末进行预压制, 在粉末无法压缩的情况下可加入质量分数为3.5%的混合物(滑石粉2.36%、微粉硅胶0.14%和硬脂酸镁1.00%) 进行实验。
干燥失重(loss on drying, %HR) 利用快速水分测定仪, 将约2 g的待测粉末平铺于样品盘中, 在105 ℃下加热10 min后直接读出数值。
吸湿性(hygroscopicity, %H)[11] 将玻璃称量瓶置于(22 ± 2) ℃恒温干燥器(下部放置氯化钠的饱和溶液), 12 h后精密称重为m1; 取适量HPMC粉末样品平铺于称量瓶内约为1 mm厚, 精密称重为m2; 将称量瓶敞口, 并与瓶盖同置于上述恒温恒湿条件下, 24 h后盖好称量瓶盖, 精密称重为m3。%H计算公式如下:
| $ \mathrm{\%}H=\frac{{m}_{3}-{m}_{2}}{{m}_{2}-{m}_{1}}\times 100\mathrm{\%} $ | (8) |
粉末物理指纹图谱的构建 采用雷达图的方式定量直观展示HPMC粉末物理指纹图谱。将所测12个二级指标的实验值(ν) 标准化至同一尺度(0~10), 转换公式见表 1。当上述12个二级物理指标的标准化值均为10时, 可用线段将各指标值连接起来形成正十二边形。每个物理指标的标准化转换值所构成的不规则十二边形即构成粉末物理指纹谱。
缓释片的制备
氨茶碱100 g、预交化淀粉54 g、HPMC K4M 40 g、滑石粉4.0 g、硬脂酸镁2.0 g, 制成1 000片。具体方法: 将氨茶碱、HPMC K4M和预交化淀粉混匀, 加80% (w/w) 的乙醇制软材, 过20目筛制粒, 于50 ℃干燥后整粒, 加入滑石粉、硬脂酸镁混匀, 确定片剂的基本指标, 规格: 100 mg; 片径: 9 mm; 片厚: 2.94 mm; 片重: (200 ± 10) mg; 硬度: (8 ± 2) kg; 压片, 即得氨茶碱缓释片。
双氯芬酸钠100 g、微晶纤维素148.4 g、HPMC K15M 108 g、硬脂酸镁3.6 g, 制成1 000片。具体方法: 将双氯芬酸钠、微晶纤维素和HPMC K15M混匀, 加80% (w/w) 乙醇制软材, 过20目筛制粒, 于50 ℃干燥后整粒, 加入硬脂酸镁混匀, 确定片剂的基本指标, 规格: 100 mg; 片径: 9 mm; 片厚: 5.60 mm; 片重: (360 ± 18) mg; 硬度: (8 ± 2) kg; 压片, 即得双氯芬酸钠缓释片。
盐酸二甲双胍125 g、微晶纤维素20.5 g、羧甲基纤维素钠15 g、HPMC K100M 87.5 g、硬脂酸镁2.0 g, 制成1 000片。具体方法: 将盐酸二甲双胍、微晶纤维素、羧甲基纤维素钠和HPMC K100M混匀, 加5% (w/w) HPMC E5溶液的制软材, 过20目筛制粒, 于50 ℃干燥后整粒, 加入硬脂酸镁混匀, 确定片剂的基本指标, 规格: 125 mg; 片径: 9 mm; 片厚: 3.60 mm; 片重: (250 ± 12.5) mg; 硬度: (8 ± 2) kg; 压片, 即得盐酸二甲双胍缓释片。
参考《中国药典》2020版脆碎度(0923) 和硬度测定方法, 考察在片剂成型阶段, 缓释片中辅料成分一致, 仅HPMC这一种辅料性质有差异, 对制备缓释片的压缩性能是否有影响。
溶出度的测定 参考《中国药典》2020版溶出度与释放度测定法(0931) : 取氨茶碱缓释片各6片, 采用篮法, 溶出温度为37 ℃, 溶出介质为1 000 mL, 转速为50 r·min-1, 分别在l、2、4、6、8、10和12 h时取样, 考察在pH 1.2缓冲液中释放情况; 双氯酚酸钠缓释片的溶出介质体积为900 mL, 转速为100 r·min-1, 其他溶出条件与氨茶碱缓释片溶出一致, 考察在pH 6.8缓冲液中释放情况; 盐酸二甲双胍缓释片的溶出介质体积为1 000 mL, 转速为100 r·min-1, 其他溶出条件与氨茶碱缓释片溶出一致, 考察在水中释放情况。配制相应的系列标准品溶液, 用紫外分光光度计以相应的检测波长(氨茶碱275 nm、双氯酚酸钠276 nm和盐酸二甲双胍233 nm) 测定系列标准品溶液和样品的吸光度值, 绘制标准曲线, 计算出各点累积溶出度并绘制不同pH溶出曲线。曲线之间的相似性可用相似因子ƒ2表示, 两者平均溶出率的ƒ2因子大于50可判断为相似。
结果 1 HPMC理化性质 1.1 粒径及物理形貌所有HPMC粒径表征结果见表 2。不同厂家HPMC在粒径及分布上存在显著差异: 与厂家A的HPMC相比, 厂家B的d10较小, d90、Span和SSA较大, 表现为小粒径产品多、分布范围较广、中值粒径偏大和比表面积较大; 厂家B的K15M批次在d50和d90整体上大于其他批次, 说明其粗粉比例较多; 粗粉(厂家B的K15M) 的SSA最低, 而细粉(厂家B的K100MCR) 的SSA最高, 说明粒径大小与比表面积呈相反的趋势。
|
Table 2 Particle size data sheet of hydroxypropyl methylcellulose (HPMC) samples from different manufacturers. A-K4M, A-K15M, A-K100M: Three batches of HPMC with different viscosity grades from manufacturer A; B-K4M, B-K4MCR, B-K15M, B-K15MCR, B-K100MCR: Five batches of HPMC with different viscosity grades from manufacturer B; K4M, K15M, K100M: The viscosity grades of HPMC are 4 000, 15 000, and 100 000 mPa·s, respectively; d10, d50, d90: The cumulative particle size distribution of the sample reaches 10%, 50%, 90%, respectively; Span: Size distribution width; SSA: Specific surface area. n = 3, |
所有HPMC扫描电镜结果见图 1。不同厂家HPMC的物理形貌均不一致: 厂家A的HPMC呈圆条形, 团聚多, 表面相对光滑; 厂家B的HPMC呈鳞片状, 团聚少, 表面比较粗糙且有孔隙, 其表面存在丝条状褶皱, 存在大量包状突起, 使其具有较大的比表面积。综上, 厂家B的HPMC较厂家A具有较小的粒径和较大的比表面积。

|
Figure 1 Scanning electron microscopy images of HPMC samples under the 200× magnification |
所有HPMC物理指纹图谱见图 2。同一厂家HPMC的物理指纹图谱相似性很高, 不同厂家HPMC的物理指纹图谱存在明显差异, 主要表现为压缩性指标(Ie、IC、Icd) 和流动性(α和t"几乎为0)。所有HPMC物理指纹图谱一级指标平均值见表 3。厂家B的HPMC可压性均值接近10, 流动性和均一性均值小于5, 表明其具有粉末直压过程中优异的可压性, 但流动性较差。结合粒径结果分析: 厂家B的HPMC粒径较小, 细粉(粒径 < 50 μm) 含量较高, 且粒径分布不均, 粒径大的颗粒含量较低, 粉末无法自由从漏斗留下, 降低了流动性和堆积性。结合物理形貌结果分析: 厂家A的HPMC颗粒表面光滑, 可以减少粒子间的摩擦力, 赋予了优异的流动性; 厂家B的HPMC呈鳞片状且粗糙表面增大了颗粒之间的摩擦力力, 阻碍了流动性。另外, 厂家B的HPMC具有粗糙表面及颗粒间较大的孔隙率, 导致粉末在压缩过程中产生较大的塑性形变, 颗粒间结合更为紧密, 表现出较优异的粉末压缩性, 满足直压的要求。综上, 在粉末直压工艺中厂家B的HPMC较厂家A具有较优异的可压性, 但流动性和均一性较差。
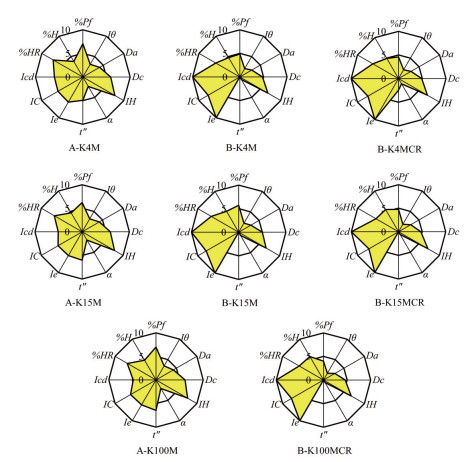
|
Figure 2 The physical fingerprint of HPMC samples |
|
Table 3 Mean value of primary indicators for HPMC physical fingerprint. n = 3, |
所有HPMC黏度结果见表 4。不同厂家HPMC的实际黏度均符合药典黏度范围要求(75%~140%), 但存在明显差异: 同黏度级别相比, 厂家B的HPMC黏度高于厂家A; 同厂家不同规格相比, 控释级黏度大于普通级。HPMC的黏度是决定其制剂应用的关键质量属性, 聚合物黏度越大, 分子量越高, 使得缓控释骨架遇水形成凝胶强度逐渐增大, 水分不易进入和溶蚀缓控释骨架, 药物的释放变慢。
|
Table 4 The viscosity of HPMC for different samples. n = 3, |
所有HPMC制备的缓释片硬度和脆碎度结果见表 5。不同厂家HPMC制备的载药缓释片的脆碎度结果均小于1%, 符合药典标准, 但硬度结果差异较大, 尤其是高黏度的K100M, 不同厂家之间的硬度差异可达2倍。同等制剂工艺厂家B的HPMC制得的片剂硬度远大于厂家A的片剂硬度, 这与其优异的粉末可压性呈正相关, 主要体现为小粒径且粗糙的表面形态更有利于原辅料颗粒的接触和镶嵌作用, 有利于片剂成型过程中微粒重排结合, 导致片剂机械强度较大。
|
Table 5 The hardness and friability of the sustained-release tablets prepared by different HPMC samples. n = 20, |
3种模型药物释放度结果和双氯芬酸钠的溶出曲线相似因子ƒ2结果分别见图 3和表 6。不同厂家的HPMC对不同模型药物的释放行为有明显差别, 主要表现为对双氯芬酸钠释放的影响较大, 对氨茶碱和盐酸二甲双胍的影响较小。对于双氯芬酸钠缓释片, 不同厂家HPMC的两条释放曲线差异较大(ƒ2 < 50), 但相同厂家B的两条释放曲线较为相似(ƒ2 > 50), 说明厂家B的HPMC载药缓释效果优于厂家A。另外, 氨茶碱和盐酸二甲双胍缓释片在12 h内药物累积释放可达到80%以上, 但双氯芬酸钠缓释片只能达到40%~60%, 这说明亲水性凝胶骨架片的药物释放不仅受HPMC理化性质的影响, 也受药物溶解度的影响。
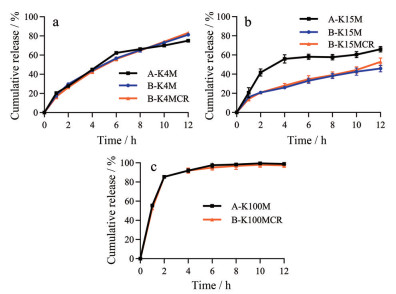
|
Figure 3 The cumulative release curves of the sustained-release tablets prepared by different HPMC samples. a: Aminophylline, pH 1.2 buffer; b: Diclofenac sodium, pH 6.8 buffer; c: Metformin hydrochloride, aqueous solution. n = 6, |
| Table 6 The ƒ2 factor of release curves of diclofenac sodium sustained-release tablets prepared by HPMC K15M |
目前, HPMC国内外制造商众多, 国外以美国Dow Chemical和日本Shin-Etsu Chemical为代表, 国内以安徽山河辅料、湖州展望和山东赫达为代表, 由于不同厂商采取的原料、设备和工艺不同, 因此, 不同厂家生产出来的HPMC在其物理化学性质及制剂应用上也不尽相同。在缓控释制剂领域中, 药典标准对于HPMC质量控制仅规定了黏度、羟丙氧基和甲氧基的含量3个理化性质, 而且药典给出的质量控制范围略大, 无法全面准确地体现出国内外产品的差距, 所以更多药典标准外理化性质被用于HPMC质量控制及缓控释制剂设计。近年来, 许多学者利用新方法和新指标评估国内外产品质量差异并不断丰富了HPMC关键质量属性: Deng等[4]利用主成分分析对不同来源HPMC的粒径、流动性、黏度、分子量分布和取代度几个功能性相关指标进行了研究, 结果表明存在厂家差异及批间差异; Gong等[5]研究表明同一黏度规格或不同来源的HPMC的性质差异较大, 对后续制得片剂的溶蚀及膨胀等性质均有影响; Devjak等[14]研究表明即使两种不同来源生产的HPMC聚合物符合药典规范, 但在物理化学性质上也有显著差异, 因此会影响制剂的性质。本实验研究表明, 不同来源HPMC的粒径、物理形貌以及粉末流动性、可压性、均一性等关键质量属性存在一定的差异, 而且不同压缩性质的HPMC对同一种亲水凝胶骨架片会产生不同的压缩效果, 并可能对药物释放度产生影响。
根据生物药剂学分类系统(biopharmaceutics classification system, BCS), 茶碱属BCS I类药物(高溶解性、高渗透性), 其在水中的溶解度约为14.46 mg·mL-1 (37 ℃)[15]。氨茶碱属BCS Ⅲ类药物(高溶解性、低渗透性), 是乙二胺分子通过与两个茶碱结构分子结合形成, 使其水溶性增强[16]。双氯芬酸钠属BCS Ⅱ类药物(低溶解性、高渗透性), 在水中的溶解度约为50 mg∙mL-1 (37 ℃)。盐酸二甲双胍属BCS Ⅲ类药物[17], 在不同溶剂中的溶解性存在很大的差异, 在水中的溶解度较高, 高达398 mg·mL-1[18]。本文研究表明, 不同来源导致的HPMC理化性质差异对不同溶解性的药物体外释放影响不同。由于氨茶碱和盐酸二甲双胍处方中50%的水溶性药物使得片剂遇水后, 药物迅速溶解在骨架表面形成大量孔隙, 使得不同厂家HPMC的压缩性质差异引起的片剂机械强度和粒径本身导致的凝胶水化速率差异对其释放度影响不大[19]。但是, 不同来源HPMC的理化性质差异对双氯芬酸钠体外释放较大, 可能受以下几方面的综合影响: 与厂家A相比, 厂家B的HPMC具有较小的堆密度、松密度和较大的比表面积, 导致颗粒间的结合位点多, 从而使得K15M对药物的吸附性增强, 有效地减缓药物释放[20]; 粗糙有孔隙的表面、较少的团聚和较小的粒径有利于水分的渗入, 加快溶解形成凝胶, 导致药物释放缓慢; 较高的黏度使得骨架与水形成的凝胶层黏度越大, 组成凝胶层的分子链越长, 骨架越难以溶蚀, 从而使药物溶出减慢[12]。
本研究以应用于缓控释制剂的2208型HPMC为研究对象, 考察A、B厂家HPMC的理化性质、片剂压缩性能和药物释放3个方面的差异及相关性, 综合评估了不同厂家HPMC的质量。结果表明, 粒径较小、物理性状为鳞片状且表面粗糙、黏度及可压缩性相对高的B厂家的HPMC, 形成凝胶的速率快及形成的凝胶更为紧密, 缓释效果更好。制剂产品的优劣往往取决于药用辅料, 因此, 药用辅料的质量控制是非常重要的, 尤其是厂家和批次导致的差异。同时, 在药用辅料质量评价的指标上, 制剂工作者应考虑对辅料进行更为全面的指标验证, 确保制剂产品的质量和疗效可控。
作者贡献: 戴传云和孙会敏是本课题的负责人, 提出课题思路、设计研究方案、文章修订; 万书林是本课题的主要执行人, 完成论文的大量数据, 论文起草; 白玉菱和谢文影负责分析实验数据和部分溶出实验; 管天冰和王伯初参与部分实验设计和表征。
利益冲突: 所有作者均同意投稿且声明不存在与本文相关的利益冲突。
| [1] |
Abrantes CG, Duarte D, Reis CP. An overview of pharmaceutical excipients: safe or not safe[J]. J Pharm Sci, 2016, 105: 2019-2026. DOI:10.1016/j.xphs.2016.03.019 |
| [2] |
Eliška M, Kateřina K, Bahijja TA, et al. Hypromellose--a traditional pharmaceutical excipient with modern applications in oral and oromucosal drug delivery[J]. J Control Release, 2020, 324: 695-727. DOI:10.1016/j.jconrel.2020.05.045 |
| [3] |
National Pharmaceutical Committee. Chinese Pharmacopoeia: 2020 version (中国药典: 2020版)[S]. Beijing: Science Publishing Company, 2020: 539-545.
|
| [4] |
Deng WB, Pan H, Li YJ, et al. Investigation and principal component analysis of 2208 hypromellose functional related indexes[J]. Acta Pharm Sin (药学学报), 2021, 56: 314-318. |
| [5] |
Gong YC, Yang BX, Sun RM, et al. Effect of different sources on properties and functions of HPMC[J]. Chin J Pharm (中国医药工业杂志), 2020, 51: 1178-1183. |
| [6] |
Carl A, Peter T, Shasad S, et al. Characterization of a novel hydroxypropyl methylcellulose (HPMC) direct compression grade excipient for pharmaceutical tablets[J]. Int J Pharm, 2020, 583: 119343. DOI:10.1016/j.ijpharm.2020.119343 |
| [7] |
Zhang JZ, Zhang XM, Ding JX, et al. Effects of the critical quality attribute of hydroxypropyl methylcellulose on the release of diclofenac sodium sustained release tablets in vitro[J]. Chin Pharm J (中国药学杂志), 2019, 54: 382-389. |
| [8] |
Lu YQ, Fu JP, Xiong H, et al. Investigation on the mechanism of the effect of the particle size of hypromellose on the release of theophylline hydrophilic gel matrix sustained-release tablets[J]. Chin J Pharm (中国医药工业杂志), 2017, 48: 208-214. |
| [9] |
Suñé-Negre JM, Pérez-Lozano P, Miarro M, et al. Application of the SeDeM diagram and a new mathematical equation in the design of direct compression tablet formulation[J]. Eur J Pharm Biopharm, 2008, 69: 1000-1039. |
| [10] |
Pérez P, Suñé-Negre JM, Miñarro M, et al. A new expert systems (SeDeM diagram) for control batch powder formulation and preformulation drug products[J]. Eur J Pharm Biopharm, 2006, 64: 351-359. DOI:10.1016/j.ejpb.2006.06.008 |
| [11] |
Zhang Y, Xu B, Sun F, et al. Research and application of physical fingerprint of Chinese medicine extract powder[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 2221-2227. |
| [12] |
Dong ZC, Jiang XT. The effect of the properties of hydroxypropyl methylcellulose on the dissolution of hydrophilic matrix tablets[J]. Acta Pharm Sin (药学学报), 1994, 29: 920-924. |
| [13] |
Zhou D, Law D, Reynolds J, et al. Understanding and managing the impact of HPMC variability on drug release from controlled release formulations[J]. J Pharm Sci, 2014, 103: 1664-1672. DOI:10.1002/jps.23953 |
| [14] |
Devjak SN, Šporar E, Baumgartner S, et al. Characterization of physicochemical properties of hydroxypropyl methylcellulose (HPMC) type 2208 and their influence on prolonged drug release from matrix tablets[J]. J Pharm Biomed Anal, 2012, 66: 136-143. DOI:10.1016/j.jpba.2012.03.032 |
| [15] |
Wei XH, Wu JJ, Liang WQ. Neural network used in the formulation of oral sustained-release preparations[J]. Acta Pharm Sin (药学学报), 2001, 36: 690-694. |
| [16] |
Liu J, Wang Y, Liu H. Real-time dissolution similarity analysis of aminophylline tablets[J]. J Pharma Anal (药物分析杂志), 2012, 6: 1096-1100. |
| [17] |
Tsume Y, Mudie DM, Langguth P, et al. The biopharmaceutics classification system: subclasses for in vivo predictive dissolution (IPD) methodology and IVIVC[J]. Eur J Pharm Sci, 2014, 57: 152-163. DOI:10.1016/j.ejps.2014.01.009 |
| [18] |
Xi J, Huang GH. Research progress of metformin hydrochloride sustained-release preparations[J]. Chin Pharm Sci (中国医药科学), 2011, 1: 36-37. |
| [19] |
Lu YQ. The Influence of Some Key Quality Attributes of HPMC on the Quality of Hydrophilic Gel Matrix Sustained Release Tablets (HPMC部分关键质量属性对亲水凝胶骨架缓释片质量的影响)[D]. Shanghai: East China University of Science and Technology, 2016.
|
| [20] |
Cai J, Gu WW, Ding YP. The powder properties of microcrystalline cellulose co-processing excipients and their application in direct compression technology[J]. Chin J Pharm (中国医药工业杂志), 2018, 49: 118-123. |
 2022, Vol. 57
2022, Vol. 57


