2. 四川省中医药科学院, 国家中医药管理局中药质量生物评价重点研究室, 四川 成都 610041;
3. 四川新盛源药业有限公司, 四川 江油 621700;
4. 成都中医药大学附属医院, 代谢性疾病中医药调控四川省重点实验室, 四川 成都 610072;
5. 江西中医药大学, 现代中药制剂教育部重点实验室, 江西 南昌 330004
2. State Key Laboratory of Biological Evaluation of TCM Quality, National Administration of TCM, Academy of Chinese Medicine Sciences, Chengdu 610041, China;
3. Sichuan Xingshengyuan Pharmaceutical Co., Ltd., Jiangyou 621700, China;
4. TCM Regulating Metabolic Diseases Key Laboratory of Sichuan Province, Hospital of Chengdu University of Traditional Chinese Medicine, Chengdu 610072, China;
5. State Key Laboratory of Innovation Drug and Efficient Energy-saving Pharmaceutical Equipment, Jiangxi University of Traditional Chinese Medicine, Nanchang 330004, China
附子为毛茛科植物乌头(Aconitum carmichaeli Debx.) 的子根加工品, 其毒剧, 不少医家常视之为毒蝎, 终身不敢使用; 其效彰, 对于各种急、慢性心衰具有很好疗效, 被誉为“回阳救逆第一品药”, 治病保命“药中四维”[1-3]。生附片是典型的“大毒有奇效”的品种, 由鲜附子切片后直接干燥制得, 并未充分减毒; 相较于附子的其他炮制品, 生附片未经过反复的水洗、浸漂、蒸煮处理, 化学成分保留较完全, 尤其是强心的水溶性生物碱保留较为充分, 药效强, 这也是《伤寒论》四逆汤原方使用生附片的主要原因[4]。目前, 由于生附片质量评价方法的建立存在一定的难度, 因此《中华人民共和国药典》[5]并未对生附片的质量进行评控。《四川省中药炮制规范》虽对生附片双酯型生物碱含量进行限定, 但仅是对毒性的控制, 与强心活性并不相关。课题组前期建立了基于急性心衰大鼠血液流变学的即时改善情况测定的附子强心活性评价方法, 该法直接反映了药物在体内的药效强度, 真实性强, 但该药理方法难度高、检测通量低、需消耗大量实验动物, 亟须建立一种关联生附片强心药效、快速、低检测成本的质量评价方法[6]。
目前, 普遍认为去甲乌药碱(HI)、去甲猪毛菜碱(SA)、棍掌碱(CO) 是附子的主要强心成分。HI和SA均可作为β受体激动剂, 作用于心肌β肾上腺素受体, 对离体心房产生正性肌力作用[7, 8]。药理研究发现浓度为1 μg·mL-1 CO可使豚鼠离体右心房收缩力及心律增加, 显示强心作用[9]。课题组前期通过成分-活性相关分析, 筛选出了SA和HI为附子的强心质量标志物[6]。有趣的是, SA、HI、CO均为典型的肾上腺素结构。
在众多的快速检测手段中, 光化学比色方法因其操作简便、结果直观可见、成本低廉而受到科学家们的广泛关注。指示剂置换反应(indicators displacement assay, IDA) 是一种基于指示剂和分析物竞争结合受体的显色方法, 在光化学比色传感器的设计中有大量应用[10, 11]。本课题组前期工作中[12], 通过基于苯硼酸类受体的IDA, 实现了茶多酚的检测和区分。因此, 本文以具有邻二酚羟基结构的强心成分为分析物, 苯硼酸(PA) 为受体, 设计基于IDA的显色反应。如图 1所示, 含邻苯二酚基团的指示剂茜素红S (ARS) 与PA结合, 颜色发生改变。将生附片提取液加入反应体系中, 具有邻二酚结构的强心成分竞争性结合苯硼酸, 预先与苯基硼酸结合的茜素红S将被置换出来, 从而产生指示剂的颜色响应。该颜色响应是三种强心成分加和的效果, 且含量的高低与颜色的深浅密切相关。因此本研究拟构建基于IDA原理的茜素红S-苯硼酸光化学比色传感器, 为生附片的质量评价提供一种科学、操作简单、成本低廉、高通量的有效方法。
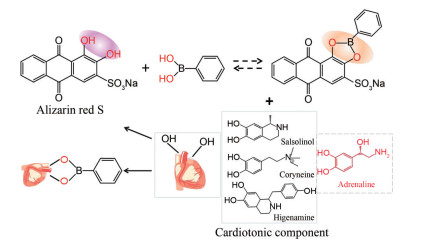
|
Figure 1 IDA principle. IDA: Indicators displacement assay |
仪器 EPSON Perfection V370 Photo全彩平板扫描仪(爱普生有限公司); KQ-500DE超声波清洗机(昆山市超声仪器有限公司); Costar 96孔细胞培养板(美国康宁公司); pHS-3C pH计(上海仪电科学仪器股份有限公司); TU-1810紫外可见分光光度计; Mili-Q型超纯水仪(美国Milipore公司); BSA 224SA型1/1万分析天平和BT25S型1/10万分析天平(德国Sartorius公司); L550型台式低速离心机(长沙湘仪离心机仪器有限公司); Agilent 6460C三重串联四极杆液质联用仪, 美国Agilent公司, 配有ESI离子源。
药材与试剂 分析甲醇(批号2021032902, 成都市科隆化学品有限公司); 色谱乙腈(批号20032512, Sigma-Aldrich西格玛奥德里奇贸易有限公司); 苯硼酸(批号C10492112, 阿法埃莎化工有限公司); 茜素红S (批号1129L031, 阿法埃莎化工有限公司); 邻苯二酚紫(pyrocatechol violet, PV)、3-氨基苯基硼酸(3-aminop-henylboric acid, APA) 购自阿拉丁试剂有限公司; 溴邻苯三酚红(bromopyrogallol red, BR) 购于TIC公司; 4-羟乙基哌嗪乙磺酸(HEPES, 批号20200918, 北京索莱宝科技有限公司); 对照品去甲乌药碱(HI, 批号CHB210118)、去甲猪毛菜碱(SA, 批号CHB190104)、棍掌碱(CO, 批号CHB180609)、乌头碱(aconitine, AC, 批号CHB180408)、新乌头碱(mesaconitine, MA, 批号CHB180311)、次乌头碱(hypaconitine, HA, 批号CHB201109)、苯甲酰乌头原碱(benzoylaconine, BAC, 批号CHB180310)、苯甲酰次乌头原碱(benzoylhypaconine, BHA, 批号CHB180307)、苯甲酰新乌头原碱(benzoylmesaconine, BMA, 批号180310) 均购于成都克洛玛生物科技有限公司, 各对照品纯度均大于98%。
14批生附片分别购自于四川、云南、陕西等地, 经成都中医药大学张定堃副教授鉴定为毛茛科植物乌头Aconitum carmichaeli Debx.的子根加工品。样品信息见表 1。
| Table 1 Sample information of Shengfupian |
指示剂和受体的筛选 由于生附片内的三种强心成分(CO、SA、HI) 均含有邻二酚羟基结构, 因此本研究以SA为目标分析物, 对PA、APA、PV、BR、ARS进行筛选, 通过肉眼观察溶液的颜色, 即指示剂溶液(1×10-4 mol·L-1)、含PA或APA (3×10-4 mol·L-1) 的指示剂溶液、含PA或APA (3×10-4 mol·L-1) 和SA (2.5×10-3 mol·L-1) 的指示剂溶液, 选取颜色变化最明显的为指示剂和受体。
紫外-可见吸收光谱的测定 使用紫外-可见分光光度计获得紫外可见光谱。所有实验均在1 cm光路的石英池中进行, 分别扫描含有ARS、ARS/PA和ARS/PA/SA的样品的光谱, 验证IDA置换机制的可行性。
专属性验证 分别取AC、MA、HA、BMA、BHA、BAC对照品适量, 1%的盐酸溶解后, 2 mol·L-1的NaOH将其pH调至7~8, 缓冲溶液定容, 制成浓度均为2.5×10-3 mol·L-1的供试品溶液。使用紫外-可见分光光度计扫描ARS、ARS/PA和ARS/PA/AC (MA、HA、BAC、BMA、BHA) 的样品的光谱, 验证茜素红S-苯硼酸光化学比色传感器的专属性。
指示剂灵敏性的测定 将SA、CO分别配制成质量浓度为1.0、0.8、0.6、0.4、0.2、0.1、0.05和0.01 mg·mL-1的溶液, HI的质量浓度分别为3.0、1.5、1、0.75、0.5、0.2、0.05和0.01 mg·mL-1, 将不同浓度的SA、CO、HI分别加入反应体系中, 反应完全后, 取200 μL反应后的溶液于96孔板中, 用平板扫描仪扫描, 获取反应后的图像。向反应体系中加入缓冲溶液, 用平板扫描仪获取反应前的图像。记录|△G| (绿色G, |△G| = |G后- G前|) 随强心成分浓度变化的曲线。
传感器条件优化
ARS和PA摩尔比的优化 在ARS (1×10-4 mol·L-1) 溶液中加入不同浓度的PA (1×10-4、2×10-4、3×10-4和4×10-4 mol·L-1), 0 ℃条件下反应, 平衡5 min后加入SA (2.5×10-3 mol·L-1), 再次平衡5 min, 分别扫描SA加入前后溶液的颜色, 根据颜色变化选择最佳摩尔比。
反应温度的优化 将ARS (1×10-4 mol·L-1) 和PA (3×10-4 mol·L-1) 的混合溶液分别置于0、15、25和40 ℃的条件下反应, 平衡5 min后, 加入SA (2.5×10-3 mol·L-1), 反应5 min后扫描反应前后溶液的颜色, 优选颜色变化最明显的温度条件。
供试品制备条件的优化
超声时间的优化 准确称取的生附片粉末约2.5 g, 准确加入10倍量的甲醇, 浸泡30 min后, 300 W、40 kHz超声提取15、30、45和60 min, 对比不同超声时间的提取液加入前后颜色的变化, 优选出最佳的超声时间。
料液比的优化 分别以1∶5、1∶10、1∶15和1∶20的料液比提取生附片, 超声15 min, 对比不同料液比提取的生附片提取液加入前后的颜色变化, 优选出最佳液料比。
生附片提取液浓度的优化 分别取生附片0.5、1.5、2.5和3.5 g, 准确称定, 加入10倍量的甲醇, 超声15 min, 对比不同浓度的提取液加入前后颜色的变化, 优选出最佳的生附片提取液浓度。
方法学考察
精密性 将SA (2.5×10-3 mol·L-1) 对照品溶液, 加入ARS (1×10-4 mol·L-1) 和PA (3×10-4 mol·L-1) 的反应体系中, 0 ℃条件下反应, 平衡5 min, 将200 μL反应后的溶液加入96孔板中, 平行移取6份, 获取反应前后的图像。通过计算每批的|△G|, 求得|△G| (绿色差值) 的RSD值。
稳定性 取同一批次生附片粉末(样品编号S9), 制成供试品溶液, 室温放置, 分别于0、0.5、1、2、4和6 h后进行反应, 获取每个时间点的G值, 计算|△G|的RSD值。
重复性 取同一批生附片粉末(样品编号S9) 约2.5 g, 平行6份, 准确称定, 分别制成供试品溶液, 获取6个批次的G值, 计算|△G|的RSD值。
附子含量的测定
色谱质谱条件[13] Agilent C18色谱柱(250 mm × 4.6 mm, 5 μm); 流动相为0.1%甲酸水溶液-乙腈的混合溶液, 梯度洗脱程序为: 0~1 min, 2%~20%乙腈; 1~5 min, 20%~50%乙腈; 5~10 min, 50%~75%乙腈; 10~15 min, 75%~100%乙腈; 体积流量为0.45 mol·L-1; 柱温25 ℃; 进样量5 μL。采用ESI源, 正离子模式检测; 脱溶剂温度300 ℃; 脱溶剂气N2体积流量11 L·min-1; 雾化器压力15 psi (1 psi = 6.895 kPa); 毛细管电压4 000 V; 扫描方式为多反应检测(MRM); 3个待测化合物优化后的离子对、碎裂电压和碰撞能量见表 2。
| Table 2 Mass spectrum datas of three alkaloids. HI: Higenamine; SA: Salsolinol; CO: Coryneine |
对照品溶液的配制 分别取各对照品适量, 精密称定, 用甲醇配制成含CO、HI、SA的质量浓度分别为101、107和102 μg·mL-1的对照品储备液, 备用。
供试品溶液的配制 准确称取各批次生附片粉末(过40目筛) 0.2 g, 分别置于10 mL容量瓶中, 用甲醇溶解定容至刻度, 称定质量, 超声提取30 min, 取出, 放冷, 称定重量, 补足减失的质量, 用0.22 μm微孔滤膜过滤, 取续滤液, 即得供试品溶液[14]。
不同批次的生附片强心强度的区分 将不同批次的生附片干燥后, 粉碎过40目筛。准确称取不同批次的生附片粉末约2.5 g, 准确加入25 mL甲醇, 称重, 300 W、40 kHz超声提取15 min, 称重, 补足失重的溶剂, 摇匀, 以5 000 r·min-1离心10 min, 将上层清液全部转移至蒸发皿中, 水浴锅80 ℃挥干溶剂, 1 mL缓冲溶液洗脱蒸发皿上的物质, 12 000 r·min-1离心10 min, 过0.22 μm微孔滤膜, 取续滤液, 即得供试品溶液。
将HEPES缓冲溶液加入茜素红S-苯硼酸的反应体系后, 平衡5 min, 用平板扫描仪获取反应“前”的图像。不同批次生附片提取液加入反应体系, 平衡5 min, 获取反应“后”的图像, 每个批次做3次平行的实验, 取平均值。使用Adobe Photoshop CS6软件包获得反应前和反应后图像中的绿色G值, 并进行差减(|△G| = |G后- G前|), 为了便于观察, |△G|从5~20扩展到0~255, 得到颜色差减图[15]。使用excel 2010软件对传感器阵列的|△G|和三种强心成分总含量进行简单的线性相关性分析。所有的实验均在1×10-2 mol·L-1的缓冲溶液(pH 8.0) 中进行。
结果 1 指示剂和受体的筛选如图 2所示, PA/APA加入后ARS、PV的颜色均发生一定的变化, 只有BR几乎无颜色变化, 其中颜色变化最明显是ARS/PA, 溶液颜色由紫红色变成黄色, 且随着SA的加入, 指示剂被置换出来, 又能恢复到茜素红的颜色, 因此筛选ARS为指示剂、PA为受体。
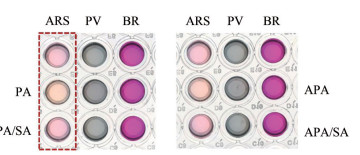
|
Figure 2 Image of indicators for IDA mechanism. ARS: Alizarin red S, PV: Pyrocatechol violet; BR: Bromopyrogallol red; PA: Phenylboronic acid; APA: 3-Aminophenylboric acid |
如图 3A所示, ARS (1×10-4 mol·L-1) 在516 nm处具有最大吸收, PA (3×10-4 mol·L-1) 加入后, 由于ARS会与PA发生反应, 光谱发生蓝移, 在469 nm处出现最大吸收, 添加SA后, SA与PA发生竞争性结合, ARS被置换出来, 溶液在516 nm处重新获得最大吸收。综上所述, 紫外可见光谱测定法验证了IDA置换机制的可行性。
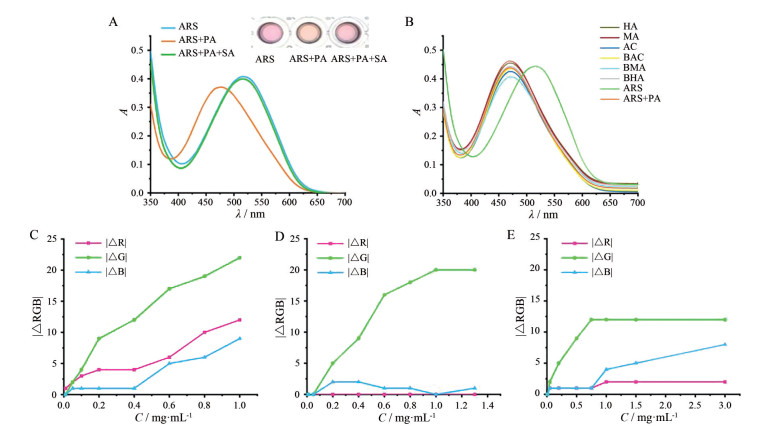
|
Figure 3 Absorption spectrum of IDA mechanism (A). Absorption spectrum veryfication specificity (B). Curve of |△R|, |△G| and |△B| versus CO (C), SA (D) and HI (E) concentration. R, G and B represented red, green and blue; |△RGB| = |RGB after-RGB before| |
如图 3B所示, ARS在516 nm处具有最大吸收, PA加入后光谱在469 nm处出现最大吸收, AC、MA、HA、BAC、BMA和BHA分别加入后, 由于这6种生物碱均不含邻二酚羟基结构, 无法与苯硼酸竞争性结合, 因此紫外光谱的最大吸收仍在469 nm处。
4 传感器灵敏性的检测如图 3C~E所示, 随着强心成分浓度的变化, |△R|、|△G|、|△B| (红色、绿色、蓝色变化的绝对值) 均将发生一定程度的改变, 说明该传感器对于强心成分浓度的变化是灵敏的。该传感器主要以|△G|值变化为主, 且在一定范围内强心成分的浓度越高, |△G|越大。因此, 本研究主要以|△G|值为参考值来评价附子强心作用的强弱。
5 方法学考察 5.1 精密性结果表明, 6次测定的|△G|的RSD值为2.62%, 表明该方法的精密性很好。
5.2 稳定性结果表明, |△G|的RSD值为4.30%, 表明供试品在6 h内基本稳定。
5.3 重复性6份供试品溶液的|△G|的RSD值为3.83%, 表明该方法的重复性较好。
6 生附片中生物碱含量的测定14批生附片的含量测定结果见表 3。HI是具有较强活性的强心成分, 但14批生附片中的HI的含量甚微, 均小于0.1 μg·g-1。SA、CO是强心活性相对较弱的成分, 14批生附片中SA、CO的含量波动较大, SA从15.70~117.46 μg·g-1, 相差7.5倍; CO从317.34~1 560.13 μg·g-1, 相差4.9倍。且同一批次, SA和CO的含量也存在较大的差异, SA和CO的含量相差约4~65倍。
| Table 3 Determination results of three compounds in Shengfupian (μg·g-1, n = 3) |
为了验证该传感器评价强心作用的科学性, 本课题组比较了强心成分总含量与|△G|值的一致性, 如图 4A所示。气泡面积代表强心作用, 气泡越大, 强心作用越强。从气泡的排列顺序来看, 强心成分的总含量排序与|△G|总体上基本一致。随后, 为了进一步判断该传感器评价生附片强心作用的准确性, 本研究对|△G|与强心成分的总含量进行了相关性分析。从图 4B可以看出, |△G|与强心成分的总含量呈现显著的线性相关, 相关系数R2高达0.87。本研究建立的茜素红S-苯硼酸光化学比色传感器可有效地评价生附片的品质, 反映其强心作用的强弱。

|
Figure 4 Consistency evaluation of |△G| and total content of cardiotonic components. Blue and magenta represented total content of cardiotonic components and |△G|, respectively. The larger the bubble area, the stronger the cardiotonic effect (A). Correlation analysis between |△G| and total content of cardiotonic components (B). The response values range and corresponding component content of Shengfupian (C). X represented the total content of the three cardiotonics and for observation purposes, |△G| is expanded from 5-20 to 0-255 |
强心是生附片的主要药理作用, |△G|的大小与强心成分含量的高低密切相关。随后, 本文根据14批样品的颜色差减图构建了生附片商品等级划分的比色范围及其对应强心成分总含量。为了便于观察, |△G|从5~20扩展到0~255。如图 4C所示, 3个等级的生附片颜色差减图的差异是非常明显的, 通过肉眼便可做出区分。通过将样品颜色差减图对照该比色范围便可对其商品等级做出一个准确的划分, 随后根据划分后的商品等级能大致推知其强心成分的总含量范围, 如三等品, 强心成分的总量小于393 μg·g-1; 二等品, 强心成分的总量为401~650 μg·g-1; 一等品, 强心成分的总量大于740 μg·g-1。基于生附片商品等级划分的比色范围可快速区分生附片商品的等级及含量, 开创了生附片品质快速评价的新方法。
讨论传感器构建条件和供试品制备条件是影响生附片强心作用区分效果的关键因素, 因此本研究对上述条件进行了逐个优化。当ARS的浓度为1×10-4 mol·L-1时, 响应信号随PA浓度的增加而增加, 随着ARS和PA的摩尔比从1∶3增加到1∶4时, 信号增加不明显, 因此优选1∶3为ARS和PA的最佳摩尔比。ARS和邻二羟基化合物之间的反应是可逆的, 体系环境的改变对苯硼酸酯的形成有显著影响[16]。在0 ℃条件下响应信号最强, 因此选择0 ℃为最适温度。提取时间对于响应强度无明显影响。料液比为1∶5时响应强度较弱, 增加至1∶10时, 响应强度增大, 继续增加至1∶20, 响应强度无明显变化, 因此站在节省时间和节约溶剂的角度, 优选15 min为最佳提取时间, 1∶10为最佳料液比。随着提取液浓度的增加, 传感器响应信号也在增加, 当浓度从2.5 g·mL-1增加至3.5 g·mL-1时, 响应信号增加不明显, 同时考虑到随着提取液浓度的增加, 部分批次的提取液颜色将加深, 影响实验结果, 因此优选2.5 g·mL-1为最佳提取液浓度。
强心是附子的主要药理作用, SA、CO、HI是附子强心的主要化学物质, 不同产地、不同批次的生附片内含强心成分的含量存在着一定的差异, 故传感器对不同生附片的响应强度会有所差别。该方法无需对所有强心化合物进行逐一检测, 反应后的颜色是三种强心成分产生的综合效应; 扫描一次仅需几秒, 检测通量高, 成本低, 无需LC-MS/MS等大型分析设备, 便于在基层单位使用, 与传统强心活性的检测方法相比, 可大大节省了成本、时间且操作简便、可及性强。
本研究也存在着一定不足。一是限于生附片趁鲜加工且含有剧毒的特殊性, 本研究仅收集到14个批次; 二是该传感器的机制是基于邻二酚羟基的置换反应, 黄酮类、多酚类鞣质类等含邻二酚羟基的化合物均可使该传感器产生颜色响应, 因此该方法仅用于评定生附片质量的优劣, 并不适用于其真伪的鉴别。今后课题组将考虑加大样本量, 并且将一些操作和细节标准化和规范化。针对于RGB值获取, 课题组计划开发一款软件, 用于快速读取96孔板中每个孔内的RGB值, 并将所获取的数据进行自动化处理, 实现数据的采集和处理的一体化, 将极大地提高实验结果的准确性、精确性和可靠性, 使得该检测方法更加智能化和高通量。
科学合理的质量评价与控制方法是中药行业发展的重大问题[17, 18], 附子药材在质量标准的研究与制定上存在很多困难, 近年来几乎没有进展, 严重阻碍了附子的临床应用和产业发展。本文基于茜素红S-苯硼酸光化学比色传感器建立的质量评价方法有望填补生附片优质性评价方法空白, 为生附片的质量评控及等级的制定提供方法借鉴, 对于支撑四川附子产业高质量发展具有重要价值。
作者贡献: 陈露梦、杨明和张定堃设计实验; 陈露梦、贺亚男、刘惠和贾明艳进行实验数据采集; 袁海峰、谭鹏和马鸿雁进行药材收集; 陈露梦、林俊芝和张定堃撰写、修改论文。
利益冲突: 无利益冲突。
| [1] |
Zhang DK, Han X, Tan P, et al. Establishment of one-step approach to detoxification of hypertoxic aconite based on the evaluation of alkaloids contents and quality[J]. Chin J Nat Med, 2017, 15: 49-61. |
| [2] |
Peng C. Study progress of multidimensional evaluation and integrated analysis between toxicity and efficacy on heart of Radix Aconiti Lateralis Praeparata[J]. World Chin Med (世界中医药), 2017, 12: 2543-2550. |
| [3] |
Xiong L, Peng C, Miao LL, et al. Discussion on material basis of toxic herb Radix Aconiti Lateralis Praeparata based on the "integrated analytical method of toxicity and efficacy"[J]. World Chin Med (世界中医药), 2017, 12: 2568-2578. |
| [4] |
Guo DL. Studies on Chemical Constituents of Raw Slices of Acoitum carmichaeli Debx. (生附片的化学成分研究)[D]. Chengdu: Chengdu University of Traditional Chinese Medicine, 2012.
|
| [5] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2020 Ed. Part Ⅰ. Beijing: China Medical Science Press, 2020: 200.
|
| [6] |
Zhang DK, Zhao ZH, Li CY, et al. Quality evaluation of different processed products of Aconiti Lateralis Radix Praeparata combining bioassay and toxicity detection[J]. Acta Pharm Sin (药学学报), 2019, 54: 2169-2177. |
| [7] |
Park CW, Chang KC, Lim JK, et al. Effects of higenamine on isolatedheart adrenoceptor of rabbit[J]. Arch Int Pharmacodyn Ther, 1984, 267: 279-288. |
| [8] |
Praman S, Mulvany MJ, Williams DE, et al. Crude extract and purified components isolated from the stems of Tinospora crispa exhibit positive inotropic effects on the isolated left atrium of rats[J]. J Ethnopharmacol, 2013, 149: 123-132. DOI:10.1016/j.jep.2013.06.010 |
| [9] |
Liu DY. New cardiotonic constituents from Radix Aconiti Carmichaeli[J]. Chin Tradit Herb Drugs (中草药), 1979, 10: 48. |
| [10] |
Liu F, Kan XW. Dual-analyte electrochemical sensor for fructose and alizarinred S specifically sensitive detection based on indicator displacement assay[J]. Electrochim Acta, 2019, 319: 286-292. DOI:10.1016/j.electacta.2019.07.001 |
| [11] |
Ma Y, Geng FH, Wang YX, et al. Novel strategy to improve the sensing performances of split ATP aptamer based fluorescent indicator displacement assay through enhanced molecular recognition[J]. Biosens Bioelectron, 2019, 134: 36-41. DOI:10.1016/j.bios.2019.03.047 |
| [12] |
Jia MY, Pan YX, Zhou J, et al. Identification of Chinese teas by a colorimetric sensor array based on tea polyphenol induced indicator displacement assay[J]. Food Chem, 2021, 335: 127566. DOI:10.1016/j.foodchem.2020.127566 |
| [13] |
He YN, Xiong X, Lin JZ, et al. Study on the transfer rule of alkaloids in the preparation process of fupian liquid using multi-component contents determination by HPLC-MS/MS coupled with chemometric[J]. Chin J New Drugs (中国新药杂志), 2018, 27: 2954-2961. |
| [14] |
He YN, Ou SP, Xiong X, et al. Stems and leaves of Aconitum carmichaelii Debx. as potential herbal resources for treating rheumatoid arthritis: chemical analysis, toxicity and activity evaluation[J]. Chin J Nat Med, 2018, 16: 641-650. |
| [15] |
Sun W. Application of Photochemical Colorimetric Array Sensor in Volatile Odor Detection of Animal Food (光化学比色阵列传感器在动物性食品挥发性气味检测中的应用)[D]. Dalian: Dalian Polytechnic University, 2016.
|
| [16] |
Li YY, Han J, Yang XJ, et al. Synthesis and application of a phenylboronic acid functionalized block polymer: CN, 201610653703[P]. 2016-8-11.
|
| [17] |
Xiao XH. Towards accurate quality evaluation and control of traditional Chinese Medicine[J]. Acta Pharm Sin (药学学报), 2019, 54: 2139-2140. |
| [18] |
Sun Y, Xu G, Ma SC, et al. Development of an overall evaluation system for traditional Chinese medicine[J]. Acta Pharm Sin (药学学报), 2021, 56: 1752-1756. |
 2022, Vol. 57
2022, Vol. 57


