2. 苏州泽达兴邦医药科技有限公司, 江苏 苏州 215000;
3. 太极集团重庆涪陵制药厂有限公司, 重庆 408099
2. Suzhou Zeda Xingbang Pharmaceutical Technology Co., Ltd., Suzhou 215000, China;
3. Taiji Group Chongqing Fuling Pharmaceutical Factory Co., Ltd., Chongqing 408099, China
藿香正气口服液由苍术、陈皮、厚朴(姜制)、白芷、茯苓、大腹皮、生半夏、甘草浸膏、广藿香油、紫苏叶油制成, 具有解表化湿、理气和中之功效, 用于外感风寒、内伤湿滞或夏伤暑湿所致的感冒。藿香正气口服液收录于2020版《中国人民共和国药典》一部, 以和厚朴酚、厚朴酚及橙皮苷含量评价其质量[1]。然而, 药典中以两种不同的高效液相色谱法分别测定和厚朴酚、厚朴酚总含量和橙皮苷含量, 其方法耗时烦琐。其次, 口服制剂传统含量检测通常是将药液从包装容器中取出后进行含量测定, 这种质量分析方式耗时烦琐, 又有污染的可能, 本文希望在口服制剂质量控制时引入一种快速又无损的分析方法解决该问题, 近红外光谱分析恰好具备该方面的优势[2]。
近红外光谱技术因其快速、无损、无污染等优势, 已被广泛用于快速评价药品质量[3-5]。近红外光谱技术结合化学计量学, 可有效消除外包装对分析的影响[6]。该思路已被应用于定性分析胶囊[7, 8]、片剂[9], 无需打开药物包装即可实现对假药和仿制药的辨别, 大大降低检测的时间成本。此外, 已有研究证明透过安瓿瓶或者塑料注射器可实现对双嘧啶[10]以及抗生素药物[11]的无损测定, 有利于提高注射剂临床使用的安全性。Broad等[12]采用近红外光谱技术, 直接透过琥珀色塑料瓶扫谱, 快速定量测定塑料瓶中乙醇、丙二醇和水的含量, 为口服制剂的无损快速分析提供了可行性依据。与西药口服制剂相比, 中药口服制剂成分更为复杂。Li等[13]采用近红外光谱技术实现了阿胶口服液的透瓶定量分析, 证明近红外光谱技术在中药口服制剂透瓶分析的可行性, 为实现藿香正气口服液的透瓶分析提供参考。
本文以藿香正气口服液为对象, 旨在利用近红外光谱技术结合化学计量学, 以厚朴酚、和厚朴酚及橙皮苷含量为关键质量指标, 建立定量校正模型, 并对模型的预测能力进行验证, 构建一种透瓶检测藿香正气口服液质量的方法, 以期为该类制剂的快速无损检测提供方法参考。
材料与方法仪器及软件 ANTARIS Ⅱ傅里叶变换近红外光谱仪(Thermo, USA), 含OPUS采样系统和数据处理软件; Agilent 1290高效液相色谱仪(Agilent Technologies, USA), 含在线脱气装置、四元泵、自动进样器、二极管阵列检测器(diode array detector, DAD); 色谱柱Phenomenex C18 (250 mm × 4.6 mm, 5 µm), A2004B万分之一电子分析天平(上海越平科学仪器有限公司); Milli-Q超纯水仪(Millipore, USA); 数控超声波清洗机(济南天华超声电子仪器有限公司); DK-S26电热恒温水浴锅; 循环水式多用真空泵(郑州长城科工贸有限公司)。OPUS化学计量学软件; MATLAB (2018b) 软件; Origin函数绘图软件。
试剂与样品 厚朴酚(批号MUST-20031614, 纯度99.90%)、和厚朴酚(批号MUST-20032205, 纯度99.34%)、橙皮苷(批号MUST-20031701, 纯度98.46%), 均购自成都曼思特生物技术有限公司。乙腈和甲醇(HPLC级, 北京百灵威科技有限公司)、乙腈和甲醇(分析级, 国药集团化学试剂有限公司)、磷酸(HPLC级, 北京百灵威科技有限公司); 实验用水为超纯水由Milli-Q纯水仪制得。171批藿香正气口服液由太极集团涪陵制药厂提供, 样品取于罐装完成后, 贴标签前。
样品设计 仅基于生产样本建立的模型范围较窄, 当出现异常样本时则模型失效, 因此引入一组自制样本以扩大校正范围, 提高预测准确性[14]。任取25批样品稀释为原来浓度的50%~80%, 得到25个稀释样本; 另任取50批样品, 随机划分为25组, 每组混合后旋蒸至加入量的75%~90%, 获得25个浓缩样本。每个样品的稀释和浓缩倍数均不同, 不构成线性关系。上述50个自制样本与86个生产样本, 共计136个样本用于建立模型, 另外10个生产样本作为验证样本。
近红外光谱的采集 使用傅里叶变换近红外光谱仪在12 000~4 000 cm-1内采集近红外光谱(near infrared spectra, NIRS)。在室温下以空气为参比, 扣除背景, 扫描次数为32次, 分辨率为8 cm-1。每个样品采集3次光谱, 计算平均值作为样品NIRS。为了探究玻璃瓶对近红外光谱的影响, 实验以两种方式采集光谱, 一是直接透过玻璃瓶扫谱(将藿香正气口服液玻璃瓶直接置于透射检测池位置), 二是从瓶中将藿香正气口服液取出, 置于样品管中进行扫谱(非透瓶)。除扫描玻璃瓶和样品管的差异外, 其余扫谱条件相同。
含量测定参考方法 采用HPLC测定藿香正气口服液中厚朴酚、和厚朴酚及橙皮苷含量作为参考值。因药典方法无法同时测定3个指标含量, 前处理需要两次, HPLC测定需两次, 操作复杂且耗时长, 为提高分析效率, 在参考文献方法[15]的基础上优化色谱条件, 同时测定3种成分, 并进行方法学验证。
供试品及对照品溶液制备 精密吸取藿香正气口服液1.00 mL于10 mL量瓶中, 甲醇定容, 即得供试品溶液。精密称取厚朴酚、和厚朴酚、橙皮苷对照品适量, 加甲醇制成每1 mL含厚朴酚、和厚朴酚、橙皮苷1 mg的溶液, 即得对照品溶液。
色谱条件 色谱柱为Phenomenex C18 (4.6 mm × 250 mm, 5 µm), 流速为0.9 mL·min-1; 以乙腈(A)-0.1%磷酸(B) 为流动相; 柱温为25 ℃, 和厚朴酚和厚朴酚的检测波长为294 nm, 橙皮苷的检测波长为283 nm。梯度洗脱: 0~9 min, 20% A; 9~23 min, 20%~22% A; 23~30 min, 22%~46% A; 30~42 min, 46% A; 42~47 min, 46%~78% A; 47~55 min, 78% A; 55~60 min, 78%~90% A; 60~65 min, 90%~20% A。
方法学考察
专属性 取空白溶液、混合对照品溶液、供试品溶液分别注入液相色谱仪, 比较色谱图, 考察对被测成分是否存在干扰。
线性关系 精密移取1.00、2.00、4.00、6.00、8.00、10.00 mL对照品溶液于20 mL量瓶中, 甲醇定容至刻度, 摇匀, 按HPLC色谱条件进样测定, 记录各成分峰面积。分别以对照品浓度为横坐标、以峰面积为纵坐标进行线性回归, 计算线性回归方程和相关系数。
精密度 精密吸取中间浓度混合对照品溶液, 连续进样6次, 以3种成分的峰面积值计算RSD值。
重复性 精密移取藿香正气口服液6份, 平行制备供试品溶液, 按HPLC色谱条件测定3种成分的含量, 计算RSD。
稳定性 制备供试品溶液1份, 分别于0、2、4、6、8、10和12 h进样分析, 以3种成分的峰面积计算RSD。
加样回收率 精密移取0.5 mL已知浓度的藿香正气口服液9份, 分别置于10 mL量瓶中; 配制与该浓度相近的混合对照品溶液, 分别精密移取0.4、0.5、0.6 mL对照品溶液各3份于上述样品中, 甲醇定容, 混匀, 测定3种成分的峰面积, 计算各成分浓度、回收率及其RSD。
模型建立与评价 通过蒙特卡洛交叉验证算法(Monte Carlo cross validation, MCCV) 识别并剔除异常样本, 采用KS (Kennard-Stone) 算法划分校正集和验证集, 采用一阶导数、归一化对近红外光谱进行预处理。一阶导数可消除基线漂移, 矢量归一化能增强光谱差异, 可以校正由光程或样品稀释等导致的光谱变化[16]。预处理后的光谱由竞争性自适应重加权(competitive adaptive reweighted sampling, CARS) 算法进行变量筛选, 建立和厚朴酚、厚朴酚及橙皮苷的偏最小二乘回归(partial least squares regression, PLSR) 模型, 以校正集相关系数Rc、校正集均方根误差(root mean square errors of calibration, RMSEC)、校正集相对标准误差(relative standard errors of calibration, RSEC)、交叉验证均方根误差(root mean square errors of cross-validation, RMSECV) 作为模型性能评估指标。用建立的PLSR模型对验证集进行预测, 以验证集相关系数Rp、验证集均方根误差(root mean square errors of prediction, RMSEP)、验证集相对标准误差(relative standard errors of prediction, RSEP) 作为指标, 评价模型的预测能力。为进一步验证模型的预测能力, 引入10批独立的藿香正气口服液作为外部验证集, 以配对t检验[17]的t值和P值作为指标进行显著性分析, 选择显著性水平α = 0.05, 进行了两次t检验, 一是预测值和真实值(HPLC测定值) 之间, 二是透瓶和非透瓶两种模型预测值之间, 如果t值均低于临界值2.262, P值均大于0.05, 说明二者之间无显著性差异, 模型预测性良好。
结果 1 方法学验证 1.1 专属性图 1为检测波长294、283 nm时的高效液相色谱图, 阴性溶液未出现与对照品及藿香正气口服液中3种待测成分保留时间相的色谱峰, 表明阴性溶液对待测成分均无干扰。
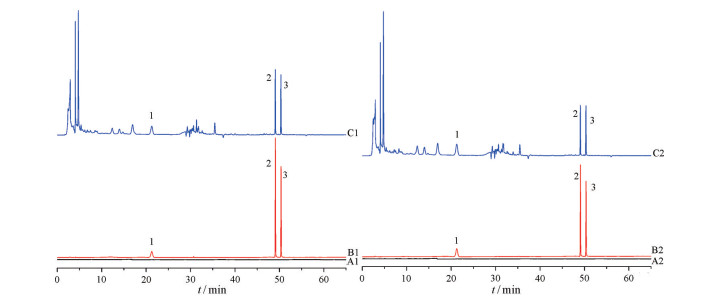
|
Figure 1 High performance liquid chromatograms. A1: Blank solvent at 294 nm; B1: Mixed reference solution at 294 nm; C1: Sample solution at 294 nm; A2: Blank solvent at 283 nm; B2: Mixed reference solution at 283 nm; C2: Sample solution at 283 nm; 1: Hesperidin; 2: Honokiol; 3: Magnolol |
结果如表 1所示, 厚朴酚、和厚朴酚、橙皮苷在各自的浓度范围内线性回归系数均大于0.999, 线性关系良好。
| Table 1 Linearity of the 3 analytes in Huoxiang Zhengqi oral liquid |
厚朴酚、和厚朴酚、橙皮苷峰面积的RSD分别为0.03%、0.14%、0.18%, 表明仪器精密度良好。
1.4 重复性厚朴酚、和厚朴酚、橙皮苷含量的RSD分别为0.80%、0.74%、2.02%, 表明重复性良好。
1.5 稳定性厚朴酚、和厚朴酚、橙皮苷峰面积的RSD分别为0.20%、0.24%、0.19%, 说明供试品溶液在12 h内稳定。
1.6 加样回收率厚朴酚、和厚朴酚、橙皮苷的平均加样回收率分别为98.74%、98.38%、99.00%, RSD分别为0.81%、1.22%、1.84%。该方法准确可靠, 可用于藿香正气口服液中厚朴酚、和厚朴酚、橙皮苷的含量测定。
2 透瓶扫取及非透瓶扫取近红外光谱由图 2A、2B可知, 透瓶和非透瓶得到的两种谱图之间存在明显差异; 由图 2C可知, 空玻璃瓶光谱与背景光谱也不相同, 说明玻璃瓶对近红外吸收光谱存在影响。另外, 图 2A透瓶扫谱时玻璃瓶的直径远大于图 2B所用样品管, 故光谱差异可能是玻璃瓶以及光程不同造成的[18]。

|
Figure 2 Raw near infrared spectra (NIRS) scanned in a non-destructive way (A) and in a destructive way (B) and NIRS of background (C) |
经MCCV剔除异常点后, 使用KS按7∶3划分校正集和验证集, 结果如表 2所示。校正集浓度范围涵盖验证集, 划分结果合理。
| Table 2 Results of sample set partition |
分别采用一阶导数和矢量归一化对NIRS进行预处理。然后采用CARS在12 000~4 000 cm-1内筛选特征变量, 设置采样次数为100, 选择RMSECV最小时的子集为关键变量。CARS算法的运行过程如图 3所示, 随着采样次数增加, 变量数逐渐减小, RMSECV先减小后增大, 说明冗余信息被剔除后, 模型效果得以优化, 而后一些有效信息也被消除。当采样次数为42次时, RMSECV最小, 回归系数接近于1, 选择该采样次数作为利用CARS算法筛选变量时的参数。
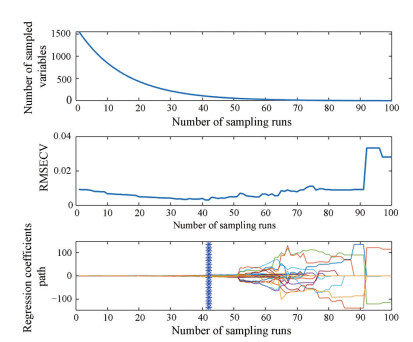
|
Figure 3 Competitive adaptive reweighted sampling (CARS) variable screening results for combination data set |
选取最优变量子集后, 建立PLSR定量校正模型。表 3为用非透瓶扫描的NIRS建模得到的模型效果。由表 3可知, 3个指标模型的Rp值均高于0.98, RMSEP均小于0.008 3, 模型预测能力较强。经一阶导数预处理后, 厚朴酚模型的RMSEP和RMSEC较小, 但相差较大, 存在过拟合的风险, 因此将无预处理的模型作为最佳模型。和厚朴酚和橙皮苷的光谱经一阶导数处理后建模效果最佳, Rp值较高, RSEP明显降低, RMSEP和RMSEC较小且接近。3个指标的最佳模型预测效果如图 4所示, 样本均分分布在y = x两侧, 模型预测效果较好。
| 表 3 Effects of different pretreatment methods on performance of the destructive models. LVs: Latent variables; RMSEC: Root mean square errors of calibration; RMSEP: Root mean square errors of prediction; R: Correlation coefficient; RSEC: Relative standard errors of calibration; RSEP: Relative standard errors of prediction; RMSECV: Root mean square errors of cross-validation |
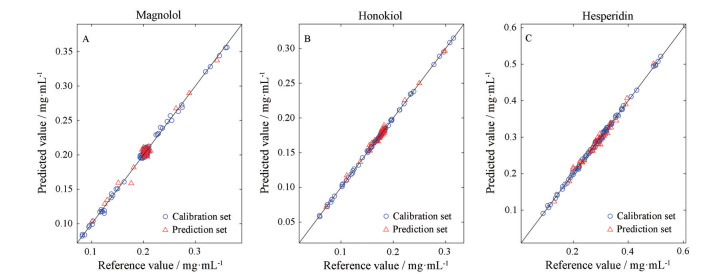
|
Figure 4 The correlation between reference values and predicted values of calibration models in the destructive way. A: Magnolol; B: Honokiol; C: Hesperidin |
表 4为以透瓶采集的NIRS建模得到的模型效果, 从表 4可以看出, 3个指标模型的Rp值均高于0.99, RMSEP均小于0.008 4, RSEP均控制在2.83%以内, 模型的预测能力较强。经一阶导数预处理后, 厚朴酚及和厚朴酚的模型RMESP和RMSEC相差较大, 存在过拟合的风险, 故选择无预处理的模型作为最佳模型。橙皮苷选择一阶导数预处理后的模型为最佳模型, 该模型Rp值较高, RMSEP和RMSEC较小且接近, RSEP最小。3个指标的最佳模型预测效果如图 5所示。
| Table 4 Effects of different pretreatment methods on performance of the non-destructive models |

|
Figure 5 The correlation between reference values and predicted values of calibration models in the non-destructive way. A: Magnolol; B: Honokiol; C: Hesperidin |
对比透瓶扫谱和非透瓶扫谱, 二者均有较好的建模效果, 可以判定玻璃瓶不会影响模型的预测准确性, 藿香正气口服液的透瓶快检是可行的。
5 透瓶扫谱建模和非透瓶扫谱建模的外部验证和评价以独立的10个藿香正气口服液样品作为外部验证, 进一步比较两种模型的预测能力。以前述建立的最佳模型进行预测, 首先将透瓶模型得到的预测值与HPLC参考值进行配对t检验(n = 9, α = 0.05), 结果厚朴酚、和厚朴酚、橙皮苷组的t值分别为0.721 4、0.313 9、0.051 5, 对应的P值分别为0.755 5、0.619 6、0.520 0, t值均低于临界值2.262, P值均大于0.05, 说明透瓶模型得到的预测值与HPLC参考值之间无显著差异, 透瓶模型能较准确地预测各指标含量。其次, 将透瓶模型和非透瓶模型的预测值进行配对t检验(n = 9, α = 0.05), 结果厚朴酚、和厚朴酚、橙皮苷组的t值分别为0.439 5、0.909 2、0.388 8, 对应的P值分别为0.664 7、0.806 5、0.646 8, t值均低于临界值2.262, P值均大于0.05, 表明两类预测值之间无显著差异, 说明直接透瓶扫谱对最终模型的预测效果无显著影响, 且不会降低模型的预测能力。
讨论本文采用近红外光谱技术结合化学计量学建立了藿香正气口服液的定量分析模型。各项评价指标表明, 直接透瓶扫谱建立的模型预测性能较好, 对比非透瓶模型, 玻璃瓶对建模效果无影响, 透瓶扫谱不会降低模型预测性。相较于传统高效液相色谱技术耗时长、操作复杂、离线滞后的缺点, 近红外光谱技术可以在不破坏产品原包装的情况下预测相关被测成分含量, 该方法成本低、效率高, 适用范围广, 可提高企业对产品监测的效率, 也为其他瓶装液体制剂的质量监测提供了参考。另外, 玻璃瓶有近红外吸收, 不同厂家玻璃瓶的吸收可能不同, 本文藿香正气口服液样品包装均是低硼硅玻璃瓶, 由太极集团涪陵制药厂统一购置, 对光谱的影响较一致, 微小差异可以通过化学计量学方法加以消除。如果拟建立适用于不同厂家的通用模型, 需要采集不同厂家样品进行建模, 以消除玻璃瓶的影响。由于不同外包装对光谱的影响程度不同, 直接透过外包装进行快速检测的方法普适性仍需进一步探究。
作者贡献: 吴永江负责整体设计; 李倩设计并完成实验; 李倩、斯乐婷和何衍钦整理数据并撰写论文; 王钧、彭涛、董自亮提供实验材料。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Part 1. Beijing: China Medical Science Press, 2020: 1880.
|
| [2] |
Cui PD, Zhao J, Liu M, et al. Non-invasive detection of medicines and edible products by direct measurement through vials using near-infrared spectroscopy: a review[J]. Infrared Phys Technol, 2021, 115: 103687. DOI:10.1016/j.infrared.2021.103687 |
| [3] |
Wu YJ, Jin Y, Li YR, et al. NIR spectroscopy as a process analytical technology (PAT) tool for on-line and real-time monitoring of an extraction process[J]. Vib Spectrosc, 2012, 58: 109-118. DOI:10.1016/j.vibspec.2011.10.006 |
| [4] |
Liu XS, Chen JS, Chen GQ, et al. On-line detection of concentration process of Ganmaoling granules by near infrared spectroscopy combined with automatic control system[J]. Acta Pharm Sin (药学学报), 2017, 52: 127-132. |
| [5] |
Liu XS, Sun FF, Jin Y, et al. Application of near infrared spectroscopy combined with particle swarm optimization based least square support vactor machine to rapid quantitative analysis of Corni Fructus[J]. Acta Pharm Sin (药学学报), 2015, 50: 1645-1651. |
| [6] |
Rodionova OY, Balyklova KS, Titova AV, et al. Application of NIR spectroscopy and chemometrics for revealing of the 'high quality fakes' among the medicines[J]. Forensic Chem, 2018, 23: 82-89. |
| [7] |
Rodionova OY, Titova AV, Demkin NA, et al. Qualitative and quantitative analysis of counterfeit fluconazole capsules: a non-invasive approach using NIR spectroscopy and chemometrics[J]. Talanta, 2019, 195: 662-667. DOI:10.1016/j.talanta.2018.11.088 |
| [8] |
Si LT, Ni HF, Pan DY, et al. Nondestructive qualitative and quantitative analysis of Yaobitong capsule using near-infrared spectroscopy in tandem with chemometrics[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2021, 252: 119517. DOI:10.1016/j.saa.2021.119517 |
| [9] |
Rodionova OY, Titova AV, Balyklova KS, et al. Detection of counterfeit and substandard tablets using non-invasive NIR and chemometrics[J]. Talanta, 2019, 205: 120150. DOI:10.1016/j.talanta.2019.120150 |
| [10] |
Sanches FA, Abreu RB, Pontes M, et al. Near-infrared spectrometric determination of dipyrone in closed ampoules[J]. Talanta, 2012, 92: 84-86. DOI:10.1016/j.talanta.2012.01.045 |
| [11] |
Mai LM, Eveleigh L, Hasnaoui I, et al. Rapid discrimination and determination of antibiotics drugs in plastic syringes using near infrared spectroscopy with chemometric analysis: application to amoxicillin and penicillin[J]. J Pharm Biomed Anal, 2017, 138: 249-255. DOI:10.1016/j.jpba.2017.02.019 |
| [12] |
Broad NW, Jee RD, Moffat AC, et al. Non-invasive determination of ethanol, propylene glycol and water in a multi-component pharmaceutical oral liquid by direct measurement through amber plastic bottles using Fourier transform near-infrared spectroscopy[J]. Analyst, 2000, 125: 2054-2058. DOI:10.1039/b006789j |
| [13] |
Li WL, Han HF, Zhang L, et al. A feasibility study on the non-invasive analysis of bottled Compound E Jiao oral liquid using near infrared spectroscopy[J]. Sens Actuator B Chem, 2015, 211: 131-137. DOI:10.1016/j.snb.2015.01.073 |
| [14] |
Wan XH, Li G, Li T, et al. A review on M + N theory and its strategies to improve the accuracy of spectrochemical composition analysis of complex liquids[J]. Appl Spectrosc Rev, 2020, 52: 87-104. |
| [15] |
Chen JF, Guo DL, Dong ZL, et al. Simultaneous determination of 9 components in Huoxiang Zhengqi oral liquid by HPLC[J]. China Pharm (中国药房), 2019, 663: 82-87. |
| [16] |
Li HD, Liang YZ, Xu QS, et al. Key wavelengths screening using competitive adaptive reweighted sampling method for multivariate calibration[J]. Anal Chim Acta, 2009, 648: 77-84. DOI:10.1016/j.aca.2009.06.046 |
| [17] |
Bi YF, Zhu HB, Xing JP, et al. Effects of six kinds of Chinese herb extracts on the activities of rat liver microsomes in vitro[J]. Acta Pharm Sin (药学学报), 2013, 48: 1131-1135. |
| [18] |
Wang SP, Gong ZM, He YJ, et al. Effects of background and optical path length on predicting the contents of tea polyphenol with NIR models[J]. J Huazhong Agric Univ (华中农业大学学报), 2015, 34: 120-124. |
 2022, Vol. 57
2022, Vol. 57


