2. 上海交通大学医学院附属第九人民医院, 上海 201999
2. Shanghai Ninth People's Hospital, Shanghai Jiao Tong University, School of Medicine, Shanghai 201999, China
新型冠状病毒(COVID-19) 自2019年底暴发以来, 至今已在210个国家和地区传播, 累计逾1.3亿人感染[1], 然而目前仍未研发出治疗COVID-19的特效药物[2], 临床中主要采取中西医结合对症治疗。我国传统中医药在历次瘟疫防治中积累了大量临床经验, 借鉴其既往成功经验对于新冠肺炎的防治具有积极作用。
中医药组方“金花清感颗粒”由金银花、石膏、蜜麻黄、炒苦杏仁、黄芩、连翘、浙贝母、知母、牛蒡子、青蒿、薄荷、甘草等共12味中药组成[3], 以银翘散、白虎汤、麻杏石甘汤三方为基础, 集温病、伤寒两学派之大成, 具有疏风宣肺, 清热解毒等功效, 曾在甲型H1N1流感防治中发挥重要作用[4]。疫情暴发初期, 金花清感颗粒相继被国家卫健委、国家中医药管理局列为临床指南用药, 作用效果显著。段燦等[5]纳入123例COVID-19患者进行临床对照试验, 其中金花清感颗粒联合常规治疗的82例患者相对于常规治疗组发热、乏力、咳嗽等临床症状均得到明显缓解, 证实金花清感颗粒具有明确的临床疗效。金花清感颗粒药味众多、成分复杂, 目前尚无系统的体内外化学成分研究报道。本研究利用UPLC-QTOF/MS技术, 分析金花清感颗粒体外化学组分及体内暴露组分, 旨在揭示金花清感颗粒的药效物质基础与组方原理, 以期为推进中医药组方在COVID-19临床中的应用提供实验依据。
材料与方法仪器 安捷伦1200型液相色谱仪(Agilent 1200 series, Agilent Technologies, Palo Alto, CA, USA); Masshunter工作站和质谱分析软件(B.07.00, Agilent Technologies, Palo Alto, CA, USA); 6538 UHD Accurate-Mass Q-TOF/MS; SB3200-T超声发生器(50 kHz, 120 W, 上海科导超声仪器公司); WinNonlin药动分析软件(Pharsight Corporation, v.8.1, CA, USA)。
药品与试剂 金花清感颗粒[聚协昌(北京) 药业有限公司, 20200333]; 连翘苷酯Ⅰ (S23N7D25441, 纯度≥ 95%)、甘草苷(Z07J12X136344, 纯度≥ 98%)、绿原酸(A22GB158496, 纯度≥ 98%)、异绿原酸C (P03N11L129757, 纯度≥ 98%)、连翘苷酯A (Z10N9L71605, 纯度≥ 98%), 对照品均购于上海源叶生物科技有限公司; 纯净水(杭州娃哈哈集团有限公司)。
样品和对照品溶液的制备 精密称取金花清感颗粒5.0 g, 置于锥形瓶中, 精密加入纯净水100 mL溶解, 摇匀后置于220 V、50 Hz的超声中提取42 min, 取出, 冷却至室温, 用纯净水补足刻度, 均分为两管10 000 r·min-1离心10 min, 取上清液用0.22 μm微孔滤膜滤过, 滤液分析后得到金花清感颗粒样品溶液。准确称取连翘苷酯Ⅰ、甘草苷、绿原酸、异绿原酸C、连翘苷酯A对照品各5 mg, 加入200 μL二甲基亚砜稀释溶解, 反复吹吸混匀, 得到对照品储备液; 分别精密量取40 μL, 混合, 制成5 mg·mL-1的对照品混合储备液。
实验动物 购买于上海斯莱克动物有限责任公司, 许可证号: SYXK (沪) 2017-0004。9只SD雄鼠, 体重(250 ± 20) g, 随机分为空白组(3只) 和给药组(6只), 饲养于独立换气笼盒, 12 h明暗交替、动物房内温度为(18 ± 2) ℃, 期间自由饮水进食, 实验前禁食12 h, 自由饮水。本实验动物饲养于海军军医大学药学系, 本研究中所有实验动物的使用严格按照海军军医大学伦理委员会要求进行。
色谱条件 色谱柱: Agilent Zorbax SB-Aq柱(250 mm × 4.6 mm, 5 m); 流动相为蒸馏水(A相)-乙腈(B相), 梯度洗脱: A相为0~2 min, 0~2%, B相为2~19 min, 2%~98%; 进样量200 μL; 进样前以流动相按梯度初始条件平衡5 min; 流速: 0.4 mL·min-1; 柱温: 40 ℃; 检测时间19 min。
质谱条件 使用全扫描模式进行Q-TOF分析, 质量范围设置为m/z 50~1 500, 分别在正离子、负离子模式下进行。ESI源条件如下: 干燥气体流速, 11 L·min-1; 干燥气体温度, 350 ℃; 雾化器气体压力, 45 psi (1 psi ≈ 6.9 kPa); 毛细管电压, 3 500 V; 碎片器电压, 从100 V动态调整至350 V; 撇沫器电压, 60 V; octopoleRF, 750 V。正离子模式下参比离子m/z分别为121.050 9和922.009 8, 负离子模式参比离子m/z为112.985 6和1 033.988 1。所有数据均由安捷伦MassHunter软件处理。
生物样品采集和处理 取适量金花清感颗粒样品, 以蒸馏水溶解, 制成0.590 g·mL-1总苷灌胃液。实验组灌胃给予溶液3.71 g·kg-1, 空白组灌胃等量生理盐水。给药后0.5、1、2、4和8 h分别于眼眶静脉取血0.8 mL。采集血样置于肝素钠离心管中, 5 000 r·min-1离心15 min, 上清液于-70 ℃冷冻保存。精密称取L-氯苯丙氨酸(内标) 5 mg溶于1 mL甲醇, 置于220 V、50 Hz的超声中提取5 min后取50 μL至50 mL量瓶定容, 得到5 μg·mL-1内标试液, 预冷于-80 ℃冰箱放置12 h。精密量取100 μL自然融化后的血清样品, 加入150 μL内标试液中, 涡旋混匀3 min, 4 ℃、12 000 r·min-1离心15 min, 取上清150 μL, 进样分析。
数据采集与处理 通过QTOF/MS采集金花清感颗粒体内外化学成分的精确分子信息, 数据导入质谱分析软件Mass Hunter进行处理与计算, 通过与化合物库的比对搜索对每个化合物进行成分鉴定。药代动力学部分: 内标法测定大鼠血样中4种主要化学成分的含量。数据导入WinNonLin (Pharsight Corporation, v.8.1, CA, U.S.A.) 分析该4种化合物的药代动力学特征, 选择单次给药模式, 按一级消除动力学计算, 获取达到最大血药浓度时间、最大血药浓度、血药浓度时间曲线下面积、消除半衰期、平均停留时间、血浆清除率和表观分布容积共8个PK参数。
结果 1 金花清感颗粒体外成分分析在上述色谱质谱条件下, 金花清感颗粒供试品溶液分别在正离子、负离子模式下扫描并获取UPLC-QTOF/MS总离子流图(图 1), 其中25个化合物峰在正离子模式下测得, 52个化合物峰在负离子模式下测得。
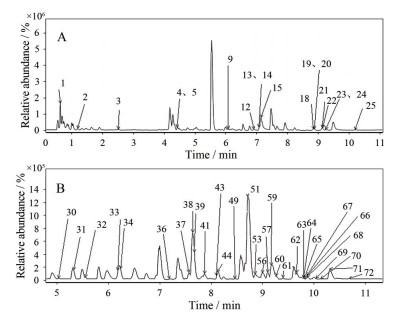
|
Figure 1 Analysis of Jinhua Qinggan granules components in the test solution by UPLC-QTOF/MS. A: Negative ion mode high resolution total ion current chromatogram; B: Positive ion mode high resolution total ion current chromatogram. The number of peak 1-77 in this figure was consistent with that in Table 1 |
金花清感颗粒化学成分数据库根据金花清感颗粒的方剂组成构建, 共包含328个已知成分。金花清感颗粒化学成分的精确分子信息由QTOF/MS检测, 质谱分析软件Mass Hunter采集并计算, 随后通过与化学成分数据库一一比对获得成分鉴定结果。为进一步确定其成分, 本研究结合对照品和相关文献对其中5种可能存在同分异构体的样品(连翘酯苷A和I、绿原酸和新绿原酸、甘草苷) 在120 V电压、10 eV能量下进行了二级质谱的碎片离子鉴定分析。
其中33号峰准分子离子为m/z 353.087 6 [M-H]-, 主要碎片离子峰为m/z 191.055 6, 可推测为该准分子离子峰脱去一分子咖啡酰基(-C9H7O3) 得到; 碎片进一步丢失两分子H2O和一分子CO可得到碎片离子m/z 126.880 8 [M-C9H7O3-H]-; 碎片离子m/z 179.034 6表示脱去一分子奎宁酸(-C7H12O6), 得到[M-H-C7H12O6]-, [M-H-C7H12O6]-继续丢失一分子CO2得到m/z 126.880 8 [M-H-C7H12O6-CO2]-, 与文献[6, 7]报道一致, 因此33号峰可鉴定为新绿原酸, 裂解途径如图 2所示。38号峰保留时间7.641 min与对照品连翘酯苷Ⅰ保留时间7.613 min接近, 主要碎片离子m/z 577与文献[8]报道一致, 可推测为连翘酯苷Ⅰ。50号峰保留时间为8.46 min, 与对照品甘草苷保留时间8.027 min接近, 二级信号m/z 255.066 0, 提示为脱去-C6H8O6得到[M-C6H8O6-H]-, 该化合物可鉴定为甘草苷[9-11]。最终鉴定得到77种化学成分, 其中正离子模式下25种, 负离子模式下52种(表 1)。
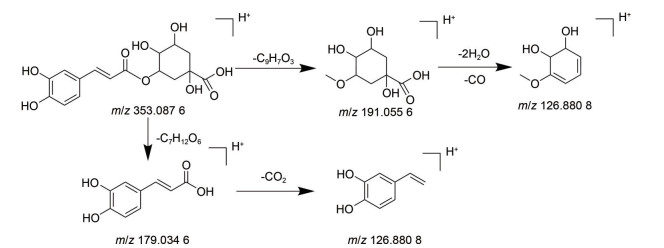
|
Figure 2 The MS fragmentation pattern of neochlorogenic acid |
| Table 1 Compounds identified in Jinhua Qinggan test solution and rat plasma by UPLC-QTOF/MS. RT: Retention time. *Compounds were proved by standard references. No. 1-25 were performed in positive ion mode while 26-77 in negative ion mode |
本文采用UPLC-QTOF/MS技术对金花清感颗粒在大鼠体内的暴露组分进行了鉴定分析, 共鉴定出22个能在体内以原型暴露的化合物组分。中药复方中能被吸收进入循环并维持一定暴露水平的化合物单体, 是其发挥药效作用的主要药效物质。临床应用及药理研究表明, 金花清感颗粒具有显著的抗病毒及抗新冠肺炎活性, 因此22种体内暴露组分是潜在的抗新冠肺炎活性化合物。在后续的研究中, 课题组将对这些组分进行深入的活性组分筛选及药效验证, 以期得到药效及机制明确的抗病毒及新冠肺炎活性的单体成分。
此外, 连翘酯苷Ⅰ和新绿原酸等可以显著抑制血管紧张素转化酶2 (angiotensin converting enzyme 2, ACE2) 活性, 能够阻断病毒与S蛋白结合从而发挥抗新冠病毒的潜在作用[12]。汉黄芩素、木犀草素、山柰酚等可能通过调节花生四烯酸、缺氧诱导因子1 (hypoxia inducible factor 1, HIF-1) 等多种信号通路, 抑制白细胞介素17 (interleukin 17, IL17), 从而下调炎症反应、调节免疫清除自由基, 治疗新冠肺炎[13]。水杨酸、根皮酸、5-羟基-3, 6, 7, 4'-四甲氧基黄酮、甘草苷4种化学成分在体内暴露水平较高。其中甘草苷具有抗炎、抗病毒等多种活性, 已有研究表明其能调控相关功能基因、模拟Ⅰ型干扰素起到抑制新冠复制的效果[14]。水杨酸通过调控花生四烯酸代谢通路、抑制白细胞激活能有效调控炎性因子水平, 缓解炎症反应[15]。
3 药动学分析利用Mass Hunter获得大鼠体内4种主要化学成分的峰面积, 与精确标定浓度的内标物峰面积进行比对, 计算得到其血药浓度并绘制药时曲线(图 3), 获得达到最大血药浓度时间、最大血药浓度、血药浓度时间曲线下面积、消除半衰期、平均停留时间、血浆清除率和表观分布容积共8个PK参数(表 2)。其中, 甘草苷和5-羟基-3, 6, 7, 4′-四甲氧基黄酮同为黄酮类成分, 在大鼠体内表现出相似的药动学特征, 甘草苷吸收速率较快, 在给药0.5 h时后即达到血药浓度最大值。4种化合物中水杨酸生物利用度最高, AUC浓度时间曲线面积为22.175 2 μg·h·mL-1。根皮酸表观分布容积为2 268.695 3 mL·kg-1, 血浆清除率为89.654 0 mL·h-1·kg, 高于其他组分, 表明其在大鼠体内吸收速率高且滞留时间短暂。
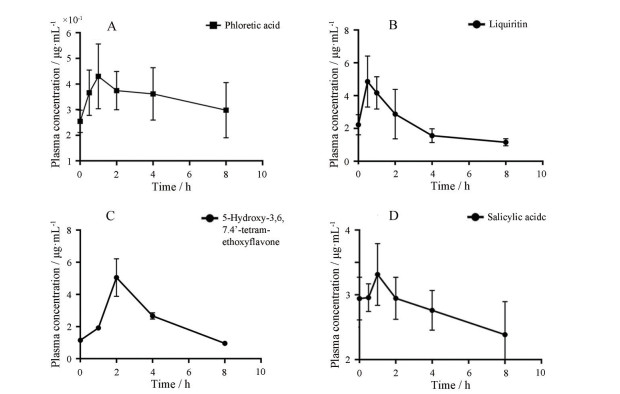
|
Figure 3 The concentration-time curve of the four main compounds. A: Phloretic acid; B: Liquiritin; C: 5-Hydroxy-3, 6, 7, 4'-tetramethoxyflavone; D: Salicylic acid |
| Table 2 Pharmacokinetic parameters of Jinhua Qinggan after intragastric administration (n = 6) |
传统中医药组方金花清感颗粒具有良好的抗新冠肺炎作用, 然而现有研究对于组方中的有效化学成分尚不清晰, 因此明确其主要化合物组分以及体内暴露成分对于揭示金花清感颗粒的药效物质基础与组方原理, 阐明其作用机制具有重要意义。
本研究采用UPLC-QTOF/MS技术对金花清感颗粒的主要化学组分进行了鉴定分析, 共鉴定出77种体外化学成分。该方法稳定性强, 具有高灵敏度与高分析效率, 能在20 min内完成组方的成分分析, 并检测出样品中含量较低的化学组分。随后, 经过与对照品二级图谱的比对, 具有同分异构体的3个化学组分分别被鉴别为连翘酯苷Ⅰ、新绿原酸和甘草苷。已鉴定出的化学成分主要分布于金银花、黄芩、连翘, 符合中药复方中君臣佐使配伍原则。
在金花清感颗粒大鼠体内暴露组分的分析过程中, 22种化合物组分被鉴定出在大鼠体内具有较高暴露水平。由此推测, 这些体内暴露组分可能为金花清感颗粒的药效物质基础, 是在体内发挥抗炎、抗病毒等活性以缓解肺炎症状的潜在活性组分。在后期研究中, 对这些组分深入的药效研究有望能够揭示金花清感颗粒的药理作用机制, 为新冠肺炎治疗药物的研发提供新的活性化合物。本研究通过对体内暴露组分的鉴定, 为金花清感组方中活性单体成分的筛选研究范围提供了参考, 以期能加快活性化合物的发现进程。
本研究进一步绘制4种体内暴露水平较高的组分的药时曲线图, 获得达到最大血药浓度时间、最大血药浓度、血药浓度时间曲线下面积、消除半衰期、平均停留时间、血浆清除率和表观分布容积共8个PK参数, 金花清感颗粒有效成分药动学特征得到了简要的阐明, 其中两种黄酮类成分甘草苷吸收速率较快, 最早达到血药浓度峰值水平, 表现出相似的药物代谢特征, 水杨酸生物利用度最高, 根皮酸能在大鼠体内滞留时间较短, 吸收速率较高。实验初步揭示了金花清感颗粒的潜在活性成分, 并为其临床用药剂量及用药频率等提供了理论依据和参考。
作者贡献: 本文由曾垣烨、何盈盈、陈嫣婷负责研究思路设计; 曾垣烨、陈嫣婷、何盈盈负责实验实施; 陈嫣婷、何盈盈负责数据处理; 曾垣烨负责论文撰写; 陈啸飞和顾妍秋负责论文修改。
利益冲突: 本文的作者和所涉及的内容不存在潜在的利益冲突。
| [1] |
Peng WT, Xu Y, Han D, et al. Mechanism of Jinhua Qinggan granule in treating novel coronary viral pneumonia based on network pharmacology and molecular docking technology[J]. Nat Prod Res Dev (天然产物研究与开发), 2020, 12: 1992-2002. |
| [2] |
Chen LL, Ge WB, Rong Y, et al. The application and research progress of Chinese medicine in the prevention and treatment of new crown pneumonia[J]. Acad J Shanghai Univ Tradit Chin Med (上海中医药大学学报), 2020, 34: 1-8. |
| [3] |
Guo CC, Jiao HC, Li YL, et al. Traditional Chinese medicine "to correct evil" treatment in the "three drugs three-way" treatment of new crown pneumonia reflected[J]. J Liaoning Univ Tradit Chin Med (辽宁中医药大学学报), 2020, 22: 159-163. |
| [4] |
Yang YY, Dou XX, Wang FY, et al. The theory of Chinese medicine against the "three drugs and three sides" of new coronavirus pneumonia is discussed[J]. Tianjin J Tradit Chin Med (天津中医药), 2021, 38: 700-705. |
| [5] |
Duan C, Xia WG, Zheng CJ, et al. Clinical observation on the treatment of mild COVID-19 with Jinhua Qinggan granules combined with conventional western medical treatment protocol[J]. J Tradit Chin Med (中医杂志), 2020, 61: 1473-1477. |
| [6] |
Tian YT, Wang Y, Huo ZP, et al. The reaction of chlorogenic acid and sulfite and its application in identifying sulfur-fumigated medicinal materials[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2019, 25: 122-127. |
| [7] |
Liu R, Wang R, Pei K, et al. UHPLC-Q-Orbitrap HRMS rapid identification of the chemical constituents of sheep red mutton[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2020, 26: 145-151. |
| [8] |
Ye LH, Guo YL, Yang Y, et al. Based on UPLC-Q-TOF-MS method for rapid analysis and identification of the chemical components of Forsythia suspense[J]. Pharm Clin Chin Mater Med (中药与临床), 2020, 11: 14-18, 35. |
| [9] |
Wen W, Li L, Li DK, et al. Analysis of the chemical composition difference of licorice processed products based on liquid mass spectrometry and plant metabolomics[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2020, 26: 104-110. |
| [10] |
Yang B, Wang Y, Tian M, et al. Based on UPLC-Q-TOF-MS/MS to study the chemical constituents of licorice in Pinellia ternate[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2017, 23: 45-49. |
| [11] |
Ji WL, Zhou ZH, Wang TT, et al. Analysis of the chemical constituents of Banxia Xiexin Decoction based on UPLC-LTQ-Orbitrap-MS method[J]. Chin J Pharm Anal (药物分析杂志), 2020, 40: 1736-1750. |
| [12] |
Chen XF, Wu YL, Chen C, et al. Identifying potential anti-COVID-19 pharmacological components of traditional Chinese medicine Lianhuaqingwen capsule based on human exposure and ACE2 biochromatography screening[J]. Acta Pharm Sin B, 2021, 11: 222-236. DOI:10.1016/j.apsb.2020.10.002 |
| [13] |
Leung EL, Pan HD, Huang FY, et al. The scientific foundation of Chinese herbal medicine against COVID-19[J]. Engineering, 2020, 6: 1099-1107. DOI:10.1016/j.eng.2020.08.009 |
| [14] |
Li JF, Li HR, Shen FF, et al. Biochemical and molecular biological mechanisms of anti-inflammatory effects of salicylic acid[J]. J Clin Med Lit (临床医药文献电子杂志), 2017, 4: 1375-1377. |
| [15] |
Zhu J, Deng YQ, Wang X, et al. An artificial intelligence system reveals liquiritin inhibits SARS-CoV-2 by mimicking type Ⅰ interferon[J/OL]. BioRxiv, 2020. https://doi.org/10.1101/2020.05.02.074021.
|
 2022, Vol. 57
2022, Vol. 57


