广西美登木(Maytenus guangxiensis C. Y. Cheng et W. L. Sha) 为卫矛科(Celastraceae) 美登木属植物, 主要分布于中国广西, 是中国的特有植物, 也是广西的特有品种[1]。现代药理实验表明, 广西美登木具有抗肿瘤等活性[2]。该植物可用于调火路, 清热毒, 祛风毒, 抗癌等[3]。美登木属植物富含三萜类、倍半萜及其生物碱类等化学成分。其中, 三萜类为该属植物的特征成分, 具有抗菌[4]、抗肿瘤[5]等活性。目前, 国内外研究者从美登木属植物中已分离得到100多个新的三萜类化合物[6]。但针对广西美登木中的化学成分及其药理活性研究尚不深入, 本研究在开展美登木属三萜类等成分的归纳基础上[6], 初步开展了广西美登木三萜类化学成分研究, 从中分离得到了4个三萜类化合物, 分别鉴定为: 广西美登木酮A (1)、广西美登木酮B (2)、11α-methoxyurs-12-ene-1β, 3β-diol (3) 和lup-20(29)-ene-3β, 11α-diol (4) (图 1), 其中化合物1和2为两个新的三萜类化合物, 化合物3和4为首次从广西美登木中分离得到。同时, 采用MTT法评价化合物1、3和4体外细胞毒活性, 实验结果表明化合物3对人宫颈癌细胞(HeLa) 具有良好的抑制作用, 其IC50值为10.68 μmol·L-1。
|
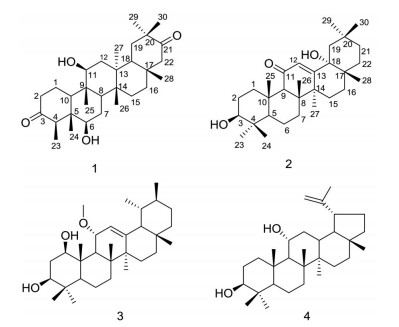
Figure 1 Chemical structures of compounds 1-4 |
化合物1 白色粉末, TLC薄层色谱喷10%的硫酸乙醇溶液, 加热显色呈紫红色, 提示其可能为三萜类化合物。红外光谱IR显示化合物结构中存在羟基官能团(3 473 cm-1)、甲基官能团(2 937 cm-1), 在1 708 cm-1处的碳氧双键伸缩振动提示有羰基存在。HR-ESI-MS显示准分子离子峰m/z: 473.360 9 [M+H]+ (计算值: 473.363 1), 确定其分子式为C30H48O4, 不饱和度为7。在1H NMR谱中, 高场区显示7个甲基氢质子单峰信号δH 0.79 (3H, s)、0.93 (3H, s)、1.07 (3H, s)、1.09 (3H, s)、1.15 (3H, s)、1.17 (3H, s)、1.22 (3H, s) 和1个甲基氢质子双峰信号δH 1.13 (3H, d, J = 6.7 Hz), 低场区显示2个连有电负性基团的氢质子信号δH 3.67 (1H, dd, J = 6.5, 4.9 Hz) 和3.69 (1H, dd, J = 5.9, 4.9 Hz), 提示结构母核中含有2个含氧取代基。结合13C NMR和DEPT135°谱, 发现该化合物共有30个碳信号, 其中包括8个伯碳、8个仲碳、6个叔碳、8个季碳。在高场区部分显示8个甲基碳信号δC 9.4、10.6、12.5、19.5、21.0、25.0、28.9、33.5, 以及2个连氧碳信号δC 76.2、79.0, 均与氢谱中所得结论相符。同时, 还给出了2个羰基碳信号δC 212.8、218.5。通过HSQC图谱, 对化合物1的碳氢信号进行了准确的归属, 发现其核磁数据与文献报道的已知化合物D: A-friedo-oleanan-3, 21-dione的核磁数据[7]相似, 同时化合物1的分子质量比D: A-friedo-oleanan-3, 21-dione多32 Da, 推测化合物1比D: A-friedo-oleanan-3, 21-dione多了两个羟基, 这一推断可通过H-6/H2-7和H-11/H2-12的1H-1H COSY相关以及HMBC谱中H-6 [δH 3.69 (1H, dd, J = 5.9, 4.9 Hz)] 与C-4 (δC 58.2)、C-24 (δC 9.4) 相关, H-11 [δH 3.67 (1H, dd, J = 6.5, 4.9 Hz)] 与C-10 (δC 59.5)、C-25 (δC 12.5) 相关得到证实, 说明两个羟基分别连接在6位和11位上。
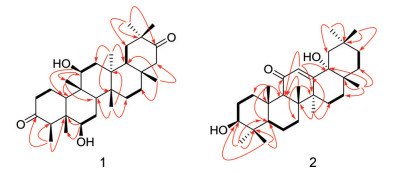
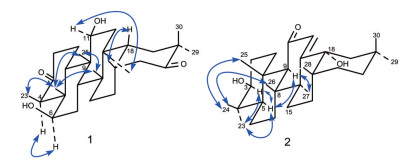
此外, 在HMBC谱(图 2) 中, H3-23 [δH 1.13 (3H, d, J = 6.7 Hz)] 与C-3 (δC 212.8)、C-4 (δC 58.2)、C-5 (δC 48.6) 相关, 提示C-3位存在羰基; H3-29 [δH 1.09 (3H, s)] 和H3-30 [δH 1.17 (3H, s)] 都与C-19 (δC 37.1)、C-20 (δC 42.8)、C-21 (δC 218.5) 相关, 提示C-29和C-30是连在同一碳上的偕甲基以及C-21位存在羰基。由以上数据进一步确定化合物的平面结构。同时通过ROESY谱(图 3) 确定羟基的相对构型。在ROESY谱中, Hα-4和H-6相关, H-11和Hα-27相关, 说明C-6、11位上相连的羟基为β构型(图 3)。
|
Figure 2 Key HMBC (  |
|
Figure 3 Key ROESY ( |
综上所述该化合物的结构鉴定为6β, 11β-dihydroxy-D: A-friedo-oleanane-3, 21-dione, 经文献检索未见报道, 为一新化合物, 命名为广西美登木酮A (maytguanone A)。化合物的波谱数据归属见表 1。
| Table 1 1H NMR (600 MHz) and 13C NMR (150 MHz) data in CDCl3 for compounds 1 and 2 |
化合物2 白色粉末, TLC薄层色谱喷10%的硫酸乙醇溶液, 加热显色呈紫红色, 提示其可能为三萜类化合物。红外光谱IR显示化合物结构中存在羟基官能团(3 426 cm-1)、甲基官能团(2 927 cm-1)、双键官能团(1 637cm-1), 在1 653 cm-1处的碳氧双键伸缩振动提示有羰基存在。HR-ESI-MS显示准分子离子峰m/z: 457.367 5 [M+H]+ (计算值: 457.368 2), 确定其分子式为C30H48O3, 不饱和度为7。在1H NMR谱中, 高场区显示8个甲基氢质子单峰信号δH 0.78 (3H, s)、0.80 (3H, s)、0.94 (3H, s)、1.00 (3H, s)、1.10 (3H, s)、1.10 (3H, s)、1.13 (3H, s)、1.55 (3H, s), 低场区显示1个连有电负性基团的氢质子信号δH 3.22 (1H, dd, J = 11.1, 5.3 Hz), 以及1个烯氢信号δH 5.75 (1H, s), 提示结构母核中含有1个含氧取代基和1个双键基团。结合13C NMR和DEPT135°谱, 发现该化合物共有30个碳信号, 其中包括8个伯碳、9个仲碳、4个叔碳、9个季碳。在高场区部分显示8个甲基碳信号δC 15.7、16.5、18.8、19.1、24.0、28.2、29.8、35.2, 2个连氧碳信号δC 75.9、78.9, 以及1组sp2杂化烯碳信号δC 124.2、167.2, 此外, 还给出了1个羰基碳信号δC 201.4。通过HSQC图谱, 对化合物2的碳氢信号进行了准确的归属, 发现其核磁数据与文献报道的已知化合物3β-hydroxyolean-12-en-11-one的核磁数据[8]相似, 同时化合物2分子质量比3β-hydroxyolean-12-en-11-one多16 Da, 推测化合物2比3β-hydroxyolean-12-en-11-one多一个羟基。这一推断可通过HMBC谱中H-12 [δH 5.75 (1H, s)] 与C-9 (δC 61.6)、C-14 (δC 44.2)、C-18 (δC 75.9) 相关, H3-28 [δH 0.78 (3H, s)] 与C-16 (δC 30.9)、C-18 (δC 75.9)、C-22 (δC 31.2)相关得到证实, 说明羟基连在18位上。
此外, 在HMBC谱中, H3-23 [δH 1.00 (3H, s)] 和H3-24 [δH 0.80 (3H, s)] 都与C-3 (δC 78.9)、C-4 (δC 39.2)、C-5 (δC 54.9) 相关, H3-29 [δH 0.94 (3H, s)] 和H3-30 [δH 1.10 (3H, s)] 都与C-19 (δC 44.0)、C-20 (δC 31.2)、C-21 (δC 33.7) 相关, 提示C-23和C-24、C-29和C-30是连在同一个碳上的偕甲基以及3位存在羟基; H-9 [δH 2.39 (1H, s)] 与C-11 (δC 201.4) 相关, H-12 [δH 5.75 (1H, s)] 与C-9 (δC 61.6) 相关, 提示11位存在羰基; H-12 [δH 5.75 (1H, s)] 与C-9 (δC 61.6)、C-14 (δC 44.2)、C-18 (δC 75.9) 相关, 提示双键在12和13位上。同时通过ROESY谱(图 3) 确定羟基的相对构型。在ROESY谱中, Hα-5和H-3相关, 说明C-3相连的羟基为β构型; 根据文献报道, 当C-18相连的羟基为α构型时, H3-27的化学位移明显向低场位移, 当为β构型时, H3-27的化学位移没有明显的变化或者变化很小[9], 化合物2的H3-27 [δH 1.55 (3H, s)] 的化学位移较已知化合物3β-hydroxyolean-12-en-11-one的H3-27 [δH 1.36 (3H, s)][8]的化学位移相比, 明显向低场位移, 故C-18相连的羟基为α构型(图 3)。
综上所述该化合物的结构鉴定为3β, 18α-dihydroxy-12-oleanen-11-one, 经文献检索未见报道, 为一新化合物, 命名为广西美登木酮B (maytguanone B)。化合物的波谱数据归属见表 1。
2 化合物的抗癌活性采用MTT法对化合物1、3和4进行了人宫颈癌细胞(HeLa)、人膀胱癌细胞(EJ)、人乳腺癌细胞(PANC-1) 3种常见癌细胞的细胞毒活性实验, 并以顺铂作为阳性对照进行评价。结果表明化合物3对人宫颈癌细胞(HeLa) 有良好的抑制作用(表 2)。
| Table 2 Cytotoxicities of compounds 1, 3, 4 (IC50/μmol·L-1) |
Bruker AV Ⅲ 600型核磁共振波谱仪(德国Bruker公司); Agilent 1260 InfinityⅡ制备型高效液相色谱仪(美国Agilent公司); Finnigan MAT-95质谱仪(美国Thermo Finnigan公司); EYELA型旋转蒸发仪(上海爱朗仪器有限公司); Thermo iS50 FT-IR红外光谱仪(美国Thermo Fisher Scientific); 酶标仪(瑞士帝肯公司); 二氧化碳培养箱(新加坡ESCO公司); 湘仪TD5A-WS医用离心机(湖南长沙湘仪离心机公司); EVOS XL Core倒置显微镜(美国Thermo Fisher Scientific); 细胞株(HeLa、EJ、PANC-1, 凯基公司, 中国); SunFire C18 OBD Prep Column色谱柱(10 mm × 150 mm, 5 μm, 美国Waters公司); MCI GEL (CHP20/P120) (Mitsubishi Chemical Corporation); Sephadex LH-20 (GE Healthcare, Tokyo, 日本); 柱色谱硅胶、薄层色谱硅胶(青岛海洋化工); 乙腈、甲醇(色谱纯), 其余试剂均为国产分析纯。
广西美登木于2019年6月采于广西马山县, 由广西中医药研究院黄云峰副研究员鉴定为广西美登木M. guangxiensis的茎叶。
1 提取与分离广西美登木茎叶200 kg, 干燥, 粉碎成10目粗粉, 用95%乙醇加热回流提取3次, 每次2 h, 提取液减压回收溶剂后得浸膏9 kg, 分散于水中, 加入2%盐酸使pH = 2~3, 过滤酸不溶物, 酸水层用二氯甲烷萃取3次, 合并浓缩萃取液得到二氯甲烷萃取物(a) 260 g, 酸水层继续加入30% Na2CO3溶液使pH = 9~10, 产生大量沉淀, 过滤沉淀, 碱水层分别用二氯甲烷、乙酸乙酯、正丁醇萃取3次, 回收溶剂后得到二氯甲烷萃取物(b) 10 g、乙酸乙酯萃取物10 g和正丁醇萃取物30 g。
将酸化后过滤所得的酸不溶物用甲醇溶解, 过滤, 回收溶剂, 得浸膏(500 g), 取浸膏200 g经硅胶(100~200目) 柱色谱, 二氯甲烷-甲醇(100∶0、100∶1、70∶1、50∶1、30∶1、10∶1、5∶1、1∶1、0∶1) 梯度洗脱, 合并相同极性部分, 得到9个流分Fs. Ⅰ~Fs. Ⅸ。流分Fs. Ⅲ经硅胶(100~200目) 柱色谱, 石油醚-乙酸乙酯(12∶1、10∶1、8∶1、6∶1、4∶1、2∶1、0∶1) 梯度洗脱, 合并相同极性部分, 得到7个流分Fs. Ⅲ.1~Fs. Ⅲ.7。流分Fs. Ⅲ.5经MCI反相柱色谱, 乙醇-水(80%、90%、100%) 梯度洗脱, 得到3个流分Fs. Ⅲ.5.1~Fs. Ⅲ.5.3。流分Fs. Ⅲ.5.1经Sephadex LH-20柱色谱, 二氯甲烷-甲醇(1∶1) 洗脱, 得到4个流分Fs. Ⅲ.5.1.1~Fs. Ⅲ.5.1.4, 流分Fs. Ⅲ.5.1.2经制备型HPLC (MeOH-H2O 90∶10, 3 mL·min-1) 分离纯化, 得到化合物1 (20.9 mg)。流分Fs.Ⅱ经硅胶(100~200目) 柱色谱, 石油醚-乙酸乙酯(70∶1、50∶1、30∶1、10∶1、8∶1、6∶1、4∶1、2∶1、0∶1) 梯度洗脱, 合并相同极性部分, 得到9个流分Fs.Ⅱ.1~Fs.Ⅱ.9。流分Fs.Ⅱ.7经Sephadex LH-20柱色谱, 二氯甲烷-甲醇(1∶1) 洗脱, 得到4个流分Fs.Ⅱ.7.1~Fs.Ⅱ.7.4, 流分Fs.Ⅱ.7.3经制备型HPLC (MeOH-H2O 90∶10, 3 mL·min-1) 分离纯化, 得到化合物4 (6.6 mg)。流分Fs.Ⅱ.7.4经制备型HPLC (MeOH-H2O 80∶20→92∶8, 3 mL·min-1) 分离纯化, 得到化合物2 (7.8 mg)。流分Fs.Ⅴ经硅胶(100~200目) 柱色谱, 石油醚-乙酸乙酯(10∶1、8∶1、6∶1、4∶1、2∶1、0∶1) 梯度洗脱, 合并相同极性部分, 得到6个流分Fs.Ⅴ.1~Fs.Ⅴ.6。流分Fs.Ⅴ.3经MCI反相柱色谱, 乙醇-水(80%、90%、100%) 梯度洗脱, 得到3个流分Fs.Ⅴ.3.1~Fs.Ⅴ.3.3。流分Fs.Ⅴ.3.2经Sephadex LH-20柱色谱, 二氯甲烷-甲醇(1∶1) 洗脱, 得到4个流分Fs.Ⅴ.3.2.1~Fs.Ⅴ.3.2.4, 流分Fs.Ⅴ.3.2.3经制备型HPLC (MeOH-H2O 90∶10, 3 mL·min-1) 分离纯化, 得到化合物3 (5.0 mg)。
2 结构鉴定化合物1 白色粉末; IR (KBr) νmax: 3 473, 2 937, 1 708 cm-1; 1H NMR (CDCl3, 600 MHz) 和13C NMR (CDCl3, 150 MHz) 数据见表 1; HR-ESI-MS m/z 473.360 9 [M+H]+ (计算值473.363 1, C30H48O4)。
化合物2 白色粉末; IR (KBr) νmax: 3 426, 2 927, 1 653, 1 637 cm-1; 1H NMR (CDCl3, 600 MHz) 和13C NMR (CDCl3, 150 MHz) 数据见表 1; HR-ESI-MS m/z 457.367 5 [M+H]+ (计算值457.368 2, C30H48O3)。
化合物3 白色粉末; 1H NMR (600 MHz, CDCl3) δ: 5.38 (1H, d, J = 3.3 Hz, H-12), 4.11 (1H, dd, J = 8.6, 3.3 Hz, H-11), 3.40 (1H, m, H-1), 3.37 (3H, s, 11-OCH3), 3.30 (1H, m, H-3), 1.15 (3H, s, H-27), 1.06 (3H, s, H-25), 1.05 (3H, s, H-26), 1.00 (3H, s, H-23), 0.94 (3H, br s, H-30), 0.88 (3H, d, J = 6.4 Hz, H-29), 0.80 (3H, s, H-28), 0.79 (3H, s, H-24); 13C NMR (150 MHz, CDCl3) δ: 77.1 (C-1), 35.7 (C-2), 76.1 (C-3), 39.2 (C-4), 52.5 (C-5), 17.7 (C-6), 33.4 (C-7), 43.9 (C-8), 52.4 (C-9), 44.8 (C-10), 75.9 (C-11), 122.4 (C-12), 146.3 (C-13), 42.1 (C-14), 27.3 (C-15), 28.0 (C-16), 33.7 (C-17), 58.7 (C-18), 39.3 (C-19), 39.6 (C-20), 31.2 (C-21), 41.4 (C-22), 28.3 (C-23), 15.3 (C-24), 13.2 (C-25), 18.4 (C-26), 22.5 (C-27), 28.8 (C-28), 17.8 (C-29), 21.5 (C-30), 53.9 (11-OCH3)。以上数据与文献[10]报道基本一致, 故鉴定化合物为11α-methoxyurs-12-ene-1β, 3β-diol。
化合物4 白色粉末; 1H NMR (600 MHz, CDCl3) δ: 4.71 (1H, d, J = 1.6 Hz, H-29), 4.59 (1H, br s, H-29), 3.93 (1H, td, J = 10.7, 5.3 Hz, H-11), 3.20 (1H, dd, J = 9.1, 7.3 Hz, H-3), 1.68 (3H, s, H-30), 1.03 (3H, s, H-26), 1.03 (3H, s, H-25), 0.98 (3H, s, H-23), 0.96 (3H, s, H-27), 0.79 (3H, s, H-24), 0.78 (3H, s, H-28); 13C NMR (150 MHz, CDCl3) δ: 39.1 (C-1), 27.5 (C-2), 78.7 (C-3), 39.5 (C-4), 55.8 (C-5), 18.2 (C-6), 35.4 (C-7), 41.2 (C-8), 55.7 (C-9), 37.7 (C-10), 70.7 (C-11), 27.8 (C-12), 37.2 (C-13), 42.7 (C-14), 27.5 (C-15), 35.6 (C-16), 43.2 (C-17), 47.8 (C-18), 47.9 (C-19), 150.4 (C-20), 29.9 (C-21), 40.0 (C-22), 28.4 (C-23), 15.7 (C-24), 16.5 (C-25), 17.4 (C-26), 14.6 (C-27), 18.2 (C-28), 110.1 (C-29), 19.5 (C-30)。以上数据与文献[11]报道基本一致, 故鉴定化合物为lup-20(29)-ene-3β, 11α-diol。
3 抗肿瘤活性筛选采用MTT法进行肿瘤细胞增殖抑制活性测定, 分别将人宫颈癌细胞(HeLa)、人膀胱癌细胞(EJ)、人乳腺癌细胞(PANC-1) 培养于含10%胎牛血清的细胞培养液中, 取对数生长期的细胞约每毫升5×104个细胞的密度接种于96孔板, 每孔接种200 μL, 于37 ℃、5% CO2培养箱中孵育24 h后加入样品(终浓度分别为0、5、10、20、30、40和60 μmol·L-1), 继续培养48 h后, 每孔加入20 μL MTT (浓度为5 mg·mL-1) 溶液, 继续在37 ℃、5% CO2培养箱中孵育4 h后小心吸弃去上清液, 每孔加入200 mL DMSO, 摇床振荡10 min, 用酶标仪在490 nm波长处检测吸光度(OD值), 使用Graphpad Prism 8软件计算其半数存活浓度IC50[12, 13]。
致谢: 感谢广西中医药大学附属瑞康医院广西壮族自治区中西医结合转化医学中心提供平台进行细胞毒活性实验。
作者贡献: 黄园园负责进行实验、结构鉴定、论文撰写; 贾学恭和邓富声协助进行细胞毒活性实验; 莫静雅协助进行分离实验; 袁经权负责了研究选题提出、研究方案设计以及论文的修改。
利益冲突: 所有作者声明不存在任何利益冲突。
| [1] |
Editorial Committee of Flora of China. Flora of China (中国植物志)[M]. 45th Vol. Beijing: Science Press, 1999: 136.
|
| [2] |
Qian XL, Cai CC, Yao SH. Studies on the antileukemic princople of Maytenus guangsiensis cheng et sha[J]. Acta Pharm Sin (药学学报), 1979, 14: 182-184. |
| [3] |
Huang RS. Selection of Zhuang Medicine (first volume) (壮药选编·上册)[M]. Nanning: Guangxi Science & Technology Publishing House Co., Ltd, 2015: 230.
|
| [4] |
Gonzalez AG, Alvarenga NL, Ravelo AG, et al. Antibiotic phenol nortriterpenes from Maytenus canariensis[J]. Phtochemistry, 1996, 43: 129-132. DOI:10.1016/0031-9422(96)00205-1 |
| [5] |
Magalhães CG, De Fátima Silva GD, Duartel LP, et al. Salicassin, an unprecedented chalconediterpene adduct and a quinone methide triterpenoid from Maytenus salicifolia[J]. Helv Chim Acta, 2013, 96: 1046-1054. DOI:10.1002/hlca.201200316 |
| [6] |
Huang YY, Chen L, Ma GX, et al. A review on phytochemicals of the genus Maytenus and their bioactive studies[J]. Molecules, 2021, 26: 4563-4604. DOI:10.3390/molecules26154563 |
| [7] |
Anjaneyulu V, Suresh Babu J, Hari Babu B, et al. Two D: A-friedo-oleanane derivatives from Euphorbia tortilis[J]. Phytochemistry, 1993, 33: 647-649. DOI:10.1016/0031-9422(93)85466-5 |
| [8] |
Herath HMTB, Athukoralage PS. Oleanane triterpenoids from Gordonia ceylanica[J]. Nat Prod Sci, 1998, 4: 253-256. |
| [9] |
Itokawa H, Nakajima H, Ikuta A, et al. Two triterpenes from the flowers of Camellia Japonica[J]. Phytochemistry, 1981, 20: 2539-2542. DOI:10.1016/0031-9422(81)83089-0 |
| [10] |
Hichem L, Ahmed K, Abdulmagid AM, et al. Triterpenoids from Salvia argentea var. aurasiaca (Pomel) Batt. & Trab. and their chemotaxonomic significance[J]. Phytochemistry, 2014, 102: 145-151. DOI:10.1016/j.phytochem.2014.03.009 |
| [11] |
Vigar UA, Shaheen B, Wolfgang V, et al. Chemical examination of Nepeta hindostana (Roth) haines the structure of nepeticin[J]. Tetrahedron Lett, 1981, 22: 1714-1718. DOI:10.1016/S0040-4039(01)90420-4 |
| [12] |
Wu YL. Study on the Anti-tumor Mechanism of B-cholesterol Benzimidazole Compounds (B降胆甾苯并咪唑化合物的抗肿瘤机制研究)[D]. Nanning: Nanning Normal University, 2019.
|
| [13] |
Yan HL, Chen Y, Tang F, et al. A novel fatty acid monoglyceride from the stem and leaves of Ligusticum chuanxiong Hort[J]. Acta Pharm Sin (药学学报), 2021, 56: 2573-2576. |
 2022, Vol. 57
2022, Vol. 57


