非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD) 是一种常见的慢性肝脏疾病, 其病理特征表现为无过量饮酒史或其他损肝因素而出现的肝细胞内脂质过度沉积, 部分患者最后会发展成肝硬化和肝癌[1]。NAFLD已成为严重威胁人类健康的疾病, 全球患病人数超过15亿, 呈现逐年增加的趋势, 该疾病与内脏脂肪增加和随之而来的代谢异常有关, 包括胰岛素抵抗、糖尿病、高血压、血脂异常、动脉粥样硬化等, 并且尚无任何药物被美国食品药品监督管理局(FDA) 或欧洲药品管理局(EMA) 批准用于临床, 因此寻找有效的预防和治疗候选物成为全球研究热点[2, 3]。其中, 肝细胞内甘油三酯(triglyceride, TG) 的蓄积是NAFLD的发病重要诱因之一, 使得肝细胞更容易受到损伤, 进而发展为非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH), 因此抑制肝细胞内TG的累积被认为是预防NAFLD的一种重要手段之一[4, 5]。
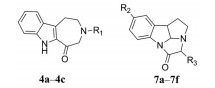
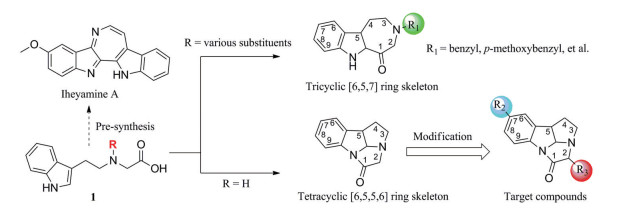
吲哚生物碱天然产物结构多样, 具有降脂、抗糖尿病、抗癌、抗菌等多种生物活性, 是开发新型药物的重要来源[6-9]。本课题组长期致力于从生物碱天然产物中寻找化学结构新颖、作用机制独特的创新药物候选物。本研究在探索吲哚生物碱(iheyamine A, 图 1) 的合成过程中[10], 偶然发现当起始原料1中氮原子上含取代基时, 可以获得独特结构的三环[6, 5, 7]吲哚类化合物; 1的氮原子上为氢原子时, 却得到四环[6, 5, 5, 5]吲哚类全新骨架化合物。本研究在此工作基础上, 继续开展了两类化合物的合成研究, 共合成9个全新结构吲哚类衍生物, 包括3个三环[6, 5, 7]吲哚类和6个四环[6, 5, 5, 5]吲哚类衍生物, 并通过X单晶衍射确定了其立体构型, 以及阐明两类吲哚骨架的化学形成机制。同时对9个全新化合物的生物活性进行了探索, 首次发现其均具有降TG活性, 并进一步对代表性化合物开展了初步成药性评价和作用机制研究。
|
Figure 1 The chemical structures of iheyamine A and two types of novel skeleton |
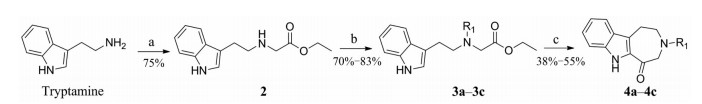
如路线1所示: 首先, 将起始原料色胺(tryptamine) 与溴乙酸乙酯经N-取代反应得到中间体2, 2再经N-取代反应得到关键中间体3a~3c, 收率为70%~83%。经过氢氧化钠水解成羧酸, 并与伊顿试剂(Eaton reagent) 环合得到目标物4a~4c, 收率为38%~55%。
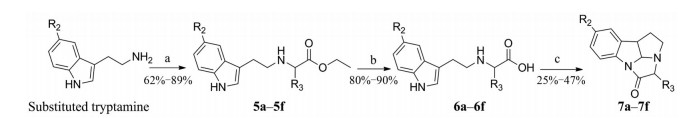
如路线2所示: 以不同取代基的色胺为起始原料, 先经取代、水解反应得到6a~6f, 然后其与伊顿试剂进行分子内环合, 得到目标物7a~7f, 收率为25%~47%。所有目标化合物结构经1H NMR、13C NMR以及HR-MS分析确证。目标化合物的收率、理化参数和波谱数据见表 1。
| Table 1 Physical properties and spectra data of all synthesized compounds |
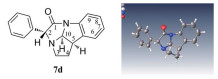
选择四环[6, 5, 5, 5]吲哚类化合物7d进一步测定单晶X衍射, 对其立体结构进一步确证(表 2), 结果表明化合物7d的2-、5-以及10-位的绝对构型分别是2S、5S、10R-构型。
| 表 2 Crystal data and structure refinement statistics of compound 7d |
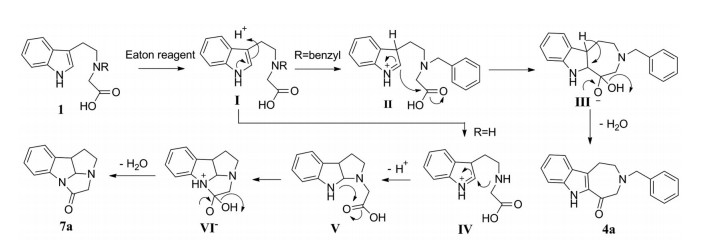
两类不同骨架化合物4a和7a的可能反应机制如图 2: 化合物1在伊顿试剂中经质子化生成中间体I, 当氮原子上含取代基时, I经过质子化反应得到中间体Ⅱ, Ⅱ通过吲哚的C2位对羧基进行亲核攻击得到中间体Ⅲ, Ⅲ通过质子转移消除一分子H2O得到化合物4a; 当氮原子取代基为氢原子时, I质子化转移得到Ⅳ, Ⅳ通过氮原子氢原子进行分子内亲核攻击吲哚的C2位, 转变为四氢吡咯并[2, 3-b]吲哚体系Ⅴ, 进而吲哚的NH与羧基反应消除一分子H2O, 形成化合物7a。
|
Figure 2 Possible synthetic mechanism of compounds 4a and 7a mediated by Eaton reagent |
|
Scheme 1 Synthetic route of target compounds 4a-4c. Reagent and conditions: (a) K2CO3, CH2Cl2, 1-3 h; (b) K2CO3, CH2Cl2, 2-6 h; (c) 1) MeOH, NaOH, 70 ℃, 2 h; 2) Eaton reagent, 45 ℃, 0.5-3 h 4a: R1 = benzyl; 4b: R1 = p-methoxybenzyl; 4c: R1 = p-toluenesulfonyl |
|
Scheme 2 Synthetic route of target compounds 7a-7f. Reagent and conditions: (a) Substituted ethyl bromoacetates, K2CO3, CH2Cl2, 2-5 h; (b) MeOH, NaOH, 70 ℃, 2 h; (c) Eaton reagent, 45 ℃, 0.5-3 h 7a: R2 = H, R3 = H; 7b: R2 = H, R3 = CH3; 7c: R2 = H, R3 = (CH3)2; 7d: R2 = H, R3 = C6H5; 7e: R2 = OCH3, R3 = H; 7f: R2 = Cl, R3 = H |
非诺贝特作为一种降脂药物, 对NAFLD患者有一定的治疗作用, 研究表明, 非诺贝特主要通过改善脂质代谢来治疗NAFLD[11]。本研究选取非诺贝特为阳性对照药, 在人肝癌细胞HepG2中测定了9个衍生物在20 μmol·L-1下的TG抑制活性, 目标化合物结构与活性结果见表 3。三环[6, 5, 7]吲哚骨架衍生物中, 化合物4a~4c的氮原子取代基分别为苄基、对甲氧基苄基和对甲苯磺酰基, 它们对TG的下调活性分别为32.6%、3.2%和64.1%, 化合物4c的活性优于阳性对照非诺贝特。在6个四环[6, 5, 5, 5]吲哚类衍生物中, 化合物7a~7d的2-位取代基分别为氢原子、甲基、二甲基和苯基, 它们的活性均低于非诺贝特。然后当2-位为氢原子, 在其7-位分别引入甲氧基和氯原子得到7e和7f, 其中化合物7e的抑制率为53.7%, 与非诺贝特相当, 说明7-位引入给电子取代基可能有利于活性的提高。综上, 选取两个骨架系列中活性较优的活性化合物4c和7e进行IC50值的测定, 其抑制TG的IC50值分别为6.35 ± 4.00 μmol·L-1和17.67 ± 2.51 μmol·L-1, 并进行下一步成药性初步评价。
| 表 3 Structures and anti-triglyceride activities of all the target compounds. aConcentration of all compounds is 20 μmol·L-1 (n = 3). bIC50: 50% inhibitory concentration (means ± SD of three experiments). cUsed as a positive control |
首先使用ADMET Predictor 9.5软件对活性化合物4c和7e的吸收、代谢和毒理性质进行初步成药性预测并打分(表 4)。其中, 参数吸收风险系数(Absn Risk)、代谢性质风险系数(CYP Risk) 和致突变性风险系数(Mut Risk) 评估化合物的吸收、代谢性质及致突变性, 而参数ADMET Risk对化合物进行全方面的成药性预测。结果显示, 4c和7e的预测分值均在软件设定的合理范围内, 提示两者可能具有良好的成药性。
| 表 4 ADMET prediction results of 4c and 7e. aAbsn risk (evaluation of absorption properties of compounds), suggested values: ≤ 3.5. bCYP risk (evaluation of metabolic properties of compounds), suggested values: ≤ 2.5. cMut risk (evaluation of mutagenicity of compounds), suggested values: ≤ 1. dADMET risk (evaluation of medicinal properties of compounds), suggested values: ≤ 7.5 |
接下来对两个活性化合物进行了细胞毒活性评价。分别选取人肝癌HepG2细胞、人正常肾上皮细胞293T及非洲绿猴肾细胞Vero, 测定了4c和7e的细胞毒性。结果如表 5所示: 化合物4c的CC50值均大于400 μmol·L-1, 7e的CC50值均大于300 μmol·L-1, 提示两者均具有较好的细胞安全性, 4c的选择性指数(selection index, SI = CC50/IC50) 大于63, 7e的SI值为21, 其中4c显示更好的安全性, 选为代表性化合物进行作用机制的探索。
| Table 5 Cytotoxicities of the target compounds |
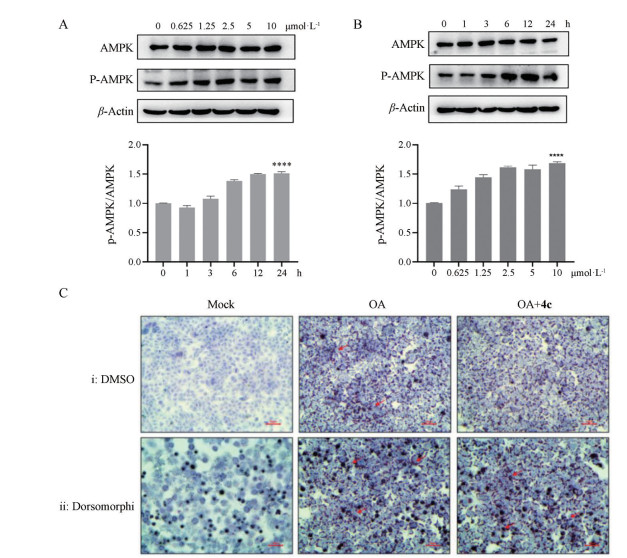
AMPK通过磷酸化作用抑制脂肪酸、胆固醇和TG的合成途径, 从而降低肝细胞内TG的累积[12-16], 因此, 本研究评价了4c对AMPK的激活活性。结果如图 3A、3B所示, 化合物4c可上调AMPK磷酸化水平, 并呈现较好的剂量和时间依赖性, 而总的AMPK水平无明显变化。
|
Figure 3 AMPK activation activity of 4c. A: Compound 4c concentrations of 0, 0.625, 1.25, 2.5, 5 and 10 μmol·L-1 respectively. The histograms are representatives of independent Western blots experiments, and the quantitative results are expressed as their mean ± SD (n = 3). Statistical significant differences compared with vehicle control are indicated by ****P < 0.001. B: Compound 4c concentration of 10 μmol·L-1 and time of 1, 3, 6, 12 and 24 h respectively. The histograms are representatives of independent Western blots experiments, and the quantitative results are expressed as their mean ± SD (n = 3). Statistical significant differences compared with vehicle control are indicated by ****P < 0.001. C: i: HepG2 cells were left untreated or treated with OA or OA+4c. ii: HepG2 cells were pretreated with dorsomorphin; then the cells were again left untreated or treated with OA or OA+4c as indicated. (4c 10 μmol·L-1; dorsomorphin 5 μmol·L-1) |
进而通过油红染色实验对其作用机制进行验证, 结果如图 3C所示, 油酸(oleic acid, OA) 作用24 h可诱导HepG2细胞脂肪变性, 表现为大面积红染; 化合物4c可以降低细胞的红染程度及脂肪变性, dorsomorphin是一种有效的、可逆选择性的AMPK抑制剂[17], 加入dorsomorphin后, 4c抑制细胞脂肪变性的效果被逆转。该结果提示, 化合物4c可能是通过激活AMPK增加细胞脂质代谢, 从而降低TG的积累。
小结本研究首次设计合成了三环[6, 5, 7]与四环[6, 5, 5, 5]两类全新结构的吲哚类生物碱, 并经X单晶衍射确定了立体绝对构型。发现两类化合物均具有降TG的活性, 其中化合物4c表现出最优的活性, IC50值为6.35 μmol·L-1, 优于阳性对照非诺贝特。4c在细胞水平具有较好的安全性, 对于HepG2、293T和Vero细胞的CC50值均大于400 μmol·L-1。初步作用机制显示, 化合物4c可以通过激活AMPK的活性增加细胞脂质代谢, 进而发挥出较好的降TG活性, 并缓解OA诱导HepG2细胞脂肪变性。研究结果为两类化合物的进一步结构修饰与优化提供了有益的科学数据。
实验部分熔点用美国CXM-300型精密熔点仪(Mettler-Toledo) 测定, 温度未校正; 核磁共振氢谱和碳谱分别采用美国Varian Mercury Plus 400 (600 MHz) 和Bruker Avance Ⅲ 500 (151 MHz) 核磁共振仪测定, 溶剂均为DMSO-d6, TMS为内标; HR-MS采用英国Autospec Ultima-TOF质谱测定仪(Micromass UK Ltd.) 测定; Flash柱分离纯化用美国Combiflash Rf200快速制备液相(Teledyne); 荧光检测用中国上海宝山顾村电光仪器厂ZF-20D暗箱式紫外分析仪; 薄层色谱(TLC) 采用E-Merck公司预铺硅胶铝箔卷。所用试剂为Acros公司和国产分析纯或化学纯的试剂。
1 化学合成 1.1 目标化合物4a~4c的合成将色胺(10 mmol) 溶于二氯甲烷中, 加入碳酸钾(2.07 g, 15 mmol), 室温搅拌30 min, 缓慢滴加溴乙酸乙酯(11 mmol), TLC检测反应完全。反应完全后减压浓缩, 加入适量水用乙酸乙酯萃取3次(20 mL×3), 合并有机层, 饱和NaCl溶液洗涤, 无水硫酸钠干燥, 减压浓缩并加少量硅胶匀化样品, 以石油醚/乙酸乙酯为流动相进行Flash分离纯化, 得到淡黄色油状物2, 收率为75%。
将化合物2 (2.46 g, 10 mmol) 溶于40 mL二氯甲烷中, 加入碳酸钾(2.07 g, 15 mmol), 室温搅拌30 min, 分别与溴苄、对甲氧基苄氯、对甲苯磺酰氯(11 mmol) 进行反应, TLC检测反应完全。反应完全后减压浓缩, 加入适量水用乙酸乙酯萃取3次(20 mL×3), 合并有机层, 饱和NaCl溶液洗涤, 无水硫酸钠干燥, 减压浓缩并加少量硅胶匀化样品, 以石油醚/乙酸乙酯为流动相进行Flash分离纯化, 得到淡黄色固体3a~3c, 收率为70%~83%。
将3a~3c (10 mmol) 加入甲醇中, 室温搅拌下加入10 mL的3 mol·L-1氢氧化钠溶液, 升温至70 ℃, 反应2 h, TLC检测反应完全, 反应结束后冷却至室温, 减压浓缩除去甲醇后, 用浓盐酸调pH至3~4, 析出大量白色固体, 水洗并干燥后直接用于下一步反应。
将白色固体(0.8 mmol) 分别加入2.5 mL伊顿试剂中, 氮气保护下进行搅拌, 升温至45 ℃反应0.5~3 h, TLC检测反应完全后, 置于冷阱中冷却至0 ℃, 用饱和NaHCO3溶液调节pH至7~8, 加入适量水用二氯甲烷萃取3次, 合并有机层, 饱和NaCl溶液洗涤, 无水硫酸钠干燥, 以石油醚/乙酸乙酯和二氯甲烷/甲醇为流动相进行Flash分离纯化, 得到目标化合物4a~4c, 收率为38%~55%。
1.2 目标化合物9a~9f的合成室温下, 将不同取代的色胺(10 mmol) 溶于二氯甲烷中, 加入碳酸钾(2.07 g, 15 mmol), 室温搅拌30 min, 缓慢滴加含有不同取代基的溴乙酸乙酯(11 mmol), TLC检测反应完全。反应完全后减压浓缩, 加入适量水用乙酸乙酯萃取3次(20 mL×3), 合并有机层, 饱和NaCl溶液洗涤, 无水硫酸钠干燥, 减压浓缩并加少量硅胶匀化样品, 以石油醚/乙酸乙酯为流动相进行Flash分离纯化, 得到淡黄色固体5a~5f, 收率为62%~89%。
将5a~5f (10 mmol) 加入甲醇中, 室温搅拌下加入20 mL的1.5 mol·L-1氢氧化钠溶液, 升温至70 ℃, 反应2 h, TLC检测反应完全, 反应结束后冷却至室温, 减压浓缩除去甲醇后, 用浓盐酸调pH至3~4, 析出大量固体, 水洗, 干燥后得中间体6a~6f, 白色固体, 收率为80%~90%。
向2.5 mL伊顿试剂中加入6a~6f (0.8 mmol), 氮气保护下进行搅拌, 升温至45 ℃反应0.5~3 h, TLC检测反应完全后, 置于冷阱中冷却至0 ℃, 用饱和NaHCO3溶液调节pH至7~8, 加入适量水用二氯甲烷萃取3次, 合并有机层, 饱和NaCl溶液洗涤, 无水硫酸钠干燥, 以石油醚/乙酸乙酯和二氯甲烷/甲醇为流动相进行Flash分离纯化, 得到目标化合物7a~7f, 收率为25%~47%。
2 结构测定在室温(293 K) 下采集单晶X射线衍射数据, 将化合物7d在石油醚与乙酸乙酯体积比为10∶1的混合溶剂中重结晶。
3 细胞内TG活性测定HepG2细胞系经胰酶消化成单个细胞, 接种12孔板, 每孔接种3×105个细胞, 10% FBS+MEM培养基培养24 h, 后换用0.5% FBS+MEM饥饿培养24 h, 继续用0.5% FBS+MEM加OA终浓度为600 μmol·L-1, 同时加药培养24 h。细胞处理后用高脂样本甘油三酯(TG) 酶法测定试剂盒(北京普利莱基因技术有限公司) 测定细胞内TG含量, 结果用蛋白浓度校准。向12孔板中加入0.5 mL PBS清洗细胞, 弃去PBS后, 用胰酶消化细胞, 收集细胞后, 加入100 μL裂解液, 混匀后室温静置10 min。取20 μL上清液用于BCA法蛋白定量。另取70 μL上清液转移到1.5 mL离心管中, 70 ℃加热10 min。室温2 000 r·min-1离心5 min, 上层清液用于酶学测定。用96孔板测定, 设置空白组、标准品组、样品组, 向孔中加入10 μL蒸馏水、系列浓度标准品以及待测样品, 37 ℃反应10 min。于全波长酶标仪中测定550 nm处吸光度, 绘制标准曲线并计算待测样品中TG浓度, 结果用蛋白浓度校准[18]。
4 细胞毒活性测定取对数生长期细胞, 消化后计数, 将细胞接种于96孔培养板。培养过夜待贴壁后, 用无血清培养基稀释药物, 用浓度梯度的药物处理细胞。72 h后, 去除培养液, 加入10倍稀释的CCK8试剂100 μL, 37 ℃温箱孵育2~3 h后, 震荡3 min混匀, 用酶标仪测定450 nm吸收度值(A)。细胞存活率% = (加药细胞A - 本底A) / (对照细胞A - 本底A) × 100%。实验数据以
将处理后的HepG2细胞用细胞刮刀刮下, 1 200 ×g离心收集细胞。加入适量裂解液(50 mmol·L-1 Tris-HCl pH 7.5, 1% Triton-100, 150 mmol·L-1 NaCl, 2 mmol·L-1 EDTA, 1×Cocktail), 冰上放置30 min, 然后14 000 ×g离心15 min, 收集上清液即为蛋白提取液。用标准Bradford方法测定样品的蛋白浓度, 于12% SDS聚丙烯酰胺凝胶电泳分离蛋白, 半干法将蛋白转至PVDF膜。转膜结束后, 将其放入含5%脱脂奶粉的TBS-T (20 mmol·L-1 Tris-HCl, 150 mmol·L-1 NaCl, 0.1% Tween-20, pH 7.6) 中振荡封闭1 h。封闭后的膜装入杂交袋与一抗溶液(1∶1 000稀释) 4 ℃孵育过夜, 用TBS-T洗膜3次, 以洗去未结合的一抗。与辣根过氧化物酶标记的二抗溶液(抗兔二抗1∶2 000稀释、抗鼠二抗1∶5 000稀释) 在室温孵育1~2 h后, TBS-T洗膜3次, 按照ECL Plus免疫试剂盒说明书进行显色, 通过Tanon-5100凝胶成像系统捕获并分析图像。
6 油红染色实验弃去处理后的HepG2细胞培养液, 用PBS洗涤2次。从培养板壁缓慢加入4%多聚甲醛进行固定0.5~1 h。弃去固定液, 水洗两次, 再用60%异丙醇孵育5 min。弃去异丙醇, 加入油红工作液(油红储备液∶去离子水= 3∶2, 需过滤), 摇晃孵育10~20 min。弃去油红工作液, 用水洗2次, 直至水无色。加入苏木素染色1 min, 弃去苏木素, 用水洗2~5次, 于显微镜下观察并拍照, 观察脂滴的分布情况。
致谢: 目标化合物的核磁共振氢谱、碳谱、高分辨质谱及单晶X衍射数据由中国医学科学院医药生物技术研究所分析测试中心测定。
作者贡献: 赵丽萍负责所有目标物的合成、文献的调研整理及初稿的撰写; 程阳阳负责甘油三酯抑制活性的测定; 曾庆轩负责AMPK蛋白表达水平测定和油红染色实验; 范田运、孔维佳、宋丹青对实验过程中出现的问题及论文撰写提供了有益的指导; 汪燕翔负责实验把关、稿件修改等工作。以上作者均已通读手稿并同意论文的刊发。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Tariq T, Desai AP. Nonalcoholic fatty liver disease: making the diagnosis[J]. Clin Liver Dis (Hoboken), 2020, 16: 53-57. DOI:10.1002/cld.924 |
| [2] |
Younossi ZM, Koenig AB, Abdelatif D, et al. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes[J]. Hepatology, 2016, 64: 73-84. DOI:10.1002/hep.28431 |
| [3] |
Tanaka N, Kimura T, Fujimori N, et al. Current status, problems, and perspectives of non-alcoholic fatty liver disease research[J]. World J Gastroenterol, 2019, 25: 163-177. DOI:10.3748/wjg.v25.i2.163 |
| [4] |
Cohen JC, Horton JD, Hobbs HH. Human fatty liver disease: old questions and new insights[J]. Science, 2011, 332: 1519-1523. DOI:10.1126/science.1204265 |
| [5] |
Buzzetti E, Pinzani M, Tsochatzis EA. The multiple-hit pathogenesis of non-alcoholic fatty liver disease (NAFLD)[J]. Metabolism, 2016, 65: 1038-1048. DOI:10.1016/j.metabol.2015.12.012 |
| [6] |
Yan Y, Li X, Zhang C, et al. Research progress on antibacterial activities and mechanisms of natural alkaloids: a review[J]. Antibiotics (Basel), 2021, 10: 108. DOI:10.3390/antibiotics10020108 |
| [7] |
Zhu Y, Zhao J, Luo L, et al. Research progress of indole compounds with potential antidiabetic activity[J]. Eur J Med Chem, 2021, 223: 113665. DOI:10.1016/j.ejmech.2021.113665 |
| [8] |
Song F, Bian Y, Liu J, et al. Indole alkaloids, synthetic dimers and hybrids with potential in vivo anticancer activity[J]. Curr Top Med Chem, 2021, 21: 377-403. DOI:10.2174/1568026620666200908162311 |
| [9] |
Tian KM, Li JJ, Xu SW. Rutaecarpine: a promising cardiovascular protective alkaloid from Evodia rutaecarpa (Wu Zhu Yu)[J]. Pharmacol Res, 2019, 141: 541-550. DOI:10.1016/j.phrs.2018.12.019 |
| [10] |
Sasaki T, Ohtani II, Tanaka J, et al. Iheyamines, new cytotoxic bisindole pigments from a colonial ascidian, Polycitorella sp. [J]. Tetrahedron Lett, 1999, 40: 303-306.
|
| [11] |
Fabbrini E, Mohammed BS, Korenblat KM, et al. Effect of fenofibrate and niacin on intrahepatic triglyceride content, very low-density lipoprotein kinetics, and insulin action in obese subjects with nonalcoholic fatty liver disease[J]. J Clin Endocrinol Metab, 2010, 95: 2727-2735. DOI:10.1210/jc.2009-2622 |
| [12] |
Davies SP, Carling D, Munday MR, et al. Diurnal rhythm of phosphorylation of rat liver acetyl-CoA carboxylase by the AMP-activated protein kinase, demonstrated using freeze-clamping. Effects of high fat diets[J]. Eur J Biochem, 1992, 203: 615-623. DOI:10.1111/j.1432-1033.1992.tb16591.x |
| [13] |
Merrill GF, Kurth EJ, Hardie DG, et al. AICA riboside increases AMP-activated protein kinase, fatty acid oxidation, and glucose uptake in rat muscle[J]. Am J Physiol, 1997, 273: E1107-E1112. |
| [14] |
Zong H, Ren JM, Young LH, et al. AMP kinase is required for mitochondrial biogenesis in skeletal muscle in response to chronic energy deprivation[J]. Proc Natl Acad Sci U S A, 2002, 99: 15983-15987. DOI:10.1073/pnas.252625599 |
| [15] |
Li Y, Xu S, Mihaylova MM, et al. AMPK phosphorylates and inhibits SREBP activity to attenuate hepatic steatosis and atherosclerosis in diet-induced insulin-resistant mice[J]. Cell Metab, 2011, 13: 376-388. DOI:10.1016/j.cmet.2011.03.009 |
| [16] |
Li J, Zhong L, Wang F, et al. Dissecting the role of AMP-activated protein kinase in human diseases[J]. Acta Pharm Sin B, 2017, 7: 249-259. DOI:10.1016/j.apsb.2016.12.003 |
| [17] |
Kim YM, Kim MY, Kim HJ, et al. Compound C independent of AMPK inhibits ICAM-1 and VCAM-1 expression in inflammatory stimulants-activated endothelial cells in vitro and in vivo[J]. Atherosclerosis, 2011, 219: 57-64. DOI:10.1016/j.atherosclerosis.2011.06.043 |
| [18] |
Wang C, Jiang JD, Wu W, et al. The compound of mangiferin-berberine salt has potent activities in modulating lipid and glucose metabolisms in HepG2 cells[J]. Biomed Res Int, 2016, 2016: 8753436. |
 2022, Vol. 57
2022, Vol. 57