2. 江苏正大丰海制药有限公司, 江苏 盐城 224100
2. Jiangsu Chia Tai Fenghai Pharmaceutical Co., Ltd., Yancheng 224100, China
肺癌, 按组织病理学分类可分为非小细胞肺癌(non-small cell lung cancer, NSCLC) 和小细胞肺癌(small cell lung cancer, SCLC)。作为全球癌症死亡率最高的癌症之一, 非小细胞肺癌各阶段5年内的生存率为14%~17%, 小细胞肺癌的5年总生存率为6%[1]。现代临床和流行病学研究表明, 免疫、炎症和慢性感染与肺癌之间存在强相关性, 肿瘤炎症微环境由多个细胞(成纤维细胞、免疫细胞等) 和细胞外元素(趋化因子、细胞因子、细胞外基质等) 组成, 形成促进肿瘤起始和进展的慢性炎症间质。肺癌炎症微环境发展过程中的一些炎症细胞如白细胞、巨噬细胞等会被促炎症细胞因子激活和招募, 并释放出炎症细胞因子。炎症细胞因子又能够释放趋化因子、白细胞介素和干扰素等, 从而参与促进肿瘤进展[2]。TNF-α是TNF家族的由单核-巨噬细胞分泌的细胞因子, 一方面, TNF-α可介导自身免疫, 用于某些癌症的治疗; 另一方面, TNF-α作为NF-κB的关键激活因子, 可通过NF-κB诱导炎症加重癌症的发展[3]。白细胞介素1β (IL-1β) 是由单核-巨噬-树突状细胞产生, 被炎症小体NLRP3激活后释放, 是多种肺部疾病炎症反应启动的关键介质[4]。研究表明, IL-1β的过表达可增加炎症相关的肿瘤侵袭性并刺激肿瘤炎症微环境[5], 起到介导的作用。白细胞介素6 (IL-6) 由淋巴-巨噬细胞产生, 是肿瘤炎症微环境中的主要细胞因子之一, 几乎在所有类型的肿瘤中都有过表达。肿瘤微环境中高表达的IL-6反映了炎症和癌症之间的强关联[6]。IL-1β和IL-6可通过调节癌症的多种通路促进肿瘤发生, 包括凋亡、存活、增殖、血管生成、侵袭和转移。福多司坦是一种具有司坦类基本骨架的半胱氨酸衍生物, 作为一种新型黏痰溶解剂, 对气管中分泌黏痰液的杯状细胞的过度形成与对高黏度的岩藻黏蛋白的产生有抑制作用, 因而使痰液的黏滞性降低, 易于咳出。适用于支气管哮喘、慢性喘息性支气管炎、支气管扩张、肺结核、尘肺、慢性阻塞性肺气肿、非典型分枝杆菌病、肺炎、弥漫性支气管炎等呼吸道疾病的祛痰治疗。近年来, 文献报道称福多司坦能显著降低多种肺部疾病如慢性肺阻塞性疾病[7, 8]、支气管扩张[9, 10]、重症肺部感染疾病[11]的炎症因子水平, 降低TNF-α诱导的肺癌细胞NCI-H292细胞的黏蛋白高表达。代谢组学(metabolomics) 是后基因组学生物化学迅速发展的领域, 是功能基因组学的代谢补充[12]。细胞代谢组学能对生化反应产物的内源性小分子进行表征, 进而揭示在活细胞内的生化现象, 并能根据健康和患病生物体内的生物化学差异提供有关疾病潜在原因的信息, 进而提出药物干预的目标和靶点[13]。本研究拟采取基于气相色谱-质谱(gas chromatography-mass spectrometer, GC-MS) 的细胞代谢组学技术, 筛选福多司坦干预炎症环境下肺癌A549细胞的生物标志物, 从而可在代谢网络调控角度探讨福多司坦缓解肺癌细胞炎症微环境的作用机制。
材料与方法细胞株 人肺癌细胞A549 (武汉普诺赛生命科技有限公司), 已通过STR基因型检测。
试剂 胎牛血清(20040502, 浙江天杭生物科技股份有限公司); 磷酸盐缓冲液(33820004, 美国Corning公司); 0.25%胰蛋白酶-EDTA (AE29456443, 美国Gibco公司); 青霉素-链霉素双抗(J200039, 美国Hyclone公司); F-12k培养基(H210810, 上海源培生物科技有限公司); TNF-α (纯度 > 98%, MB604, 大连美仑生物技术有限公司); CCK-8试剂(K10189133EF5E, 美国APE-BIO公司); 总RNA提取试剂盒(090420201102, 上海碧云天生物科技有限公司); 逆转录试剂盒(7E402J0)、SYBR qPCR试剂盒(7E430K0), 均购自南京诺唯赞生物科技有限公司; 甲醇(质谱纯, 德国Merck), 1, 2-13C2-肉豆蔻酸、吡啶、N-O-双三甲基硅基三氟乙酰胺(MBBC6775、BCBZ4865), 均购自美国Sigma-Aldrich公司; 甲氧基胺盐酸盐(WXBD0638V, 美国Sigma-Aldrich公司); 正己烷(美国ROE Scientific公司)。
仪器 Thermo Forma 3111 CO2恒温培养箱(美国Thermo Fisher Scientific公司); SW-CJ-2F*超净工作台(苏州净化设备工作台有限公司); 倒置显微镜(日本Olympus公司); Leica DMi8倒置荧光显微镜(德国Leica公司); HYQ-3110微量振荡器涡旋混匀器(美国Crystal公司); TDL-80-2B低速台式离心机(上海安亭科学仪器厂); HH-ZK1电热恒温水浴锅(上海科升仪器有限公司); TOMY SX-500高压灭菌锅(日本TOMY公司); Milli-Q超纯水系统(美国Millipore公司); Infinite 200 Pro Tecan多功能酶标仪(瑞士Tecan公司); Bio Rad CFX96荧光定量PCR仪(美国Bio Rad公司); Applied Biosystems梯度PCR仪器(购自美国ABI公司); Trace 1310气相系统、TSQ 8000质谱仪(美国Thermo Fisher Scientific公司); TG-5MS毛细管色谱柱(0.25 mm × 30 m, 0.25 μm)。
TNF-α最佳浓度选择实验 A549肺癌细胞用10% FBS的F12K培养基在37 ℃、5% CO2下进行培养, 生长至90%融合时进行1∶4传代。将第9代A549细胞以每孔5×103个细胞接种于96孔板, 分为空白对照组、不同浓度TNF-α组(分别为5、10、25、50和100 ng·mL-1), 每组复孔6个。细胞贴壁24 h后, 加入不同剂量的TNF-α处理24 h后, 每孔加入CCK-8试剂10 μL, 孵育2 h后在波长450 nm处测量其吸光度值并计算其细胞存活率, 将上述各组细胞处理后提取RNA, 进行IL-6的测定。
福多司坦最佳浓度选择实验 A549肺癌细胞用10% FBS的F12K培养基在37 ℃、5% CO2下进行培养, 生长至90%融合时进行1∶4传代。将第9代A549细胞以每孔5×105个细胞接种于六孔板, 分为空白对照组、TNF-α组(50 ng·mL-1)、福多司坦组(0.1、1、10 mmol·L-1), 每组复孔3个。细胞贴壁24 h后, TNF-α组更换为含50 ng·mL-1的TNF-α处理24 h, 福多司坦组更换为含不同浓度的福多司坦(分别为0.1、1、10 mmol·L-1) 与50 ng·mL-1 TNF-α处理24 h, 提取各组细胞RNA进行逆转录, 逆转录条件为37 ℃持续15 min, 85 ℃持续30 s, 然后取适量cDNA进行IL-6与IL-1β基因的荧光定量PCR实验, 并设置GAPDH作为内参基因, 比较各组2-△△Ct值。引物序列见表 1。
| Table 1 Primer sequences |
福多司坦对TNF-α干预的A549细胞的代谢组学研究 A549肺癌细胞用10% FBS的F12K培养基在37 ℃、5% CO2下进行培养, 生长至90%融合时进行1∶4传代。将第9代A549细胞以每孔5×105个细胞接种于六孔板, 分为空白对照组、TNF-α组(50 ng·mL-1)、福多司坦组(10 mmol·L-1), 每组复孔6个。细胞贴壁24 h后, TNF-α组更换为含50 ng·mL-1的TNF-α处理24 h, 福多司坦组更换为福多司坦(10 mmol·L-1) 与50 ng·mL-1 TNF-α处理24 h, 作为细胞代谢组学样本。
GC-MS样品前处理与衍生化 取上述细胞培养结束后的样本, 弃去上清液, 加入37 ℃ PBS清洗2遍, 弃去PBS后每孔加入-80 ℃含HEPES (70 mmol·L-1) 的60% 甲醇1 mL, 快速吸去, 使细胞淬灭。加入含1, 2-13C2-肉豆蔻酸(5 μg·mL-1) 的75%甲醇-MTBE (9∶1, v/v) 500 μL, 用细胞刮刀刮取细胞, 转移至1.5 mL离心管里, 在液氮和37 ℃反复冻融3次, 在4 ℃、14 000 r·min-1离心10 min, 上清液转移至新的1.5 mL离心管中, 使用真空浓缩仪在45 ℃下挥干。挥干后进行衍生化, 样本加入30 μL现配的甲氧胺吡啶(w/v, 10 mg·mL-1) 溶液, 涡旋5 min, 在30 ℃下振摇1.5 h。再加入30 μL BSTFA (1% TMCS), 涡旋5 min, 37 ℃下振摇0.5 h。上述处理结束后在4 ℃、18 000 r·min-1离心10 min, 取50 μL进样分析。
GC-MS分析条件 使用美国Thermo Fisher公司的Trace 1310气相系统, 样本的分离在TG-5MS毛细管色谱柱(0.25 mm × 30 m, 0.25 μm) 上进行。氦气以流速1.2 mL·min-1作为载气, 进样口温度为300 ℃, 采用分流流速为24.0 mL·min-1, 分流比20∶1进行进样, 进样量为1 μL。传输线温度为300 ℃, 采用程序升温: 先用60 ℃维持1 min, 再以20 ℃·min-1的速率升至320 ℃, 维持5 min。美国Thermo Fisher公司的TSQ 8000质谱仪, 采用电子轰击离子化(EI离子源), 离子源温度为300 ℃。质谱采用一级全扫描的方式进行采集, 起始扫描时间为4 min, 扫描范围是m/z 50~500。
多元变量数据分析处理与统计学分析 将GC-MS采集到的图谱信息使用MS-DIAL软件进行色谱峰的提取(最小峰高: 10 000, 质量宽度: 0.5 Da, 质量准确度: 0.5 Da), 提取后用NIST进行化合物的鉴定。得到各物质的峰高与内标1, 2-13C2-肉豆蔻酸峰高比值进行数据归一化, 得到的数据矩阵导入多元变量数据分析处理软件SIMCA-P 13.0进行多维统计分析, 采用主成分分析(principal components analysis, PCA) 考察各组样本的总体分布情况, 采用偏最小二乘判别分析(partial least squares discriminant analysis, PLS-DA) 筛选在组间有区别的差异变量, 在TNF-α组与空白对照组中以变量重要性投影(variable importance in the projection, VIP) > 1建立差异变量列表。代谢组学数据分析使用SPSS 26.0对筛选得到的差异变量在各组中的峰响应值进行Shapiro-wilk (SW) 正态分布检验, 若服从正态分布, 对数据进行Levene方差齐性检验, 若方差齐性, 进行两组数据的t检验; 若方差不齐, 对数据进行Welch法的近似t检验。若比较的两组独立样本有其中一组不符合正态分布, 则对两组数据进行非参数检验(Mann-Whitney U test)。所有实验均采用(
CCK-8结果如图 1A所示, TNF-α浓度为5~100 ng·mL-1均能抑制A549细胞的增殖, TNF-α浓度为5、10、25、50、100 ng·mL-1的存活率分别为93.44% ± 4.91%、93.37% ± 3.12%、90.60% ± 5.38%、90.29% ± 2.61%、85.80% ± 5.16%。从50 ng·mL-1浓度开始TNF-α对IL-6炎性表达具有显著性影响(图 1B)。根据实验结果, 同时考虑到后期福多司坦能较好地调控和恢复TNF-α所诱导的炎症, 故选取50 ng·mL-1作为后续代谢组学中处理A549细胞的浓度。
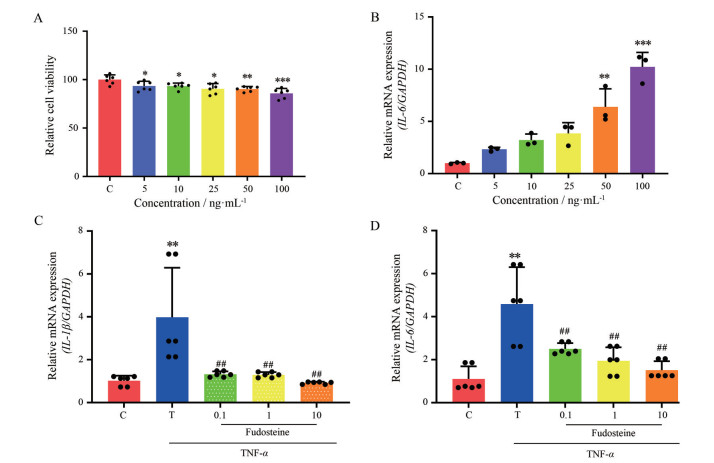
|
Figure 1 The survival rate (A) and the expression of IL-6 mRNA in A549 cell (B) treated with different concentration of TNF-α, and the relative mRNA expression of IL-1β (C) and IL-6 (D) in A549 cell treated with TNF-α and fudosteine (mmol·L-1). C: Control, T: TNF-α. **P < 0.01 vs control group, ##P < 0.01 vs TNF-α group. The black dot represents each independent sample |
如图 1C、1D所示, TNF-α处理24 h后, IL-1β与IL-6的表达分别升高了3.89和4.14倍(P < 0.01)。经过不同浓度福多司坦培养后IL-1β与IL-6的表达都有不同程度的降低, 与TNF-α组相比, 福多司坦组IL-1β的表达分别降低66.7%、67.4%和76.7%; IL-6的表达分别降低57.5%、45.5%和66.9%, 呈现浓度依赖性, 其中高浓度10 mmol·L-1福多司坦降低IL-1β与IL-6的表达最为显著。上述实验数据均可表明福多司坦可降低肺癌A549细胞炎症微环境中的炎症因子IL-1β和IL-6的表达水平, 表明福多司坦可能通过降低A549细胞炎症因子IL-1β与IL-6的表达从而纠正异常的炎症微环境, 有望缓解肺癌炎症的进一步发展。后续代谢组学实验选取高浓度10 mmol·L-1, 以获得更多的代谢物信息。
3 GC-MS代谢轮廓图Control组、TNF-α组与Fudosteine组的总离子流图(total ion chromatogram, TIC) 见图 2, 经MS-DIAL处理后共鉴定出80种代谢物, 其中包括核酸、脂质、有机酸、氨基酸、类固醇、有机氮、有机酸、糖类等小分子化合物。
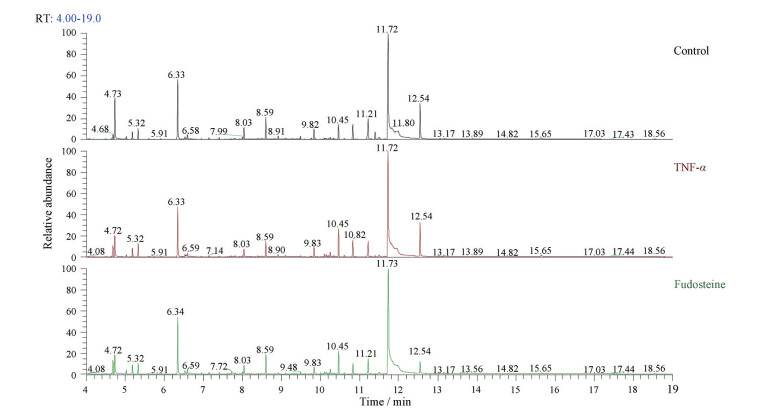
|
Figure 2 The total ion chromatogram (TIC) of each group |
主成分分析(PCA) 能反映样本之间的代谢差异, 能预测与排除离群值。如图 3A中可看出Control组与TNF-α组、Fudosteine组有明显的组间分离, 该模型的拟合程度R2X为0.725, 越接近于1表明该模型拟合程度较高。TNF-α组与Fudosteine组没有完全区分开, 因无监督的PCA的判别率较低, 进一步采取有监督模式识别方法PLS-DA进行判别分析。采用有监督分析方法PLS-DA将检测样本分组后进行分析, 忽略组内的随机差异, 进而突出TNF-α、Fudosteine、Control组间的差异, 图 3B可见Control组、TNF-α组与Fudosteine组间均有明显的分离, R2X与R2Y分别为0.626与0.974, 表明该模型拟合程度较高。该模型的Q2为0.940, 表明模型预测程度较好。
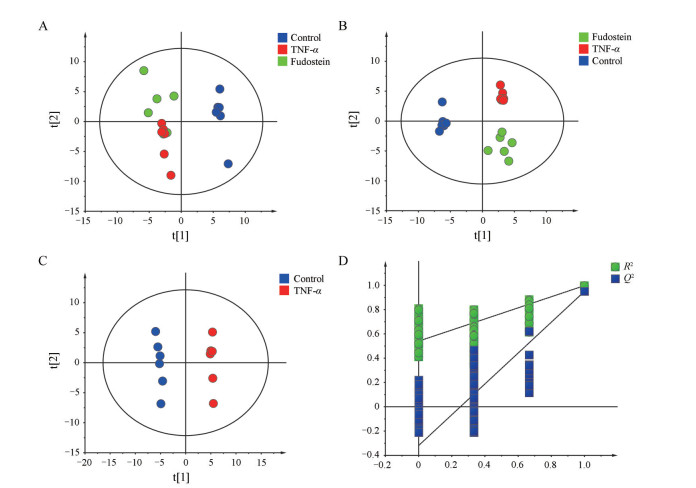
|
Figure 3 The PCA (A) and PLS-DA (B) score plots among three groups, and the PLS-DA score plot (C) and permutation test (D) of control and TNF-α groups |
采用有监督分析方法PLS-DA运用偏最小二乘回归对Control组与TNF-α组建立代谢物表达量与样本类别之间的关系模型, 并采用置换检验(permutation test) 200次评价PLS-DA模型的合理性和可靠性。通过计算变量投影重要性VIP值衡量各个代谢物的表达模式与样本分类判别的影响程度和解释能力, 进而辅助差异代谢物的筛选, 通常用VIP > 1作为筛选标准。图 3C中的PLS-DA模型的R2X与R2Y分别为0.616与0.998, Q2为0.950, 表明该模型的拟合和预测能力较强。置换检验中得到的Q2 = -0.304 < 0, 且所有的Q2、R2点均低于右侧的最高点, 表明该模型可靠且没有过拟合。
5 差异代谢物与热图分析在模型组与给药组中根据VIP > 1与P < 0.05筛选得到的差异代谢物共15个, 分别是苹果酸、异亮氨酸、乳糖、肌醇半乳糖苷二水合物、肌酸酐、葡萄糖醛酸、天冬氨酸、谷氨酸、丝氨酸、油酸、磷酸、S-(羧甲基)-L-半胱氨酸、塔格糖、尿苷和烟酰胺(表 2)。其中, 福多司坦给药后苹果酸、异亮氨酸、乳糖、肌醇半乳糖苷二水合物、肌酸酐、葡萄糖醛酸、油酸、磷酸、S-(羧甲基)-L-半胱氨酸、塔格糖和尿苷共11个代谢物均呈现不同程度的回调。该11个内源性代谢物可作为福多司坦干预炎症微环境状态下肺癌A549细胞的药效生物标志物。用Pearson相关系数将Control、TNF-α和Fudosteine组的差异代谢物归一化至[-1, 1], 绘制热图(图 4A) 直观表示代谢物上下调情况, 颜色从红到蓝代表代谢物的上下调情况, 蓝色代表下调, 红色代表上调。
| Table 2 Fifteen differential expressed metabolites in TNF-α and control group. TNF-α vs control group, *P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.000 1; Fudosteine vs TNF-α group, #P < 0.05, ##P < 0.01, ###P < 0.001 |
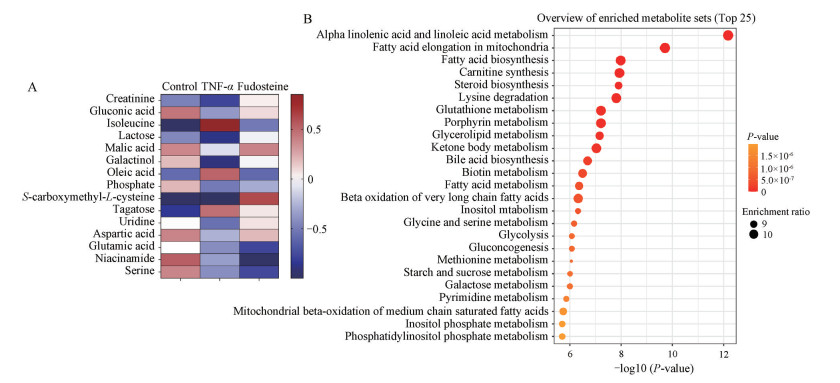
|
Figure 4 The heatmap representing upregulated and downregulated metabolites of control, TNF-α and fudosteine groups (A), and the bubble map of the pathway enrichment analysis (B) |
将差异代谢物的KEGG ID, P与FC值导入软件Cytoscape 3.7.2中的插件Metascape构建“compound”网络图, 如图 5所示, 共得到关联成分34个, 其中红色六边形为导入的差异代谢物, 六边形越大代表该代谢物度值(degree) 越显著。为了进一步分析代谢物, 以度值≥ 5为条件, 筛选关键代谢物, 得到关键代谢物4个, 分别为尿苷、烟酰胺、苹果酸和异亮氨酸。其中, 尿苷、异亮氨酸与苹果酸分别在给药福多司坦后得到显著性回调。
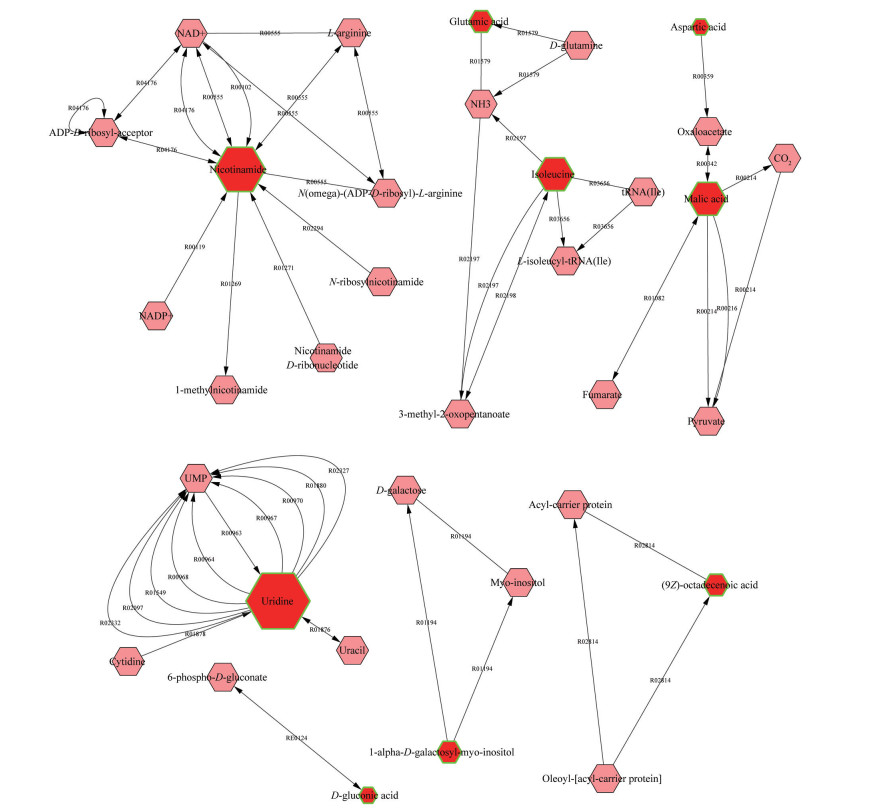
|
Figure 5 Metabolite map containing 34 related components |
将差异代谢物与峰高数据导入MetaboAnalyst的“Pathway Analysis”模块下的“Concentration Table”, 得到关联的代谢通路共23条, 通路分析数据发现15种差异代谢物分别参与氨基酸代谢、碳水化合物代谢、辅助因子和维生素代谢、其他氨基酸代谢和脂质代谢等。将差异代谢物与峰高数据导入MetaboAnalyst的“Enrichment Analysis”模块下的“Quantitative Enrichment Analysis”, 得到关联的富集通路共23条(P < 0.05)。Enrichment ratio和气泡越大表明富集程度越大。气泡图颜色深浅代表P值, P值越小颜色越黄、越浅(图 4B)。通路分析与富集分析均表明, 福多司坦调控肺癌A549细胞主要涉及氨基酸代谢通路。根据度值筛选得到的关键代谢物异亮氨酸分别参与甘氨酸、丝氨酸和苏氨酸代谢(glycine, serine and threonine metabolism) 通路, 缬氨酸、亮氨酸和异亮氨酸的降解(valine, leucine and isoleucine degradation) 通路, 缬氨酸、亮氨酸和异亮氨酸的生物合成(valine, leucine and isoleucine biosynthesis) 等氨基酸相关通路。
讨论众多研究表明, 炎症反应中炎症因子的异常表达与恶性肿瘤的发病密切相关[14]。TNF-α作为炎症反应中的始动因子, 起到放大和加重炎症反应的作用[15]。炎症因子IL-1β的水平升高与肺癌的进展相关, 能促进肺癌细胞的增殖与侵袭[16]。高循环水平的IL-6在包括NSCLC在内的许多类型的癌症中与不良预后相关, 在对NSCLC患者一年时间的随访中发现, 血清IL-6水平高的个体的总体生存率显著低于IL-6水平低的个体[17, 18]。本研究发现使用TNF-α刺激A549细胞后, 能引起炎症因子IL-6与IL-1β的表达异常升高, 在经福多司坦作用后能降低两种炎症因子的水平, 提示福多司坦可以通过降低A549细胞炎症因子IL-1β与IL-6的表达从而纠正异常的炎症微环境, 有助于减轻肺癌炎症的进一步发展。
尿苷是一类被称为嘧啶核苷的化合物的成员, 嘧啶核苷酸的从头合成途径为尿苷代谢为尿嘧啶核苷酸(UMP), 尿嘧啶核苷酸可通过嘧啶核苷酸从头合成途径生成核苷酸。尿嘧啶可以合成尿苷, 尿苷还是构成核酸的5种标准核苷之一, 其余为腺苷、胸腺嘧啶、胞苷和鸟苷。Zheng等[19]对143例肺癌患者、99例健康对照组血清中胆碱及嘌呤代谢通路上的相关代谢物定量分析, 得出血清中尿苷中的含量显著低于健康对照组的结论。本研究中发现, A549细胞模型组与对照组相比, 尿苷的含量显著减少(P < 0.05), 在给药福多司坦后得到了回调(P < 0.05)。异亮氨酸(isoleucine) 是支链氨基酸(BCAAs) 之一, 参与能量和肌肉代谢。BCAAS参与几种癌症, 其调节各种信号通路, 例如蛋白质合成、脂质合成、细胞生长和自噬。BCAAS的分解代谢在氨基酸合成中起重要作用。Eley等[20]的研究表明, 肺癌患者的异亮氨酸浓度要显著高于健康对照, 通过宿主和肿瘤对能量和增殖的需求可以解释肺癌患者异亮氨酸的上调。在本次研究中, A549细胞模型组异亮氨酸显著上调(P < 0.05), 给予福多司坦后, 异亮氨酸的含量显著下降(P < 0.01), 表明福多司坦有可能通过影响支链氨基酸的合成与降解从而影响肿瘤的发展进程。苹果酸是Krebs循环的中间产物, Krebs循环是细胞产生能量的关键步骤。Klupczynska等[21]使用LC-HRMS对健康受试者和NSCLC患者的血清进行代谢组学分析, 发现NSCLC组中代谢物苹果酸的平均水平低于对照组。本实验对A549造模后也出现了苹果酸下降的情况, 并且在给药后苹果酸产生了显著上调, 表明福多司坦有可能通过影响Krebs循环从而影响细胞能量代谢来影响肿瘤的发展。
一些研究表明, 信号通路的改变将调节肿瘤细胞的生长和代谢。甘氨酸、丝氨酸和苏氨酸代谢途径多见于早期肺腺癌, 并为多种其他肺癌中共有的代谢途径[22-24]。丝氨酸和甘氨酸为蛋白质, 核酸和脂质提供前体, 从而维持癌细胞的生长和增殖。本研究中, 福多司坦组能显著干预甘氨酸、丝氨酸和苏氨酸代谢通路, 表明福多司坦有可能通过影响丝氨酸、甘氨酸代谢重编程从而影响肿瘤的发育。支链氨基酸缬氨酸、亮氨酸和异亮氨酸是癌症生长发育所必需的, 可作为mTOR[25, 26]的激动剂, 参与蛋白质的合成构建, 是非必需氨基酸的合成以及三羧酸循环能量正常循环的来源。在福多司坦的作用下, 参与缬氨酸、亮氨酸和异亮氨酸的降解与生物合成通路的关键代谢物异亮氨酸发生显著回调, 表明福多司坦可能通过影响异亮氨酸从而影响缬氨酸、亮氨酸和异亮氨酸的代谢途径进而调控肺癌微环境。
本研究通过代谢组学的差异代谢物和通路富集分析, 从代谢物与通路关联的角度分析了福多司坦调控TNF-α诱导的肺癌细胞A549炎症因子表达的可能作用机制。异亮氨酸、苹果酸、尿苷、乳糖、油酸、S-(羧甲基)-L-半胱氨酸、肌醇半乳糖苷二水合物、葡萄糖醛酸、肌酸酐、磷酸盐、塔格糖被筛选成为生物标志物。进一步的通路富集分析表明甘氨酸、丝氨酸和苏氨酸代谢, 缬氨酸、亮氨酸和异亮氨酸的降解和生物合成, 半胱氨酸和蛋氨酸代谢, 丙氨酸、天冬氨酸和谷氨酸代谢等氨基酸代谢通路与半乳糖代谢等碳水化合物代谢为主要差异代谢通路。研究揭示了福多司坦有可能通过调节紊乱的氨基酸代谢途径来调控肺癌细胞A549微环境中的炎症进程, 从而改善和纠正肿瘤炎症微环境, 表明福多司坦有可能通过纠正肺癌炎症微环境来扼制炎症的持续反应从而防止肺癌的进一步恶化。
作者贡献: 王乙妃负责资料调研、实验和写作论文; 李鑫、高梦婷和张其乐参与实验; 丁安伟、夏文余、姚卫峰和张丽提出想法、设计实验、指导并修改论文。
利益冲突: 本文作者声明无利益冲突。
| [1] |
Duma N, Santana DR, Molina JR. Non-small cell lung cancer: epidemiology, screening, diagnosis, and treatment[J]. Mayo Clin Proc, 2019, 94: 1623-1640. DOI:10.1016/j.mayocp.2019.01.013 |
| [2] |
Conway EM, Pikor LA, Kung SH, et al. Macrophages, inflammation, and lung cancer[J]. Am J Respir Crit Care Med, 2015, 193: 116-130. |
| [3] |
Gong K, Guo G, Beckley N, et al. Tumor necrosis factor in lung cancer: complex roles in biology and resistance to treatment[J]. Neoplasia, 2021, 23: 189-196. DOI:10.1016/j.neo.2020.12.006 |
| [4] |
Garon EB, Yang CH, Dubinett SM. The role of interleukin 1β in the pathogenesis of lung cancer[J]. JTO Clin Res Rep, 2020, 1: 100001. |
| [5] |
Multhoff G, Molls M, Radons J. Chronic inflammation in cancer development[J]. Front Immunol, 2011, 2: 98. |
| [6] |
Kumari N, Dwarakanath BS, Das A, et al. Role of interleukin-6 in cancer progression and therapeutic resistance[J]. Tumor Biol, 2016, 37: 11553-11572. DOI:10.1007/s13277-016-5098-7 |
| [7] |
Zhu Q. Fudosteine for treating chronic obstructive pulmonary disease in 60 cases and its influence on serum cell factors and pulmonary function[J]. World Latest Med Inf (世界最新医学信息文摘), 2019, 19: 191-192. |
| [8] |
Chen YS. Efficacy of fudostein in patients with stable chronic obstructive pulmonary disease[J]. Henan Med Res (河南医学研究), 2020, 29: 4332-4334. |
| [9] |
Qu DM. Efficacy of fudosteine combined with bronchoscopy alveolar lavage in the treatment of elderly patients with bronchiectasis complicated with infection[J]. Chin Mod Dr (中国现代医生), 2020, 58: 89-92. |
| [10] |
Chen R, Lu HY, Shen YH. Study the efficacy of tiotropium bromide combined with fudosteine in the treatment of acute exacerbation of bronchiectasis and its effect on inflammatory factors[J]. Chin Foreign Med Treat (中外医疗), 2020, 39: 81-83, 89. |
| [11] |
Guo BW, Hou W, Wei YP. Effect of fudosteine combined with fiberoptic bronchoscopic lavage in the treatment of senile severe pulmonary infection[J]. Clin Med (临床医学), 2020, 40: 57-58. |
| [12] |
Kinross JM, Holmes E, Darzi AW, et al. Metabolic phenotyping for monitoring surgical patients[J]. Lancet, 2011, 377: 1817-1819. DOI:10.1016/S0140-6736(11)60171-2 |
| [13] |
Zhang A, Sun H, Xu H, et al. Cell metabolomics[J]. OMICS, 2013, 17: 495-501. DOI:10.1089/omi.2012.0090 |
| [14] |
Xia LM, Mo P, Huang WJ, et al. The TNF-α/ROS/HIF-1-induced upregulation of FoxMI expression promotes HCC proliferation and resistance to apoptosis[J]. Carcinogenesis, 2012, 33: 2250-2259. DOI:10.1093/carcin/bgs249 |
| [15] |
Locksley RM, Killeen N, Lenardo MJ. The TNF and TNF receptor superfamilies: integrating mammalian biology[J]. Cell, 2001, 104: 487-501. DOI:10.1016/S0092-8674(01)00237-9 |
| [16] |
Apte RN, Dotan S, Elkabets M, et al. The involvement of IL-1 in tumorigenesis, tumor invasiveness, metastasis and tumor-host interactions[J]. Cancer Metastasis Rev, 2006, 25: 387-408. DOI:10.1007/s10555-006-9004-4 |
| [17] |
Rice SJ, Liu X, Zhang J, et al. Advanced NSCLC patients with high IL-6 levels have altered peripheral T cell population and signaling[J]. Lung Cancer, 2019, 131: 58-61. DOI:10.1016/j.lungcan.2019.03.014 |
| [18] |
Maria SE, Sammartino MV, Aguiar P, et al. High systemic IL-6 is associated with worse prognosis in patients with non-small cell lung cancer[J]. PLoS One, 2017, 12: e0181125. DOI:10.1371/journal.pone.0181125 |
| [19] |
Zheng WL, Yu JQ, Du F, et al. Application of non-target and target metabolomics techniques in the screening of serum markers for the diagnosis of lung cancer[J]. Chin Mod Med (中国当代医药), 2020, 27: 4-8, 253. |
| [20] |
Eley HL, Russell ST, Tisdale MJ. Effect of branched-chain amino acids on muscle atrophy in cancer cachexia[J]. Biochem J, 2007, 407: 113-120. DOI:10.1042/BJ20070651 |
| [21] |
Klupczynska A, Dereziński P, Garrett TJ, et al. Study of early stage non-small-cell lung cancer using orbitrap-based global serum metabolomics[J]. J Cancer Res Clin Oncol, 2017, 143: 649-659. DOI:10.1007/s00432-017-2347-0 |
| [22] |
Huang L, Wang L, Hu X, et al. Machine learning of serum metabolic patterns encodes early-stage lung adenocarcinoma[J]. Nat Commun, 2020, 11: 3556. DOI:10.1038/s41467-020-17347-6 |
| [23] |
Yu S, Li J, Gao W, et al. Uncovering the anticancer mechanism of petroleum extracts of farfarae flos against lewis lung cancer by metabolomics and network pharmacology analysis[J]. Biomed Chromatogr, 2020, 34: e4878. |
| [24] |
Li J, Gong Z, Jiang H, et al. Comprehensive analysis reveals GPRIN1 is a potential biomarker for non-small cell lung cancer[J]. Curr Bioinform, 2021, 16: 130-138. DOI:10.2174/1574893615999200530201333 |
| [25] |
Li FN, Yin YL, Tan B, et al. Leucine nutrition in animals and humans: mTOR signaling and beyond[J]. Amino Acids, 2011, 41: 1185-1193. DOI:10.1007/s00726-011-0983-2 |
| [26] |
Ananieva EA, Wilkinson AC. Branched-chain amino acid metabolism in cancer[J]. Curr Opin Clin Nutr Metab Care, 2018, 21: 64-70. DOI:10.1097/MCO.0000000000000430 |
 2022, Vol. 57
2022, Vol. 57


