2. 新疆药物研究所, 新疆 乌鲁木齐 830002;
3. 新疆维吾尔药重点实验室, 新疆 乌鲁木齐 830002;
4. 中国药科大学, 江苏 南京 210009
2. Xinjiang Institute of Materia Medica, Urumqi 830002, China;
3. Xinjiang Uyghur Medicine Key Laboratory, Urumqi 830002, China;
4. China Pharmaceutical University, Nanjing 210009, China
据2019年中国卒中报告显示, 在我国, 脑血管病是继心脏病和恶性肿瘤之后的第三位居民死亡原因, 其中缺血性卒中患者约占卒中患者的80%[1]。尽早恢复脑组织的供血供氧是挽救缺血性卒中患者生命、降低致残率的有效手段之一, 因为脑组织长期缺血后, 血流的恢复会对其造成额外的损伤, 即脑缺血再灌注损伤。人脑微血管内皮细胞(human brain microvascular endothelial cells, HBMECs) 是血脑屏障的主要组成部分, 限制可溶性和细胞性物质从血液进入大脑, 调节中枢神经系统的稳态[2]。脑缺血再灌注损伤会导致HBMECs死亡, 从而造成血脑屏障不可逆的破坏。因此, 保护HBMECs对于维护血脑屏障的完整性, 减弱脑缺血再灌注损伤至关重要。
程序性坏死(necroptosis) 又称坏死性凋亡, 是一种区别于凋亡的非半胱氨酸天冬氨酸蛋白酶(cysteine aspartic acid protease, caspase) 依赖性的细胞死亡方式。在机体内, 发生程序性坏死的细胞不但受到特定信号激发, 还受到严格的程序控制。受体相互作用蛋白3 (receptor interacting protein kinase 3, RIP3) 是程序性坏死通路的关键信号分子。RIP3将导致下游分子混合谱系激酶结构域样蛋白(mixed lineage kinase domain-like protein, MLKL) 的磷酸化, 引发细胞膜完整性破坏, 这是程序性坏死的关键步骤[3, 4]。磷酸化的MLKL又将激活线粒体丝氨酸/苏氨酸磷酸酶5 (phosphoglycerate mutase 5, PGAM5), 进而导致线粒体膜通透性转化孔(mitochondrial permeability transition pore, MPTP) 开放, 使线粒体能量代谢障碍, 最终导致内皮细胞能量衰竭而死亡。研究表明, 缺血再灌注损伤诱导的细胞死亡约50%可以通过坏死相关基因的缺失而被阻断, 而约30%可被泛caspase抑制剂Z-VAD-FMK抑制[5-8], 表明坏死而非凋亡是缺血再灌注期间细胞的主要死亡模式。因此, 减少微血管内皮细胞的程序性坏死成为研究脑缺血再灌注损伤的一个重要方向。
香青兰(Dracocephalum moldavica L.) 又名巴迪然吉布亚, 是唇形科香青兰属植物, 其单味药制剂益心巴迪然吉布亚颗粒临床应用显示出较强的补益心脑、改善心烦气喘的功效[9]。香青兰有效部位(effective parts of Dracocephalum moldavica, EPDM) 是从香青兰中提取分离出来的有效部位, 其含量占总提取物的53.06%, 主要活性成分是田蓟苷、刺槐素-7-O-β-D-葡萄糖醛酸苷、木犀草素-7-O-β-D-葡萄糖醛酸苷、香叶木素-7-O-β-D-葡萄糖醛酸苷和芹菜素-7-O-β-D-葡萄糖醛酸苷、迷迭香酸[10]。研究表明, EPDM可有效抑制脑缺血再灌注损伤后的炎症级联, 保护脑组织[11]。在氧化应激条件下, EPDM还可减弱钙/钙调蛋白依赖性蛋白激酶Ⅱ (calcium/calmodulin-dependent protein kinase Ⅱ, CaMKⅡ) 依赖性线粒体凋亡, 保护人脑星形胶质细胞免受H2O2诱导的氧化胁迫损伤[10]。香青兰活性成分田蓟苷可缩小脑缺血再灌注损伤大鼠模型的脑梗死体积, 改变脑组织病理状态[12]。香青兰提取物可通过抑制细胞凋亡途径发挥对脑缺血再灌注大鼠的保护作用[13]。此外, 香青兰与神香草不同提取部位联用亦被报道对脑缺血再灌注损伤大鼠具有保护作用[14]。但是, EPDM抑制程序性坏死、保护脑缺血再灌注损伤的研究尚未见诸报道。本文拟从EPDM抑制程序性坏死角度, 探讨其抗脑缺血再灌注损伤的作用及机制, 进一步为EPDM治疗脑缺血性相关疾病提供实验依据。
材料与方法药物与试剂 EPDM (新疆药物研究所自制[15], 批号201804); DMEM高糖培养基、DMEM无糖培养基、胎牛血清, Gibco公司; 0.25%胰酶, TRANS公司; 厌氧采气袋和密封培养罐, 日本三菱公司; Z-VAD-FMK, 美国Selleck Chem公司; Hoechst 33342和碘化丙啶(propidium iodide, PI), Sigma公司; 乳酸脱氢酶(lactate dehydrogenase, LDH) 测定试剂盒、活性氧测定试剂盒, 南京建成生物工程研究所; SDS-PAGE凝胶快速配制试剂盒、线粒体膜通透性转换孔检测试剂盒, 碧云天生物技术公司; 线粒体膜电位(mitochondrial membrane potential, MMP) 检测试剂盒(JC-1)、RIPA (强) 裂解液和苯甲基黄酰氟(phenylmethyl sulfonyl fluoride, PMSF)、人肿瘤坏死因子α (TNF-α) 酶联免疫吸附实验(enzyme-linked immunosorbent assay, ELISA) 试剂盒、人白介素-6 (interleukin-6, IL-6) ELISA试剂盒, 北京索莱宝科技有限公司; 人白介素-1β (interleukin-1β, IL-1β) ELISA试剂盒, 武汉伊莱瑞特生物科技股份有限公司; 广谱磷酸酶抑制剂, 武汉博士德生物工程有限公司; 蛋白定量试剂盒、预染蛋白marker, Thermo Fisher Pierce公司; RIP3抗体、MLKL抗体、PGAM5抗体, Abcam公司; p-MLKL (Ser358) 抗体, Cell Signaling Technology公司; β-actin抗体、山羊抗小鼠IgG/辣根酶标记二抗和山羊抗兔IgG/辣根酶标记二抗, 中国中杉金桥公司; ECL发光液, 美国Millipore公司。
仪器 HERA cell-150i细胞培养箱、Evos FLoid细胞成像工作站(美国Thermo Fisher公司); SPARK多功能微孔板检测仪(瑞士TECAN公司); 荧光显微镜(Invitrogen公司); FUSION FX6多功能成像系统(法国VILBER公司); TGL-16K离心机(湖南湘仪实验室仪器开发有限公司); 蛋白电泳仪和电泳槽(美国Bio-Rad公司)。
药物配制 每50 mg香青兰有效部位粉末加入DMSO至1 mL, 配制成浓度为50 mg·mL-1的香青兰有效部位母液。每10 mg Z-VAD-FMK加入0.427 8 mL DMSO配制成浓度为50 mmol·L-1 Z-VAD-FMK母液。
细胞培养 HBMECs培养于含10%胎牛血清(fetal bovine serum, FBS) 的DMEM高糖培养基, 置于37 ℃、5% CO2细胞培养箱中培养, 待细胞融合度达到90%左右, 用0.25%胰酶消化后用于后续实验。
细胞模型建立及分组给药 本实验用氧糖剥夺/复氧(oxygen-glucose deprivation/re-oxygenation, OGD/R) 方式建立缺血再灌注损伤模型。Z-VAD-FMK联合OGD/R (Z + OGD/R) 建立缺血再灌注损伤程序性坏死模型。细胞随机分为对照组(control)、Z-VAD-FMK + OGD/R模型组(model)、Z-VAD-FMK + OGD/R + EPDM低、中、高剂量(25、50、100 µg·mL-1) 组(model + EPDM)。Z-VAD-FMK + OGD/R模型组用40 µmol·L-1 Z-VAD-FMK[16]预处理细胞6 h, 然后加入无糖培养基并放入含厌氧袋的培养罐中氧糖剥夺12 h, 再弃去无糖培养基, 加入高糖培养基并放入5% CO2培养箱复氧2 h。EPDM预处理6 h发生于Z-VAD-FMK预处理之后。
细胞活力测定 将对数生长期的HBMECs按5 000个/孔接种于96孔板中。待细胞贴壁后, 加入不同浓度EPDM作用24 h, 或按上述“细胞模型建立及分组给药”进行细胞模型建立和加药处理。实验同时设无细胞对照组(blank) 和无药对照组(control), 模型实验时还需设立无药模型组(model)。实验结束后, 弃培养上清, 每孔加入100 µL含CCK-8的DMEM作用1 h, 酶标仪测定450 nm吸光度值(A), 并按公式(1) 计算细胞活力(cell viability)。
| $ \begin{array}{l}\mathrm{C}\mathrm{e}\mathrm{l}\mathrm{l}\;\mathrm{v}\mathrm{i}\mathrm{a}\mathrm{b}\mathrm{i}\mathrm{l}\mathrm{i}\mathrm{t}\mathrm{y}\;\left(\mathrm{\%}\right)=\\ \frac{{A}_{\mathrm{D}\mathrm{r}\mathrm{u}\mathrm{g}\;\mathrm{o}\mathrm{r}\;\mathrm{M}\mathrm{o}\mathrm{d}\mathrm{e}\mathrm{l}\;\mathrm{o}\mathrm{r}\;\mathrm{M}\mathrm{o}\mathrm{d}\mathrm{e}\mathrm{l}\;+\;\mathrm{D}\mathrm{r}\mathrm{u}\mathrm{g}}\;\;\;-{A}_{\mathrm{B}\mathrm{l}\mathrm{a}\mathrm{n}\mathrm{k}}}{{A}_{\mathrm{C}\mathrm{o}\mathrm{n}\mathrm{t}\mathrm{r}\mathrm{o}\mathrm{l}}-{A}_{\mathrm{B}\mathrm{l}\mathrm{a}\mathrm{n}\mathrm{k}}}\times 100\end{array} $ | (1) |
Hoechst 33342/PI双染色法检测细胞程序性坏死情况 将对数生长期细胞按2×105个/孔接种于6孔板中, 细胞贴壁后按上述方法分组造模。实验结束后, 弃去培养液, PBS漂洗2次, 分别加入10 μg·mL-1 Hoechst 33342和20 μg·mL-1 PI染液, 在细胞培养箱中孵育20 min, 荧光显微镜观察并拍照, Image J计算坏死细胞比例。Hoechst 33342使细胞核产生蓝色荧光; PI不能透过完整的细胞膜, 无法使具有完整细胞膜的正常细胞核或凋亡细胞核染色, 而坏死细胞由于丧失膜的完整性, PI可使其细胞核染色而产生强红色荧光。
LDH释放量检测 将对数生长期细胞按2×105个/孔接种于6孔板中, 细胞贴壁后按前述方法分组造模。实验结束后, 取细胞培养液上清, 按照LDH细胞检测试剂盒说明书进行后续测定。测定结果以450 nm处的A值表示。LDH活性按照公式(2) 进行计算。
| $ \begin{array}{l}\mathrm{L}\mathrm{D}\mathrm{H}\mathrm{活}\mathrm{性}(\mathrm{U}·{\mathrm{L}}^{-1})=\frac{{A}_{\mathrm{测}\mathrm{定}}-{A}_{\mathrm{对}\mathrm{照}}}{{A}_{\mathrm{标}\mathrm{准}\mathrm{品}}-{A}_{\mathrm{空}\mathrm{白}}}\times \\ \mathrm{标}\mathrm{准}\mathrm{品}\mathrm{浓}\mathrm{度}(0.2\mathrm{ }\mathrm{\mu }\mathrm{m}\mathrm{o}\mathrm{l}·\mathrm{m}{\mathrm{L}}^{-1})\times 1\mathrm{ }000\end{array} $ | (2) |
ROS测定 将对数生长期细胞按2×105个/孔接种于6孔板中, 细胞贴壁后按前述方法分组造模, 复氧复糖的同时加入浓度为10 µmol·L-1 2, 7-二氯二氢荧光素二乙酸酯(2, 7-dichlorodihydrofluorescein diacetate, DCFH-DA)。实验结束后, 用胰酶消化细胞后, 加入培养基终止消化, 制成细胞悬液, 1 000 ×g离心5 min收集细胞。PBS洗涤1次后, 用荧光酶标仪在激发波长500 nm、发射波长525 nm下检测细胞平均荧光强度(mean fluorescence intensity, MFI)。
MPTP开放情况检测 将对数生长期细胞按2×105个/孔接种于6孔板中, 细胞贴壁后按前述方法分组造模。实验结束后, 贴壁细胞经胰酶消化后用培养液重悬, 1 000 ×g室温离心5 min; 弃上清, 加入1 mL含calcein AM染色液和荧光淬灭剂的检测缓冲液, 37 ℃避光孵育30 min。孵育完成后, 1 000 ×g室温离心5 min; 收集细胞, 加入1 mL检测缓冲液重悬并离心洗去多余染料; 再加入400 µL检测缓冲液重悬, 在激发波长494 nm、发射波长517 nm下, 用流式细胞仪进行荧光检测。
MMP检测 将对数生长期细胞按2×105个/孔接种于6孔板中, 细胞贴壁后按前述方法分组造模。吸弃培养基, PBS洗涤1次, 加入含有JC-1染色工作液(1×) 的细胞培养液2 mL, 于细胞培养箱中孵育20 min。孵育结束后, 吸弃上清, 用JC-1染色缓冲液洗涤两次后, 加入细胞培养液, 荧光显微镜观察并拍照, Image J计算MFI。
炎性因子释放的检测 将对数生长期细胞按2×105个/孔接种于6孔板中, 细胞贴壁后按前述方法分组造模。造模结束后, 收集细胞上清备用。按ELISA试剂盒说明书进行操作。简言之, 每孔加入样品100 µL, 37 ℃孵育90 min; 倒去孔内液体, 加入100 µL生物素化抗体工作液, 37 ℃孵育60 min; 洗涤3次后, 加入100 µL酶结合物工作液, 37 ℃孵育30 min; 洗涤5次后, 加入90 µL底物工作液, 37 ℃孵育15 min, 再加入50 µL终止液, 立即用多功能酶标仪在450 nm波长处测定A值。
免疫印迹 将对数生长期细胞按2×105个/孔接种于6孔板中, 细胞贴壁后按前述方法分组造模。造模结束后, PBS清洗细胞2次, 加入含1%蛋白磷酸酶抑制剂和1% PMSF的RIPA (强) 裂解液, 冰上裂解30 min后, 于4 ℃、12 000 r·min-1离心20 min。收集上清, BCA蛋白定量后, 加入1×上样缓冲液, 金属浴使蛋白变性, 短期储存在-20 ℃。蛋白样品经SDS-PAGE凝胶电泳后, 转至PVDF膜, 用5%脱脂奶粉室温封闭2 h。TBST洗涤3次, 分别加入以TBST按1∶1 000稀释的RIP3抗体、MLKL抗体、p-MLKL抗体、PGAM5抗体和β-actin抗体, 4 ℃孵育过夜。TBST洗涤3次, 加入相应的二抗孵育2 h, ECL发光液显影, 采用多功能成像系统拍照, Image J分析蛋白条带的灰度值。
数据处理 各组计量数据以
采用CCK-8检测细胞活力。CCK-8在电子载体的作用下可被细胞线粒体中的一些脱氢酶还原生成橙色的甲瓒(formazan)。细胞增殖越多越快, 颜色越深, 因此, 可通过测定A值计算细胞活力。结果显示, 在6.25~100 μg·mL-1浓度范围内, EPDM对HBMECs活力无明显影响, 而200 μg·mL-1 EPDM则使细胞活力显著下降(图 1A)。图 1B结果显示, 与对照组相比, 模型组HBMECs活力显著降低(P < 0.000 1); 与模型组相比, 中、高剂量EPDM可使HBMECs活力显著升高(P < 0.000 1), 且EPDM高剂量组改善细胞活力的能力比中剂量组更强(P < 0.05)。这些结果提示, EPDM可改善Z-VAD-FMK + OGD/R诱导的细胞损伤, 增强HBMECs活力。
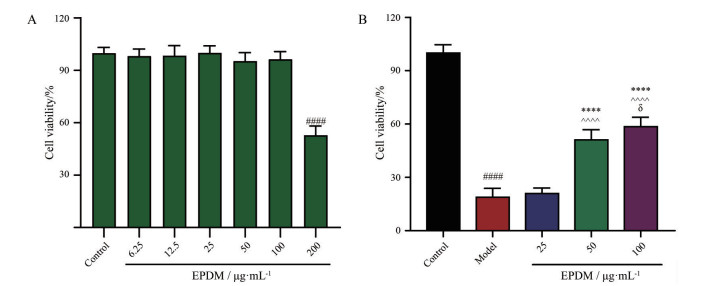
|
Figure 1 Effective parts of Dracocephalum moldavica (EPDM) on the cell viability of human brain microvascular endothelial cells (HBMECs) uninduced (A) and induced (B) by Z-VAD-FMK + OGD/R. n = 3, |
采用Hoechst 33342/PI双染色法检测细胞程序性坏死情况。如图 2A所示, Hoechst 33342可将活HBMECs的细胞核染成蓝色, PI可将程序性坏死细胞的细胞核染成红色, 红蓝细胞比率即为HBMECs的程序性坏死率。图 2B结果显示, 与对照组相比, 不加Z-VAD-FMK的OGD/R组程序性坏死细胞数目较少, 而加了Z-VAD-FMK的OGD/R组程序性坏死细胞数显著增多(P < 0.000 1); 与模型组相比, EPDM中、高剂量组可显著降低HBMECs的程序性坏死率(P < 0.05)。

|
Figure 2 Effects of EPDM on the necroptosis in HBMECs induced by Z-VAD-FMK + OGD/R. A: Cell nuclei double-stained by Hoechst 33342/PI, bar: 125 μm; B: Total necroptosis rates by Image J based on the cell nuclei images. n = 3, |
细胞膜完整性的破坏是程序性坏死细胞的特征表现[4]。LDH是存在于胞浆中的一种酶, 在细胞膜受损破裂时被释放。采用LDH测定试剂盒检测细胞培养上清中LDH释放量可间接反映细胞膜的受损程度。如图 3所示, 与对照组相比, 模型组LDH活性显著升高(P < 0.000 1); 与模型组相比, EPDM高剂量组LDH活性显著降低(P < 0.001), 提示EPDM可部分逆转Z-VAD-FMK + OGD/R诱导的细胞程序性坏死, 减弱对细胞膜完整性的破坏。
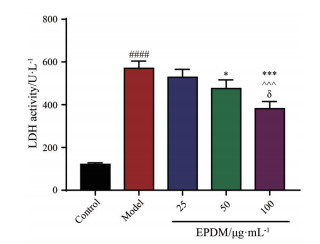
|
Figure 3 Effects of EPDM on the lactate dehydrogenase (LDH) activity of HBMECs induced by Z-VAD-FMK + OGD/R. n = 3, |
采用DCFH-DA作为活性氧检测探针, DCFH-DA本身没有荧光, 但具有膜渗透性。DCFH-DA一旦进入细胞, 就被细胞酯酶水解为2', 7'-二氯二氢荧光素(2', 7'-dichlorodihydrofluorescein, DCFH)。在活性氧存在时, DCFH可被快速氧化为不能穿透细胞膜的强绿色荧光物质2', 7'-二氯荧光素(2', 7'-dichlorofluorescein, DCF), 且DCF荧光强度MFI与细胞内ROS水平呈正比。如图 4所示, 与对照组相比, 模型组ROS水平显著升高(P < 0.000 1); 与模型组相比, EPDM低、中、高剂量预保护均可使OGD/R组ROS水平显著降低(P < 0.000 1)。
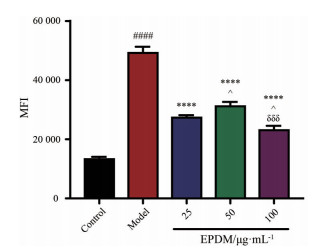
|
Figure 4 Effects of EPDM on the reactive oxygen species (ROS) production in HBMECs induced by Z-VAD-FMK + OGD/R. ROS in HBMECs was detected by DCFH-DA fluorescence probe. n = 3, |
为了评价MPTP的开放情况, 本实验采用calcein AM荧光探针标记HBMECs, 再用流式细胞仪检测其荧光强度。Calcein AM本身没有荧光, 进入细胞后可被细胞内的酯酶水解, 生成没有膜通透性的极性荧光染料钙黄绿素(calcein), 使细胞质包括线粒体等呈现强绿色。CoCl2作为淬灭剂可淬灭胞质中的绿色荧光。正常情况下, 线粒体的MPTP是关闭的, CoCl2无法进入, 因此, MPTP关闭的线粒体的荧光不被淬灭。当MPTP开放时, 线粒体荧光将被部分或者全部淬灭。因此, 可用平均荧光强度MFI反映线粒体MPTP开放情况。如图 5所示, 与对照组相比, 模型组MFI显著降低, 表明MPTP被开放(P < 0.000 1); 与模型组相比, EPDM预保护可使MFI值升高, 提示, MPTP被部分关闭(P < 0.000 1)。
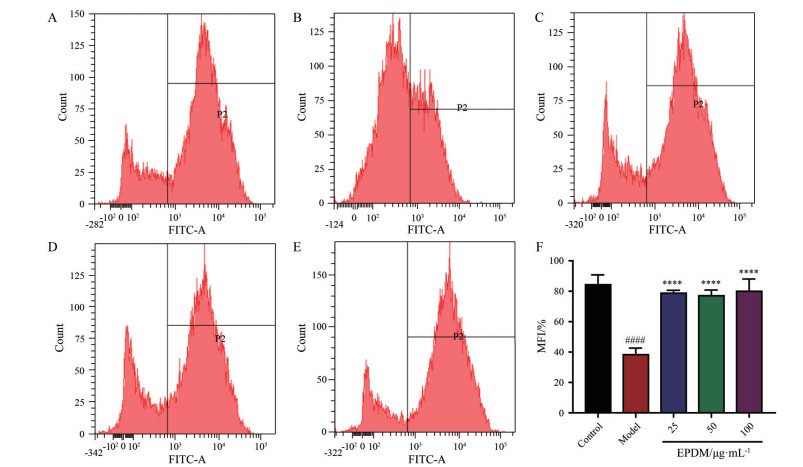
|
Figure 5 Effects of EPDM on mitochondrial permeability transition pore (MPTP) in HBMECs induced by Z-VAD-FMK + OGD/R. A: Control group; B: Model group; C: Model + 25 μg·mL-1 EPDM; D: Model + 50 μg·mL-1 EPDM; E: Model + 100 μg·mL-1 EPDM; F: MFI percentages of A to E groups. n = 3, |
MMP是由于线粒体内膜两侧质子及其他离子不对称分布造成的, MMP变化与MPTP开放密切相关。为了评价MMP变化, 采用JC-1荧光探针标记HBMECs, 并用荧光显微镜观察细胞荧光强度。正常细胞MMP较高, JC-1会聚集在线粒体的基质中, 形成聚合物, 产生红色荧光; 当MMP较低时, JC-1以单体形式存在, 不能聚集于线粒体基质中, 产生绿色荧光。红绿荧光相对比值常被用来判断MMP的变化。如图 6所示, 与对照组相比, 模型组绿色荧光增强, 红绿荧光相对比值降低, MMP降低(P < 0.000 1); 与模型组相比, EPDM中、高剂量预保护可使绿色荧光逐渐减弱, 红绿荧光相对比值逐渐升高, MMP亦逐渐升高(P < 0.000 1)。
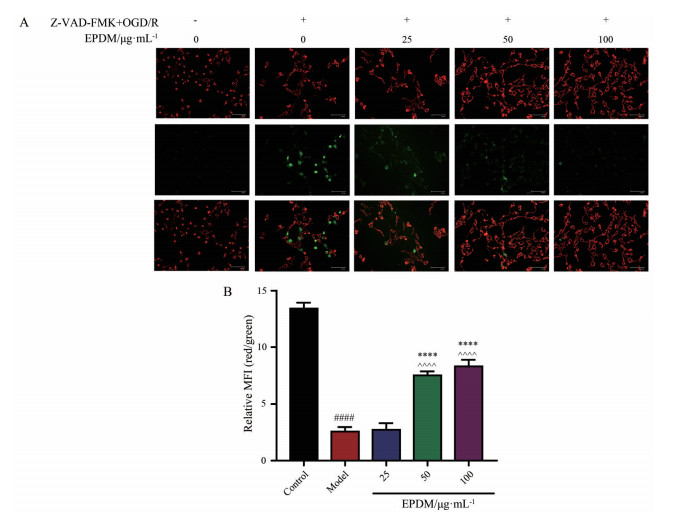
|
Figure 6 Effects of EPDM on mitochondrial membrane potential (MMP) in HBMECs induced by Z-VAD-FMK + OGD/R. A: Cell images stained by the lipophilic cationic probe JC-1. Red signal indicates JC-1 in mitochondria, and green signal indicates cytosolic JC-1. Bar: 125 μm; B: Quantitative analysis of MMP based on the MFI ratio of red to green. n = 3, |
采用ELISA试剂盒检测炎性因子TNF-α、IL-1β和IL-6释放情况。如图 7所示, 与对照组相比, 模型组TNF-α、IL-1β和IL-6释放量显著增多(P < 0.01); 与模型组相比, EPDM高浓度给药组可使TNF-α释放量显著降低; EPDM低、中、高浓度给药组均使IL-1β释放量显著降低; EPDM低、高浓度给药组则使IL-6释放量显著降低。上述结果提示, Z-VAD-FMK + OGD/R引发的细胞程序性坏死可诱导HBMECs发生炎症反应, 而EPDM可部分抑制此炎性过程。
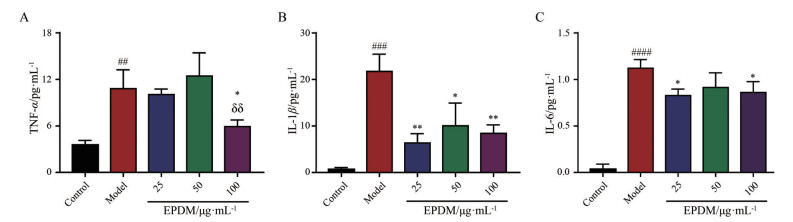
|
Figure 7 Effects of EPDM on the release of inflammatory factors in HBMECs induced by Z-VAD-FMK + OGD/R. A: Tumor necrosis factor-α (TNF-α); B: Interleukin-1β (IL-1β); C: Interleukin-6 (IL-6). n = 3, |
如图 8所示, 与对照组相比, 模型组RIP3 (P < 0.05) 和PGAM5 (P < 0.01) 蛋白水平显著升高, p-MLKL/MLKL比值亦显著升高(P < 0.001); 与模型组相比, 高浓度EPDM可使HBMECs内RIP3 (P < 0.01) 和PGAM5 (P < 0.01) 蛋白表达显著降低, p-MLKL/MLKL比值亦显著降低(P < 0.05)。
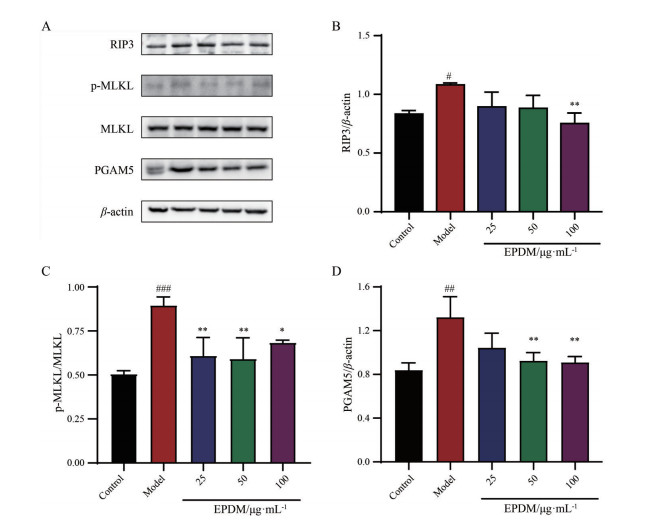
|
Figure 8 Effects of EPDM on the expression of necroptosis-related proteins in HBMEC induced by Z-VAD-FMK + OGD/R. A: Representative images of protein expression; B: The expression of receptor interacting protein kinase 3 (RIP3) protein relative to β-actin; C: The expression of phospho-mixed lineage kinase domain-like protein (p-MLKL) relative to MLKL; D: The relative expression of phosphoglycerate mutase 5 (PGAM5) relative to β-actin. n = 3, |
越来越多的证据表明, 程序性坏死在缺血再灌注诱导的细胞死亡中起着关键作用[17]。程序性坏死是一种非caspase依赖的细胞死亡形式, 可被高度调节, 但又不同于细胞凋亡。程序性坏死的典型特征是: 细胞呈坏死样、膜完整性被破坏、ROS浓度增加、坏死组织线粒体膜通透性转化孔开放、线粒体膜电位缺失、发生炎性反应、程序性死亡通路相关蛋白表达等[18]。对缺血再灌注诱导的程序性坏死机制的探讨可为缺血再灌注损伤相关疾病的治疗提供新策略。因此, 本研究使用HBMECs通过caspase抑制剂Z-VAD-FMK联合氧糖剥夺/复氧方法建立了体外脑缺血再灌注损伤诱导的程序性坏死模型, 并从细胞活力、Hoechst 33342/PI双染、LDH释放、ROS产生、MPTP开放、线粒体膜电位改变、炎性因子和程序性坏死相关蛋白表达等方面证实了该脑缺血再灌注损伤程序性坏死模型的成功构建。同时, 本文亦从上述众方面证明, 在Z-VAD-FMK作用之后加入EPDM对HBMEC进行预保护可部分抑制细胞程序性坏死的发生, 为EPDM可用于脑缺血再灌注损伤治疗提供了实验依据。此外, 本研究还发现, EPDM中、高剂量组在细胞活力、LDH释放量、ROS生产和TNF-α分泌方面表现出显著性差异, 而在程序性坏死率、MPTP开放、MMP、IL-1β和IL-6分泌, 以及蛋白表达方面则没有显著性差异, 究其原因可能与所检测参数在脑缺血再灌注程序性坏死中的功用和量变/质变属性的不同有关。
脑对氧化应激更为敏感, 这与大脑耗氧量大、更易于产生ROS有关。在缺血再灌注情况下, ROS生成增多, 导致细胞内线粒体膜发生脂质过氧化。此外, ROS还可氧化脂质和蛋白质, 进一步导致内皮细胞损伤, 增加血脑屏障通透性[19]。本研究通过对ROS释放量的检测, 发现EPDM可减少自由基的生成, 增加细胞抗氧化应激的能力。MPTP是跨越在线粒体内外膜之间的非选择性通道。已有大量文献表明, MPTP开放与细胞缺血缺氧性损伤密切相关, 在脑缺血再灌注损伤中有很重要的作用[20, 21]。缺血再灌注过程有利于MPTP的开放。MPTP开放后, 线粒体膜通透性改变, 线粒体跨膜电位消失, 氧化呼吸链电子传递障碍; 同时, 伴随线粒体外膜破裂, 呼吸链的一些成分也释放到胞质, 这些均导致线粒体功能障碍, 使细胞最终因能量耗竭而坏死性死亡[22]。本研究通过对MPTP开放情况和线粒体膜电位进行检测, 发现EPDM可减少MPTP的开放, 增加线粒体膜电位, 发挥线粒体保护作用。
当组织发生缺血时, 缺氧会阻止线粒体呼吸和氧化磷酸化, 能量缺损将最终导致细胞坏死性死亡, 并伴随着质膜破裂和随后的炎症反应。血脑屏障的完整性在脑缺血再灌注损伤中起关键作用。微血管是血脑屏障的重要构成部分。缺血再灌注发生时, 由于炎症的发生, 使得血管内皮细胞损伤和血管内皮细胞之间紧密连接的完整性受到损害。这将增加血脑屏障的通透性, 从而导致脑损伤加剧[23]。本研究通过对HBMECs炎性因子分泌的检测, 发现EPDM可明显减少炎性因子TNF-α、IL-1β、IL-6的释放, 减少质膜的破裂和坏死组织周围的炎性反应而发挥细胞保护作用。
RIP3是程序性坏死通路的关键信号分子, 其可导致MLKL磷酸化, 作为程序性坏死的关键步骤, 这将导致细胞膜的破裂。磷酸化的MLKL又将上调PGAM5的表达, PGAM5是一种线粒体外膜丝氨酸/苏氨酸蛋白磷酸酶, 最初在真核细胞中发现, 其与细胞适应性反应之间存在联系, 可通过氧化应激、线粒体异常分裂、线粒体融合缺陷和有丝分裂失调多效性效应协同导致线粒体功能障碍, 致使MPTP开放从而导致细胞坏死性死亡[24]。缺血再灌注损伤介导的脑细胞死亡与线粒体功能障碍有关, PGAM5和坏死之间的这些相互联系的机制可以为防止脑细胞死亡提供新的靶点。本研究通过程序性坏死相关蛋白的检测, 发现EPDM可下调RIP3、p-MLKL、PGAM5的表达, 抑制程序性坏死的发生, 发挥细胞的保护作用。此外, 除RIP3、MLKL、PGAM5外, 线粒体中还存在另一种线粒体丝氨酸蛋白酶HtrA2/omi。研究表明, 长时间OGD暴露会启动线粒体HtrA2/omi释放至细胞质中, 显著降低磷蛋白和x连锁凋亡抑制蛋白水平, 激活caspase 3和基质金属蛋白酶9, 诱导细胞凋亡[25]。在脑缺血性疾病甚至脑缺血性程序性坏死模型中, EPDM是否会参与HtrA2/omi调控有待进一步研究。
综上所述, 本研究在EPDM对脑缺血再灌注大鼠及人脑星形胶质细胞具有保护作用的基础上, 以HBMECs为研究对象, 联合Z-VAD-FMK与OGD/R损伤建立了脑缺血再灌注程序性坏死模型, 并证明了EPDM发挥脑保护作用可能与维持线粒体功能、增强氧化应激能力、减少炎症反应、抑制RIP3/MLKL/PGAM5/MPTP通路, 减轻程序性坏死有关, 为EPDM治疗脑缺血性疾病提供了实验依据。
| [1] |
Wang YJ, Li ZX, Gu HQ, et al. China Stroke Statistics 2019:a report from the National Center for Healthcare Quality Management in Neurological Diseases, China National Clinical Research Center for Neurological Diseases, the Chinese Stroke Association, National Center for Chronic and Non-communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention and Institute for Global Neuroscience and Stroke Collaborations[J]. Stroke Vasc Neurol, 2020, 5: 211-239. DOI:10.1136/svn-2020-000457 |
| [2] |
Yu QJ, Tao H, Wang X, et al. Targeting brain microvascular endothelial cells: a therapeutic approach to neuroprotection against stroke[J]. Neural Regen Res, 2015, 10: 1882-1891. DOI:10.4103/1673-5374.170324 |
| [3] |
Cho YS, Challa S, Moquin D, et al. Phosphorylation-driven assembly of the RIP1-RIP3 complex regulates programmed necrosis and virus-induced inflammation[J]. Cell, 2009, 137: 1112-1123. DOI:10.1016/j.cell.2009.05.037 |
| [4] |
Wang H, Sun L, Su L, et al. Mixed lineage kinase domain-like protein MLKL causes necrotic membrane disruption upon phosphorylation by RIP3[J]. Mol Cell, 2014, 54: 133-146. DOI:10.1016/j.molcel.2014.03.003 |
| [5] |
Wang K, Liu F, Liu CY, et al. The long noncoding RNA NRF regulates programmed necrosis and myocardial injury during ischemia and reperfusion by targeting miR-873[J]. Cell Death Differ, 2016, 23: 1394-1405. DOI:10.1038/cdd.2016.28 |
| [6] |
de Almagro MC, Goncharov T, Izrael-Tomasevic A, et al. Coordinated ubiquitination and phosphorylation of RIP1 regulates necroptotic cell death[J]. Cell Death Differ, 2017, 24: 26-37. DOI:10.1038/cdd.2016.78 |
| [7] |
Zhu P, Hu S, Jin Q, et al. Ripk3 promotes ER stress-induced necroptosis in cardiac IR injury: a mechanism involving calcium overload/XO/ROS/mPTP pathway[J]. Redox Biol, 2018, 16: 157-168. DOI:10.1016/j.redox.2018.02.019 |
| [8] |
Zhou H, Zhu P, Guo J, et al. Ripk3 induces mitochondrial apoptosis via inhibition of FUNDC1 mitophagy in cardiac IR injury[J]. Redox Biol, 2017, 13: 498-507. DOI:10.1016/j.redox.2017.07.007 |
| [9] |
Yu N, Chen W, Xing J, et al. HPLC determination of four components in Yixin Badiranjibuya granules[J]. Chin J Pharm Anal (药物分析杂志), 2015, 35: 670-674. |
| [10] |
Zheng RF, Du YW, Zeng C, et al. Total flavones of Dracocephalum moldavica L. protect astrocytes against H2O2-induced apoptosis through a mitochondria-dependent pathway[J]. BMC Complement Med Ther, 2020, 20: 78. DOI:10.1186/s12906-020-2846-4 |
| [11] |
Sun Y, Liu T, Dai X, et al. Effect of total flavones of Dracocephalum moldavica L. on inflammation induced by transient cerebral ischemia[J]. Acta Biophys Sin (生物物理学报), 2012, 28: 469-476. DOI:10.3724/SP.J.1260.2012.20026 |
| [12] |
Ma l, Zeng C, Zheng R, et al. Protective effects of tilianin on brain tissue in cerebral ischemia-reperfusion injury model rats[J]. J Chin Pharm (中国药房), 2018, 29: 2805-2810. |
| [13] |
Wu P, Yan XS, Zhou LL, et al. Involvement of apoptosis in the protective effects of Dracocephalum moldavaica in cerebral ischemia reperfusion rat model[J]. J Toxicol Environ Health A, 2019, 82: 1036-1044. DOI:10.1080/15287394.2019.1684707 |
| [14] |
Maihemuti M, Abulaiti R, Parhat A. Study on the protective effect of different extraction sites of Hyssopus officinalis and Dracocephalum moldavica combination on cerebral ischemia-reperfusion injury in rats[J]. Tradit Med Mod Med, 2019, 2: 171-177. DOI:10.1142/S2575900019500149 |
| [15] |
Xing J, He C, Yu N, et al. The preparation method and application of the Dracocephalum moldavica extracts: China, CN201510652848.7[P]. 2016-01-20.
|
| [16] |
Zhang Y, Zhang X, Park TS, et al. Cerebral endothelial cell apoptosis after ischemia-reperfusion: role of PARP activation and AIF translocation[J]. J Cereb Blood Flow Metab, 2005, 25: 868-877. DOI:10.1038/sj.jcbfm.9600081 |
| [17] |
Oerlemans MI, Liu J, Arslan F, et al. Inhibition of RIP1-dependent necrosis prevents adverse cardiac remodeling after myocardial ischemia-reperfusion in vivo[J]. Basic Res Cardiol, 2012, 107: 270. DOI:10.1007/s00395-012-0270-8 |
| [18] |
Zhang Y, Dai S, Xu B, et al. Pharmacological research progress of total saponins of Panax Notoginseng on myocardial ischemia-reperfusion injury[J]. Jiangsu J Tradit Chin Med (江苏中医药), 2017, 49: 82-85. |
| [19] |
Shen B, Wu X. Research progress of programmed necrosis[J]. Chongqing Med J (重庆医学), 2018, 47: 406-409. |
| [20] |
Bauer TM, Murphy E. Role of mitochondrial calcium and the permeability transition pore in regulating cell death[J]. Circ Res, 2020, 126: 280-293. DOI:10.1161/CIRCRESAHA.119.316306 |
| [21] |
Li X, Ming Y, Niu Y, et al. Programmed necrosis: a new target for ischemia reperfusion iniury[J]. J Cent South Univ (Med Sci) (中南大学学报(医学版)), 2016, 41: 765-770. |
| [22] |
Feng Y, Liu J, Huang G. Research progress of structure and function of mitochondrial permeability transition pore[J]. J Shanghai Jiaotong Univ Med Sci (上海交通大学学报(医学版)), 2012, 32: 356-360. |
| [23] |
Chen W, Guo Y, Yang W, et al. Protective effect of ginsenoside Rb1 on integrity of blood-brain barrier following cerebral ischemia[J]. Exp Brain Res, 2015, 233: 2823-2831. DOI:10.1007/s00221-015-4352-3 |
| [24] |
Zhu H, Tan Y, Du W, et al. Phosphoglycerate mutase 5 exacerbates cardiac ischemia-reperfusion injury through disrupting mitochondrial quality control[J]. Redox Biol, 2021, 38: 101777. DOI:10.1016/j.redox.2020.101777 |
| [25] |
Han F, Tao RR, Zhang GS, et al. Melatonin ameliorates ischemic-like injury-evoked nitrosative stress: involvement of HtrA2/PED pathways in endothelial cells[J]. J Pineal Res, 2011, 50: 281-291. DOI:10.1111/j.1600-079X.2010.00838.x |
 2022, Vol. 57
2022, Vol. 57


