非酒精性脂肪肝病(nonalcoholic fatty liver disease, NAFLD) 指在没有或极少量饮酒情况下, 由于过多的脂肪在肝脏部位累积, 进而引起全身性代谢性障碍的疾病, 进而加速形成非酒精性脂肪肝炎(NASH) 及肝细胞癌(HCC)[1]。据统计, 全球受到NAFLD影响的人数超过17亿[2], NAFLD的流行揭示了严重的公共健康问题。由于NAFLD的发病机制未被完全阐明, 导致市场尚无用于专一对症的有效药, 在研药物也从代谢紊乱、炎症等角度缓解病情[3]。西药成分单一, 往往只能针对部分指标[4], 因此, 加大备选药物分子, 寻找可用于改善NAFLD患者状况的中药活性成分并加以合理研究利用是一种必要的应对策略。
水飞蓟[Silybum marianum (L.) Gaertn.] 为一年生草本植物, 其味苦、性凉, 叶片似椭圆, 原产于南欧及北非地区, 1972年从德国引进国内并广泛种植。水飞蓟素(silymarin) 是从水飞蓟的果实和种子中提取得到的黄酮木脂素类的活性成分[5]。目前, 水飞蓟素已作为市售部分饮片、胶囊的主要成分, 具有良好的肝胆疾病治疗效果[6, 7], 包括肝炎、肝硬化、肝中毒等, 以及抗非小细胞肺癌等癌症的效果[8, 9]。作为水飞蓟素中的主要成分, 水飞蓟宾可通过调节过氧化物酶体增殖物激活受体α (peroxisome proliferators-activated receptor α, PPARα)、miR-122等的表达改善肝脂肪变性[10, 11], 在保肝护肝、抗肿瘤、治疗糖尿病、清除自由基等方面也作用显著[12-14]。虽然水飞蓟宾在治疗NASH的机制方面已有较全的科学研究[15], 但水飞蓟化学成分中与水飞蓟宾结构类似的黄酮类物质研究却鲜有报道。因此, 本文采用网络药理学的研究思路与方法, 结合分子对接与实验结果验证, 观察水飞蓟宾的结构特征, 从水飞蓟提取物中发掘其结构类似物, 比较和整理各类似物的作用靶点, 构建水飞蓟黄酮提取物的“成分-靶点-通路”网络图, 预测其潜在的治疗作用, 为深入了解并补充水飞蓟的活性黄酮提取物以及挖掘临床治疗NAFLD的中药活性成分提供参考。
材料与方法水飞蓟黄酮类活性成分的筛选及确定 水飞蓟提取物中包含众多黄酮类活性成分。进入中药系统药理学分析平台(TCMSP, https://tcmsp-e.com/), 检索中药材名称, 得到水飞蓟提取物中的主要化学成分。通过对水飞蓟素产生药效作用的核心成分的文献调研及人体口服生物利用度(oral bioavailability, OB) ≥ 30%和类药性(drug like, DL) ≥ 0.18的综合考量, 初步确定水飞蓟的潜在黄酮类活性成分[16]。后根据PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/) 确定成分的化学结构及唯一的CAS编号[17], 下载对应3D的SDF格式文件备用, 在ChemDraw18.1软件中绘制2D结构并保存。
水飞蓟黄酮提取物的预测靶点的获取及PPI网络的构建 访问SwissTargetPrediction数据库(http://www.swisstargetprediction.ch/), 导入化合物结构文件, 限制种属“homo sapiens”, 点击预测并导出结果[18], 筛选得到水飞蓟各黄酮类活性成分的预测作用靶点, 排除无可能性靶点后将预测靶点于UniProtKB网站比对验证。整理各组分的预测靶点后, 导入Cytoscape3.7.2软件, 以度值(degree) 调节图形, 得到水飞蓟黄酮提取物活性成分-预测靶点图, 保存备用。进入GeneCards平台, 以“nonalcoholic fatty liver disease”为关键词, 限制种属, 得到与NAFLD患者发病相关的预测疾病靶点库[19], 下载预测结果, 根据相关性得分(relevance score) > 3进行筛选[20]。利用Venny 2.1.0等在线工具对预测靶点和疾病靶点两者映射比对取交集, 筛选得到的靶蛋白即水飞蓟黄酮类活性成分中对NAFLD的潜在治疗靶点。
运用String平台(https://string-db.org/), 多蛋白条目下上传交集靶点, 限制种属, 建立蛋白质-蛋白质相互作用网络(PPI), 相互作用得分筛选最低值设为“medium confidence” (0.4)[21], 去除游离蛋白后下载合适格式文件保存。以Cytoscape3.7.2软件运行文件, 分析数据的度值、节点紧密度(closeness) 等拓扑学参数并作图, 即水飞蓟黄酮提取物的潜在治疗靶点的PPI网络图[22]。
治疗靶点的GO分析、KEGG通路富集分析及“成分-靶点-通路”网络图构建 上传潜在治疗靶点于生物学信息注释数据库DAVID 6.8数据库, 限制种属, 分析目录选择GO功能分析(包括生物过程BP、分子功能MF、细胞组分CC) 及KEGG信号通路富集分析。下载结果并认定P < 0.05筛选, 各条目结果保存。GO富集分析结果整理表格, 导入GraphPad, 分别将GO分析三部分及KEGG通路分析取靠前条目做柱状图和气泡图, 规定图形坐标及数量。
收集KEGG富集得到的通路, 整理以上得到的潜在治疗靶点信息, 后导入Cytoscape软件, 定义Network及Type文件, 以不同颜色区别类型, 以度值大小调节图形形状, 整理得到水飞蓟黄酮提取物的“成分-靶点-通路”网络图。
小分子与潜在靶点的分子对接验证 分子对接可进一步验证单一小分子药物与具体的靶标结合活性。自Protein Data Bank官网(https://www1.rcsb.org/) 下载受体蛋白分子的pdb格式文件, 使用OpenBabel软件转换小分子的SDF格式为MOL2格式, 将蛋白及小分子进行前处理, 初步预测结合的可能性, 后参考PDB网站和文献中已有其他小分子与蛋白结合的情况共同确定蛋白的对接口袋, 使用分子对接软件AutoDock对受体和配体模拟进行半柔性对接, 并保存为pbdqt格式, 结果以结合能(binding energy) 衡量结合活性, 结合能越小反映结合情况更好[23]。结合能小于0表示两者可自发结合, 小于-17.78 kJ·mol-1表明有一定结合活性, 小于-20.92 kJ·mol-1显示较好结合情况[24], 部分受体配体结合位点信息以PyMOL进行搜寻并可视化。
细胞培养与试剂 人正常肝细胞系L02细胞保种于本实验室。异水飞蓟宾A和异水飞蓟宾B购于MedChemExpress公司; 小分子水飞蓟宁(CAS#29782-68-1)、水飞蓟亭(CAS#33889-69-9) (HPLC ≥ 98%) 购于成都瑞芬思生物科技有限公司; 牛血清白蛋白(BSA) 购于杭州吉诺生物技术公司; 油酸钠(OA, CAS#1310-06-5) 和油红O粉末购于上海阿拉丁生物公司; 棕榈酸钠(PA) 和DMSO溶剂购于美国SIGMA生物公司; 异丙醇购于国药集团化学试剂有限公司; 高糖DMEM培养基购于Gibco公司; 胎牛血清(FBS) 购于杭州天航生物医药技术有限公司。
细胞培养箱(德国Heraeus公司); 立式高压蒸汽灭菌锅(中国合肥华泰医疗公司); DMi8倒置显微镜(德国徕卡公司)。
L02细胞培养于含10%胎牛血清的DMEM培养基中, 于5% CO2、37 ℃的无菌细胞培养箱达到75%~85%细胞密度条件下常规传代、冻存等, 接板实验前使细胞处于对数生长期。
细胞脂质堆积模型构建与给药处理 待对数期L02细胞于培养瓶中达到85%密度时, 以胰蛋白酶消化细胞, 并以合适密度将细胞接种于6孔板中。细胞贴壁后分为3组, 分别是DMSO对照组、0.5 mmol·L-1 OA (溶于甲醇) 与0.25 mmol·L-1 PA (溶于纯水) 处理(24 h) 作为模型组、建模后加入不同浓度药品处理24 h的给药组。
油红O储备液与工作液 称取0.5 g油红O粉末溶解于100 mL异丙醇, 以双层滤纸过滤, 4 ℃避光保存, 即油红O储备液; 油红O储备液与蒸馏水以3∶2比例稀释, 混匀后双层滤纸过滤, 静置, 现配现用, 即油红O工作液。
细胞脂质堆积的检测 经建模和给药处理后, 用油红O染色检测细胞内中性脂质的堆积。L02细胞以4%多聚甲醛固定30 min, PBS漂洗两次, 60%异丙醇漂洗1 min后用油红O溶液室温避光孵育30 min, 再以PBS、60%异丙醇和PBS分别清洗3次、30 s和3次, 整个过程动作轻柔迅速, 避免细胞干燥, 最后将细胞放置DMi8显微镜下, 观察拍照。
结果 1 水飞蓟黄酮类活性成分的获取及筛选通过文献报道, 从水飞蓟植物果实中提取得到的水飞蓟素是其主要的活性成分, 常用于保肝护肝、清热解毒方面。水飞蓟素是一类天然的黄酮木脂素类化合物, 主要包括水飞蓟宾(silybin)、异水飞蓟宾(isosilybin)、水飞蓟宁(silydianin)、水飞蓟亭(silychristin), 其中水飞蓟宾活性最好、含量最高, 其可稳定细胞膜调节肝再生[25], 在临床用药也显示出较好的肝保护性[26]。然而, 水飞蓟的提取产物也包含以上4种主要成分之外的结构类似物, 如与水飞蓟亭互为同分异构体的异水飞蓟亭, 水飞蓟宾和异水飞蓟宾也分别包含A、B两种构型。
本研究于TCMSP数据库中检索, 共检索水飞蓟植物中33个化学成分, 结合多文献设置筛选条件, 纳入不同的A、B构型, 共得到9个含异构体的水飞蓟黄酮类提取物。将这9个化学成分于PubChem数据库检索比对, 平面2D结构见图 1。

|
Figure 1 Structural analogues in flavone extracts of Silybum marianum (S. marianum) |
将每个化合物3D格式文件上传至SwissTargetPrediction网站, 并收集得到水飞蓟黄酮提取物的潜在作用靶点共110个。GeneCards数据库经筛选得到共1 055个NAFLD相关靶点, 与预测靶点在Venny 2.1.0平台取交集得到水飞蓟黄酮提取物的治疗NAFLD靶点共24个。
潜在治疗靶点共24个, 详细名称见表 1。将筛选得到的潜在靶点构建蛋白-蛋白相互作用(PPI) 网络, 去除2个游离节点, 得到22个节点的互作网络, 63条边, 平均度值5.25, 平均介数0.674。将PPI网络图导入Cytoscape软件, 以节点大小及节点颜色深浅反映度值高低、连线粗细及颜色深浅反映相互作用(combined score) 强弱[27], 输出得到图 2。图中雌激素受体1 (estrogen receptor 1, ESR1)、雷帕霉素激酶靶蛋白(mechanistic target of rapamycin kinase, MTOR)、血管内皮生长因子A (vascular endothelial growth factor A, VEGFA)、磷脂酰肌醇-4, 5-二磷酸3-激酶催化亚基α (phosphatidylinositol-4, 5-bisphosphate 3-kinase catalytic subunit alpha, PIK3CA) 等蛋白的连接蛋白较多, 且作用能力较强, 表明这几个蛋白可能在水飞蓟黄酮提取物治疗NAFLD中发挥主要作用。
| Table 1 Therapeutic targets of flavone extracts of S. marianum |

|
Figure 2 The protein-protein interaction network of therapeutic targets of flavone extracts of S. marianum. Circle size and its color depth show the degree of them. Connection thickness and its color depth reflect the combined score of them |
如图 3所示, 将22个核心治疗靶点进行GO富集分析(P < 0.05): BP部分富集得到59个条目, 包括细胞对缺氧反应、基因表达调控、RNA聚合酶Ⅱ启动子正调控、凋亡、炎症等过程; CC部分富集得到10个条目, 包含胞质、线粒体外膜、核染色质等部位; MF部分富集得到15个条目, 涉及酶的结合、特异性蛋白的结合、锌离子结合等过程。GO的富集分析提示, 水飞蓟黄酮提取物在治疗NAFLD过程中, 细胞的众多部位及生命活动过程都参与其中, 比如酶在胞质与转录底物的结合。
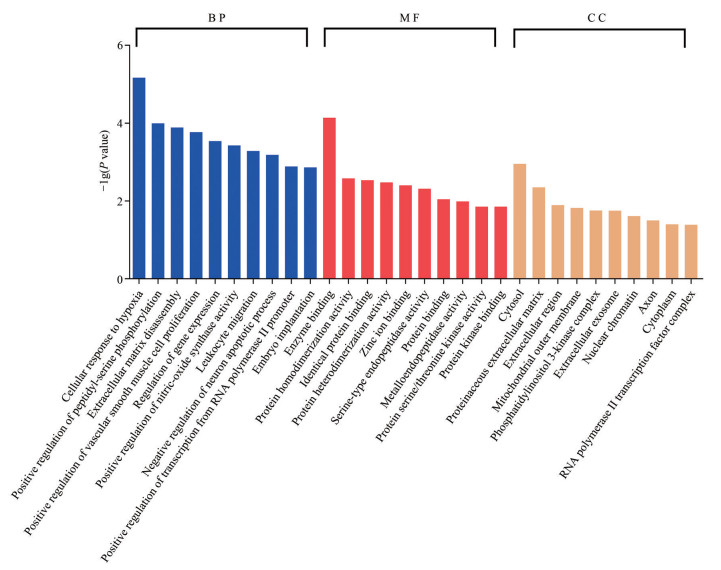
|
Figure 3 The results of GO enrichment analysis |
KEGG通路富集分析显示, 核心治疗靶点主要富集在30个通路中(图 4) (P < 0.05): 通路主要涉及癌症、磷脂酰肌醇3-激酶-蛋白激酶B通路(PI3K-Akt signaling pathway)、2型糖尿病(type 2 diabetes mellitus)、脂肪细胞因子信号通路(adipocytokine signaling pathway)、肿瘤坏死因子信号通路(TNF signaling pathway) 及胰岛素抵抗通路(insulin resistance pathway) 等。可见水飞蓟黄酮提取物与许多中药成分类似, 可以从多个角度缓解疾病进程, 如改善胰岛素抵抗进而加强葡萄糖氧化分解、减少凋亡等的产生来减缓非酒精性脂肪肝炎症的发展。
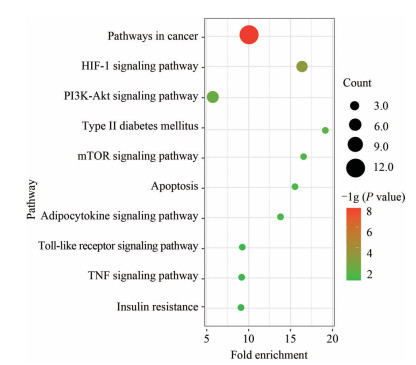
|
Figure 4 The diagram of KEGG pathway enrichment analysis |
收集以上KEGG富集分析结果, 与水飞蓟黄酮提取物潜在治疗靶点对应, 导入Cytoscape软件, 整理得到水飞蓟黄酮提取物的“成分-靶点-通路”网络图如图 5所示。图 5中蓝色节点为水飞蓟, 红色节点为其黄酮提取物, 绿色为其潜在靶点, 黄色为富集通路。网络图表明, 水飞蓟宾A和B、异水飞蓟宾A和B是成分中度值靠前的组分, PIK3CA、B细胞淋巴瘤-2 (B-cell lymphoma 2, BCL2)、核因子kappa B激酶亚基β抑制子(inhibitor of nuclear factor kappa B kinase subunit beta, IKBKB) 能富集到较多的通路。
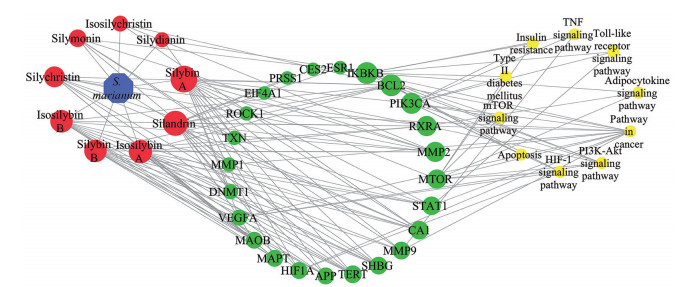
|
Figure 5 The "components-targets-pathways" network of flavone extracts of S. marianum. Components and targets with higher degree show bigger in size |
将水飞蓟黄酮提取物成分中预测靶点量排名靠前的成分(水飞蓟宾A和B、异水飞蓟宾A和B、水飞木质林) 与KEGG通路富集程度较高的靶点PIK3CA和IKBKB进行分子对接。如对接结合能热图 6初步预测显示, 5种成分对两个靶蛋白的结合能均小于0, 表明有自发进行的趋势。水飞木质林对靶蛋白PIK3CA (PDB-ID 7JIU)、IKBKB (PDB-ID 4KIK) 均有较好的结合活性, 结合能均小于-20.92 kJ·mol-1。水飞蓟宾A和水飞蓟宾B对这两种靶蛋白有相近的结合活性, 异水飞蓟宾A比异水飞蓟宾B显示出更好的两靶蛋白的结合活性。
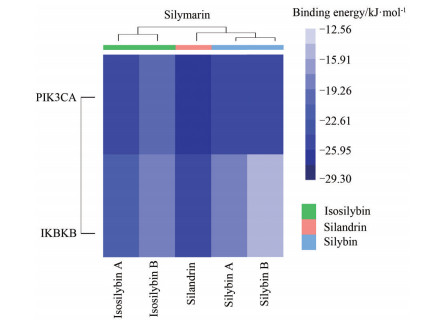
|
Figure 6 Thermogram of preliminary prediction docking binding energy of flavone extracts of S. marianum. PIK3CA: Phosphatidylinositol-4, 5-bisphosphate 3-kinase catalytic subunit alpha (upper); IKBKB: Inhibitor of nuclear factor kappa B kinase subunit beta (lower) |
经考察, 异水飞蓟宾A和B的主要差异是两个取代基2-(4-羟基-3-甲氧基苯基) 和3-(羟甲基), 在空间上构型分别为(2R, 3R) 和(2S, 3S)。鉴于良好的对接活性, 参考已有的小分子配体对接情况设置活性口袋, 挑选异水飞蓟宾A、B两种构型分别与两受体蛋白(PIK3CA、IKBKB) 进行分子对接部位可视化。结果如图 7所示, 两分子对两蛋白均有多位点的氨基酸残基的结合活性, 包括丙氨酸、赖氨酸和苏氨酸等; 结合的作用力包括氢键、碳氢键和苯环π共轭效应等, 这些作用力促进了彼此的结合活性; 同时, 从PyMOL可视化看出, 在相同空间距离下, 异水飞蓟宾A相比B构型能够结合更多的氨基酸残基, 这表明R构型的取代基导致异水飞蓟宾A在空间上与靶蛋白的结合上更占优, 进一步验证分子对接热图中A强于B的结合活性。
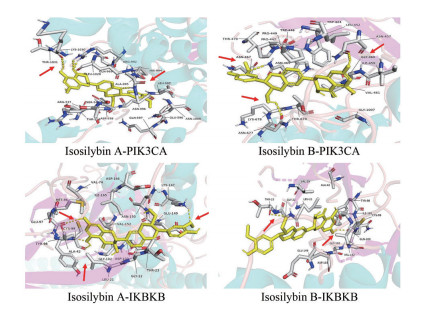
|
Figure 7 Molecular docking of isosilybin A (left) and B (right) with target proteins PIK3CA (upper) and IKBKB (lower). The red arrow points to the site of the bound amino acid residue |
根据以上结果进行油红O染色验证。结果如图 8显示, 对照组处于正常培养, 可见细胞内含有少量的红色脂滴; 与对照组相比, 经过细胞诱导液OA + PA处理24 h的模型组在细胞内出现大量红色脂滴; 而其后分别经过25 μmol·L-1异水飞蓟宾A、异水飞蓟宾B、水飞蓟宁和水飞蓟亭的处理后, 脂堆积情况有所改善, 脂滴的减小代表药物可能加强了脂质的氧化分解过程。且这4种化合物中, 相比于水飞蓟宁和水飞蓟亭, 异水飞蓟宾对脂堆积的改善作用更为显著, 其中异水飞蓟宾B构型的作用明显优于A构型。以上结果说明, 水飞蓟宾的结构类似物也能够改善OA + PA造成的脂质堆积情况, 且单一组分之间也存在明显差异。该实验进一步验证了分子对接的结果, 同时筛选出水飞蓟黄酮提取物中在治疗NAFLD过程发挥更大作用的单一组分。
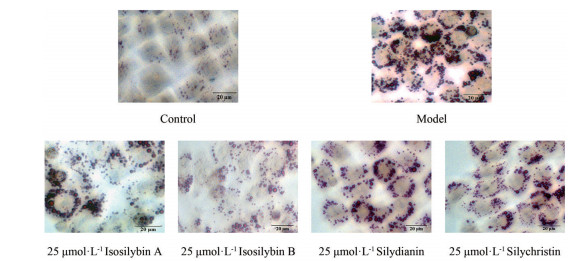
|
Figure 8 Analogues in flavone extracts of S. marianum inhibit oleic acid (OA) + palmitic acid (PA) induced lipid accumulation in L02 cells (light microscope 400 ×, scale bar: 20 μm) |
作为水飞蓟种子和果实的提取物, 水飞蓟素一直以来被用作食物补充剂和肝胆疾病的治疗佐剂, 在畜牧业也可提高动物抗应激能力[28, 29], 其中单体又以水飞蓟宾活性含量最佳、研究最为广泛[30-32]。事实上水飞蓟黄酮提取物中包含一系列的水飞蓟宾结构类似物, 尽管彼此互为同分异构体或结构类似物, 各单一组分在治疗作用上也各有偏重。NAFLD以过量的脂质堆积在肝脏为其根本特征, 长时间的病理状态会加速形成NASH、HCC, 是危害公共的重大卫生健康问题, 同时对该疾病的分子生物学研究表明NAFLD患者在多通路的相关蛋白表达上差异显著, 包括脂氧化与转运、胰岛素抵抗、凋亡和内质网应激等[33-36]。
本文运用网络药理学的思路与方法, 辅以分子对接技术和生物学实验进行验证, 探讨水飞蓟黄酮提取物治疗NAFLD的作用机制。通过数据库比对筛选出水飞蓟黄酮提取物的24个NALFD治疗靶点。根据治疗靶点的蛋白质-蛋白质相互作用网络分析, 发现ESR1、VEGFA、PIK3CA、MTOR和IKBKB等编码蛋白间存在较好的互作。在KEGG及GO富集分析中, 靶蛋白PIK3CA和IKBKB在多通路富集, 表明NF-κB及PIK3-AKT信号通路受到小分子药物的积极调控。分子对接进一步表明, 水飞蓟活性黄酮成分与NAFLD靶点具有较好的结合。在对5种单一组分的结合能的评估中, 水飞木质林表现出较好活性, 水飞蓟宾和异水飞蓟宾的两种构型都能自发较好地结合到靶蛋白的多个氨基酸残基上, 这表明水飞蓟黄酮提取物可通过多种成分在多靶点中以多种方式发挥生物学治疗作用。体外实验表明, 人正常肝细胞系L02用OA + PA处理24 h后, 脂质堆积显著增加, 给予水飞蓟黄酮提取物中4种不同的结构类似物干预后, 可观察到脂质堆积现象的改善, 进一步验证了水飞蓟黄酮提取物中各单一组分的治疗作用。
值得注意的是, 其一, 在KEGG分析中, 癌症相关信号通路也得到较大程度富集, 其中包括VEGFA、MTOR、BCL2等的靶蛋白的富集, 这表明水飞蓟黄酮提取物的各成分除了对NAFLD具有改善作用, 可能还通过介导癌通路相关基因表达进而改善癌症进程, 这与文献报道的水飞蓟宾抗卵巢癌、结肠癌、皮肤癌等癌症的报道是一致的[37-39]; 其二, 水飞蓟宾的结构类似物和衍生物也有较好活性, Viktorová等[40]证明细胞内水飞蓟亭的抗氧化、抗炎活性, 并指出其脱氢衍生物抗氧化活性升至母体两倍; Maihesuti等[41]表明从水飞蓟宾等修饰得来的水飞木质林在抵抗癌细胞增殖上有更显著的效果, 这些现象说明对水飞蓟中天然成分的更深一步的研究, 并结合化学方法对结构优化与改造是提升其药效乃至于开发新药的重要手段; 其三, 网络药理学是基于数据库进行的挖掘, 该方法对建立成分-靶点的关联具有可行性, 所预测的结果也与文献报道基本吻合, 但其同时也存在一定缺陷, 如数据的开放性程度以及数据质量参差不齐[42]、数字模拟的分子对接不能等同体内体外具体的生物学结合过程等。同时, 疾病的发生总是涉及多条通路的。分子对接结果显示, 异水飞蓟宾A对PIK3CA及IKBKB两靶蛋白的结合活性强于B构型, 但体外细胞实验结果却显示B构型具有更好的改善脂质堆积活性, 说明B构型可能是异水飞蓟宾混合物中发挥降脂作用更大的构型, A构型则可能在两靶蛋白涉及的其他通路或疾病中有更好效果, 因此可以从这个角度来鉴别异水飞蓟宾发挥降脂活性的主要成分, 异水飞蓟宾两种异构体展现出不同降脂活性的具体原因还需进一步探索。
综上所述, 本研究应用网络药理学分析水飞蓟植物的活性黄酮提取物的保肝护肝作用。水飞蓟黄酮提取物可通过多靶点组成的多通路改善NAFLD表型; 分子对接进一步验证了水飞蓟黄酮提取物单一成分与核心靶蛋白的较好结合; 生物学实验表明, 水飞蓟黄酮提取物中的4种单一组分具有一定的体外降低脂质堆积的积极作用。该研究为中药活性成分治疗NAFLD提供参考。
作者贡献: 本研究思路由陈勇教授和梁继超副教授设计; 叶晨负责网络药理学的研究部分和文章的撰写; 江雯负责虚拟分子对接部分; 胡熳负责油红O染色体外筛选小分子药物降脂活性研究; 张艳和刘钰偲负责相关文献的调研与收集。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Friedman SL, Neuschwander-Tetri BA, Rinella M, et al. Mechanisms of NAFLD development and therapeutic strategies[J]. Nat Med, 2018, 24: 908-922. DOI:10.1038/s41591-018-0104-9 |
| [2] |
Younossi Z, Tacke F, Arrese M, et al. Global perspectives on nonalcoholic fatty liver disease and nonalcoholic steatohepatitis[J]. Hepatology, 2019, 69: 2672-2682. DOI:10.1002/hep.30251 |
| [3] |
Zhou ZT, Deng LM, Hu LJ, et al. Recent advances in research on targets and drugs for treatment of non-alcoholic fatty liver disease[J]. Chin New Drugs J (中国新药杂志), 2020, 29: 1363-1374. |
| [4] |
Qian K, Liu YY, Zang Y, et al. Research progress on molecular mechanism of traditional Chinese medicine against non-alcoholic fatty liver disease[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 5083-5092. |
| [5] |
van Wenum E, Jurczakowski R, Litwinienko G. Media effects on the mechanism of antioxidant action of silybin and 2, 3-dehydrosilybin: role of the enol group[J]. J Org Chem, 2013, 78: 9102-9112. DOI:10.1021/jo401296k |
| [6] |
Zhang ZP, Meng YQ, Wang Z. Research progress on biological activities and mechanism of silybin and their derivatives[J]. Chin Tradit Herb Drugs (中草药), 2021, 52: 3717-3724. |
| [7] |
Chen RJ, Wu YJ, Hu KL. Research progress on pharmacological effects of silibinin[J]. Shanghai J Tradit Chin Med (上海中医药杂志), 2021, 55: 90-96. |
| [8] |
Rugamba A, Kang DY, Sp N, et al. Silibinin regulates tumor progression and tumorsphere formation by suppressing PD-L1 expression in non-small cell lung cancer (NSCLC) cells[J]. Cells, 2021, 10: 1632. DOI:10.3390/cells10071632 |
| [9] |
Huang ZH, Zhang JY. Research progress of anti-tumor mechanism of silymarin[J]. J Zunyi Med Univ (遵义医科大学学报), 2021, 44: 260-264. |
| [10] |
Cui S, Pan XJ, Ge CL, et al. Silybin alleviates hepatic lipid accumulation in methionine-choline deficient diet-induced nonalcoholic fatty liver disease in mice via peroxisome proliferator-activated receptor α[J]. Chin J Nat Med, 2021, 19: 401-411. |
| [11] |
Yang LY, Liu QQ, Zhang H, et al. Silibinin improves nonalcoholic fatty liver by regulating the expression of miR-122:an in vitro and in vivo study[J]. Mol Med Rep, 2021, 23: 335. DOI:10.3892/mmr.2021.11974 |
| [12] |
Rong JM, Yu M, Ge YK, et al. Protective effects and mechanism of silibinin on SH-SY5Y cell injury induced by hydrogen peroxide[J]. J Nanjing Med Univ (Nat Sci) (南京医科大学学报自然科学版), 2020, 40: 515-520. |
| [13] |
Kim SH, Choo GS, Yoo ES, et al. Silymarin inhibits proliferation of human breast cancer cells via regulation of the MAPK signaling pathway and induction of apoptosis[J]. Oncol Lett, 2021, 21: 492. DOI:10.3892/ol.2021.12753 |
| [14] |
Qin S, Wu LL, Qin LL, et al. Study on effects and mechanisms of silybin on insulin resistance of C2C12 cells[J]. World Sci Technol Mod Tradit Chin Med (世界科学技术-中医药现代化), 2020, 22: 3450-3455. |
| [15] |
Liu YY, Xu W, Zhai T, et al. Silibinin ameliorates hepatic lipid accumulation and oxidative stress in mice with non-alcoholic steatohepatitis by regulating CFLAR-JNK pathway[J]. Acta Pharm Sin B, 2019, 9: 745-757. DOI:10.1016/j.apsb.2019.02.006 |
| [16] |
Veber DF, Johnson SR, Cheng HY, et al. Molecular properties that influence the oral bioavailability of drug candidates[J]. J Med Chem, 2002, 45: 2615-2623. DOI:10.1021/jm020017n |
| [17] |
Kim S, Chen J, Cheng T, et al. PubChem 2019 update: improved access to chemical data[J]. Nucleic Acids Res, 2019, 47: D1102-D1109. DOI:10.1093/nar/gky1033 |
| [18] |
Daina A, Michielin O, Zoete V. SwissTargetPrediction: updated data and new features for efficient prediction of protein targets of small molecules[J]. Nucleic Acids Res, 2019, 47: W357-W364. DOI:10.1093/nar/gkz382 |
| [19] |
Zhang Y, He X, Chuan JL, et al. Identifying drug PK/PD-related genes and their polymorphism sites using public bioinformatical databases[J]. Pract Pharm Clin Rem (实用药物与临床), 2018, 21: 1073-1077. |
| [20] |
Zhang LH, Geng QS, Zhu ZJ, et al. Biomolecular mechanism of resveratrol against lung cancer based on network pharmacology[J]. Chin J Inf Tradit Chin Med (中国中医药信息杂志), 2021, 28: 46-51. |
| [21] |
Song JB, Liao H, Li YP. Mechanism exploration of Astragali Radix in treatment of diabetic nephropathy based on network pharmacology[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 2988-2996. |
| [22] |
Szklarczyk D, Gable AL, Lyon D, et al. STRING v11:protein-protein association networks with increased coverage, supporting functional discovery in genome-wide experimental datasets[J]. Nucleic Acids Res, 2019, 47: D607-D613. DOI:10.1093/nar/gky1131 |
| [23] |
Gao H, Xu W, Zhang YH, et al. Anti-fatigue mechanism of Acanthopanax senticosus glycosides based on network pharmacology[J]. Chin Tradit Herb Drugs (中草药), 2021, 52: 413-421. |
| [24] |
Zhu XQ, Liu ZQ, Wang BL. Mechanism of quercetin against cervical cancer based on biomolecular network and molecular docking[J]. Nat Prod Res Dev (天然产物研究与开发), 2020, 32: 23-31. |
| [25] |
Csupor D, Csorba A, Hohmann J. Recent advances in the analysis of flavonolignans of Silybum marianum[J]. J Pharm Biomed Anal, 2016, 130: 301-317. DOI:10.1016/j.jpba.2016.05.034 |
| [26] |
Zhao H, Lv FF, Sang RX, et al. Clinical efficacy of silybin capsule in the treatment of drug-induced liver injury[J]. Gansu Med J (甘肃医药), 2021, 40: 490-493. |
| [27] |
Shan LF, Kang GJ, Zhang C, et al. Mechanism of Siwu Decoction on breast cancer based on network pharmacology and molecular docking[J]. Chin Tradit Herb Drugs (中草药), 2021, 52: 3943-3953. |
| [28] |
Shi YB, Pang WP, Kong B, et al. Preventive effect of silymarin on fatty liver hemorrhage syndrome in chickens[J]. Mod J Anim Husb Vet Med (现代畜牧兽医), 2021, 50: 19-22. |
| [29] |
Li HF, Li EC, Xu C, et al. Effects of silymarin on growth, activities of immune-related enzymes, hepatopancreas histology and intestinal microbiota of the Pacific white shrimp (Litopenaeus vannamei) at low salinity[J]. J Fish China (水产学报), 2021, 45: 98-114. |
| [30] |
Liu JX, Qi Wen, Peng XF, et al. Simultaneous analysis of seven active components in silymarin from fruits, peels, nutlets and commercial extracts of Silybum marianum by HPLC[J]. J Shenyang Pharm Univ (沈阳药科大学学报), 2016, 33: 56-62. |
| [31] |
Guo XC, Zhang ZP, Deng YG, et al. Research on the protection of four kinds monomer of silymarin on acute liver injury in rats induced by Amanita fuliginea[J]. Pharm Today (今日药学), 2017, 27: 9-12. |
| [32] |
Chen XZ, Zhang Y. Flavonoid and lignins from Silybum marianum L. Gaertn[J]. Acta Chin Med Pharmacol (中医药学报), 2017, 45: 64-66. |
| [33] |
Farzanegi P, Dana A, Ebrahimpoor Z, et al. Mechanisms of beneficial effects of exercise training on non-alcoholic fatty liver disease (NAFLD): roles of oxidative stress and inflammation[J]. Eur J Sport Sci, 2019, 19: 994-1003. DOI:10.1080/17461391.2019.1571114 |
| [34] |
Berkan-Kawińska A, Piekarska A. Hepatocellular carcinoma in non-alcohol fatty liver disease-changing trends and specific challenges[J]. Curr Med Res Opin, 2020, 36: 235-243. DOI:10.1080/03007995.2019.1683817 |
| [35] |
Sai WB, Wu ZY. Progress in research on treatment of non-alcoholic fatty liver disease with glucagon-like peptide-1 receptor agonist[J]. Chin J Biol (中国生物制品学杂质), 2021, 34: 878-882. |
| [36] |
Li ZY, Zhou ZJ, Yan B, et al. Role of endoplasmic reticulum stress in nonalcoholic fatty liver disease[J]. Chin J Obes Metab Dis (中华肥胖与代谢电子杂志), 2020, 6: 122-126. |
| [37] |
Zhen RJ, Cao HL, Ma JH, et al. Inhibition effect of silibinin on colitis-associated cancer in mice[J]. Chin J Cancer Prev Treat (中华肿瘤防治杂质), 2018, 25: 1217-1221, 1226. |
| [38] |
Liu L, Hu CJ, Li ZJ, et al. Silibinin inhibited the survival of ovarian cancer HO-8910 cells and its mechanism[J]. Prog Mod Biomed (现代生物医学进展), 2017, 17: 3811-3815. |
| [39] |
Wang HJ, Jang YY, Lu P, et al. An updated review at molecular pharmacological level for the mechanism of anti-tumor, antioxidant and immunoregulatory action of silibinin[J]. Acta Pharm Sin (药学学报), 2010, 45: 413-421. |
| [40] |
Viktorová J, Dobiasová S, Řehořová K, et al. Antioxidant, anti-inflammatory, and multidrug resistance modulation activity of silychristin derivatives[J]. Antioxidants, 2019, 8: 303. DOI:10.3390/antiox8080303 |
| [41] |
Maihesuti L, Gao HW, Wang Q, et al. Structural modification of sylibin to derivatives of sylibin/hydnocarpin D/silandrin, and evaluation of their cytotoxicity against cancer cells[J]. Curr Top Med Chem, 2021. DOI:10.2174/1568026621666210701142826 |
| [42] |
Wang FX, Gao Y, Liu HB. Research process and representative database tools of traditional Chinese medicine network pharmacology[J]. Mod Chin Med (中国现代中药), 2021, 23: 1111-1118. |
 2022, Vol. 57
2022, Vol. 57


