2. 上海中药标准化研究中心, 上海 201203
2. Shanghai R&D Center for Standardization of Traditional Chinese Medicines, Shanghai 201203, China
吡咯里西啶生物碱(pyrrolizidine alkaloids, PAs) 是一种天然的毒性成分, 目前已发现600多种PAs及氮氧化物存在于6 000多种高等有花植物中[1, 2], 以菊科、豆科、紫草科和兰科等最为广泛。PAs是毒性最强的植物性肝毒物质之一, 世界各地均有因误服误用含PAs的中草药、药茶或被PAs污染的食物导致肝窦阻塞综合征(hepatic sinusoidal obstruction syndrome, HSOS) 的报道[3-5]。2017年, 中华医学会消化病学分会肝胆疾病协作组发布了针对PA致临床肝损伤的诊断和治疗指南(“南京标准”)[6], 有利于该疾病的临床治疗; 然而, 目前临床尚无有效的治疗药物。
PAs是一大类结构相似的化合物, 由双稠吡咯环(次碱) 和植物中的有机酸(次酸) 酯化形成。其中次碱结构上C1和C2位的不饱和双键为PAs致毒的关键结构。肝脏中包含丰富的药物代谢酶, 是PAs代谢的主要场所。大部分PAs本身无毒性, 其致毒与代谢过程密切相关。PAs在体内经过细胞色素酶P450 (cytochrome P450, CYP) 3A4代谢活化生成中间体脱氢吡咯, 其不稳定、亲电性强, 与体内大分子物质如蛋白等结合生成吡咯-蛋白加合物(pyrrole-protein adducts, PPAs), 从而导致蛋白结构、功能的异常, 进一步诱导肝损伤[7, 8]。早期大量体外实验证实, CYP3A4是人体内PAs致肝毒性的关键酶[9], 如利用人重组单酶体系进行了研究[10], 只有重组的CYP3A4表现出对PAs代谢活化产物生成的严重抑制, 而其他重组单酶的抑制活性极为微弱。然而, 这一点在体内试验尚未得到证实。
菊科植物菊三七(Gynura japonica) 为我国传统中草药, 又称“土三七”, 常用于活血化瘀、跌打损伤[11], 其根茎与药用三七(五加科植物三七Panax notoginseng) 相似, 极易与三七混淆。然而菊三七中含有大量的PAs[12, 13], 超量服用可导致严重的肝毒性, 是我国临床HSOS的主要原因[14]。因此, 本研究以菊三七单次灌胃大鼠构建PAs肝损伤模型, 利用CYP3A4化学抑制剂利托那韦从整体动物水平探讨CYP3A4酶对于PAs肝毒性的关键作用, 为含PAs药物的临床应用安全提供理论依据。
材料与方法药品与试剂 分析纯三氟化硼乙醚、无水乙醇、硝酸银、丙酮均购自国药控股化学试剂有限公司; 分析纯4-二甲氨基苯甲醛购自Sigma公司。称取4-二甲氨基苯甲醛20 mg, 加入无水乙醇1 mL和三氟化硼乙醚20 μL溶解, 得到Ehrlich试剂。称取硝酸银20 mg, 加入无水乙醇1 mL, 得2%硝酸银溶液。
利托那韦(ritonavir, RIT) 购自大连美仑生物技术有限公司。称取利托那韦粉末适量, 溶解于适量吐温80∶无水乙醇= 1∶1的混合溶剂中, 以超纯水稀释至3 mg·mL-1。
菊三七提取物(Gynura japonica extracts, GJE) 为课题组前期制备[12, 15], 菊三七(采自江苏省扬州市) 粗粉以95%乙醇回流提取3次制备, 所含PAs主要为千里光碱(senecionine)、千里光菲林碱(seneciphylline)、千里光碱氮氧化物(senecionine N-oxide) 和千里光菲林碱氮氧化物(seneciphylline N-oxide) (图 1), 每克总提物含PAs 50 mg。称取菊三七提取物适量, 溶解于5%盐酸水溶液中, 加入1 mol·L-1 NaOH调至pH 6~7, 以生理盐水稀释至0.8 g·mL-1。
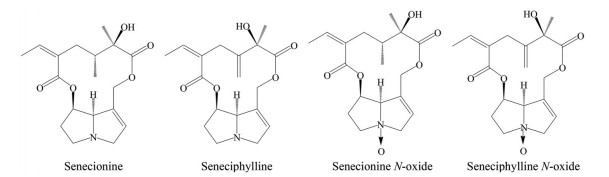
|
Figure 1 Chemical structures of main pyrrolizidine alkaloids (PAs) in Gynura japonica extracts (GJE) |
动物实验 雄性Sprague Dawley (SD) 大鼠, 体重200 ± 20 g, SPF级, 购自上海斯莱克实验动物有限公司[合格证号: SCXK (沪) 2017-0005]。饲养条件: 温度20 ± 2 ℃, 相对湿度55% ± 5%, 室内空气每小时交换12~18次, 12 h昼/夜循环, 自由摄取食物和水。实验方案经上海中医药大学动物实验伦理委员会批准(PZSHUTCM190912019), 所有程序均严格按照动物使用和护理的伦理原则进行。
实验动物适应性喂养3天, 随机分为4组, 每组6只, 分别为溶剂对照组(VEH组)、模型组(GJE组)、利托那韦干预组(RIT + GJE组)、利托那韦对照组(RIT组)。给药前及取材前各禁食8 h, 自由饮水。GJE组单次灌胃菊三七提取物8 g·kg-1; RIT + GJE组单次灌胃利托那韦30 mg·kg-1 1 h后, 单次灌胃菊三七提取物8 g·kg-1; VEH和RIT组分别灌胃空白溶剂和利托那韦30 mg·kg-1。各组大鼠分别于菊三七提取物给药后10 min、1、2、4、6、12、24 h异氟烷麻醉, 眼眶静脉丛取血; 24 h后异氟烷麻醉, 腹主动脉取血, 收集肝脏。全血于室温下静置2 h, 4 ℃、4 000 ×g离心15 min, 分离血清; 取大鼠肝脏最大叶中心1 cm × 1 cm置4%多聚甲醛中, 其余肝脏以液氮速冻后保存于-80 ℃。
肝损伤评价 肝组织以4%多聚甲醛固定24 h后, 依次进行脱水、包埋、切片、苏木素-伊红(hematoxylin-eosin, HE) 染色、乙醇脱水、二甲苯透明、树胶封固, 于光学显微镜下观察组织病理变化并采集图片。
血清肝功能指标, 包括谷丙转氨酶(alanine aminotransferase, ALT) 活力、谷草转氨酶(aspartate aminotransferase, AST) 活力、总胆汁酸(total bile acids, TBA) 含量, 均以日立7080全自动生化分析仪(Hitachi Co., Tokyo, Japan) 测定。
血清PPAs含量测定 取不同时间点大鼠血清适量, 加入5倍体积4 ℃预冷的丙酮提取蛋白, 蛋白以Ehrlich试剂和2%硝酸银溶液进行衍生化[12, 15], 所得上清液利用LC-MS/MS进行检测。采用多反应监测模式进行PPAs含量测定[12, 15], 离子通道为: 341 > 252 (定量离子对), 341 > 296 (定性离子对)。
胆汁酸含量测定 取大鼠血清和肝组织适量, 加入3倍体积4 ℃预冷的甲醇沉淀蛋白, 离心后取上清氮气吹干, 残渣以含100 ng·mL-1 4-氘代胆酸(d4-cholic acid) 内标的5%乙腈水溶液复溶, 参考课题组前期报道方法[13, 16]以LC-MS测定大鼠血清中13种主要胆汁酸的含量, 包括胆酸(cholic acid, CA)、鹅脱氧胆酸(chenodeoxycholic acid, CDCA)、熊脱氧胆酸(ursodeoxycholic acid, UDCA)、石胆酸(lithocholic acid, LCA)、牛磺胆酸(taurocholic acid, TCA)、牛磺石胆酸(taurolithocholic acid, TLCA)、牛磺鹅脱氧胆酸(taurochenodeoxycholic acid, TCDCA)、牛磺熊脱氧胆酸(tauroursodeoxycholic acid, TUDCA)、牛磺脱氧胆酸(taurodeoxycholic acid, TDCA)、牛磺猪脱氧胆酸(taurohyodeoxycholic acid, THDCA)、甘氨熊脱氧胆酸(glycoursodeoxycholic acid, GUDCA)、甘氨脱氧胆酸(glycodeoxycholic acid, GDCA)、甘氨鹅脱氧胆酸(glycochenodeoxycholic acid, GCDCA)。
统计学分析 实验数据采用均数±标准差(
大鼠单次灌胃菊三七提取物(8 g·kg-1) 24 h后, GJE模型组出现状态萎靡、体温凉等不良状态; RIT + GJE组大鼠状态正常。如图 2A所示, GJE模型组肝窦扩张显著增大, 并且伴随着严重的肝窦出血、肝细胞点状坏死、脂肪空泡化, 与前期研究报道[12]相符; RIT + GJE组仅可见少量不均匀的淤血, 无明显的细胞坏死; RIT对照组与VEH溶剂对照组无明显差异。由图 2B可知, GJE组血清肝功能检测指标血清ALT (P < 0.01)、AST (P < 0.05)、TBA (P < 0.001) 均显著升高; 而RIT + GJE组ALT (P < 0.001)、AST (P < 0.01)、TBA (P < 0.001) 均较模型组显著降低。以上结果提示, CYP3A4抑制剂利托那韦对菊三七致大鼠肝损伤有明显的保护作用。此外, RIT组TBA值(6.57 μmol·L-1) 较VEH组(23.03 μmol·L-1) 有下降趋势。
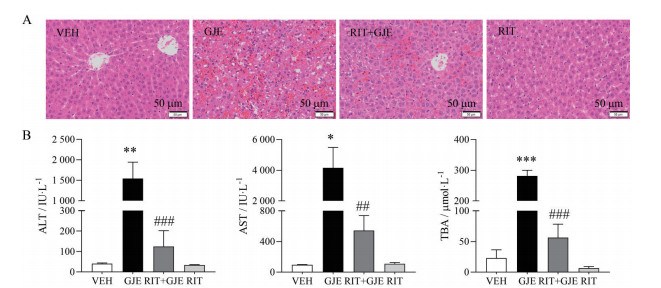
|
Figure 2 The protection effect of ritonavir (RIT) against GJE-induced liver injury in rats. Rats were treated with RIT (30 mg·kg-1) 1 h before the treatment of GJE (8 mg·kg-1), and sacrificed 24 h after GJE administration. A: Hematoxylin-eosin (HE) staining of liver tissue; B: Serum levels of alanine aminotransferase (ALT), aspartate aminotransferase (AST), and total bile acids (TBA). n = 6, |
检测GJE组和RIT + GJE组大鼠血清中PPAs的含量。如表 1所示, 单次灌胃GJE后0.17 h (10 min)~6 h内血清PPAs含量逐渐升高, 在6~24 h PPAs含量相对稳定; RIT + GJE组PPAs血清含量在0.17~12 h内逐渐升高, 在12~24 h PPAs含量有所下降(24 h时RIT + GJE组PPAs含量较12 h下降13.3%)。相比GJE组, RIT + GJE组大鼠在给药菊三七提取物10 min后生成的PPAs含量就显著降低(P < 0.01); 此后1~24 h内各时间点RIT + GJE组大鼠PPAs含量较GJE组均显著降低。以上结果提示, CYP3A4抑制剂利托那韦可显著降低大鼠给药菊三七后生成PPAs的含量, 并在一定程度上加速了血清PPAs的清除。
|
Table 1 The pyrrole-protein adducts (PPAs) contents in serum of rats. n = 6, |
对大鼠中13种主要胆汁酸进行了含量测定。给药菊三七总提物后, 血清胆汁酸含量发生显著变化(图 3), 含量最高的CA、TCA分别升高8.8、76.1倍, 含量相对较低的TUDCA、THDCA、TDCA、TLCA、GUDCA、GDCA、LCA含量也显著升高, 由此导致初级胆汁酸(CA、CDCA、UDCA、TCA、TCDCA、TUDCA、GCDCA、GUDCA) 总含量、次级胆汁酸(LCA、TLCA、TDCA、THDCA、GDCA) 总含量显著升高(表 2), 游离型胆汁酸(CA、CDCA、UDCA、LCA) 总含量和结合型胆汁酸(TCA、TCDCA、TUDCA、TDCA、THDCA、TLCA、GCDCA、GUDCA、GDCA) 总含量也显著升高。此外, 各胆汁酸的相对百分含量也发生了明显变化(图 3C), 游离型胆汁酸CA、CDCA、UDCA、LCA的相对百分含量均有下降, 而结合型胆汁酸TCA、TUDCA、THDCA、TLCA、GUDCA的相对百分含量均升高3~24倍。相比GJE组, RIT + GJE组血清中大部分胆汁酸的含量均显著下降, 各类型胆汁酸总含量均显著下降(P < 0.05), 相对百分含量也有所下降。相比VEH组, GJE组血清初级胆汁酸总含量与次级胆汁酸总含量的比值明显下降(4.9 vs 25.2), 游离型胆汁酸总含量与结合型胆汁酸总含量的比值也降低(0.6 vs 3.8); 但RIT + GJE组中二者均无向VEH组回调趋势。进一步测定肝脏中胆汁酸的含量(图 4), 总的来说, 肝脏中胆汁酸的变化趋势与血清中相似; 与VEH组比较, 模型组肝脏中主要的胆汁酸CA、TCA分别升高6.0、10.5倍, TUDCA、THDCA、TDCA也升高3.1~3.5倍, 且以上5种胆汁酸在RIT + GJE组中均有不同程度的下降(为GJE组的40%~60%); 肝脏中各类型胆汁酸总含量在GJE组均有所升高(总胆汁酸含量较VEH组升高4.8倍), 而在RIT + GJE组中下降(RIT + GJE组总胆汁酸下降为GJE组的34%)。值得注意的是, 与空白组比较, RIT组血清中CA、CDCA、TCDCA、GCDCA均显著下降, 造成初级胆汁酸总含量及游离型胆汁酸含量的显著降低(表 2); 而由于CA和CDCA在RIT组肝脏中显著下降, 导致RIT组肝脏总游离型胆汁酸含量较VEH组显著降低(21.0 ng·g-1 vs 112.1 ng·g-1, P < 0.05), 尽管RIT组部分含量较高的初级胆汁酸(CA、CDCA、GUDCA和GCDCA) 较VEH组有显著下降, 但初级胆汁酸总含量无明显变化。以上结果提示, CYP3A4抑制剂利托那韦可显著改善菊三七致大鼠胆汁酸代谢紊乱, 与降低损伤大鼠胆汁酸特别是CA等初级胆汁酸的含量有关。
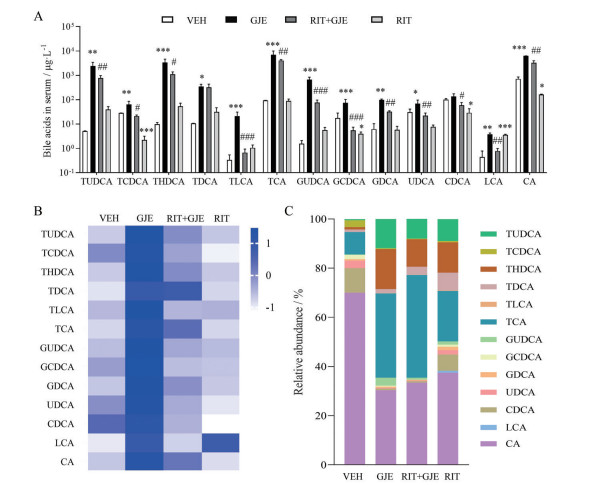
|
Figure 3 The changes of bile acids (BAs) profiling in serum samples of rats. A: The contents of individual bile acids; B: The heatmap of individual bile acids contents; C: Relative abundance of individual bile acids. n = 6, |
|
Table 2 The contents of different types of BA in serum of rats. n = 6, |
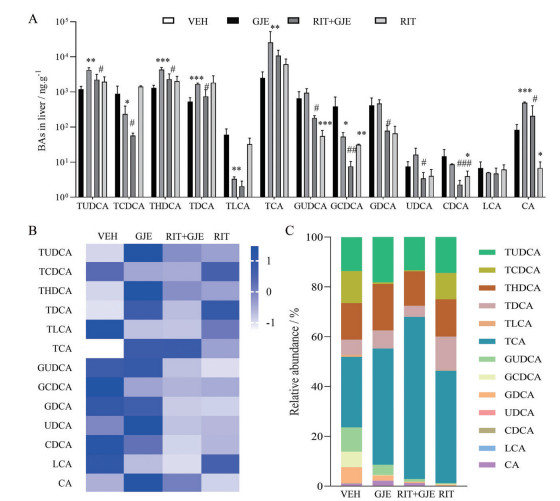
|
Figure 4 The changes of BAs profiling in liver samples of rats. A: The contents of individual bile acids; B: The heatmap of individual bile acids contents; C: Relative abundance of individual bile acids. n = 6, |
PAs安全性问题已引起世界范围的关注。肝脏含有丰富的代谢酶, 是药物代谢的主要场所, 也是PAs毒性的主要靶器官[2]。大量研究表明, CYP3A4是人体内PAs致毒的关键酶[5, 7, 8], 而其同工酶CYP3A1和CYP3A2是致大鼠肝毒性的关键酶。
酮康唑是美国食品药品监管局和欧洲药品管理局共同认定的强效CYP3A4抑制剂, 被广泛应用于临床研究和科学研究中[17, 18]。人肝微粒体实验表明, CYP3A4抑制剂酮康唑可显著抑制PAs的代谢活化。酮康唑还可抑制野百合碱代谢活化从而降低野百合碱诱导的小鼠肝肾损伤[19]。然而酮康唑存在潜在的肝毒性[20], 利托那韦对CYP3A4的抑制效果与酮康唑类似, 是其最优的替代品[21]。故本研究利用利托那韦从整体动物水平探讨CYP3A4对菊三七肝毒性的影响。肝脏病理及血清生化指标分析表明, 单独给药利托那韦对正常大鼠的肝脏功能和结构未造成明显影响, 但对菊三七提取物致大鼠肝损伤有显著的保护作用, 可修复菊三七致大鼠肝窦出血、肝细胞坏死和脂肪空泡化, 并降低血清转氨酶活性。
PPAs为PAs经CYP3A4代谢活化生成, 已作为临床诊断PAs诱导HSOS的指标[6]。利托那韦干预组大鼠不同时间点血清PPAs的含量明显低于模型组, 由此推断, 利托那韦可抑制PAs代谢活化, 从而导致PPAs的含量降低。课题组[12]前期研究表明, 大鼠给药菊三七后生成PPAs的动力学呈现一定的剂量依赖性, AUC0-t、MRT、Vd、t1/2e均随剂量而明显增大, PPAs在体内的消除率随着给药剂量的增加明显减慢, 与肝损伤严重程度有一定的关联。在本研究中, 大鼠给药菊三七提取物(8 g·kg-1, 折合PAs 400 mg·kg-1), 直至24 h实验结束未观察到PPAs快速清除阶段; 但与菊三七肝损伤组比较, 利托那韦干预组血清PPAs含量在10 min~24 h内均显著降低, 且在24 h时PPAs含量较12 h已有所降低, 提示利托那韦降低了PPAs的生成并加速其清除。在后续实验中, 可以不同剂量菊三七给药, 进一步明确CYP3A4抑制剂利托那韦对PAs代谢活化和PPAs代谢动力学的影响, 为含PAs药物临床用药安全的合理评估提供参考。
课题组[13, 16, 22]前期研究已经发现, PAs致肝毒性与胆汁酸代谢紊乱密切相关; Hessel-Pras等[23]的最新研究也表明, PAs致胆汁酸代谢紊乱具有CYP依赖性。本研究发现, 利托那韦干预组大鼠血清TBA含量明显低于菊三七模型组, 不同类型胆汁酸总含量(包括初级胆汁酸、次级胆汁酸、游离型胆汁酸以及结合型胆汁酸) 也显著降低, 提示抑制CYP3A4酶可影响胆汁酸代谢。胆汁酸是由胆固醇在肝脏合成的一系列胆甾烷类的内源性化合物, 不仅调控胆固醇代谢、排泌、溶解和食物脂类的消化、吸收, 也是重要的信号分子, 是临床肝脏疾病诊断、治疗、预后的重要生物标志物。在胆汁淤积等肝损伤病理状态下, 毒性胆汁酸(特别是疏水性胆汁酸如CA、CDCA、LCA) 将对肝脏造成“二次打击”, 加剧肝损伤。本研究表明CYP3A4抑制剂利托那韦可缓解菊三七致大鼠胆汁酸代谢紊乱, 与其对菊三七肝损伤的保护作用有一定的关联性, 但无法阐明二者的因果关系及深层的作用机制, 后续还需要进一步探讨。
综上所述, 本研究表明利托那韦可明显改善菊三七致大鼠肝损伤的情况, 与抑制PAs代谢活化及调控胆汁酸代谢密切相关。本研究利用CYP3A4化学抑制剂利托那韦从大鼠水平证明了CYP3A4对菊三七致肝毒性的影响, 加强了CYP3A4酶与PAs毒性的相关性的理解, 对于PAs临床疾病干预策略的开发以及菊三七等含PAs药物临床用药安全的合理评估均具有重要意义。
作者贡献: 陈岩、熊爱珍设计实验、撰写及修改论文; 陈岩、叶铉玲、王汛江负责实验样本及数据的采集与分析; 杨莉、王峥涛、王长虹提供学术指导; 熊爱珍、王峥涛提供基金的支持。
利益冲突: 无利益冲突。
| [1] |
Chen L, Mulder PPJ, Peijnenburg A, et al. Risk assessment of intake of pyrrolizidine alkaloids from herbal teas and medicines following realistic exposure scenarios[J]. Food Chem Toxicol, 2019, 130: 142-153. DOI:10.1016/j.fct.2019.05.024 |
| [2] |
Neuman MG, Cohen L, Opris M, et al. Hepatotoxicity of pyrrolizidine alkaloids[J]. J Pharm Pharm Sci, 2015, 18: 825-843. DOI:10.18433/J3BG7J |
| [3] |
Jank B, Rath J. The risk of pyrrolizidine alkaloids in human food and animal feed[J]. Trends Plant Sci, 2017, 22: 191-193. DOI:10.1016/j.tplants.2017.01.002 |
| [4] |
Zhang Y, Ma SQ, Yang FF, et al. Status of content analysis of pyrrolizidine alkaloids in food and herbs[J]. China J Chin Mater Med (中国中药杂志), 2020, 45: 5421-5428. |
| [5] |
Moreira R, Pereira DM, Valentão P, et al. Pyrrolizidine alkaloids: chemistry, pharmacology, toxicology and food safety[J]. Int J Mol Sci, 2018, 19: 1688. DOI:10.3390/ijms19061688 |
| [6] |
Cooperative Group for Hepatic and Gall Diseases, Chinese Society of Gastroenterology, Chinese Medical Association. Expert consensus on diagnosis and treatment of pyrrolidine alkaloids related sinusoidal obstruction syndrome (2017, Nanjing)[J]. J Clin Hepatol (临床肝胆病杂志), 2017, 33: 1627-1637. |
| [7] |
Xu J, Wang WQ, Yang X, et al. Pyrrolizidine alkaloids: an update on their metabolism and hepatotoxicity mechanism[J]. Liver Res, 2019, 3: 176-184. DOI:10.1016/j.livres.2019.11.004 |
| [8] |
Fu PP, Xia Q, Lin G, et al. Pyrrolizidine alkaloids--genotoxicity, metabolism enzymes, metabolic activation, and mechanisms[J]. Drug Metab Rev, 2014, 36: 1-55. |
| [9] |
Ruan J, Liao C, Ye Y, et al. Lack of metabolic activation and predominant formation of an excreted metabolite of nontoxic platynecine-type pyrrolizidine alkaloids[J]. Chem Res Toxicol, 2014, 27: 7-16. DOI:10.1021/tx4004159 |
| [10] |
Ruan JQ, Yang MB, Fu P, et al. Metabolic activation of pyrrolizidine alkaloids: insights into the structural and enzymatic basis[J]. Chem Res Toxicol, 2014, 27: 1030-1039. DOI:10.1021/tx500071q |
| [11] |
Zhu BR, Pu SB, Xu DR, et al. Advances in studies on chemical constituents and bioactivities of the genus Gynura Cass[J]. Chin Wild Plant Resour (中国野生植物资源), 2012, 31: 1-4. |
| [12] |
Chen Y, Wang XJ, Xiong F, et al. Kinetic study of pyrrolizidine alkaloid-derived pyrrole-protein adducts in rats after intragastric administration of Gynura japonica[J]. Acta Pharm Sci (药学学报), 2020, 55: 473-477. |
| [13] |
Xiong AZ, Shao YL, Fang LX, et al. Comparative analysis of toxic components in different medicinal parts of Gynura japonica and its toxicity assessment on mice[J]. Phytomed, 2019, 54: 77-88. DOI:10.1016/j.phymed.2018.06.015 |
| [14] |
Hu Y, Mu YX. Research and prospect of sinusoidal obstruction syndrome caused by Gynura segetum[J]. J Syst Med (系统医学), 2019, 4: 196-198. |
| [15] |
Chen Y, Xiong F, Wang WQ, et al. The long persistence of pyrrolizidine alkaloid-derived pyrrole-protein adducts in vivo: kinetic study following multiple exposures of a pyrrolizidine alkaloid containing extract of Gynura japonica[J]. Toxicol Lett, 2020, 323: 41-47. DOI:10.1016/j.toxlet.2020.01.021 |
| [16] |
Xiong AZ, Yang F, Fang LX, et al. Metabolomic and genomic evidence for compromised bile acid homeostasis by senecionine, a hepatotoxic pyrrolizidine alkaloid[J]. Chem Res Toxicol, 2014, 27: 775-786. DOI:10.1021/tx400451q |
| [17] |
Xu Y, Zhang YF, Chen XY, et al. CYP3A4 inducer and inhibitor strongly affect the pharmacokinetics of triptolide and its derivative in rats[J]. Acta Pharmacol Sin, 2018, 39: 1386-1392. DOI:10.1038/aps.2017.170 |
| [18] |
Shayeganpour A, EI-Kadi AOS, Brocks DR. Determination of the enzyme(s) involved in the metabolism of amiodarone in liver and intestine of rat: the contribution of cytochrome P4503A isoforms[J]. Drug Metab Dispos, 2006, 34: 43-50. DOI:10.1124/dmd.105.006742 |
| [19] |
Yao J, Li CG, Gong LK, et al. Hepatic cytochrome P450s play a major role in monocrotaline-induced renal toxicity in mice[J]. Acta Pharmacol Sin, 2014, 35: 292-300. DOI:10.1038/aps.2013.145 |
| [20] |
Shehu AI, Lu J, Wang P, et al. Pregnane X receptor activation potentiates ritonavir hepatotoxicity[J]. J Clin Invest, 2019, 129: 2898-2903. DOI:10.1172/JCI128274 |
| [21] |
Greenblatt DJ, Harmatz JS. Ritonavir is the best alternative to ketoconazole as an index inhibitor of cytochrome P450-3A in drug-drug interaction studies[J]. Br J Clin Pharmacol, 2015, 80: 342-350. DOI:10.1111/bcp.12668 |
| [22] |
Jiang KY, Ye XL, Xiong F, et al. The protective effects and mechanism of Alismatis Rhizoma extracts against senecionine-induced acute liver injury in mice[J]. Acta Pharm Sci (药学学报), 2021, 56: 823-830. |
| [23] |
Hessel-Pras S, Braeuning A, Guenther G, et al. The pyrrolizidine alkaloid senecionine induces CYP-dependent destruction of sinusoidal endothelial cells and cholestasis in mice[J]. Arch Toxicol, 2020, 94: 219-229. DOI:10.1007/s00204-019-02582-8 |
 2022, Vol. 57
2022, Vol. 57


