2. 军事科学院军事医学研究院毒物药物研究所, 北京 100850;
3. 中国人民解放军 73101部队, 江苏 徐州 221000
2. Institute of Pharmacology and Toxicology, Academy of Military Medical Sciences, Academy of Military Sciences, Beijing 100850, China;
3. 73101 Unit of the Chinese People's Liberation Army, Xuzhou 221000, China
黄体酮(progesterone) 是一种由肾上腺皮质、性腺、中枢神经系统和外周神经系统分泌的类固醇激素[1] (结构见图 1), 是女性生殖系统调节的重要组成部分, 为胚胎的植入和妊娠所必需[2, 3]。黄体酮通过与同工同码的两个特定受体(PR-A、PR-B) 结合, 受其介导而发挥作用[4]。由于黄体酮的低溶解性、低渗透率特点, 在生物药剂学分类系统中(biopharmaceutical classification system, BCS) 被归类为BCS IV类药物[5]。

|
Figure 1 Chemical structure of progesterone |
黄体酮在临床上是黄体支持的首选药物, 其适应症主要有先兆流产、预防早产、体外受精、经前期紧张综合征、功能失调性子宫出血与闭经等。然而, 随着临床研究的不断深入, 黄体酮的新适应症逐渐被发掘, 例如: ①调节三叉神经眼支的神经纤维, 发挥角膜局部镇痛作用[6]; ②剂量依赖性地抑制转化生长因子β1 (transforming growth factor β1, TGF-β1) 激活的母体DPP同源物(Smad) 信号通路, 调节参与支气管发育异常(bronchopulmonary dysplasia, BPD) 发病机制的TGF-β1相关基因, 如结缔组织生长因子、转蛋白和纤溶酶原激活物抑制剂-1, 降低早产儿BPD的发病率和严重程度[7]; ③竞争性拮抗醛固酮, 促进Na+和Cl-的排泄并利尿[8]; 肌肉注射后, 结石随输尿管平滑肌节律性下移, 适用于肾绞痛、输尿管结石和顽固性肝硬化腹水的治疗; ④由于免疫抑制作用, 舒张平滑肌, 缓解支气管痉挛; 调节气道微循环, 减小黏膜水肿, 用于经期哮喘的治疗; ⑤抑制雄性激素分泌, 选择性抑制5α还原酶及前列腺素对睾酮的吸收, 阻止睾酮转化为双氢睾酮, 用于治疗前列腺增生症; ⑥抑制腹绞痛引起的平滑肌兴奋性增强及痉挛, 发挥解痉镇痛作用, 用于内科急性腹绞痛的治疗[9]; ⑦有效减少过度炎症和兴奋性毒性, 同时维持发育中的大脑细胞增殖和凋亡在正常水平, 发挥神经保护剂的作用, 可用于创伤性脑损伤等治疗[10]; ⑧抑制垂体分泌促性腺素、催乳素, 拮抗雄性激素, 可用于体内性激素平衡失调的男性周期性精神病[11]。此外, 最新研究显示, 黄体酮还可在妊娠时保护胎儿中枢神经、降低癫痫发作频率[12]、改善慢性呼吸衰竭、糖尿病和睡眠呼吸暂停综合征等症状。
黄体酮现有上市剂型有片剂、胶囊、油针剂和阴道凝胶等, 主要通过口服、注射和阴道进行给药。随着市场需求量及临床新适应症的增加, 基于原有给药途径的创新制剂以及新兴给药途径不断被开发。本文将根据药物的给药途径对黄体酮药物的新剂型及其制备工艺进行综述。
1 已有上市制剂黄体酮市售传统制剂的给药途径主要有口服、注射及阴道(表 1)。口服给药服用方便、患者使用舒适, 具有较高的依从性[13], 但水不溶性和肝脏首过效应, 使得口服黄体酮的生物利用度不足10%。黄体酮在胃肠外给药疗效较高, 临床上一般采用肌注黄体酮的给药方式。注射给药有剂量精准、无肝脏首过效应、生物利用度高和吸收好等优点, 能够确保药物达到更好的疗效[14], 但易引起局部刺激及硬结、无菌囊肿、炎症或过敏等不良反应, 且频繁给药给患者带来不便, 降低患者顺应性[15]。国家药品监督管理局于2016年11月16日要求修改黄体酮注射液说明书, 特别提示该给药途径的风险性。阴道给药在使用较低的给药剂量的同时可避免肝脏首过效应[16]。经阴道给药的药物由于“子宫首过效应”, 即一种通过阴道/子宫静脉、动脉和淋巴脉络丛之间的逆流交换来完成药物的直接运输的现象, 可优先输送到上生殖道, 减少全身循环吸收引起的药物流失, 从而达到更好的治疗效果[17]。但该方式也存在阴道渗漏、刺激、瘙痒、分泌物、出血、性交困难或疼痛、乳房压痛和吸收剂量不准确等缺点[18], 且由于文化差异、个人或临床认知原因, 也一定程度上限制了阴道给药的广泛应用[1]。
| Table 1 Traditional progesterone formulation on the market |
随着市场需求的增大及新适应症的发现, 黄体酮新型制剂接连上市(表 2), 也有部分新型制剂进入临床试验阶段(表 3), 这些制剂的出现完善了黄体酮制剂的临床应用范围。
| Table 2 Improved and new progesterone formulation on the market |
| Table 3 New progesterone preparations undergoing preclinical and clinical studies |
经文献调研发现, 黄体酮创新制剂及新给药途径有脂质体口服制剂、微球注射剂、缓释栓剂和肺部给药等, 具体分类见图 2, 下文将基于给药途径对黄体酮新型制剂及给药新途径进行叙述, 并简要综述相关制备方法。
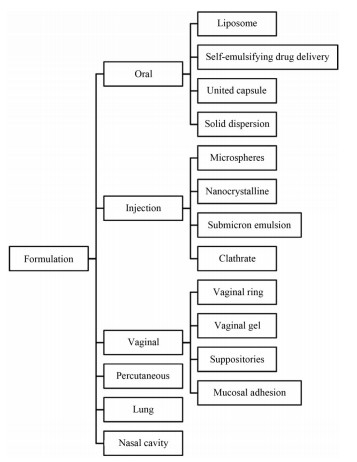
|
Figure 2 Classification of new dosage forms of progesterone |
脂质体(liposome) 是指将药物包封于类双脂质双分子层内而形成的微型囊泡体, 它有着靶向性、淋巴定向性、缓释和提高药物稳定性等特点。Wang等[19]利用脂质体的特点, 制备了一种黄体酮前体脂质体软胶囊。研究发现随着药脂比的减小、稀释倍数的增大, 黄体酮脂质体包封率降低, 当药脂比为1∶20、稀释倍数为1∶10时, 脂质体包封率可达(72.36 ± 11.69) %, 为脂质体的最佳处方, 且该制剂在初期突释后达到稳定状态。
脂质层类似于细胞膜, 通常由磷脂和胆固醇组成。黄体酮在结构上与胆固醇类似, 能够与磷脂相互作用[20]。与胆固醇相比, 黄体酮对脂质双层膜的相性质有轻微的膜破坏作用。因此, 黄体酮可以替代胆固醇制备无胆固醇脂质体。脂质体的淋巴定向性可以增加药物的转运, 但常规脂质体不能抵抗胃内的酸性环境及酶促降解[21]。壳聚糖(一种带正电荷的天然多糖) 可以通过静电相互作用覆盖在脂质体表面, 稳定并保护脂质体。壳聚糖修饰的脂质体可与带负电荷的细胞膜作用而与其紧密连接, 以增强药物的转运[22]。
基于此, Wang等[23]制备了壳聚糖修饰的无胆固醇脂质体, 结构如图 3, 将质量比为1∶10的黄体酮和大豆磷脂的混合物在60 ℃下溶解于丙二醇和PEG 400 (体积比为3∶1) 的溶液中。然后, 将该溶液添加至蒸馏水(20倍体积) 中以获得脂质体。在室温下, 将所得脂质体(5 mL) 缓慢滴入20 mL壳聚糖溶液(0.1 mg·mL-1) 中, 搅拌2 h形成壳聚糖修饰的无胆固醇脂质体。结果表明, 制得的脂质体呈球形, 平均包封率达80%, 具有良好的体外稳定性和缓释作用, 与市售黄体酮软胶囊(Qining) 相比, 制备的脂质体相对口服生物利用度提高了6.03倍。
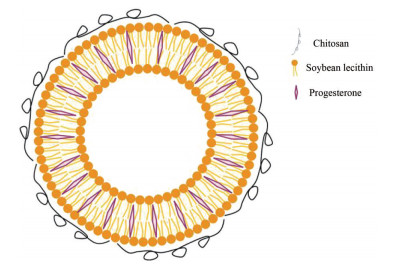
|
Figure 3 Chitosan coated progesterone liposome |
自乳化药物给药系统(self-emulsifying drug delivery system, SEDDS) 有改善药物的口服吸收、提高药物的稳定性、减少对胃部的刺激和制备简单等特点。Tuleu等[24]在自乳化系统中通过挤出/滚圆工艺制备了一种具有良好体外释药性能的黄体酮微丸制剂, 在与黄体酮悬浮液的犬体内生物利用度对比实验中发现, 自乳化制剂的AUC和Cmax是水悬浮液的7~9倍。
Hassan等[25]在自乳化药物系统中通过溶剂置换法, 制备了负载黄体酮的PEG-30-di-(polyhydroxystearate) (DPHS) 半固态新剂型, 避免了以往将SNEDDS填充在明胶胶囊中, 产生的不稳定及药物沉淀等问题。该制剂的平均粒径小于25 nm, 是一种在室温下为半固体, 而在人体温度下能够分散于水性介质, 并显示出高效迁移率的纳米分散体。其制备方法为先将熔融的DPHS溶于丙酮溶液中, 然后将溶液边搅拌边滴加到50 ℃的双蒸水中, 待乳液达到室温、丙酮蒸发后得到脂质, 将黄体酮加入其中, 于混合器中孵育24 h, 即得所要制剂。采用胰酶消化法进行了黄体酮溶解度的影响实验, 结果发现, 黄体酮以脂质形式保持增溶状态, 消化4 h后, 仍有80%~90%以上的黄体酮保持溶解形式, 该制剂能够显著提高黄体酮的溶解度及口服生物利用度。
2.1.3 复方胶囊近几年, 有若干雌激素和孕激素联合用于激素治疗(hormone therapy, HT) 的配方被世界各国批准用于治疗更年期症状。但到目前为止, 尚无将天然17β-雌二醇与黄体酮结合的复方产品被美国食品药品管理局(Food and Drug Administration, FDA) 和欧洲药品管理局(European Medicines Agency, EMA) 批准。Pickar等[26]叙述了SYMBOATM技术制备的一种联合使用可溶性17β-雌二醇和天然黄体酮的单一口服明胶胶囊(TX-001HR)。研究发现, TX-001HR中雌二醇和黄体酮的生物利用度与其各自的参比雌二醇片和微粉化黄体酮胶囊相似。如果获得批准, TX-001HR将成为首个获得FDA/EMA批准的用于HT的17β-雌二醇与黄体酮结合的复方胶囊。该制剂可以为经历中度至重度血管舒缩症状的更年期女性提供一种更加新颖、安全的治疗方案, 以替代现有的合成HT方案及未经监管批准的复合生物同型激素疗法[27]。
2.1.4 固体分散体固体分散体(solid dispersion) 的传统制备方法有熔融法、助溶剂法和物理混合法等[28]。Falconer等[29]运用一种新兴方法, 即超临界流体(supercritical fluid, SCF) 法, 通过自主搭建气相饱和悬浮/溶液颗粒装置, 利用超临界二氧化碳制备含有聚乙二醇400/4000 (50∶50)、明胶44/14和D-α-生育酚PEG 1000琥珀酸酯三种辅料的黄体酮分散体系。SCF法是一种将气体压缩成超临界流体(具有液体和气体性质), 并在该流体中分散固体以形成悬浮液。然后快速减压, 使气体蒸发并形成分散物[30]的制备方法。这是一种非常规的超临界工艺, 药物和辅料不需要在超临界流体中溶解, 且SCF法是通用的, 适用于高黏性或黏性材料[31]。将SCF法制备的制剂与传统方法制备的制剂相比, 其制备的新型黄体酮固体分散体晶体结构无明显变化, 溶解度显著提高, 证明该法制备的分散体在提高黄体酮溶出速率、缩短制备时间和形成稳定的结晶分散体系方面具有很大的潜力。
虽然黄体酮的口服生物利用度低, 但其服药方便、患者依从性强。因此, 黄体酮口服制剂依然有研究与开发的价值。脂质体、自乳化和固体分散体均可改善黄体酮的口服生物利用度, 复方胶囊通过与雌激素的联合应用, 可为女性更年期症状提供新的治疗方案。但这些制剂是否具有显著的临床优势, 还需大量的实验验证。
2.2 注射给药及其制备方法 2.2.1 微球微球(microspheres) 是活性成分以溶解或分散状态在如明胶、高分子多肽和蛋白等高分子材料基质中, 后经处理、固化而形成的实心微小球体, 其实质为骨架型固体物[32]。其可以以较低的剂量及频率进行给药, 从而提高药物疗效及患者依从性。
Gao等[33]运用乳化溶剂挥发法制备了黄体酮聚乳酸(PLA) 微球, 其表面光滑、球形度及分散性好, 载药量为(10.63 ± 0.05) %, 包封率为(80.60 ± 1.00) %, 具有明显的缓释效果。Kang等[34]以丙酸甲酯为分散剂, 采用乳化溶剂挥发法制备黄体酮聚乳酸-羟基乙酸共聚物(PLGA) 微球。将其与用传统分散剂乙酸乙酯制备的PLGA微球进行对比实验发现, 丙酸甲酯具有更好的挥发性和更小的水溶性, 制备的微球的包封率与乙酸乙酯的相当, 且丙酸甲酯有着与乙酸乙酯相似的安全性/毒理学特征。该特性的发现, 可以有效填补乙酸乙酯因水溶性大导致微球形状不规则的缺陷。因此, 丙酸甲酯可能成为制备聚合物微球和纳米粒的最有用溶剂。
Im等[35]运用了一种以氨解反应为基础的非卤化甲酸异丙酯微球化技术制备了黄体酮PLGA微球。与传统的溶剂蒸发/萃取法不同的是, 该方法在制备过程中运用氨解反应将乳液液滴中的不溶于水的溶剂转化为水溶性溶剂, 扩散到连续的水相中。此方法无需使用大量的淬灭剂, 降低了溶解有机物的废液的产生。该方法制备的微球包封率为(88.0 ± 3.6) %~(97.0 ± 3.6) %, 通过建立的气相色谱分析方法, 测定微球中甲酸异丙酯的残留量, 结果仅为(0.34 ± 0.07) %。
Turino等[36]运用原位成型技术制备了黄体酮PLGA微球。原位成型技术制备过程简单、成本低, 且在给药前无需将微球悬浮于水性或油性介质中。该研究首次成功地将聚乙烯醇(PVA) 应用于连续相, 以提高原位成型技术形成的O/W制剂的稳定性。并证明以三醋酸甘油酯和PVA水溶液为基础的乳状液是制备控释激素微球的有效溶剂体系。
Guo等[37]以黄体酮为模型药物, 运用湿磨结合热熔挤出法制备了高密度低孔隙率的黄体酮PLGA微球。与仅采用湿磨法制备的黄体酮微晶相比, 该法制备的微球虽然表面不够光滑, 但载药量可达40%, 且初始突释仅为6.7%, 远远低于微晶混悬液(25.7%), 并显示至少7天的缓释作用。其释放机制(图 4) 为微球内部成蜂窝状结构, 在给药后暴露于微球表面的黄体酮先被释放, 接着PLGA层被腐蚀, 然后下一网格中的黄体酮暴露于介质中继续释放。

|
Figure 4 Release mechanism of progesterone microspheres |
纳米晶体(nanocrystalline) 药物即采用少量的表面活性剂将纯的药物颗粒形成一种亚微米的胶体分散体系, 该体系无需载体材料, 不受包封率的限制, 药物剂量可调范围宽[38]。
Salem[39]采用溶剂沉淀法制备了一种具有部分两亲性稳定结构的黄体酮纳米混悬缓释热敏注射剂。将黄体酮与硬脂酸粉末快速混合在乙醇中制备纳米颗粒, 然后将颗粒分散在热敏凝胶(Pluronic® F-127加甲基纤维素) 基质中, 即得。对制剂进行体内外实验发现, 所制备的注射剂具有一定的缓释作用, 预测人体可每36 h注射1次; 且两亲性部分(硬脂酸) 可有效促进纳米晶在水性基质中的分散, 以减少市售油针剂注射时引起的局部刺激等不良反应。
Li等[40]采用“自上而下(top-down)”法中的湿磨法制备了含10% (w/v) 黄体酮的纳米晶注射液。与市售黄体酮油针剂相比, 其生物利用度提高了2.7倍, 且肌肉刺激性低、溶血率低, 是一种优于油针注射液的剂型。Huang[41]采用“自下而上(bottom-up)”法中的乳化法制备黄体酮微乳剂, 再结合冷冻干燥法除去溶剂以获得黄体酮纳米晶粉针剂。所制得的注射剂与市售黄体酮油针相比, 达峰时间更短, 生物利用度提高了1.85倍, 稳定性更强, 且由于该粉针剂的溶剂为水, 减少了肌肉的刺激性, 能有效提高患者的顺应性。
墨西哥CARNOT实验室[42]采用气雾化法研发了一种新型的黄体酮缓释微晶注射剂。在该注射剂中, 微晶外观圆整, 粒径为33~75 μm, 是一种新型混悬水基注射剂。其只需每7天给药1次, 适用于治疗黄体功能不全引发的先兆性流产。该制剂可精确控制药物释放, 延长药物作用时间, 避免多次注射可能产生的相关不良反应。
Wei等[43]采用反溶剂沉淀-控温法制备了一种新型的黄体酮缓释微晶注射剂。以乙醇为良溶剂, 水为不良溶剂, 在超声、加热和搅拌下得到一定粒径范围的黄体酮微晶混悬液。对制备工艺参数进行考察发现, 适当的超声可以防止粒子的聚集, 使制备的微晶粒径分布更为均匀; 加热温度的升高会促使微晶生长; 加热时间的延长会使粒径的分布更为均一。微晶的体外释放与其粒径分布存在良好的相关性。该制备方法简单、成本低, 添加辅料少, 具有其独特的优势。
2.2.3 亚微乳亚微乳(submicron emulsion) 通过提高药物稳定性, 具有增加药物溶解度、使药物具有靶向性、降低毒副作用和刺激性的特性。Zhao等[10]运用适合工业化生产的两步乳化法, 采用单因素筛选, 正交试验优化, 制备了用于治疗创伤性脑损伤的黄体酮静脉脂质乳剂。对制备的制剂进行表征, 在透射电镜成像下乳滴具有光滑的球形外观, 在常温下长期稳定, 包封率高达95.23%。动物实验结果表明, 与市售产品相比, 该制剂的脑内黄体酮浓度更高, 达峰时间更短, 证明其对创伤性脑损伤有着更加的治疗效果。
2.2.4 包合物包合物(clathrate) 是指一种药物分子(客体分子) 被全部或部分包入另一种物质的分子(主体分子) 腔中形成的独特形式的络合物[44]。常用的包合材料为环糊精, 其中β-环糊精有肾毒性小、溶血作用小和水溶性好等优点, 在注射剂中广泛应用[45]。Wang等[46]采用共沉淀法制备黄体酮β-环糊精包合物, 选择三因素三水平, 以正交设计摸索工艺最佳条件。结果表明, 当包合温度为40 ℃, 时间为4 h, 主客体配比为1∶2时, 为包合物的最佳制备工艺, 并证明包合物可明显提高黄体酮的溶解度和溶出度。Zoppetti等[47]通过优化方法, 制备了一种黄体酮-羟丙基-β-环糊精包合物(P-HPBCD), 其缔合机制如图 5所示。通过形成不溶性包合物, 将残留的未反应β-环糊精从羟丙基-β-环糊精(HPBCD) 中分离出来, 使所得的包合物仅含有0.1%的残余β-环糊精, 且在稳定性研究期间不会产生沉淀。将包合物分散于水性介质中, 制备成可注射用水溶性P-HPBCD粉针剂。将其与市售油针相比, 所制备制剂具有更好的生物利用度及良好的药物动力学特性。

|
Figure 5 Mechanism of association of the progesterone-hydroxypropyl-β-cyclodextrin (P-HPBCD) |
在注射给药方式中, 微球因其含有可降解的高分子材料及较为圆整的表面结构, 可使药物达到良好的缓释效果。包合物增加了难溶性药物的水溶性, 减少了注射油针剂中辅料所带来的刺激性。亚微乳的靶向性增加了其在临床治疗上的应用。上述载体制剂的关键因素在于包封率、载药量、有机溶剂残留量及药物的稳定性等。作为非载体类制剂的微晶、纳米晶, 在制备过程中无需添加过多的辅料。其体内外的缓释效果往往受颗粒粒径、表观形态等因素的影响。因此, 在研发及选择使用制剂时, 应根据临床适应症的不同选择合适的剂型。
2.3 阴道给药及其制备方法 2.3.1 阴道环阴道环(vaginal ring) 是一种具有固定形状、大小和药物剂量的妇科给药装置(图 6), 其可以发挥局部或全身性药理作用[48]。阴道环使用安全, 可控制药物的释放, 避免日常给药, 允许使用低剂量药物, 具有良好的患者依从性[49]。

|
Figure 6 Vaginal ring. a: Two-dimensional structure; b: Commercial vaginal ring (Nuvaring) |
Helbling等[50]运用热熔挤出工艺制备了含有黄体酮的乙烯-醋酸乙烯共聚物(EVA) 阴道环, 并通过数字模型探究不同的参数(如环尺寸、黄体酮初始载药量等) 对EVA环中黄体酮释放的影响, 并根据结果对阴道环进行优化, 使其可以以适当速率释放黄体酮。市售黄体酮阴道环Progering采用硅树脂法固化法制备。该方法中的高温过程可能会使药物发生改性或降解, 且制备成本高、材料的不可降解性也会对环境造成一定的影响。设计所得的EVA环无需额外的高温固化、交联步骤, 且EVA是一种热塑性材料, 使用后可以回收利用。在载药量小于Progering的情况下, EVA环释放量与之相同甚至略高, 且释放后药物的残留量更低。因此, 优化后的EVA环具有较好的体外性能, 且可减少制备的时间与成本, 具有巨大的经济优势。
Yao等[51]运用注塑成型法制备了黄体酮储库型阴道环, 并在其表面运用加热硫化法包裹了一层控释膜。通过对药物释放的考察发现, 控释膜的增加, 使得药物的释放速率降低, 明显改善了药物的首日突释的现象。此外, 药物的缓慢释放减缓了阴道环药芯中空白区的形成, 使药芯中的黄体酮在膜的内侧维持一定的浓度, 保证阴道环中黄体酮药物的平稳释放。
Fu等[52]运用3D打印技术, 以聚乳酸(PLA) 和聚己内酯(PCL) 为基质、PEG 4000为成孔剂、Tween 80为表面活性剂, 使用计算机辅助设计软件设计各种形状的负载有黄体酮的3D打印阴道环, 并以熔融沉积建模技术进行了3D打印。与传统制备方法不同, 3D技术打印可通过调节打印参数来制备出形态各异、剂量精准、药物空间定位准确的药物制剂[53]。因此, 该剂型的最大优点即个性化, 可为具有不同需求、习惯和身体素质的女性量身定制, 弥补市售阴道环形状、大小和剂量固定的不足。
2.3.2 缓释凝胶剂阴道凝胶大多为水性凝胶, 制备材料主要是以共价键形式交联的具有黏膜黏附力的聚合物。由于弱交联作用, 凝胶中的聚合物在与水接触时, 吸水膨胀, 扩展于黏膜表面并紧密黏连, 从而延长药物滞留时间, 控制药物释放, 在用药部位发生直接作用[53]。
Chi[54]采用球磨机先将黄体酮进行微粉化, 使其均匀分散于34型混合酸甘油酯凝胶基质中, 然后以机械剪切搅拌法制备黄体酮缓释凝胶。英国Fleet公司将黄体酮原料药进行微粉化后, 将其与交联丙烯酸聚合物制成水包油性凝胶剂, 即市售黄体酮阴道凝胶Crinone。将实验制备的凝胶与Crinone进行体外释放行为比较实验, 发现相似因子 > 50, 释放行为相似。
Almomen等[55]利用一种热敏性黏胶聚合物乙二醇甲壳素(GC) 制备了新型的黄体酮水凝胶。通过对该体系进行流变学、释放曲线及体内外安全性和有效性研究发现, 其在接近体温时表现出理想的溶胶-凝胶转换及流动行为, 在酸性的阴道环境下形成并维持稳定的凝胶形态, 且该凝胶在体内可有效阻止单纯子宫内膜增生演变为复杂的非典型子宫内膜增生。
Salem等[56]采用注射超声法制备了负载黄体酮的纳米囊泡透皮质体凝胶, 并通过24因素全因子设计方法及数学因子回归模型对该凝胶进行优化, 以确保纳米囊泡在阴道黏膜中的长期稳定性和高渗透性。将优化过程中得到的最佳处方掺入黏膜黏附性阴道凝胶中, 并在无排卵性多囊卵巢综合征的患者中进行了临床研究。结果表明, 该制剂能显著提高黄体酮的血药浓度、子宫内膜厚度和妊娠率。
Velázquez等[57]采用冷冻干燥法制备了黄体酮与随机甲基化β-环糊精包合物, 将其掺入壳聚糖温敏性水凝胶中, 得黄体酮阴道凝胶。在进行体外扩散实验后, 发现制备的壳聚糖凝胶具有与市售的Crinone相似的持续扩散性, 但壳聚糖为天然聚合物, 可避免Crinone中交联丙烯酸聚合物累积引起的阴道刺激、性交疼痛等相关不良反应。
2.3.3 缓释栓剂阴道栓剂在常温下为固体, 塞入腔道后, 在体温下迅速软化熔融或溶解于分泌液, 逐渐释放药物, 产生局部或全身作用[58]。该剂型具有生物利用度高、刺激性小和操作简便等优点。
Zhou等[59]采用热熔法制备了黄体酮缓释栓剂。以转篮法和高效液相色谱法对制备处方进行考察后, 选择混合脂肪酸甘油酯作为栓剂基质, 浓度为1%的硬脂酸作为释放速度调节剂。所制备的栓剂能够维持剂型完整形态达50 h, 在48 h的释放度为73.90%, 释药时间超过50 h。
Correia等[60]制备了一种含纳米结构脂质载体(NLC) 的黄体酮阴道缓释栓剂。NLC易于生产, 能够包裹和保护亲脂分子, 使制剂长期稳定并延长药物释放。将预制的热的水包油型纳米乳液以骤冷方式形成负载黄体酮的NLC分散体, 基底熔化冷却后, 在连续搅拌下将分散体溶液加入冷却至(30.0 ± 0.5) ℃的基底中, 最后, 将混合液放入模具, 即得栓剂。通过评估该制剂在人角质形成细胞(HaCaT) 中的生物相容性, 以及其在阴道中延长黄体酮释放的有效性, 发现该制剂浓度在25 μg·mL-1以下无细胞毒性, 释放时间较仅负载黄体酮的栓剂长, 具有良好的缓释作用。
2.3.4 黏膜黏附剂黏膜黏附性(mucosal adhesion) 是指天然或合成的聚合物通过形成物理或化学键而黏附在黏膜表面的能力[61]。该特性能够有效延长药物在应用部位的滞留时间, 提高药物的生物利用度[62]。
Hassan等[63]采用直接压片法将黄体酮/Pluronic F-127固体分散体、无水乳糖(稀释剂)、硬脂酸镁(润滑剂) 和不同的黏液黏附性聚合物的混合物制备成阴道黏附片。对制得的黏附片进行系统评价后发现, 20%壳聚糖-10%海藻酸钠混合制剂的溶胀指数和黏附时间最高, 制剂在最初的2 h内存在突释但能持续释放约48 h。体内研究表明, 黏附片与口服黄体酮相比, 药物在血液中的平均滞留时间延长了约2倍, 生物利用度提高了5倍。此外, 在动物实验中发现, 与肌注黄体酮相比, 黏附片组的兔子宫肌层厚度增加了2倍, 证明黏附片在提高黄体酮的生物利用度及药效方面具有一定的潜力。
Brako等[64]采用加压旋转法将负载黄体酮的生物黏附性纳米纤维掺入阴道插入物中, 用于阴道给药。通过改变溶剂体系、初始载药量和聚合物组成等制备工艺参数, 优化纤维结构, 提高药物掺入效率。研究结果表明, 该制剂以纳米晶形式存在, 黄体酮含量高达25%, 从载药纤维中释放出来的黄体酮的释放率与市售的黄体酮栓剂Cyclogest释放率相当。且该技术能够生产与实际应用量相匹配的纤维, 用于商业化生产。
在阴道中, 药物分布和滞留受宫颈阴道黏液、高度折叠的上皮表面、腹腔内压力、重力和渗透力的限制[65]。而纳米药物的应用可改变包括呼吸道、胃肠道、眼部表面、膀胱和女性生殖道在内的黏膜给药现状[66]。Hoang等[67]采用湿法研磨, 以2%的Pluronic F-127为稳定剂制备了一种黏液惰性黄体酮纳米混悬液。与市售凝胶Crinone相比, 该制剂为低渗混悬液, 可引起水吸收, 使黏液惰性颗粒分布在整个阴道及上皮表面, 实现最大程度的药物吸收。低渗透性使该制剂可进一步提高水溶性、溶解度、吸收性、生物利用度及生物相容性, 可避免高渗透压制剂出现的阴道刺激、白带、上皮毒性及阴道渗漏等问题。
与口服和注射不同, 经阴道给予黄体酮, 可靶向作用于子宫, 子宫局部黄体酮浓度高, 血药浓度也高, 可减少全身的不良反应。阴道环作为一种缓控释给药系统, 缓释时间长, 血药浓度稳定, 且作用可逆, 取用方便。因此, 黄体酮阴道环常用于长效避孕及激素替代疗法。缓释凝胶及黏膜黏附剂的表面黏附性使得药物的作用时间延长, 常用于辅助生育技术中黄体酮的补充治疗。在很多国家, 经阴道给药黄体酮已成为试管婴儿周期首选的黄体支持方式。而与口服和注射相似, 缓释栓剂往往用于月经失调、功能性子宫出血、先兆流产和经前期紧张综合征等的治疗。
2.4 经皮给药及其制备方法经皮给药(transdermal drug delivery) 是指药物经由皮肤进入人体血液循环达到有效血药浓度、实现疾病治疗或预防的一种给药新途径, 能避免肝脏首过效应、药物在胃肠道被破坏, 具有减少血药浓度波动、降低毒副反应、用药方便和患者顺应性好等优点。然而, 角质层的屏障作用限制了大多数药物的经皮渗透[68]。
El Maghraby等[69]将搅拌制得的微乳液, 添加过量的黄体酮, 水浴连续搅拌72 h, 最后加乙醇与之混合, 得到一种含乙醇的黄体酮微乳透皮制剂。将其与无乙醇的微乳液进行对比实验, 发现在该制剂中加入乙醇以及过饱和的药物能够使药物的经皮渗透性显著提高。该制剂作为黄体酮的透皮给药方式, 具有良好的应用潜力, 且该微乳的开发也为局部喷剂的引入打开了大门。
Zhang[70]采用乙醇注入-均质法制备了一种黄体酮醇质体凝胶膏剂, 该制剂由亲水性高分子聚合物、保湿剂、交联剂及载药醇质体混悬液组成, 是一种具有空间网状交联结构的透皮给药制剂。醇质体是由磷脂、乙醇和水等组成的具有类脂双分子层结构的含醇新型纳米囊泡, 且乙醇作为促渗剂, 可改变皮肤角质层脂质分子的排列, 增加脂质的流动性及渗透能力。因此, 以醇质体作为经皮渗透载体具有流动性较好、包封率高和药物稳定的特点[71]。体外释放实验证明, 与黄体酮乙醇溶液相比, 该制剂具有明显的缓释作用。体外透皮渗透实验表明, 该制剂的累积渗透量及滞留量是黄体酮饱和溶液的30.39倍。
Elgindy等[72]采用乳化法制备了一种负载黄体酮的自组装纳米混悬液, 用于调节非侵入性黄体酮透皮给药后的荷尔蒙紊乱。通过析因设计及质量评估对该透皮制剂进行了优化, 优化后的制剂表现出很高的物理稳定性, 在室温下可以维持稳定立方结构至少3个月。体内研究表明, 与纯药物混悬液相比, 该制剂的透皮渗透率显著提高了6倍。
Tao等[73]基于苯乙烯-异戊二烯-苯乙烯热塑性弹性体热熔压敏胶与高亲脂性药物相容性好、药物释放速率快的特性, 选择其为骨架材料, 制备了一种黄体酮热熔压敏胶透皮贴剂。通过体外透皮渗透实验对各参数进行考察后, 选择2%的肉豆蔻酸异丙酯为促渗剂、黄体酮载药量为4%、贴片的涂布厚度为300 μm为该制剂的最优处方及参数。
2.5 肺部给药及其制备方法肺部给药(pulmonary drug delivery) 一直是受众多药学研究人员关注的给药途径。药物的肺部给药可避免肝脏首过效应从而减少药物剂量和不良反应、生物利用度高、吸收迅速、起效快、制剂要求没有注射剂高、相对成本低和可局部靶向呼吸道区域等[74]。
Ragab等[75]通过析因设计方法优化设计出一种用于肺部给药的黄体酮纳米晶。研究结果显示, 反溶剂(水) 的添加速度、纳米晶的结晶方法、药物的浓度及反溶剂的质量百分比都会对纳米晶的粒径分布产生影响。最终, 选择100 mL·min-1的添加速率、冷却和反溶剂沉淀相结合的结晶方法、1 g·L-1药物浓度、反溶剂的质量百分比为50%和75%为制备工艺的最佳参数。该处方能够使药物颗粒的中值粒径(D50) 减小至适合肺部给药的尺寸, 并缩小了颗粒的粒径分布, 使得药物在肺部的沉积情况得到明显的改善。
当可吸入颗粒的粒径小于100 nm时, 可增加颗粒的肺泡沉积, 并最大化地躲避肺泡吞噬清除机制[76]。基于此, Ragab等[77]采用聚合物和表面活性剂自组装的方法合成一种负载黄体酮的聚合磁性纳米聚集体, 用于肺部给药。纳米聚集体由Pluronic F-68和β-环糊精的嵌段共聚物围绕在纳米颗粒的磁芯周围而形成, 运用合成后载药法添加黄体酮, 并通过添加表面活性剂来防止纳米颗粒的团聚。该方法制备简单, 不需要使用任何有机溶剂, 不产生有毒的聚合物降解产物。实验研究中还发现, 药物以纳米聚集体扩散的方式延长了释放, 可减少相关的不良反应, 且通过改变聚合物和/或表面活性剂的浓度可以有效控制药物的释放。
2.6 鼻腔给药及其制备方法鼻黏膜由于表面积大和脉管系统丰富, 使鼻腔给药(nasal drug delivery) 可以达到非常有效的药物吸收[78]。该方式具有避免肝首过效应、生物利用度高、不良反应少、使用方便、患者依从性好和速效等特点。
Carbo等[79]通过体内外实验, 对鼻腔给药、口服和静脉注射黄体酮在卵巢切除家兔中的药动学进行了比较。结果表明, 与口服相比, 鼻腔给药可有效减少黄体酮的肝肠首过效应, 有效提高生物利用度, 且鼻腔给药与喷雾剂相比具有明显的持续作用。
Guennoun等[80]在研究中提到瑞士医药公司开发了一种具有黏性和触变性的用于鼻腔给药的黄体酮油凝胶。该制剂通过将黄体酮溶解于蓖麻油基混合物中, 以二氧化硅凝胶化而得, 其根据鼻腔容积的大小来调节给药剂量, 以减少对鼻腔的损害。研究发现, 鼻内应用黄体酮, 可以促进睡眠且无苯二氮䓬类药物的不良反应, 诱导多巴胺释放, 抗焦虑, 减少早期血脑屏障开放等。该凝胶于2009年被德国卫生部批准用于减轻绝经后女性的睡眠障碍的临床研究第一阶段。Guennoun等[80]从脑卒中模型实验中发现, 黄体酮的鼻腔给药可以有效地将黄体酮输送到大脑, 从而改善运动功能、减少梗塞体积、减轻神经元损失、血脑屏障破坏和大脑线粒体功能障碍。
3 总结与展望黄体酮的市场需求量大, 临床应用广泛, 不同的给药方式使其适用于不同的临床症状。为适应市场需求、克服现有制剂存在的缺陷, 新型黄体酮药物及给药途径不断被开发, 如前文所述的微球、纳米晶、黏膜黏附剂、磁性纳米粒、肺部给药、鼻腔给药等。黄体酮的口服生物利用度低, 在该途径下的创新制剂均以改善其口服吸收效果为目标, 如将其制备成壳聚糖修饰的无胆固醇脂质体, 该制剂在提高黄体酮口服生物利用度的同时可达到一定的缓释效果, 其有望打破上市口服制剂的药物吸收低的短板。注射制剂在延续其疗效强、缓释效果好的同时, 也在逐渐发掘新的剂型, 如开发纳米混悬水针剂、包合物水针剂来缓解注射时可能发生的刺激性等不良反应, 又如静脉脂质乳剂的开发为创伤性脑损伤的治疗提供了新的方法, 本课题组也在致力于黄体酮纳米晶及其新型缓释微球的相关研究, 以期为黄体酮的新型制剂提供新的研究思路。使用更高端简便的制备方法、运用更环保低毒的载体材料, 是黄体酮阴道制剂优化与创新发展的热点, 安全性的提高与制备成本的降低为该给药方式的广泛应用提供了可能。经皮、肺部及鼻腔给药途径的开拓, 更是丰富了黄体酮制剂及临床应用的发展空间。相信随着时间的推移、探究的深入, 会有更多更优的新型制剂及给药方式被开发, 使黄体酮的临床应用更加成熟与完善。
作者贡献: 王玥负责相关文献的检索和筛选, 并完成文章的撰写任务; 程艺、刘原兵和李静如负责文章的修改; 张慧和郑爱萍确定文章方向, 负责文章质量的把关和校审。
利益冲突: 文章内容不涉及任何利益冲突。
| [1] |
Goletiani NV, Keith DR, Gorsky SJ. Progesterone: review of safety for clinical studies[J]. Exp Clin Psychopharmacol, 2007, 15: 427-444. DOI:10.1037/1064-1297.15.5.427 |
| [2] |
Dey S, Lim H, Das S, et al. Molecular cues to implantation[J]. Endocr Rev, 2004, 25: 341-373. DOI:10.1210/er.2003-0020 |
| [3] |
Ruan X, Mueck AO. Systemic progesterone therapy--oral, vaginal, injections and even transdermal?[J]. Maturitas, 2014, 79: 248-255. DOI:10.1016/j.maturitas.2014.07.009 |
| [4] |
Scarpin KM, Graham JD, Mote PA, et al. Progesterone action in human tissues: regulation by progesterone receptor (PR) isoform expression, nuclear positioning and coregulator expression[J]. Nucl Recept Signal, 2009, 7: 1-13. |
| [5] |
O'Driscoll CM, Griffin BT. Biopharmaceutical challenges associated with drugs with low aqueous solubility--the potential impact of lipid-based formulations[J]. Adv Drug Deliv Rev, 2008, 60: 617-624. DOI:10.1016/j.addr.2007.10.012 |
| [6] |
Meng ID, Barton ST, Goodney I, et al. Progesterone application to the rat forehead produces corneal antinociception[J]. Invest Ophthalmol Vis Sci, 2019, 60: 1706-1713. DOI:10.1167/iovs.18-26049 |
| [7] |
Kunzmann S, Ottensmeier B, Speer CP, et al. Effect of progesterone on Smad signaling and TGF-β/Smad-regulated genes in lung epithelial cells[J]. PLoS One, 2018, 13: e0200661. DOI:10.1371/journal.pone.0200661 |
| [8] |
Zhai Y. Research progress in clinical application of progesterone[J]. Strait Pharm (海峡药学), 2017, 29: 110-112. |
| [9] |
Pei DS, Fang XY. Application of progesterone in non-gynecology and obstetric diseases[J]. Pract Country Doctor (实用乡村医生), 1997, 4: 44-45. |
| [10] |
Zhao J, Yuan Q, Cai W, et al. Formulation, optimization, characterization, and pharmacokinetics of progesterone intravenous lipid emulsion for traumatic brain injury therapy[J]. AAPS PharmSciTech, 2017, 18: 1475-1487. DOI:10.1208/s12249-016-0637-5 |
| [11] |
Ying YZ, Zhao SX. A case report of progesterone treatment of male periodic psychosis[J]. Chin Neuropsychiatric Dis (中国神经精神疾病), 1989, 1: 270. |
| [12] |
Ying MH, Xu CX, Zhang ZQ, et al. Progress in clinical research of progesterone[J]. Pharm Clinic Res (药学与临床研究), 2018, 26: 361-364. |
| [13] |
Hou J, Sun E, Sun C, et al. Improved oral bioavailability and anticancer efficacy on breast cancer of paclitaxel via Novel Soluplus®-Solutol® HS15 binary mixed micelles system[J]. Int J Pharm, 2016, 512: 186-193. DOI:10.1016/j.ijpharm.2016.08.045 |
| [14] |
Hubayter ZR, Muasher SJ. Luteal supplementation in in vitro fertilization: more questions than answers[J]. Fertil Steril, 2008, 89: 749-758. DOI:10.1016/j.fertnstert.2008.02.095 |
| [15] |
Phy JL, Weiss WT, Weiler CR, et al. Hypersensitivity to progesterone-in-oil after in vitro fertilization and embryo transfer[J]. Fertil Steril, 2003, 80: 1272-1275. DOI:10.1016/S0015-0282(03)01170-1 |
| [16] |
Alexander NJ, Baker E, Kaptein M, et al. Why consider vaginal drug administration?[J]. Fertil Steril, 2004, 82: 1-12. |
| [17] |
De Ziegler D, Bulletti C, De Monstier B, et al. The first uterine pass effect[J]. Ann N Y Acad Sci, 1997, 828: 291-299. DOI:10.1111/j.1749-6632.1997.tb48550.x |
| [18] |
Archer DF, Fahy GE, Viniegra-Sibal A, et al. Initial and steady-state pharmacokinetics of a vaginally administered formulation of progesterone[J]. Am J Obstet Gynecol, 1995, 173: 471-478. DOI:10.1016/0002-9378(95)90268-6 |
| [19] |
Wang M, Gao XL. Determination of the entrapment efficiency of oral progesterone proliposome preparation[J]. Chin J New Drugs (中国新药杂志), 2011, 20: 2254-2256. |
| [20] |
Abboud R, Greige-Gerges H, Charcosset C. Effect of progesterone, its hydroxylated and methylated derivatives, and dydrogesterone on lipid bilayer membranes[J]. J Membr Biol, 2015, 248: 811-824. DOI:10.1007/s00232-015-9803-z |
| [21] |
Caddeo C, Pons R, Carbone C, et al. Physico-chemical characterization of succinyl chitosan-stabilized liposomes for the oral co-delivery of quercetin and resveratrol[J]. Carbohydr Polym, 2017, 157: 1853-1861. DOI:10.1016/j.carbpol.2016.11.072 |
| [22] |
Chen H, Pan H, Li P, et al. The potential use of novel chitosan-coated deformable liposomes in an ocular drug delivery system[J]. Colloids Surf B Biointerfaces, 2016, 143: 455-462. DOI:10.1016/j.colsurfb.2016.03.061 |
| [23] |
Wang M, Liu M, Xie T, et al. Chitosan-modified cholesterol-free liposomes for improving the oral bioavailability of progesterone[J]. Colloids Surf B Biointerfaces, 2017, 159: 580-585. DOI:10.1016/j.colsurfb.2017.08.028 |
| [24] |
Tuleu C, Newton M, Rose J, et al. Comparative bioavailability study in dogs of a self-emulsifying formulation of progesterone presented in a pellet and liquid form compared with an aqueous suspension of progesterone[J]. J Pharm Sci, 2004, 93: 1495-1502. DOI:10.1002/jps.20068 |
| [25] |
Hassan TH, Mäder K. Novel semisolid SNEDDS based on PEG-30-di-(polyhydroxystearate): progesterone incorporation and in vitro digestion[J]. Int J Pharm, 2015, 486: 77-87. DOI:10.1016/j.ijpharm.2015.03.044 |
| [26] |
Pickar JH, Bon C, Amadio JM, et al. Pharmacokinetics of the first combination 17β-estradiol/progesterone capsule in clinical development for menopausal hormone therapy[J]. Menopause, 2015, 22: 1308-1316. DOI:10.1097/GME.0000000000000467 |
| [27] |
Mirkin S, Amadio JM, Bernick BA, et al. 17β-Estradiol and natural progesterone for menopausal hormone therapy: REPLENISH phase 3 study design of a combination capsule and evidence review[J]. Maturitas, 2015, 81: 28-35. DOI:10.1016/j.maturitas.2015.02.266 |
| [28] |
Sethia S, Squillante E. Solid dispersion of carbamazepine in PVP K30 by conventional solvent evaporation and supercritical methods[J]. Int J Pharm, 2004, 272: 1-10. DOI:10.1016/j.ijpharm.2003.11.025 |
| [29] |
Falconer JR, Wen J, Zargar-Shoshtari S, et al. Preparation and characterization of progesterone dispersions using supercritical carbon dioxide[J]. Drug Dev Ind Pharm, 2014, 40: 458-469. DOI:10.3109/03639045.2013.768630 |
| [30] |
Sousa ARSD, Calderone M, Rodier E, et al. Solubility of carbon dioxide in three lipid-based biocarriers[J]. J Supercrit Fluids, 2006, 39: 13-19. DOI:10.1016/j.supflu.2006.01.014 |
| [31] |
Knez Ž, Knez Hrnčič M, Škerget M. Particle formation and product formulation using supercritical fluids[J]. Annu Rev Chem Biomol Eng, 2015, 6: 379-407. DOI:10.1146/annurev-chembioeng-061114-123317 |
| [32] |
Zhang X, Qi YG, Wu YJ, et al. Domestic and international research progress of novel injectable products[J]. Prog Pharm Sci (药学进展), 2018, 42: 897-904. |
| [33] |
Gao H, Fang BH, Liu YH, et al. Preparation of progesterone polylactic acid microspheres and its in vitro release characteristics[J]. China Anim Husb Veter (中国畜牧兽医), 2011, 38: 228-231. |
| [34] |
Kang J, Sah E, Sah H. Applicability of non-halogenated methyl propionate to microencapsulation[J]. J Microencapsul, 2014, 31: 323-332. DOI:10.3109/02652048.2013.843729 |
| [35] |
Im HY, Sah H. Ammonolysis-based microencapsulation technique using isopropyl formate as dispersed solvent[J]. Int J Pharm, 2009, 382: 130-138. DOI:10.1016/j.ijpharm.2009.08.020 |
| [36] |
Turino LN, Mariano RN, Boimvaser S, et al. In situ-formed microparticles of PLGA from O/W emulsions stabilized with PVA: encapsulation and controlled release of progesterone[J]. J Pharm Innov, 2014, 9: 132-140. DOI:10.1007/s12247-014-9180-7 |
| [37] |
Guo Y, Yang Y, He L, et al. Injectable sustained-release depots of PLGA microspheres for insoluble drugs prepared by hot-melt extrusion[J]. Pharm Res, 2017, 34: 2211-2222. DOI:10.1007/s11095-017-2228-x |
| [38] |
Junghanns JU, Müller RH. Nanocrystal technology, drug delivery and clinical applications[J]. Int J Nanomedicine, 2008, 3: 295-309. |
| [39] |
Salem HF. Sustained-release progesterone nanosuspension following intramuscular injection in ovariectomized rats[J]. Int J Nanomedicine, 2010, 5: 943-954. |
| [40] |
Li L, Li W, Sun J, et al. Preparation and evaluation of progesterone nanocrystals to decrease muscle irritation and improve bioavailability[J]. AAPS PharmSciTech, 2018, 19: 1254-1263. DOI:10.1208/s12249-017-0938-3 |
| [41] |
Huang WH. Preparation and Evaluation of Progesterone Nanocrystalline Injection (黄体酮纳米晶注射液的制备及评价)[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2018.
|
| [42] |
Roberto BE, Manuel CB, Rosalba AC, et al. Observational study of the local tolerability of injectable progesterone microspheres[J]. Gynecol Obstet Invest, 2012, 73: 124-129. DOI:10.1159/000330711 |
| [43] |
Wei SS, Gao J, Li ZS, et al. Preparation of progesterone microcrystals by antisolvent precipitation temperature controlling method[J]. J Int Pharm Res (国际药学研究杂志), 2020, 47: 390-394. |
| [44] |
Zhou YF, Li Y, Zhen WJ. Review on preparation, properties and application of cyclodextrin-polymer inclusion complexs[J]. Plast Technol (塑料科技), 2016, 44: 97-101. |
| [45] |
Zhang Y. Research progress on inclusion technology of cyclodextrin[J]. Chem Eng Design Commun (化工设计通讯), 2016, 42: 87-88. |
| [46] |
Wang XY, Xuan ZG. Preparation of progesterone β-cyclodextrin inclusion compound[J]. Chin Hosp Pharm J (中国医院药学杂志), 2003, 23: 17-19. |
| [47] |
Zoppetti G, Puppini N, Pizzutti M, et al. Water soluble progesterone-hydroxypropyl-β-cyclodextrin complex for injectable formulations[J]. J Incl Phenom Macro Chem, 2007, 57: 283-288. DOI:10.1007/s10847-006-9174-2 |
| [48] |
López-Picado A, Lapuente O, Lete I. Efficacy and side-effects profile of the ethinylestradiol and etonogestrel contraceptive vaginal ring: a systematic review and meta-analysis[J]. Eur J Contracept Reprod Health Care, 2017, 22: 131-146. DOI:10.1080/13625187.2017.1287351 |
| [49] |
Carr SL, Gaffield ME, Dragoman MV, et al. Safety of the progesterone-releasing vaginal ring (PVR) among lactating women: a systematic review[J]. Contraception, 2016, 94: 253-261. DOI:10.1016/j.contraception.2015.04.001 |
| [50] |
Helbling IM, Ibarra JC, Luna JA. The optimization of an intravaginal ring releasing progesterone using a mathematical model[J]. Pharm Res, 2014, 31: 795-808. DOI:10.1007/s11095-013-1201-6 |
| [51] |
Yao XD, Ning MY. Study on preparation and release mechanism of progesterone reservoir-type intravaginal rings[J]. Chin J Fam Plann, 2018, 539: 75-82. |
| [52] |
Fu J, Yu X, Jin Y. 3D printing of vaginal rings with personalized shapes for controlled release of progesterone[J]. Int J Pharm, 2018, 539: 75-82. DOI:10.1016/j.ijpharm.2018.01.036 |
| [53] |
Zhao J, Jiang ML, Ding Y. Research progress and engineering progspect on the formulation design of 3D printing technology[J]. Acta Pharm Sin (药学学报), 2018, 53: 75-82. |
| [54] |
Chi LL. Preparation and Influencing Factors of Bioequivalence of Progesterone Sustained Release Gel In Vitro (黄体酮缓释凝胶制备与生物等效性影响因素体外研究)[D]. Dalian: Dalian University of Technology, 2018.
|
| [55] |
Almomen A, Cho S, Yang CH, et al. Thermosensitive progesterone hydrogel: a safe and effective new formulation for vaginal application[J]. Pharm Res, 2015, 32: 2266-2279. DOI:10.1007/s11095-014-1616-8 |
| [56] |
Salem HF, Kharshoum RM, Abou-Taleb HA, et al. Progesterone-loaded nanosized transethosomes for vaginal permeation enhancement: formulation, statistical optimization, and clinical evaluation in anovulatory polycystic ovary syndrome[J]. J Liposome Res, 2019, 29: 183-194. DOI:10.1080/08982104.2018.1524483 |
| [57] |
Velázquez NS, Turino LN, Luna JA, et al. Progesterone loaded thermosensitive hydrogel for vaginal application: formulation and in vitro comparison with commercial product[J]. Saudi Pharm J, 2019, 27: 1096-1106. DOI:10.1016/j.jsps.2019.09.006 |
| [58] |
Wang YH, Li HJ, Yang L, et al. Research progress of vaginal mucosal drug delivery system[J]. Chin J Exp Tradit Med Formul (中国实验方剂学杂志), 2019, 25: 219-225. |
| [59] |
Zhou T, Guo XQ, Yao Q, et al. Preparation and optimization of progesterone sustained-release suppositories[J]. J Chengsu Univ (成都大学学报), 2020, 39: 42-45. |
| [60] |
Correia A, Costa CP, Silva V, et al. Pessaries containing nanostructured lipid carriers (NLC) for prolonged vaginal delivery of progesterone[J]. Eur J Pharm Sci, 2020, 153: 1-23. |
| [61] |
Caramella CM, Rossi S, Ferrari F, et al. Mucoadhesive and thermogelling systems for vaginal drug delivery[J]. Adv Drug Deliv Rev, 2015, 92: 39-52. DOI:10.1016/j.addr.2015.02.001 |
| [62] |
de Araújo Pereira RR, Bruschi ML. Vaginal mucoadhesive drug delivery systems[J]. Drug Dev Ind Pharm, 2012, 38: 643-652. DOI:10.3109/03639045.2011.623355 |
| [63] |
Hassan AS, Soliman GM. Mucoadhesive tablets for the vaginal delivery of progesterone: in vitro evaluation and pharmacokinetics/pharmacodynamics in female rabbits[J]. Drug Devel Ind Pharm, 2018, 44: 224-232. DOI:10.1080/03639045.2017.1386203 |
| [64] |
Brako F, Raimi-Abraham BT, Mahalingam S, et al. The development of progesterone-loaded nanofibers using pressurized gyration: a novel approach to vaginal delivery for the prevention of pre-term birth[J]. Int J Pharm, 2018, 540: 31-39. DOI:10.1016/j.ijpharm.2018.01.043 |
| [65] |
Ensign LM, Hoen TE, Maisel K, et al. Enhanced vaginal drug delivery through the use of hypotonic formulations that induce fluid uptake[J]. Biomaterials, 2013, 34: 6922-6929. DOI:10.1016/j.biomaterials.2013.05.039 |
| [66] |
Ensign LM, Tang BC, Wang YY, et al. Mucus-penetrating nanoparticles for vaginal drug delivery protect against herpes simplex virus[J]. Sci Transl Med, 2012, 4: 643-653. |
| [67] |
Hoang T, Zierden H, Date A, et al. Development of a mucoinert progesterone nanosuspension for safer and more effective prevention of preterm birth[J]. J Control Release, 2019, 295: 74-86. DOI:10.1016/j.jconrel.2018.12.046 |
| [68] |
Mehanna MM, Motawaa AM, Samaha MW. Nanovesicular carrier-mediated transdermal delivery of tadalafil: i-formulation and physicsochemical characterization[J]. Drug Dev Ind Pharm, 2015, 41: 714-721. DOI:10.3109/03639045.2014.900075 |
| [69] |
El Maghraby GM. Occlusive and non-occlusive application of microemulsion for transdermal delivery of progesterone: mechanistic studies[J]. Sci Pharm, 2012, 80: 765-778. DOI:10.3797/scipharm.1201-01 |
| [70] |
Zhang XL. Study on Pharmaceutical Preparation and Transdermal Permeation In Vitro of Progesterone (黄体酮经皮给药系统的设计与制备)[D]. Guangzhou: Guangdong College of Pharmacy, 2012.
|
| [71] |
Touitou E, Dayan N, Bergelson L, et al. Ethosomes-novel vesicular carriers for enhanced delivery: characterization and skin penetration properties[J]. J Control Release, 2000, 65: 403-418. DOI:10.1016/S0168-3659(99)00222-9 |
| [72] |
Elgindy NA, Mehanna MM, Mohyeldin SM. Self-assembled nano-architecture liquid crystalline particles as a promising carrier for progesterone transdermal delivery[J]. Int J Pharm, 2016, 501: 167-179. DOI:10.1016/j.ijpharm.2016.01.049 |
| [73] |
Tao H, Chen FF, Gao XL. Preparation and in vitro release characterization of hot-melt pressure sensitive adhesive transdermal patch of progesterone[J]. J Pharm Pract (药学实践杂志), 2016, 34: 44-47. |
| [74] |
Patton JS, Byron PR. Inhaling medicines: delivering drugs to the body through the lungs[J]. Nat Rev Drug Discov, 2007, 6: 67-74. DOI:10.1038/nrd2153 |
| [75] |
Ragab D, Rohani S, Samaha MW, et al. Crystallization of progesterone for pulmonary drug delivery[J]. J Pharm Sci, 2010, 99: 1123-1137. DOI:10.1002/jps.21896 |
| [76] |
Hoet PH, Brüske-Hohlfeld I, Salata OV. Nanoparticles-known and unknown health risks[J]. J Nanobiotechnol, 2004, 2: 1-15. DOI:10.1186/1477-3155-2-1 |
| [77] |
Ragab DM, Rohani S, Consta S. Controlled release of 5-fluorouracil and progesterone from magnetic nanoaggregates[J]. Int J Nanomedicine, 2012, 7: 3167-3189. |
| [78] |
Minn A, Leclerc S, Heydel JM, et al. Drug transport into the mammalian brain: the nasal pathway and its specific metabolic barrier[J]. J Drug Target, 2002, 10: 285-296. DOI:10.1080/713714452 |
| [79] |
Carbo D, Lu WG. Comparison of pharmacokinetics of nasal, oral and intravenous progesterone in ovariectomized rabbits[J]. Foreign Med (国外医药), 1989, 46: 228-229. |
| [80] |
Guennoun R, Fréchou M, Gaignard P, et al. Intranasal administration of progesterone: a potential efficient route of delivery for cerebroprotection after acute brain injuries[J]. Neuropharmacology, 2019, 145: 283-291. DOI:10.1016/j.neuropharm.2018.06.006 |
 2022, Vol. 57
2022, Vol. 57


